Introducción
La enfermedad de Chagas, causada por el protozoo Trypanosoma cruzi, es la responsable de la mayor carga de morbilidad de todas las enfermedades parasitarias en el hemisferio occidental. Se estima que seis millones de personas la padecen, y la mayoría viven en México, Centroamérica y Sudamérica1. La enfermedad de Chagas se caracteriza por una fase asintomática prolongada, pero cerca del 30% de los pacientes, con el tiempo, desarrollan una miocardiopatía crónica con complicaciones como apoplejía, alteraciones del ritmo y diversos grados de insuficiencia cardíaca. El aneurisma apical del ventrículo izquierdo es una lesión típica de la enfermedad de Chagas y se detecta con cierta frecuencia en los estudios ecocardiográficos2.
El aneurisma ventricular se define como una dilatación sacular y circunscrita del miocardio, con tejido fibroso no contráctil de espesor reducido, que incluye todas las capas de la pared cardíaca y con expansión sistólica, descrito por primera vez en 1757 por Hunter3. El ventrículo izquierdo (VI), con una geometría ovoidal, tiene puntos débiles en sus polos. El VI actúa como un fuelle, empujando la sangre tanto al tracto de salida de la aorta como a los segmentos apicales; si el daño tisular se localiza en esos puntos débiles, es factible la formación de aneurismas. Por esta razón, los aneurismas se encuentran con mayor frecuencia en los segmentos apicales del ventrículo izquierdo y menos en los inferolaterales (Fig. 1)4.
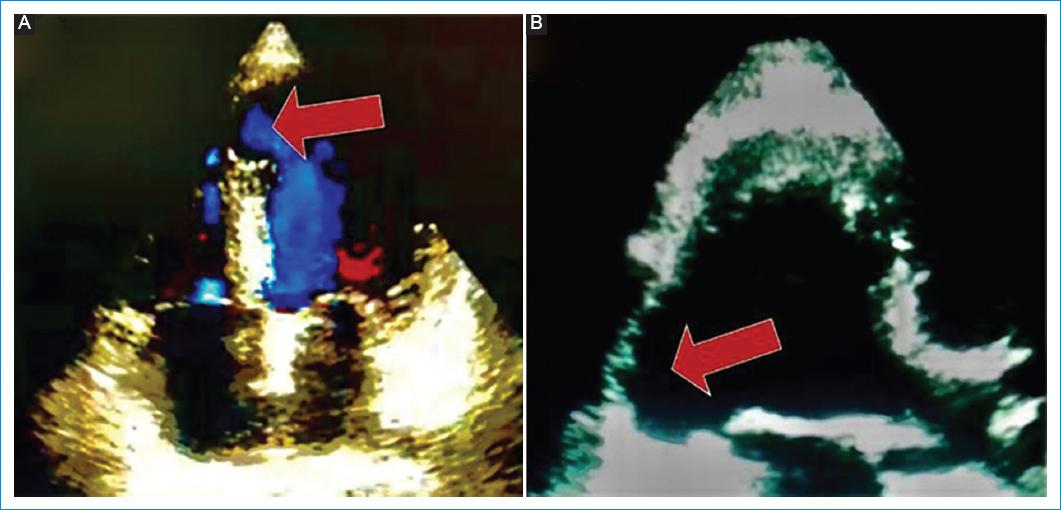
Figura 1 A: aneurisma septoapical (vista de ecocardiografía 2D apical cuatro 4 cámaras). B: aneurisma inferolateral (vista de ecocardiografía 2D hemiaxial apical).
Las miocardiopatías idiopáticas rara vez desarrollan aneurismas ventriculares5; por el contrario, en la cardiopatía isquémica se detectan con frecuencia, como en la miocardiopatía chagásica crónica (CChC). El aneurisma ventricular en la cardiopatía isquémica suele presentarse como una complicación del infarto de miocardio transmural, con una incidencia de aproximadamente el 5-10%6, pero también se encuentra en la miocardiopatía hipertrófica y la displasia arritmogénica del ventrículo derecho, y puede ser congénito, entre otras causas. En la CChC se han descrito aneurismas ventriculares mediante ecocardiografía en el 2.0% al 8.6% de los pacientes asintomáticos y en el 24% al 64% (media del 55%) de los pacientes con afectación miocárdica de moderada a grave1. El aneurisma ventricular en la CChC predice el desarrollo de trombo mural (Fig. 2) y accidente cerebrovascular embólico; también contribuye como sustrato para las arritmias ventriculares, pero no se ha demostrado que sea un predictor independiente de mortalidad, aparte de la disfunción sistólica del VI7.
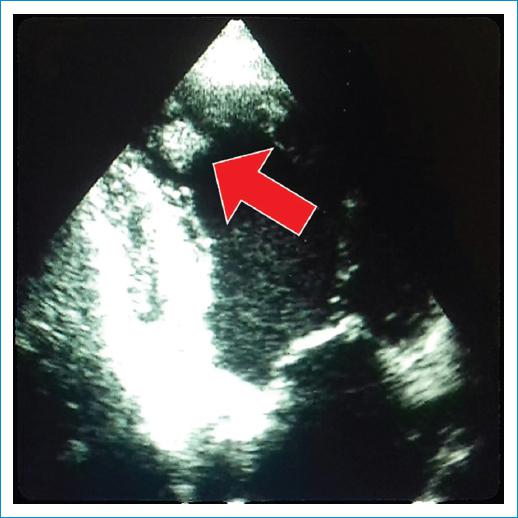
Figura 2 Aneurisma inferoapical (ecocardiografía 2D apical de dos cámaras) con un trombo mural (flecha).
Nuestro objetivo fue analizar el perfil clínico de individuos con aneurismas ventriculares, pertenecientes a una población de pacientes con diagnóstico confirmado de CChC, buscando asociación significativa entre varias variables categóricas: sexo, edad mayor o igual (y menor) de 50 años, fracción de eyección del ventrículo izquierdo (FEVI) mayor o igual (y menor) del 50%, tamaño del aneurisma (grande frente a pequeño) y presencia o ausencia de arritmia ventricular grave.
Método
El Comité de Ética del Centro de Investigación y Enseñanza en Enfermedad de Chagas Dr. Humberto Lugones (Santiago del Estero, Argentina) manifestó que, teniendo en cuenta que todos los datos fueron recolectados previamente durante las consultas periódicas y que con los datos disponibles no resultaba posible la identificación de ningún paciente, esta investigación retrospectiva podría realizarse sin el consentimiento escrito de los sujetos.
En el citado Centro de Chagas de la provincia de Santiago del Estero, región endémica de Chagas en la República Argentina, todos los pacientes son diagnosticados como CChC con prueba de seropositivo al menos por dos pruebas diferentes enzimáticas inmunoabsorbentes (ELISA) y pruebas indirectas de hemaglutinación, exploración física completa, electrocardiograma (ECG) estándar de 12 derivaciones, radiografía de tórax y ecocardiograma bidimensional (2-D ecocardiografía, ultrasonido Esaote, Mylab 50). Los volúmenes bidimensionales del VI y la FEVI se midieron utilizando la regla de Simpson modificada, con imágenes obtenidas de las proyecciones apicales de cuatro y dos cámaras, como recomiendan las guías de la American Society of Echocardiography8. El tamaño de los aneurismas se categorizó como pequeño o grande si la relación entre el área aneurismática y el área del VI era < 0.4 o ≥ 0.4, respectivamente, método descrito por Matsumoto et al.9 con anterioridad. El ritmo cardíaco de todos los pacientes se controló con monitorización de 24 horas mediante un monitor Holter cardíaco digital de tres canales (Eccosuc HT103, estado sólido). Finalmente, solo en un pequeño número de sujetos los estudios de admisión podrían complementarse con resonancia magnética.
El análisis estadístico, buscando la interdependencia significativa de distintas variables categóricas, se realizó mediante tablas de contingencia de ji al cuadrado 2 × 2, con un nivel de significancia de 0.05. Se calcularon la sensibilidad, la especificidad y los valores predictivos de varios marcadores clínicos, ECG, Holter y ecocardiografía para predecir la FEVI baja (< 40%) y las taquicardias ventriculares no sostenidas (TVNS) y sostenidas (TVS).
Resultados
En un período de 36 meses consecutivos, 627 pacientes fueron diagnosticados como CChC, y de ellos, 60 tenían aneurismas documentados, 36 mujeres (60%) y 24 hombres (40%). Los datos demográficos, los síntomas y la clase funcional de la New York Heart Association se describen en la tabla 1.
Tabla 1 Datos generales de los pacientes con miocardiopatía chagásica crónica (n = 60)
| Sexo | |
| Femenino | (n = 36) (60%) |
| Masculino | (n = 24) (40%) |
| Edad promedio (años) | 50.1 ± 8.3 |
| Rango de edad (años) | 31-68 |
| Síntomas | |
| No síntomas | (n = 17) (28.3%) |
| Síncope | (n = 10) (16.7%) |
| Mareo | (n = 7) (11.7%) |
| Palpitaciones | (n = 33) (55%) |
| Dolor torácico | (n = 8) (13.3%) |
| Clase funcional de la New York | |
| Heart Association | |
| Clase I | (n = 44) (73.3%) |
| Clase II | (n = 14) (23.3%) |
| Clase III | (n = 2) (3.3%) |
De acuerdo con las definiciones y la progresión de la enfermedad de Chagas de la American Heart Association1, 44 pacientes (73.3%) podrían incluirse en la fase B1 de la clasificación, es decir, cardiopatía estructural, pero con función ventricular preservada y sin evidencia de antecedentes de insuficiencia cardíaca actual; de los 16 pacientes restantes, 3 tenían función ventricular deteriorada, pero sin síntomas previos ni actuales de insuficiencia cardíaca (fase B2), y solo 13 (21.7%) tenían la combinación de FEVI baja y síntomas de insuficiencia cardíaca (grupos C y D).
Electrocardiografía
De los 60 sujetos, 8 (13.3%) tenían un ECG normal. El ritmo sinusal estuvo presente en 58 individuos (97%), 13 de ellos con bradicardia grave (21.6%); la fibrilación auricular permanente solo se encontró en 2 pacientes (3%). Hubo bloqueos de rama en 28 sujetos, siendo el bloqueo de rama derecha, solo o asociado a bloqueo fascicular anterior izquierdo, la alteración más frecuente (Fig. 3); 32 pacientes (53.3%) no presentaron alteraciones de la conducción intraventricular. Se observaron alteraciones de la repolarización en el 60% de los casos, especialmente en las derivaciones correspondientes a la pared anteroseptal del VI (75%). La tabla 2 resume todos los datos.
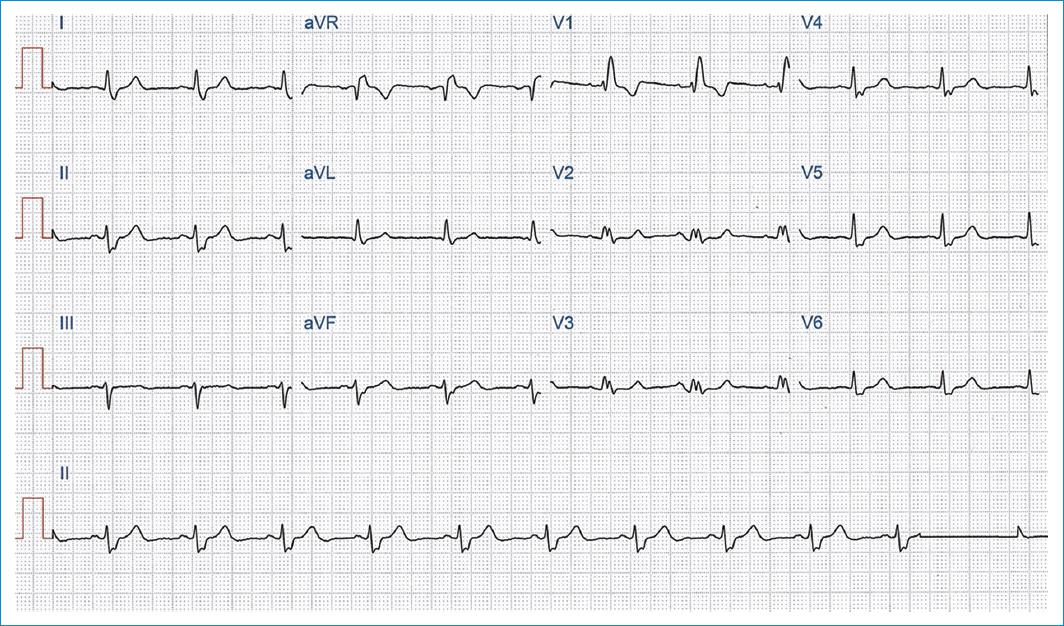
Figura 3 Electrocardiograma estándar de 12 derivaciones en un paciente con miocardiopatía chagásica crónica. Bloqueo avanzado de rama derecha con eje de QRS desviado a la izquierda (hemibloqueo anterior izquierdo).
Tabla 2 Variables electrocardiográficas en los pacientes con miocardiopatía chagásica crónica y aneurismas del ventrículo izquierdo (n = 60)
| Ritmo cardíaco | |
| Sinusal y FC normal | (n = 44) (73.3%) |
| Bradicardia sinusal | (n = 13) (21.7%) |
| Fibrilación atrial | (n = 3) (5%) |
| Complejos QRS | |
| Normal | (n = 34) (58.3%) |
| BRI | (n = 3) (5%) |
| HAI | (n = 7) (11.7%) |
| BRD | (n = 8) (13.3%) |
| BRD + HAI | (n = 8) (13.3%) |
| Repolarización anormal (n = 36) | |
| QRS normal | (n = 23) (38.3%) |
| QRS anormal | (n = 13) (21.7%) |
BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; FC: frecuencia cardíaca; HAI: hemibloqueo anterior izquierdo.
Monitoreo Holter
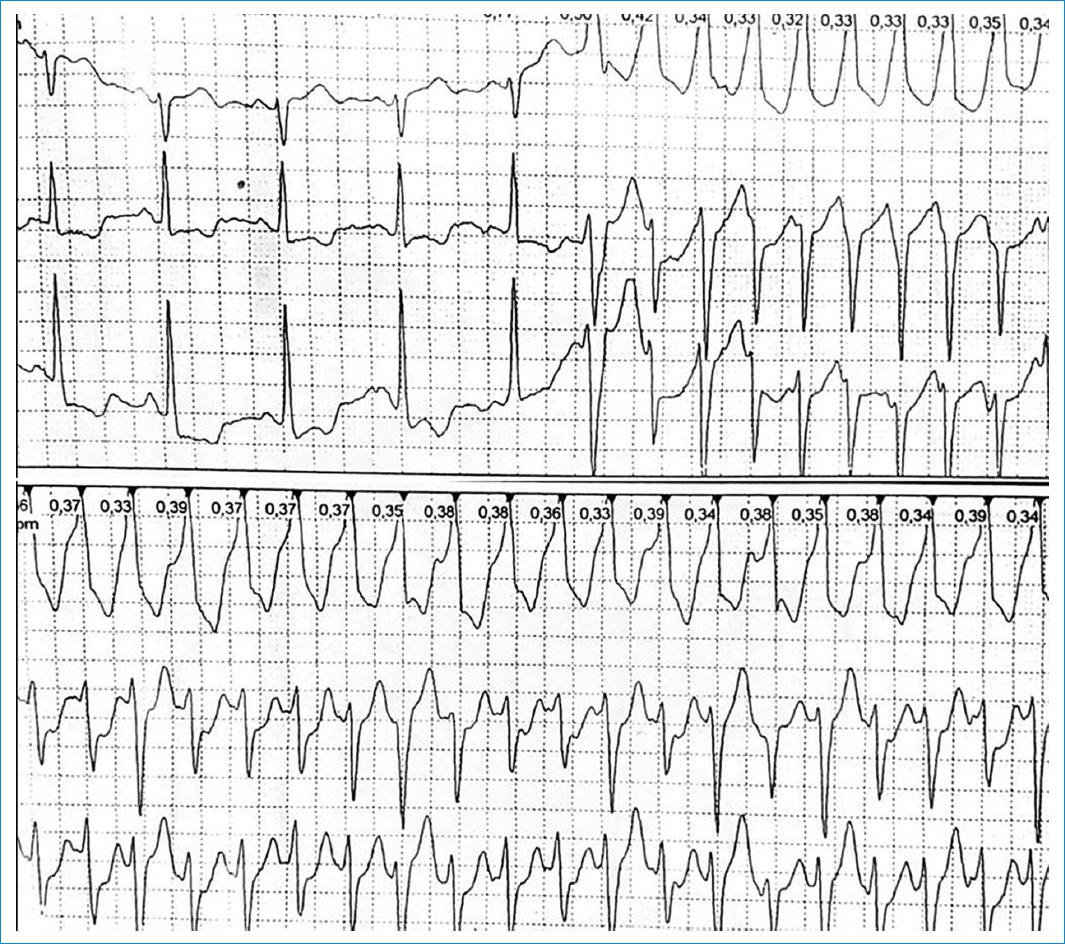
El monitoreo del ritmo cardíaco confirmó la presencia de complejos ventriculares prematuros en el 86.6% de los casos, TVNS en el 40% (n = 24) y TVS (Fig. 4) en el 13.3% (n = 8); el Holter fue normal en 5 pacientes (8.3%).
Ecocardiografía
En el 9.6% de los 627 pacientes con CChC se detectaron aneurismas ventriculares con ecocardiografía (n = 60). La prevalencia encontrada concuerda con diferentes publicaciones sobre aneurismas ventriculares en la enfermedad de Chagas9. Se encontró aneurisma apical en 53 pacientes (88.3%) y aneurisma inferolateral aislado en solo 1 paciente (1.7%); tanto apical como inferolateral se encontró en 6 casos (10%). De los 66 aneurismas detectados, 12 se describieron como abovedados y grandes (18.2%), todos ellos apicales; 54 se caracterizaron como pequeños. La FEVI fue normal (> 50%) en 44 casos, y de los 16 sujetos restantes con FEVI baja (< 50%), 3 estaban asintomáticos, mientras que los 13 restantes tenían síntomas de insuficiencia cardíaca (tabla 3). En la figura 5 se muestra un resumen gráfico de los principales hallazgos según la FEVI.
Tabla 3 Variables ecocardiográficas en los pacientes con miocardiopatía chagásica crónica con aneurismas ventriculares izquierdos (n = 60)
| DDVI promedio (mm) | 56.2 |
| Rango DDVI (mm) | 41-70 |
| DDVI > 53 mm | (n = 38) (63.3%) |
| FEVI promedio (%) | 53.4 ± 9.1 |
| Rango FEVI (%) | 33-75 |
| FEVI ≥ 50% | (n = 44) (73.3%) |
| FEVI rango medio (40-49%) | (n = 10) (16.7%) |
| FEVI reducida (< 40%) | (n = 6) (10%) |
| Aneurisma apical | (n = 53) (88.3%) |
| Aneurisma inferolateral | (n = 1) (1.7%) |
| Más de un aneurisma | (n = 6) (10%) |
| Aneurismas grandes en domo | 12/66 (18.2%) |
| Aneurismas pequeños | 54/66 (81.8%) |
| Trombos intracavitarios | (n = 3) (5%) |
DDVI: diámetro diastólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo.
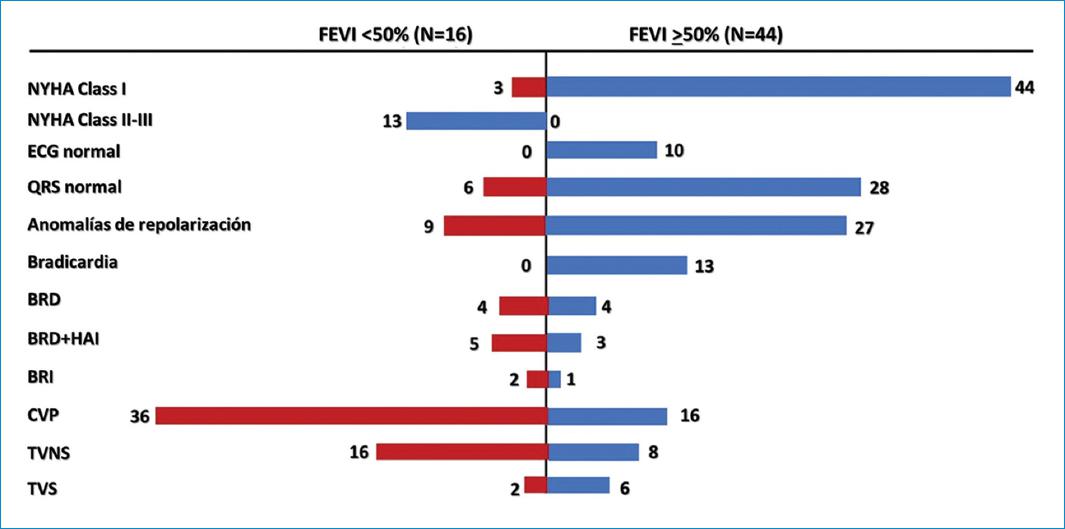
Figura 5 Comparación de la incidencia de diferentes variables respecto a la fracción de eyección del ventrículo izquierdo (FEVI). ECG: electrocardiograma; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; CVP: complejos ventriculares prematuros; NYHA: New York Heart Association; HAI: hemibloqueo anterior izquierdo; TVNS: taquicardia ventricular no sostenida; TVS: taquicardia ventricular sostenida.
Análisis estadístico
En nuestra serie de 60 pacientes con CChC y aneurismas ventriculares:
- Hubo una relación estadísticamente significativa entre la edad > 50 años y una FEVI normal (χ2 = 6.07; p = 0.014).
- No se encontró dependencia entre la edad y la TVS/TVNS (χ2 = 2.51; p = 0.11).
- El valor predictivo negativo de la clase funcional I con un ECG sin alteraciones de la conducción intraventricular para la detección de FEVI < 50% o taquicardia ventricular fue del 47.4%.
- Las alteraciones de la conducción intraventricular como marcador de FEVI < 50% tienen una sensibilidad del 56.2%, una especificidad del 65.9%, un valor predictivo positivo del 37.5% y un valor predictivo negativo del 80%. No se encontró relación significativa entre los trastornos de la conducción intraventricular y la FEVI (χ2 = 3.26; p = 0.71).
- Las alteraciones de la conducción intraventricular como marcador para predecir TVS/TVNS tienen una sensibilidad del 33.3%, una especificidad del 50%, un valor predictivo positivo del 40% y un valor predictivo negativo del 42.9%. No hubo asociación estadísticamente significativa entre las alteraciones de la conducción intraventricular y la TVS/TVNS (χ2 = 1.9043; p = 0.29).
- El tamaño del aneurisma (grande frente a pequeño) fue un predictor de FEVI: los aneurismas grandes se relacionaron significativamente con una FEVI < 50% (χ2 = 9.8491; p = 0.0017).
- El tamaño del aneurisma (grande frente a pequeño) no fue un predictor de TVS/TVNS (χ2 = 0.417; p = 0.52).
- No se encontró una dependencia significativa cuando se comparó el diámetro ventricular telediastólico con la incidencia de TVS/TVNS (χ2 = 1.15; p = 0.28).
- No hubo asociación estadísticamente significativa entre la FEVI y la TVS/TVNS (χ2 = 1.3636; p = 0.24).
- Los pacientes en fase B1-2 no tienen mayor riesgo de TVS/TVNS que los pacientes en fase C-D, pero la muestra de la fase C-D es muy pequeña; la prueba χ2 (con corrección de Yates) no fue significativa (χ2 = 1.93; p = 0.16).
Discusión
El carácter proteiforme de la presentación clínica de la miocardiopatía chagásica y el alto riesgo de eventos potencialmente mortales, incluso cuando la expresión clínica de la enfermedad es mínima, requieren el esfuerzo y la atención de los cardiólogos en contacto con estos pacientes10,11. El estadio de expresión clínica cardiológica de la enfermedad de Chagas se manifiesta de forma variada, incluyendo la aparición de cardiomegalia, insuficiencia cardíaca, fenómenos tromboembólicos, disfunción sinusal, arritmias auriculares o ventriculares, bloqueos sinoauriculares, auriculoventriculares e intraventriculares, y aneurismas ventriculares12-15.
Aneurismas ventriculares en la cardiopatía isquémica y la cardiopatía chagásica
El 30-35% de los pacientes con enfermedad de las arterias coronarias con infarto de miocardio transmural desarrollarán un aneurisma ventricular durante la etapa crónica, debido al proceso de remoción del tejido miocárdico afectado y su reemplazo por tejido fibroso, avascular y no elástico, lo que eventualmente generará dilatación y formación de un aneurisma. En sujetos que han sufrido un infarto de miocardio, la presencia de aneurisma ventricular es un factor de riesgo independiente para manifestación de síntomas, fracción de eyección baja y muerte súbita cardíaca; el tejido fibroso en el sitio del aneurisma o en la zona de transición del miocardio normal a la pared del aneurisma puede, además, convertirse en un foco arrítmico, que puede dar origen a taquicardia o fibrilación ventricular16,17. La mayoría de los pequeños aneurismas del VI son asintomáticos y se encuentran casualmente en la ecocardiografía de seguimiento, o se sospechan por la elevación persistente del segmento ST en el ECG, en particular en la pared anteroseptal.
En la CChC, los mecanismos patogénicos que conducen al desarrollo de aneurismas ventriculares son diferentes, como Milei et al.18 han analizado extensamente. El miocardio presenta una reacción inflamatoria crónica, con miocitólisis y fibrosis, con la adición de parches de tejido normal, asociada a afectación miocárdica incipiente o procesos necróticos, rodeados de tejido fibroso. A nivel ultraestructural hay hipertrofia de miocitos, con pérdida total o parcial de miofibrillas, con inflamación de las mitocondrias y rotura de sus crestas, con acumulación de gránulos de lipofuscina y edema intracelular. La alteración más llamativa es el engrosamiento de la membrana basal de los miocitos, el endotelio vascular y las células del músculo liso. La superposición entre los bordes de fibras sanas y aquellas con daño incipiente produce una configuración ideal para circuitos de reentrada y arritmias19,20.
En los pacientes isquémicos asintomáticos, los aneurismas ventriculares postinfarto son generalmente de pequeño tamaño; los de proporciones significativas se asocian a síntomas y, con mayor frecuencia, a complicaciones derivadas de la presencia de trombos y arritmias originadas en la zona límite entre aneurisma y tejido sano21. En nuestra serie de CChC se detectaron aneurismas extensos en pacientes asintomáticos (Fig. 5), incluyendo casos con trombos dentro del saco aneurismático; sin embargo, había una asociación inversa entre el tamaño del aneurisma y la FEVI. Por el contrario, no hemos encontrado ninguna correlación entre el tamaño del aneurisma y la incidencia de arritmia ventricular grave; el pequeño número de casos exige un estudio más amplio. La fibrosis en parches del VI en los casos de CChC (en lugar de las cicatrices transmurales en la enfermedad isquémica y la hipocinesia relacionada con la isquemia grave) posiblemente podría explicar por qué las anomalías del movimiento de la pared son menos prominentes18, conservando estos pacientes, al menos durante más tiempo, la FEVI y, por extensión, la clase funcional. En nuestra serie, el 73.3% de los pacientes tenían una FEVI normal, incluso en el caso de grandes aneurismas (Fig. 6).
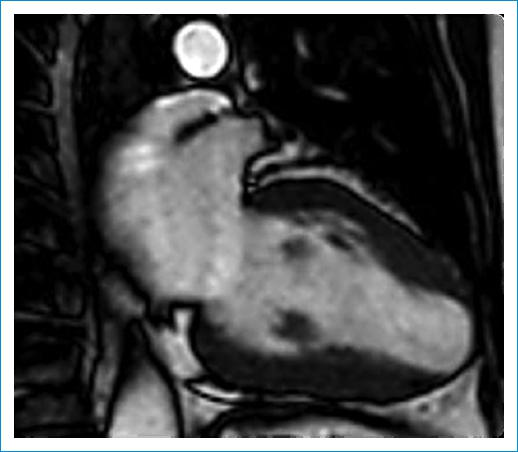
Figura 6 Resonancia magnética cardíaca de una paciente de 60 años con un aneurisma ventricular izquierdo grande en forma de cúpula. La fracción de eyección del ventrículo izquierdo era del 60% y no mostraba síntomas de insuficiencia cardíaca.
Los pacientes con aneurismas del VI, clase funcional I y ECG normal fueron el 13.3% de los casos (n = 8). La tasa aumenta al 28.3% (n = 17) cuando las anomalías del ECG se limitaban a una repolarización anormal, con QRS normal; de estos 17 pacientes, 16 tenían una FEVI normal y el restante tenía un valor límite normal (FEVI 49%). Si casi un tercio de los pacientes con aneurismas del VI evaluados solo con datos clínicos y electrocardiográficos están en clase funcional I y tienen un QRS normal, es obvio que todo paciente con diagnóstico confirmado de enfermedad de Chagas debería tener un estudio ecocardiográfico completo.
En el caso de la inestabilidad eléctrica, como han señalado Tassi et al.22, existe una relación entre la cantidad de fibrosis detectada y la posibilidad de generar arritmias ventriculares graves, pero incluso en pacientes con niveles bajos de fibrosis el riesgo sigue presente (Fig. 4)23,24. Además, 15 de 17 pacientes con características clínicas y electrocardiográficas poco relevantes tuvieron una monitorización Holter anormal, lo que refleja una marcada inestabilidad eléctrica; por lo tanto, la monitorización Holter también debe ser parte de un enfoque de diagnóstico holístico para los pacientes chagásico25-27.
Conclusiones
En los pacientes con serología positiva para Chagas se recomienda un estudio completo de monitorización ecocardiográfica28-30 y Holter, independientemente del estado clínico y de las características del ECG. El valor predictivo negativo de estos criterios es demasiado bajo y no permite excluir los riesgos de fenómenos embólicos, arritmias graves o desarrollo de insuficiencia cardíaca31,32.