Introducción
En el cuarto trimestre del año 2020 fallecieron 169,252 personas en Colombia. Aunque la causa principal de muerte en ese año fueron las enfermedades infecciosas (23.7%) incluida la COVID-19, el grupo de las enfermedades cardiometabólicas ocasionó el 23.9% de las muertes en el país. Este grupo incluye las enfermedades isquémicas del corazón (segunda causa de muerte, n = 24.181, 14.3%), la enfermedad cerebrovascular (cuarta causa de muerte, n = 7.189, 4.2%), las enfermedades hipertensivas (sexta causa de muerte, n = 4857, 2.9%) y la diabetes mellitus (décima causa de muerte, n = 4.303, 2.5%)1. Antes del inicio de la pandemia de COVID-19, las enfermedades isquémicas del corazón fueron la primera causa de muerte en el país (n = 20.522, 15.7%).
Estos datos apoyan la necesidad de disponer de nuevas opciones terapéuticas que prevengan los factores de riesgo cardiovascular, en cuyo caso el colesterol plasmático elevado es un factor predominante y fácilmente modificable. Las guías europeas recientemente publicadas sobre el manejo de la dislipidemia establecen diferentes categorías de riesgo y metas de colesterol LDL (c-LDL) según el riesgo de los pacientes. Parte fundamental del abordaje terapéutico requiere modificaciones en el estilo de vida y el uso de estatinas en la mayoría de los pacientes. En algunos casos, de acuerdo con el riesgo cardiovascular y el c-LDL, se hace necesario el uso de terapias no estatínicas, como el ezetimibe, los inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9; su sigla en inglés), el ácido bempedoico y el ácido etil-eicosapentano (EPA altamente purificado). Estas terapias han sido evaluadas en diferentes estudios y han demostrado su efectividad en la disminución del c-LDL y del riesgo cardiovascular2-6.
Es importante mencionar, que, a la fecha de realización de este trabajo, los ácidos bempedoico y etil-eicosapentano no son opciones terapéuticas disponibles en Colombia. Por otra parte, aunque los inhibidores de la PCSK9 han demostrado su seguridad y efectividad, se ha discutido en algunos escenarios su costo-efectividad. Independiente de lo anterior, estas moléculas han demostrado la importancia de la PCSK9 en la regulación del c-LDL, además de confirmar, que concentraciones bajas de c-LDL no están asociadas con un perfil de seguridad terapéutica deletéreo. Esto ratifica la plausibilidad biológica de la PCSK9 como un objetivo terapéutico real y su relación con la disminución de eventos cardiovasculares.
En la actualidad existen otras opciones terapéuticas que tienen como objetivo una acción biológica sobre la PCSK9. La molécula que se encuentra aprobada por la Agencia Europea de Medicamentos (EMA) y que pronto estará disponible en Colombia es el inclisiran. A diferencia de los MAbs inhibidores de la PCSK9, este medicamento silencia la transcripción y producción de la PCSK9 mediante un mecanismo de acción novedoso, el ARN de interferencia pequeño. Los niveles plasmáticos máximos de inclisiran se producen cuatro horas después de su administración y este se excreta a través del riñón. Cuenta con una modificación triantenario de N-acetilgalactosamina (GalNAc) que asegura la rápida captación hepática a través del receptor de la asialoglicoproteína (ASGPR), expresados exclusivamente en los hepatocitos. A nivel hepático, inclisiran se une al complejo silenciador y se vuelve indetectable en plasma dentro de las 48 horas posteriores a su administración y tiene un efecto sistémico mínimo. Ha demostrado gran potencia para disminuir el c-LDL con la importante ventaja de una aplicación semestral, y por este motivo, algunos investigadores han sugerido que esta estrategia terapéutica se asemeja a una vacunación7.
En esta revisión se pretende recopilar los estudios publicados a la fecha (abril del 2021) con esta molécula, hacer una síntesis de la evidencia y plantear la utilidad y el beneficio de su uso en Colombia.
Metodología
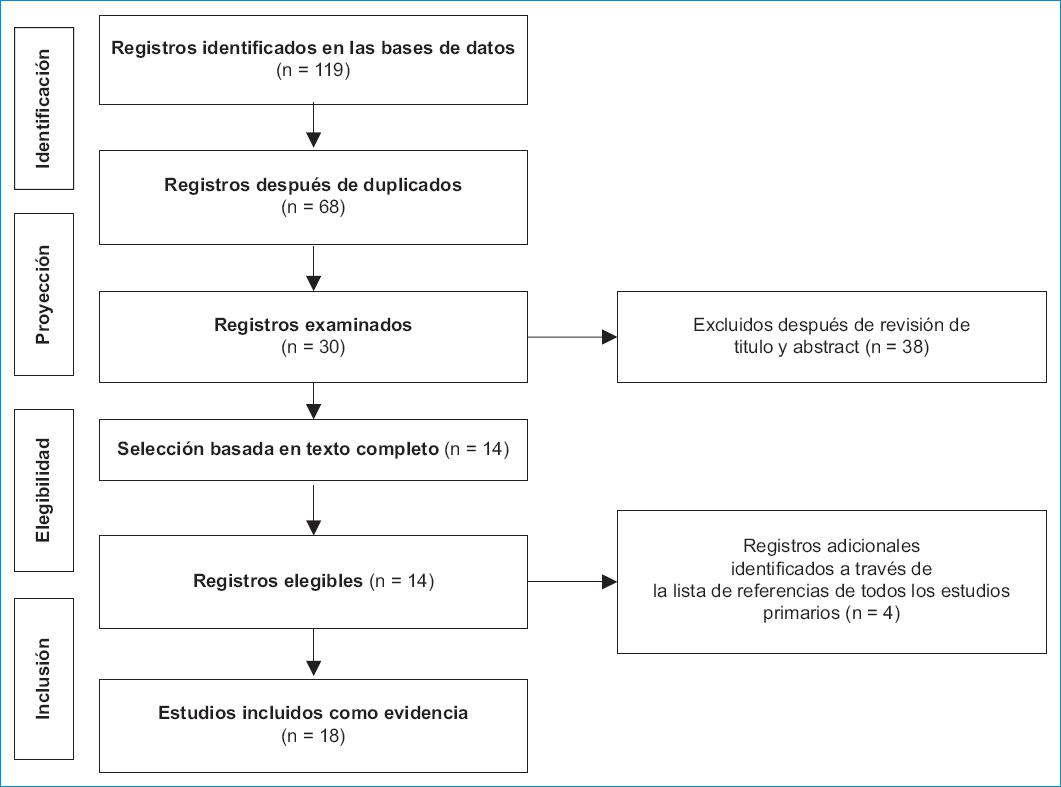
Se realizó una búsqueda en las bases de datos electrónicas PubMed/MEDLINE y Embase. Se utilizaron los términos de búsqueda (MeSH, Medical Subject Headings), "Inclisiran" o "ALN PCS". Se consideraron estudios publicados en revistas indexadas hasta abril de 2021, sin límite inicial de tiempo e idioma. Un total de 119 artículos coincidieron con los criterios de búsqueda. Se excluyeron aquellos registros duplicados y la investigación se complementó con la consulta de las listas de referencias de los artículos primarios. Se seleccionaron ensayos clínicos, revisiones sistemáticas y metaanálisis para su inclusión como evidencia (n = 18) (Fig. 1). Debido al interés exclusivo por realizar una revisión exploratoria y descriptiva con relación a la evidencia sobre el tema no se establecieron a priori otros criterios de elegibilidad para los estudios.
Anticuerpos monoclonales inhibidores de la PSCK9
La PCSK9 es una proteína sintetizada por el hígado y secretada en la circulación, que funciona como reguladora del metabolismo del c-LDL8. En los hepatocitos se une al dominio A del factor de crecimiento epidérmico (EGF-A, por su sigla en inglés) del receptor LDL (R-LDL), formando un complejo entre la proteína y el receptor, que luego es endocitado. Una vez internalizados, promueven la degradación lisosomal de los R-LDL. La reducción en la expresión de los R-LDL en la membrana celular de los hepatocitos, resulta en una disminución del metabolismo del c-LDL y, consecuentemente, en un aumento de los niveles de colesterol LDL circulante9.
Los MAbs inhibidores de la PCSK9 se dirigen a la PCSK9 libre extracelular e impiden su unión al R-LDL en la superficie de los hepatocitos; por tanto, reducen su degradación intracelular. Alirocumab y evolocumab, son MAbs humanizados inhibidores de la PSCK9 del del subtipo IgG1 e IgG2, respectivamente. La evidencia sugiere que causan una notable reducción del c-LDLC tanto en voluntarios sanos10,11, como en individuos con hipercolesterolemia12,13.
Alirocumab fue el primer MAb aprobado por la FDA; sus estudios en fase III se encuentran dentro del programa ODISSEY el cual engloba 16 ensayos clínicos que evaluaron su eficacia y seguridad en escenarios de hiperpercolesterolemia familiar heterocigota (HFHe), alto riesgo cardiovascular e intolerancia al uso previo de estatinas14. Este inhibidor de la PSCK9 ha demostrado reducir el c-LDL en un 45 a un 62%, con un perfil de seguridad comparable al del placebo. Su uso incluye dosis de 75 mg SC cada dos semanas, con titulación de hasta 150 mg SC cada dos semanas, según respuesta15.
Por su parte, evolocumab engloba un total de 14 estudios en fase III dentro del programa PROFICIO (programa para reducir el c-LDL y los eventos cardiovasculares mediante la inhibición de la PSCK9 en diferentes poblaciones; por su sigla en inglés)16. Esta molécula demostró una reducción dependiente de la dosis, entre el 43 y el 75% del c-LDL y una incidencia de efectos adversos similar a la del placebo con cada régimen de dosificación. La dosis actual recomendada de evolocumab es de 140 mg cada dos semanas o 420 mg una vez al mes; ambas dosis son clínicamente equivalentes17.
Por último, a diferencia de los anteriores, el bococizumab no es un anticuerpo totalmente humano, que mostró reducir los niveles de c-LDL en un 55% durante 12 semanas en los ensayos SPIRE 1 y 2 (NCT01975376, NCT01975389). No obstante, durante dichos estudios se demostró el desarrollo de anticuerpos neutralizantes, hecho que condujo a una incapacidad imprevista para mantener la reducción del c-LDL con el tiempo, además, de una elevada tasa de reacciones en el sitio de la inyección18.
Los MAbs aprobados por la FDA (alirocumab y evolocumab) han demostrado una reducción significativa y constante del c-LDL en diferentes escenarios clínicos, lo que ofrece grandes ventajas respecto a los fármacos hipolipemiantes orales. Estudios en vida real sugieren que el incumplimiento del régimen de dosificación continúa siendo un problema, fenómeno que, eventualmente, mitiga sus potenciales beneficios7,19.
Mecanismo de acción de inclisiran
Inclisiran es un ARN de interferencia pequeño (ARNip) químicamente modificado, conjugado a un triantenarioN- acetilgalactosamina, que ejerce su acción mediante la activación de la vía natural del silenciamiento selectivo de la expresión génica de la PCSK9 en los hepatocitos20. Los ARNip están compuestos por dos hebras: una hebra sentido (guía) y una antisentido (pasajera)21,22. Una vez dentro del hepatocito, los ARNip son reconocidos por un complejo enzimático de silenciamiento inducido por ARN (RNA-induced silencing complex -RISC-, su sigla en inglés]), el cual, a través de una actividad similar a una helicasa, desenrolla la doble hebra del ARNip para unirse a la hebra guía, que posteriormente experimenta una hibridación con la hebra complementaria del ARN mensajero (ARNm) del PCSK9 y escinde el ARNm. Una vez el ARNm está escindido, se degrada catalíticamente, lo que limita su traducción y, por ende, evita la síntesis de PCSK9 en el hígado. Esto conduce a promover el reciclaje de R-LDL, que se refleja en un incremento en la captación de c-LDL llevando a su reducción en plasma (Fig. 2). Se ha observado que el complejo silenciador permanece activo después de ocurrida la degradación de ARNm, por lo que una sola molécula de ARNip puede interferir con la expresión de múltiples moléculas de ARNm20,22.
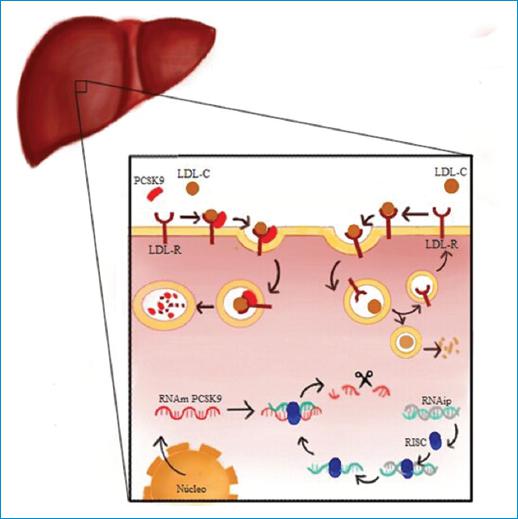
Figura 2 Representación esquemática del mecanismo de acción del inclisiran (fármaco RNA de interferencia pequeño). En el hepatocito los ARNip son reconocidos por el complejo silenciador inducido por ARN (RISC), que desenrolla la doble hebra del ARNip para unirse a la hebra guía. Posteriormente, la hebra se hibrida con el ARNm del PCSK9, es escindido y degradado catalíticamente, evitando la traducción y síntesis del PCSK9; los LCL-R pueden ser reciclados a membrana para ser reutilizados en el metabolismo del c-LCL, reduciendo niveles séricos.
Eficacia y beneficio de inclisiran
Inclisiran en la reducción de los niveles c-LDL
La eficacia de inclisiran en la reducción del c-LDL, inicialmente se evaluó en ensayos clínicos de fase 1 que enrolaron voluntarios sanos con valores de c-LDL de al menos 100 mg/dl. Fitzgerald et al.23 realizaron un estudio aleatorizado, simple ciego, controlado con placebo en adultos con c-LDL de 116 mg/dl. Los sujetos fueron aleatorizados 3:1 para recibir una dosis de ALN PCSsc (molécula precursora de inclisiran), con dosis que oscilaban entre de 0,015 a 0,400 mg/kg. Los participantes en el grupo de dosis más alta obtuvieron una reducción del c-LDL y de la PCSK9 en 40 y 70%, respectivamente (p < 0,001). Un segundo estudio24, publicado tres años después, reclutó 70 individuos entre los 18 y 75 años quienes fueron asignados aleatoriamente en una proporción de 3:1 para recibir una inyección subcutánea de inclisiran (ALN PCSsc) o placebo en una fase de dosis única ascendente (a una dosis de 25, 100, 300, 500 u 800 mg) o una fase de dosis múltiple (125 mg semanales para cuatro dosis, 250 mg cada dos semanas para dos dosis y 300 o 500 mg mensuales para dos dosis, con o sin terapia concurrente con estatinas). En la fase de dosis única, el nivel de c-LDL se redujo significativamente respecto al placebo, al día 84 después de recibir una dosis de inclisiran de 100 mg o más; la diferencia de medias osciló entre el 36.7 y el 50.6%, mientras que la mayor reducción se observó con la dosis de 500 mg de inclisiran. Por su parte, en el grupo de sujetos aleatorizados a la fase de dosis múltiple, se evidenció una disminución significativa de c-LDL, con una diferencia de medias al día 84 después de recibir la primera dosis, que varió entre el 45.1 y 59.7%, para todos los regímenes de inclisiran, excepto para la cohorte que recibió 125 mg semanales, durante 4 semanas. En este caso, la mayor reducción se alcanzó en el subgrupo que recibió 300 mg de cada mes, durante dos meses. El efecto sobre el colesterol, la ePCSK9 y el c-LDL persistió durante al menos 180 días después del inicio del tratamiento, y hubo poca variación durante un período de seis meses después de la primera dosis.
Teniendo en cuenta los resultados anteriores, se inició el programa ORION, un conjunto de diferentes ensayos clínicos mundiales, cuyo propósito es evaluar la eficacia de inclisiran en una variedad de individuos, incluidos aquellos con alto riesgo de enfermedad cardiovascular aterosclerótica, enfermedad cardiovascular aterosclerótica establecida e hipercolesterolemia familiar (HF) (Tabla 1).
Tabla 1 Resumen de los estudios clínicos de Inclisiran.
| Estudio | Descripción | Población | Intervención | Desenlace | Resultado |
|---|---|---|---|---|---|
| ORION-1 | Comparación del efecto de diferentes dosis (200 mg, 300 mg y 500 mg) de ALN-PCSSC, en pacientes con enfermedad cardiovascular aterosclerótica o equivalentes de riesgo de enfermedad cardiovascular aterosclerótica (DM2, HF) y c-LDL elevado a pesar de dosis máxima tolerada de terapia Fase 2 Multicéntrico Placebo vs. control, aleatorizado, doble ciego | 501 pacientes. Hombres y mujeres ≥ 18 años LDL-C ≥ 70 mg/dl en pacientes con historial de enfermedad cardiovascular aterosclerótica ≥ 100 mg/dl en pacientes sin este historial TGL en ayunas < 400 mg/dl | Dosis única: ALN-PCSSC (200 mg vs. 300 mg vs. 500 mg subcutáneo en día 1) vs. placebo (salino 0.9% inyección subcutánea) Dosis doble: ALN-PCSSC (100 mg vs. 200 mg vs 300 mg subcutáneo en el día 1 y día 90) vs. placebo (salino 0.9% inyección subcutánea) en día 1 y día 90 | Cambio porcentual del c-LDL de referencia en día 1 hasta el día 180 | Día 180: Reducción media de c-LDL: 1 dosis: entre 27.9% y 41.9%. 2 dosis: entre 35.5% y 52.6% Mayor reducción de c-LDL con doble dosis: 48% de sujetos tuvieron un LDL-C <50 mg/dl para el día 180. Efectos adversos severos en 11% de los pacientes que recibieron Inclisiran y en 8% de los pacientes con placebo. |
| ORION-2 | Evaluación de la eficacia, seguridad y tolerabilidad de ALN-PSSC en sujetos con HoFH Fase 2 Multicéntrico, Abierto, 1 brazo | 9 participantes. Hombres y mujeres ≥ 12 años con diagnóstico de HoFH En ayunas con c-LDL ≥ 130 mg/dl y TGL< 400 mg/dl Peso ≥ 40 kg | ALN-PCSSC (300 mg subcutáneo en día 1) más terapia estándar (estatinas a dosis máxima tolerada y/u otra terapia para disminuir c-LDL) | Cambio porcentual del c-LDL desde el día 1 hasta el día 90 Cambio porcentual del c-LDL desde el día 1 hasta el día 180 (visita final) | Por el pequeño número de sujetos y que los datos no se distribuían normalmente, se presentan los datos como estadística descriptiva sin inferencia. |
| ORION-3 | Eficacia, seguridad y tolerabilidad de la dosificación a largo plazo de inclisiran y evolocumab. Estudio de extensión del ORION-1. Fase 2 Estudio de extensión, a largo plazo, abierto | 490 participantes que completaron el estudio ORION-1 y fueron tratados previamente con cualquier dosis de inclisiran | Brazo 1: inclisiran 300 mg inyección subcutánea en día 1 y después cada 180 días por 4 años Brazo 2: evolocumab inyección subcutánea 140 mg en día 1 y después cada 14 días hasta el día 336. Seguido de inyecciones de inclisiran 300 mg a partir del día 360 y después cada 180 días por 4 años | Cambio porcentual en c-LDL en el día 210 comparado con el día 1 del estudio ORION-1 | En curso Estado de reclutamiento: activo, no reclutando Fecha estimada de finalización primaria: diciembre 31 de 2021 Fecha estimada de terminación: febrero 28 de 2022 |
| ORION-4 | Efectos de inclisiran y si este disminuye de forma segura el riesgo de IAM o ACV en sujetos quienes ya han presentado una de estas condiciones. Fase 3 Aleatorizado con cegamiento cuádruple, placebo vs. control | 15000 participantes ≥ 55 años con enfermedad cardiovascular aterosclerótica establecida | Inclisiran (300 mg subcutáneo en día 1, día 90 y después cada 180 días) vs. placebo (salino 0.9% subcutáneo en día 1, día 90 y después cada 180 días) | Número de participantes con un evento cardiovascular mayor. Definido como: Muerte por enfermedad coronaria IAM ACV fatal o no fatal Revascularización coronaria | En curso Estado de reclutamiento: activo, reclutando Fecha estimada de finalización primaria: julio de 2026 Fecha estimada de finalización del estudio: diciembre de 2029 |
| ORION-5 | Eficacia, seguridad y tolerabilidad de inclisiran en sujetos con HoFH: Fase 3 Multicéntrico, doble ciego, placebo vs. control abierto | 56 adultos con diagnóstico de HoFH LDL-C ≥ 100 mg/dl a pesar de máxima dosis tolerada de terapia con estatinas con o sin ezetimibe | Parte 1: período de 6 meses con cegamiento doble y aleatorización Inclisiran (300 mg subcutáneo en día 1 y día 90) vs. placebo (salino 0.9% subcutáneo en día 1 y día 90) Parte 2: 18 meses de seguimiento abierto. Todos los sujetos recibirán una dosis subcutánea de inclisiran 300 mg en los días 180, 270, 450 y 630 | Cambio porcentual en c-LDL de referencia hasta el día 150 | En curso Estado de reclutamiento: activo, no reclutando Fecha estimada de finalización primaria: marzo 2 de 2020 Fecha estimada de finalización del estudio: septiembre 30 de 2021 |
| ORION-6 | Farmacocinética de dosis única de inclisiran en participantes con diferentes grados de lesión hepática comparados con sujetos normales Fase 1, abierto, asignación paralela | 28 pacientes Hombres y mujeres entre 18-80 años. Participantes son incluidos según su función hepática basada en la clasificación Child-Pugh A o B. | Inclisiran 300 mg subcutáneo en día 1, en pacientes: Función hepática normal Child-Pugh A Child-Pugh B | PK del inclisiran: Cmax Tmax y t1/2 AUC0-24, AUC0-48, y AUC0-inf CL/F Vd/F F CLr | Pacientes CP B tuvieron un Cmax 2.1 veces mayor y un AUC inf 2.04 veces mayor comparado con sujetos con función hepática normal En todos los grupos inclisiran fue indetectable en plasma en 96 horas. No se considera necesario ajustar la dosis en sujetos con IH leve o moderada |
| ORION-7 | Farmacocinética de dosis única de inclisiran en participantes con IR leve, moderada y grave, comparada con función renal normal. Fase 1 Ensayo abierto, asignación paralela | 31 pacientes Hombres y mujeres entre 18-80 años. Participantes incluidos según rango de CrCl | Inclisirán 300 mg subcutáneo en día 1, en pacientes con: Función renal normal (CrCl ≥ 90 ml/min) IR leve (CrCl 60-89 ml/min) IR moderada (CrCl 30-59 ml/min) IR grave (CrCl 15-29 ml/min) | PK del inclisiran: Cmax Tmax y t1/2 AUC0-24, AUC0-48, y AUC0-inf CL/F Vd/F F CLr | Inclisiran es indetectable en plasma a las 48 horas después de su administración en todos los grupos El Pk y el perfil de seguridad fueron similares en los participantes con función renal normal y alterada. No se requirió ajuste de dosis |
| ORION-8 | Efectos a largo plazo de inclisiran en sujetos con enfermedad cardiovascular aterosclerótica o equivalentes de riesgo de enfermedad cardiovascular aterosclerótica que hayan completado cualquiera de los estudios fase 3 referentes a inclisirán: ORION 9, ORION 10, ORION 11 u ORION 5. Fase 3 Ensayo abierto, de extensión a largo plazo, multicéntrico. | 2.991 participantes hombres y mujeres ≥ 18 años Finalización de cualquier estudio ORION fase 3 Valores elevados de c-LDL a pesar de dosis máxima tolerada de terapia hipolipemiante | Inclisirán (300 mg subcutáneo dosis única en el día 1*, día 90, y después cada 180 días hasta el día 990) *Sujetos que recibieron el placebo previamente, recibirán inclisiran y sujetos a quienes se les dio inclisiran previamente tendrán placebo en día 1 | Proporción de sujetos que alcancen durante el tratamiento: c-LDL < 70 mg/dl c-LDL < 100 mg/dl | En curso Estado de reclutamiento: activo, no reclutando Fecha estimada de finalización primaria: agosto de 2023 Fecha estimada de finalización del estudio: diciembre de 2023 |
| ORION-9 | Efectos de inclisiran 300 mg en sujetos con HeFH y c-LDL elevado a pesar de manejo con dosis máxima tolerada de terapia con estatinas con o sin ezetimibe. - Fase 3 - Aleatorizado, - Doble ciego - Placebo - control | 482 hombres o mujeres ≥ 18 años Diagnóstico de HeFH LDL ≥ 100 mg/dl TGL ayunas < 400 mg/dl Terapia con dosis máxima tolerada de estatinas | Inclisiran (300 mg subcutáneo en día 1, día 90 y luego cada 180 días) vs. Placebo (salino 0.9% inyección subcutánea en día 1, día 90 y luego cada 180 días) | Cambio porcentual del c-LDL de referencia hasta el día 510 Cambio porcentual de c-LDL con ajuste del tiempo del c-LDL basal desde día 1, después del día 90 y hasta el día 540 | Para el día 510, se documentó una reducción del 39.7% de los valores de c-LDL en el grupo de inclisiran, y un aumento del 8.2% en el grupo placebo - con una diferencia total entre grupos del 47.9% Los efectos adversos fueron similares en ambos grupos |
| ORION-10 | Efectos de inclisiran 300 mg en sujetos con enfermedad cardiovascular aterosclerótica y c-LDL elevado a pesar de dosis máxima tolerada de terapia para disminuir c-LDL. Fase 3 Aleatorizado Doble-ciego Placebo-control Grupo paralelo | 1.561 hombres o mujeres ≥ 18 años en Estados Unidos Historial de enfermedad cardiovascular aterosclerótica c-LDL ≥ 70 mg/dl TGL en ayunas < 400 mg/dl | Inclisirán 300 mg subcutáneo en día 1, día 90 y luego cada 180 días por un período de 540 días vs. placebo (salino 0.9% subcutáneo de solución salina en el día 1, día 90 y luego cada 180 días | Cambio porcentual de c-LDL de referencia hasta el día 510 Cambio porcentual de c-LDL con ajuste del tiempo del c-LDL basal desde día 1, después del día 90 y hasta el día 540 | Para el día 510, inclisiran redujo el c-LDL en un 53.8% (con ajuste en el tiempo). Los efectos adversos fueron similares en ambos grupos Los efectos relacionados al sitio de inyección fueron más frecuentes en el grupo de inclisiran (2.6 vs. 0.9%) |
| ORION-11 | Efecto de 300 mg de inclisiran en sujetos con enfermedad cardiovascular aterosclerótica o equivalentes de riesgo de enfermedad cardiovascular aterosclerótica y c-LDL elevado a pesar de dosis máxima tolerada en terapia para disminuir c-LDL Fase 3 Multicéntrico Aleatorizado Doble-ciego, placebo-control Grupo paralelo | 1.617 adultos ≥ 18 años en Europa y Sudáfrica c-LDL ≥ 70 mg/dl TGL en ayunas < 400 mg/dl | Inclisiran 300 mg en 1.5 ml, subcutáneos en el día 1, día 90 y después cada 180 días vs. placebo (salino 0.9%, 1.5 ml, subcutáneos en día 1, día 90 y luego cada 180 días | Cambio porcentual de c-LDL de referencia hasta el día 510 Cambio porcentual con ajuste de tiempo del c-LDL de referencia, después del día 90 y hasta el día 540 | Para el día 510, inclisiran redujo los niveles de c-LDL en un 49.2% (con ajuste en el tiempo). Los efectos adversos fueron similares en ambos grupos Los efectos relacionados al sitio de inyección fueron más frecuentes en el grupo de inclisiran (4.7 vs. 0.5%) |
DM2: diabetes mellitus tipo 2; HF: hipercolesterolemia familiar; TGL: triglicéridos; HoFH: hipercolesterolemia familiar homocigota; HeFH: hipercolesterolemia familiar heterocigota; IAM: infarto agudo de miocardio; ACV: accidente cerebrovascular; Pk: farmacocinética; Cmax: concentración máxima; Tmax: tiempo máximo; t1/2: vida media; AUC: área bajo la curva; CL/F: aclaramiento; Vd/F: volumen de distribución; F: biodisponibilidad absoluta; CLr: aclaramiento renal; IR: insuficiencia renal.
ORION-1 fue un ensayo multicéntrico de fase 2, aleatorizado, doble ciego, controlado con placebo de dosis múltiples ascendentes de inclisiran en pacientes con alto riesgo de enfermedad cardiovascular aterosclerótica que tenían niveles elevados de c-LDL. Se aleatorizaron 500 sujetos para recibir una dosis única de placebo o 200, 300 o 500 mg de inclisiran o dos dosis (en los días 1 y 90) de placebo o 100, 200 o 300 mg de inclisiran. Desde el día 14 después de la primera inyección se encontró que los niveles de c-LDL ya estaban disminuyendo. Para el día 30, la reducción de c-LDL osciló entre el 44.5 y el 50.5% por debajo del valor inicial, con todas las dosis de inclisiran probadas. Se observó, además, un nadir aproximadamente al día 60 para los regímenes de dosis única, y al día 150 para el grupo de dos dosis. Para el régimen de una dosis, la reducción de c-LDL en el día 180 fue de 27.9 a 41.9% en tanto que con placebo se evidenció un aumento del 2.1% (p < 0.001). En el día 180, los individuos en el brazo de dos dosis experimentaron una reducción media en el c-LDL que varió entre 35.5 a 52.6%, mientras que el grupo placebo tuvo un aumento del 1.8% (p < 0.001). Los niveles de PCSK9 también se redujeron significativamente a los 180 días entre los pacientes que recibieron inclisiran25.
Un metaanálisis que agrupó los datos de cinco estudios primarios con la intención de valorar la eficacia y seguridad preliminar del inclisiran evidenció en el análisis por subgrupos que este redujo el c-LDL con una diferencia de medias estándar [DME] (-2.09; IC 95%: -2.51 a -1.66; p < 0.05) (DME -2.74; IC 95%: -3.61 a -1.87; p < 0.05) y (DME -2.21; IC 95%: -2.62 a -1.80; p < 0.05) para las dosis de 100 mg, 300 mg y 500 mg respectivamente, sin alcanzar la significancia estadística en las observaciones agrupadas. No se identificaron efectos favorables sobre los valores de triglicéridos (TGL) y colesterol de alta densidad (c-HDL)26.
Inclisiran tiene acción de larga duración, lo que puede ofrecer un régimen de dosificación conveniente para pacientes que requieren una reducción significativa del c-LDL. En el seguimiento de un año del ensayo ORION-1, se demostró que una dosis única de inclisiran y dos dosis a los días 1 y 90, redujeron los niveles de c-LDL promediados en el tiempo durante un año en 29.5%-38.7%, 29.9%-46.4%, respectivamente, en función de la dosis. Se mantuvo una reducción del 50 % de c-LDL durante al menos 6 meses después de 2 dosis de 300 mg de inclisiran los días 1 y 90. Además, este régimen de 2 dosis de 300 mg de inclisiran produjo la mayor reducción media de c-LDL durante más de un año27. Lo anterior, representa una ventaja del inclisiran respecto a otras terapias con una duración de acción más corta, como las estatinas, ezetimibe y los MAbs inhibidores de la PCSK9. La estabilidad relativa en los niveles alcanzados de c-LDL a lo largo del tiempo se puede lograr a pesar de una frecuencia de dosificación prolongada (seis meses), lo que, en teoría, podría atenuar las fluctuaciones a corto plazo en el c-LDL que pueden resultar del uso intermitente de la terapia concurrente con estatinas en sujetos con mala adherencia27,28.
Inclisiran en diabetes y dislipidemia aterogénica
Un estudio que evaluó la eficacia de inclisiran según datos provenientes del ensayo ORION-1 pero estratificado por historia de diabetes, evidenció que el tratamiento con inclisiran se asoció con fuertes reducciones en el c-LDL desde el día 14 hasta el día 210, independientemente del estado inicial de diabetes. La terapia con inclisiran también se asoció con disminuciones en el colesterol total (CT), apolipoproteína B aterogénica (Apo-B), colesterol no HDL (c-no HDL) y lipoproteína (a) [Lp(a)], así como una tendencia hacia aumentos en el c-HDL, sin tener correlación con el estado basal de diabetes o de la asignación al régimen de una o dos dosis. Adicionalmente, no se observaron cambios clínicamente significativos en la hemoglobina glicada (HbA1c) 180 días después del inicio del tratamiento, y esto persistió durante el transcurso del estudio29.
Por otra parte, evidencia experimental sugiere que la inhibición de la supresión génica de la PCSK9 con la consecuente reducción de su concentración intracelular, puede producir efectos positivos sobre el metabolismo de lípidos y lipoproteínas más allá del c-LDL30-32. En un análisis preespecificado del estudio ORION-1 se documentó que una dosis única de inclisiran logró reducir la Apo B y el C-no HDL durante 210 días. Una segunda dosis de dicho medicamento proporcionó una reducción adicional de estos lípidos. En el día 180, el C-no HDL se redujo en función de la dosis de 148 ± 43 a 110 ± 45 mg/dl (-25%) en el grupo de dosis única de 200 mg y de 161 ± 58 a 91 ± 58 mg/dl (-46%) en el grupo de 2 dosis de 300 mg. Para los mismos regímenes de dosificación, la Apo B se redujo en un 23%, de 101 ± 23 a 78 ± 29 mg/dl, y en un 41%, de 106 ± 31 a 65 ± 33 mg/dl frente a placebo (p < 0.001). En el grupo de 2 dosis de 300 mg, todos los individuos experimentaron reducciones de Apo B y C-no HDL alcanzando al día 180 los objetivos de Apo B recomendados por las guías para pacientes de alto y muy alto riesgo en 78 y 90%, respectivamente33.
Inclisiran en enfermedad cardiovascular: resultados de estudios fase 3
El ORION-10 y el ORION-11 fueron dos ensayos clínicos aleatorizados, fase 3, doble ciego, controlados con placebo, de grupos paralelos. El ensayo ORION-10 se realizó en los Estados Unidos e incluyó 1.561 adultos con enfermedad cardiovascular aterosclerótica con un nivel de c-LDL ≥ 70 mg/dl, en tanto que el ORION-11 fue conducido en Europa y Sudáfrica y reclutó 1.617 adultos con enfermedad cardiovascular aterosclerótica y un nivel de c-LDL ≥ 70 mg/dl o un riesgo equivalente de enfermedad cardiovascular aterosclerótica diabetes tipo 2, HF o un riesgo a 10 años de un evento cardiovascular de ≥ 20% según la evaluación de la escala de riesgo de Framingham) con un nivel de c-LDL ≥ 100 mg/dl. Los resultados obtenidos en el estudio ORION-10 indicaron un cambio porcentual en el nivel de c-LDL en el día 510 de 1.0% en el grupo de placebo y de -51.3% en el grupo de inclisiran, lo que resultó en una diferencia entre grupos de -52.3% (IC 95%: -55.7 a -48.8; p < 0.001). El cambio ajustado en el tiempo en el nivel de c-LDL después del día 90 y hasta el día 540 (desenlace coprimario) en comparación con el valor inicial fue del 2.5% con placebo y del -51.3% con inclisiran, para una diferencia de medias entre grupos del -53,8% (IC 95%: -56.2 a -51.3; p < 0.001). En el ensayo ORION-11, el cambio porcentual correspondiente en el c-LDL en el día 510 fue del 4.0% en el grupo de placebo y del -45.8% en el grupo de inclisiran, lo cual se tradujo en una diferencia entre los grupos de -49.9% (IC 95%: -53.1 a -46.6; p < 0.001). En ambos estudios clínicos inclisiran redujo los niveles de TGL y Lp(a), y aumentó los niveles de c-HDL en el día 510. De igual manera, la proporción de pacientes con probabilidad de tener una reducción del 50% en el c-LDL fue mayor en el grupo de inclisiran que en el grupo placebo.
Un criterio de valoración cardiovascular exploratorio preespecificado que incluía muerte cardíaca y cualquier signo o síntoma de paro cardíaco, infarto de miocardio (IAM) no fatal o accidente cerebrovascular (ACV) se produjo en 58 pacientes (7.4%) en el grupo de inclisiran y 79 (10,2%) en el grupo de placebo en el ensayo ORION-10. Lo mismo ocurrió en 63 pacientes (7.8%) en el grupo de inclisiran y 83 (10.3%) en el grupo de placebo en el estudio ORION-1134.
Cordero et al.35 en un metaanálisis que incluyó un total de 57,431 pacientes, 1,592 tratados con inclisiran y 28,259 con inhibidores de la PCSK9 (17,244 con evolocumab y 11.015 con alirocumab), notificaron un total de 5.389 eventos cardiovasculares mayores (Major Adverse Cardiovascular Events [MACE; su sigla en inglés]) en 2,482 pacientes que recibieron el fármaco del estudio y 2,907 en pacientes asignados al placebo. Como resultado, el tratamiento se asoció con una reducción del 16% en la incidencia de MACE (RR: 0.84; IC 95%: 0.80-0.89). La reducción de MACE se asoció de forma lineal con la reducción del c-LDL y todos los estudios se ajustaron correctamente indicando la concordancia de los ensayos ORION-10 y 11 con los datos actualmente disponibles sobre los inhibidores de la PCSK9.
Inclisiran en hipercolesterolemia familiar
ORION-9, fue un ensayo clínico de fase 3, doble ciego, que aleatorizó en una proporción de 1:1, a 482 adultos que tenían hipercolesterolemia familiar heterocigótica (HFHe, su sigla en inglés) para recibir inyecciones subcutáneas de inclisiran (a una dosis de 300 mg) o placebo equivalente en el día 1, 90, 270 y 450. En este estudio, el cambio porcentual en el c-LDL desde el inicio hasta el día 510 fue una reducción del 39,7% (IC 95%: -43.7 a -35.7) en el grupo de inclisiran y un aumento de 8,2 % (IC 95%: 4.3-12.2) en el grupo de placebo, para una diferencia entre los grupos de -47.9 puntos porcentuales (IC 95%: -53.5 a -42.3; p < 0.001). Para el desenlace coprimario, el cambio porcentual promediado en el tiempo del c-LDL entre el día 90 y el día 540, se observó una disminución del 38,1% (IC 95%: -41.1 a -35.1) en el grupo de inclisiran y un aumento de 6,2 % (IC 95%: 3.3-9.2) en el grupo de placebo, con una diferencia de medias entre los grupos de -44.3 puntos porcentuales (IC 95%: -48.5 a -40.1; p < 0.001). Adicionalmente, inclisiran se asoció con niveles más bajos de CT, c-no HDL, Apo B, Lp(a) y TGL, junto a valores más altos de c-HDL en comparación con el placebo. Es importante resaltar que en este estudio se encontraron marcadas reducciones en el c-LDL en todos los genotipos de HF36.
ORION-5, por su parte, es un estudio multicéntrico abierto, doble ciego, controlado con placebo, de fase 3 en curso (NCT03851705) que busca evaluar la eficacia, seguridad y tolerabilidad de inclisiran en pacientes con hipercolesterolemia familiar homocigota (HFHo)37. Datos preliminares en este subgrupo poblacional se obtuvieron a partir del ORION-2, un estudio piloto multicéntrico en fase 2, de un solo brazo y de etiqueta abierta, en el que 4 sujetos con diagnóstico genético o clínico (de acuerdo con el consenso de la Sociedad Europea de Aterosclerosis) de HFHo fueron asignados a la terapia estándar más inclisiran 300 mg SC el día uno y los días 90 o 104 si los niveles medios de PCSK9 no se suprimieron > 70% en comparación con la línea de base en los días 60 o 90. En este estudio, inclisiran mostró reducciones de c-LDL del 11.7-33.1% en el día 90 y 17.5-37.0% en el día 180 en 3 individuos, mientras que uno de los casos cursó con aumento de c-LDL en los días 90 y 180; no obstante, este último participante también tenía historia de mala respuesta a los dos inhibidores de la PCSK9 disponibles comercialmente en la actualidad38. Hay que mencionar que los anteriores son resultados piloto que sirvieron como punto de partida para el estudio clínico ORION-537.
Finalmente, un metaanálisis reciente que incluyó los ensayos ORION-10, ORION-11 y ORION-9, con un total de 3,783 pacientes (1,895 a inclisiran y 1,888 a placebo), no encontró diferencias estadísticamente significativas en el riesgo de IAM en los pacientes aleatorizados a inclisiran respecto al placebo (1.8% vs. 2.3%; RR: 0.85; IC 95%: 0.37-1.95; p = 0.70; I2= 57%). De forma similar, tampoco se observaron diferencias en el riesgo de ACV fatal y no fatal en el brazo de inclisiran en comparación con placebo (0.7 vs. 0,8%; RR: 0.69; IC 95%: 0.11-4.21; p = 0.69; I2 = 75%)39. Sin embargo, es notable que sólo dos ensayos (ORION-10 y 11) reportaron datos de IAM y ACV; además, el número total de eventos fue demasiado pequeño como para sacar conclusiones significativas sobre los posibles beneficios de inclisiran en los resultados cardiovasculares34. Para este propósito se está llevando a cabo el ensayo ORION-4, un ensayo fase 3, doble ciego, aleatorizado y controlado con placebo (NCT03705234), que evaluará los efectos de inclisiran en los resultados clínicos en pacientes con enfermedad cardiovascular aterosclerótica establecida. El estudio inició en octubre de 2018 y se estima que su fecha de finalización primaria será en julio de 2026. Se prevé que el ensayo reclute aproximadamente 15.000 participantes de 55 años o más con enfermedad cardiovascular aterosclerótica preexistente que serán aleatorizados a recibir 300 mg de inclisiran o un placebo equivalente (administrado por inyección subcutánea el día de la aleatorización, a los 3 meses y luego cada 6 meses) en una proporción de 1:1 para una mediana de duración de seguimiento planificada de aproximadamente 5 años. El desenlace primario de ORION-4 se define como número de sujetos con un evento cardiovascular mayor definido como: muerte por enfermedad coronaria, IAM, ACV isquémico fatal o no fatal o procedimiento urgente de revascularización coronaria40. Se espera que los resultados del ensayo ORION-4 proporcionen información valiosa respecto al beneficio de inclisiran en la reducción de eventos cardiovasculares adversos en población con enfermedad cardiovascular aterosclerótica establecida. En la tabla 1 se resumen los estudios del programa ORION publicados y en curso.
Seguridad
En el ensayo ORION-1 (fase 2) en un período de seguimiento de 180 días se reportaron eventos adversos graves en el 11% de los participantes que recibieron inclisiran y en el 8% de aquellos que recibieron placebo. Se produjeron reacciones en el sitio de la inyección en el 4 y en el 7% de los pacientes que recibieron una y dos dosis de inclisiran, respectivamente. Los eventos adversos más comunes (ocurridos en > 2% de los pacientes) fueron mialgia, dolor de cabeza, fatiga, nasofaringitis, dolor de espalda, hipertensión, diarrea y mareos, con incidencias similares en ambos grupos. Los pacientes con diabetes no tuvieron cambios clínicamente significativos en la HbA1c41. El ensayo ORION-3 (estudio de extensión abierto de fase 2 del ensayo ORION-1), por su parte, mostró que, durante tres años de seguimiento, no hubo cambios en el perfil de seguridad general.
Un metaanálisis agrupó los datos de los ensayos fase 3 ORION-9, 10 y 11 que se registraron durante el período de estudio de 540 días, para un n = 3,655 (1,833 participantes asignados a inclisiran y 1,822 participantes asignados a placebo). Se informaron eventos adversos emergentes que llevaron a la interrupción del fármaco en el 2,5% del grupo que recibió inclisiran y en el 1,9% del grupo que recibió placebo. La mayoría de los eventos adversos emergentes fueron leves o moderados; los eventos adversos emergentes del tratamiento en el lugar de la inyección (eritema, hipersensibilidad y prurito local) fueron más frecuentes con inclisiran que con placebo (5.0 vs. 0.7%); entre otros eventos adversos que se presentaron estuvo el empeoramiento del control glucémico (11.6% de los participantes asignados a inclisiran y 11.4% de los participantes asignados a placebo). Algunos eventos no superaron el 10% en los dos grupos (nasofaringitis, infección del tracto respiratorio superior e hipertensión), mientras que otros fueron menores al 5.0% en ambos grupos (dolor de espalda, infección del tracto urinario, diarrea, bronquitis, tos, cefalea, angina de pecho, mareo, osteoartritis, dolor en una extremidad, disnea, aumento de la creatina-fosfocinasa -CPK-) en sangre, dolor de pecho no cardiaco, influenza, sinusitis, fatiga, arteriopatía coronaria, neumonía, fibrilación auricular, reacción en el sitio de inyección, dolor musculoesquelético, mialgia, edema periférico, anemia, dolor e insuficiencia cardiaca congestiva). Los eventos adversos graves se informaron en el 20.4% de participantes que recibieron inclisiran y en el 23% de los que recibieron placebo. Se produjo el mismo número de muertes (n = 27) tanto en el grupo de inclisiran como en el de placebo. Las tasas de cáncer nuevo, que empeorara o fuera recurrente fueron menores al 3% en ambos grupos42.
Una comparación de los resultados de seguridad de los estudios ORION vs. los informes de seguridad de los MAbs inhibidores de la PCSK9, como alirocumab (resultados ODYSSEY) y evolocumab (FOURIER) evidenció una presentación similar en las reacciones adversas en el lugar de la inyección entre los diferentes medicamentos (3.1% para inclisiran vs. 0.1% para placebo; RR: 27.8; IC 95%: 6.8-113.9), 3,8% para alirocumab vs. 2,1% para placebo (p < 0.001) y 2.1% para evolocumab vs. a 1.6% para placebo). La presentación de bronquitis fue mucho mayor en el grupo asignado a inclisiran en los estudios ORION que en los participantes del grupo placebo, de forma similar ocurre con alirocumab en el estudio ODYSSEY, mientras que la incidencia de este efecto adverso con evolocumab en el estudio FOURIER fue similar a la incidencia en el grupo placebo (4.3% para inclisirán vs. 2.7% para placebo; RR: 1.55; IC 95%: 1.1-2.2), 1.6% y 5.2% para alirocumab vs. 2.0% para placebo y 1.6% para evolocumab vs. 1.4% para placebo). Respecto a los trastornos neurocognitivos, el desenlace no estuvo provisto con inclisiran en los estudios ORION y, por el contrario, sí hay datos de presentación con evolocumab (1.6% para evolocumab vs. 1.5% para placebo y 1.5% para alirocumab vs. 1.8% para placebo). El porcentaje de aparición de diabetes de novo, problemas musculoesqueléticos (definidos como dolor), elevación de la CPK y/o elevación de aminotransferasas tanto en los estudios ORION para inclisiran como en los estudios ODYSSEY y FOURIER para alirocumab y evolocumab no evidenció mayor incidencia en el grupo de intervención vs. el grupo placebo43.
Por otro lado, un análisis de los estudios ORION-7 fase 1 y ORION-1 fase 2 evaluó la seguridad del inclisiran en pacientes con daño renal comparativamente con una función renal normal. Se incluyeron 31 sujetos del ORION-7 y 247 del ORION-1 con una función renal en diferentes estadios, que recibieron 300 mg de inclisiran subcutáneo o placebo. La tos (12.5%) fue el efecto adverso más frecuente en la población con una función renal alterada (TFG < 60 ml/min por 1.73 m2), seguido por cefalea (6.3%) y fatiga (6.3 %). Se concluyó que el perfil de seguridad del inclisiran fue similar en sujetos con función renal normal y alterada, por lo que no se requiere ajuste de dosis del medicamento en este grupo de pacientes44. De forma similar, según datos provenientes del ensayo fase 1 ORION-6 no es necesario ajustar la dosis en individuos con disfunción hepática leve a moderada. El estudio ORION-6 no incluyó sujetos con deterioro hepático grave, por lo que se desconocen los efectos de inclisiran en este subconjunto de pacientes45.
En Colombia, se espera que el uso de inclisiran contribuya a la prevención de los eventos cardiovasculares fatales y no fatales en sujetos con enfermedad cardiovascular aterosclerótica establecida dadas su eficacia y seguridad probada. El perfil farmacocinético favorable de inclisiran podría vencer las barreras de la no adherencia en nuestros pacientes y, por tanto, mejorar sus desenlaces clínicos y mitigar la morbilidad asociada; adicionalmente, quizá abra la puerta a planteamientos de mayor alcance, como su utilidad en la prevención primaria de sujetos con dislipidemia.
Conclusiones
Se ha demostrado que inclisiran proporciona reducciones significativas a largo plazo en los niveles de c-LDL en sangre asociado a disminuciones notables en los niveles de PCSK9 y otros lípidos aterogénicos con un perfil de efectos secundarios favorable. La conveniencia de un régimen de dosificación dos veces al año promueve la adherencia a la terapia y facilita la consecución de los objetivos de c-LDL. Este medicamento se ha convertido en una opción terapéutica prometedora para el tratamiento de la hipercolesterolemia. Como se mencionó previamente, se espera que los resultados del ensayo ORION-4 aporten más información acerca del beneficio cardiovascular de inclisiran en pacientes con enfermedad cardiovascular aterosclerótica.