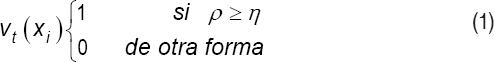Introducción
La insuficiencia cardiaca (IC) es una condición clínica que alcanza niveles de epidemia y que tiene un alto impacto en los sistemas de salud pública. A través de los últimos años se ha documentado un aumento en su incidencia y prevalencia, sin ningún cambio en sus desenlaces clínicos1. Por tratarse de un síndrome clínico complejo, los pacientes con insuficiencia cardíaca tienen un amplio espectro de riesgo de mortalidad. Ante esta situación, la evaluación del pronóstico se convierte en un aspecto fundamental para la atención de esta entidad, en especial en el contexto de las hospitalizaciones2.
La inteligencia artificial se ha posicionado como una alternativa a las herramientas estadísticas, principalmente a la regresión logística, dentro del campo de las reglas de predicción clínicas aplicables al diagnóstico o al pronóstico, con la promesa de alcanzar una mayor capacidad de generalización de sus resultados al ser aplicado a otras poblaciones3. Al interior de este campo de acción, ocupan un puesto preponderante el uso de redes neuronales artificiales y, de forma más reciente, los sistemas de ensamble.
Una de las herramientas más reconocidas en el mundo para el pronóstico de la IC es el árbol de decisiones del ADHERE, compuesta por tres variables (hemoglobina, creatinina y BUN) desarrollada en el 2005 mediante la técnica del análisis de árbol de clasificación y regresión (CARD, una estrategia de sistemas inteligentes), la cual alcanzó un AUC de 0.68 en el desarrollo4 y entre 0.58 y 0.76 en diversos estudios de validación cruzada5-7.
El objetivo de este trabajo es exponer los resultados del entrenamiento y validación interna de un sistema basado en el ensamble de un conjunto de redes neuronales artificiales para el pronóstico de la mortalidad a un mes, de los pacientes hospitalizados por insuficiencia cardíaca aguda, y comparar los resultados de cada una de las redes individuales desarrolladas y cuatro sistemas de ensamble, la votación simple y AdaBoost.
Materiales y método
Se utilizaron los datos de una cohorte prospectiva realizada en el Hospital San José de Bogotá, Colombia, entre febrero de 2010 y marzo de 20138. Se incluyeron pacientes con diagnóstico de IC descompensada, hospitalizados por el servicio de medicina interna, mayores de 18 años, que cumplían criterios diagnósticos de Framingham. Como criterios de exclusión se tuvieron: descompensación aguda de diabetes mellitus, urgencia dialítica, cirrosis avanzada o insuficiencia hepática aguda, síndrome nefrótico, choque hipovolémico, choque séptico de cualquier origen y enfermedad neoplásica terminal.
Se recolectaron los datos sociodemográficos, clínicos, comorbilidades y examen físico, así como los siguientes laboratorios: nitrógeno ureico, creatinina, NT-proBNP, hemoglobina, sodio, troponina I de alta sensibilidad y electrocardiograma. Del reporte ecocardiográfico se obtuvo el valor de la fracción de eyección del ventrículo izquierdo. Los pacientes fueron seguidos hasta el egreso hospitalario y se documentó la mortalidad intrahospitalaria y a 30 días mediante llamada telefónica o verificación del sistema de registro nacional de defunciones (RUAF).
La selección de los datos de entrada se llevó a cabo a partir de los resultados de un estudio de cohorte previo en el cual se identificaron los factores asociados con la mortalidad mediante un análisis de regresión logística multivariada8, complementado con las variables conocidas por su relación con mortalidad que han sido incluidas en la elaboración de las reglas de predicción GWTG (get with the guidelines)9, OPTIMIZE10 y ADHERE4.
Se incluyeron las siguientes 15 variables como datos de entrada: sexo, edad mayor de 70 años, hospitalizaciones previas, antecedentes de diabetes mellitus, enfermedad renal crónica, EPOC, enfermedad coronaria, tensión arterial sistólica mayor de 150 mmHg o menor de 100 mmHg, creatinina mayor de 2.7 mg/dl, sodio inferior a 130 meq/l, nitrógeno ureico mayor de 43 mg/dl, troponina mayor de 0.1 μg/dl, NT-proBNP mayor de 4.630 pg/ml y fracción de eyección del ventrículo izquierdo menor del 30%.
La población se dividió en dos partes: el 70% (323 pacientes) para entrenamiento y pruebas de las diferentes redes neuronales y el 30% restante (139 pacientes) para la validación del mecanismo de ensamble. Las redes neuronales fueron entrenadas mediante un algoritmo genético, compartían, dentro de su arquitectura, el estar conformadas por 15 variables de entrada, una capa oculta, una neurona de salida y función de activación sigmoidea. El número de neuronas de la capa oculta variaba entre 4, 6, 8, 10 y 12. El algoritmo genético seleccionó los pesos de las redes y fue programado en lenguaje Java. A su vez, se dividió a los 323 pacientes en un 70% para entrenamiento y un 30% para pruebas (con los 139 pacientes elegidos para la validación del mecanismo de ensamble, también se validaron las redes neuronales individuales).
La estrategia evolutiva estuvo organizada así:
− Representación de los individuos: dos vectores con los pesos que relacionan las neuronas de entrada y las de la capa oculta, y entre esta y la neurona de salida.
− Tamaño de la población: 250 individuos, 50 por cada grupo de neuronas en la capa oculta (4, 6, 8, 10 y 12).
− Inicialización de la población: se asignó de manera aleatoria el valor de los pesos.
− Mecanismo de evolución: se realizó mediante mutación (5%) y recombinación (95%).
− Selección: por torneo.
− Función de fitness: consistió en evaluar el resultado de cada red en cada uno de los ejemplos de entrenamiento; posteriormente, se calculaba el desempeño evaluando la precisión de cada una de ellas (número de casos correctamente discriminados sobre el total de casos evaluados), para luego seleccionar las más altas dentro de cada uno de los grupos.
− Criterio de terminación: 100 iteraciones.
Tras un gran número de experimentos con múltiples ejecuciones del algoritmo genético se seleccionaron 11 redes neuronales con el mejor desempeño basado en la exactitud, seguido por el resultado de la sensibilidad para realizar con ellas los ensambes.
Si se tiene la siguiente ecuación:
donde vt(xi)es el resultado del ensamble (0 negativo y 1 positivo).
Se pueden expresar los sistemas de ensamble de la siguiente forma:
− Votación simple: se compara la sumatoria de los positivos contra los negativos asignando como resultado el que tenga el mayor número de votos.
En la ecuación 1, ρ es el contador de los resultados positivos y η el contador de los casos negativos.
− Votación ponderada por valores predictivos: se suma a un contador de positivos o negativos el respectivo valor predictivo positivo (VPP) multiplicado por dos o negativo (VPN) obtenido en la fase de pruebas.
En este caso se reemplaza en la ecuación 1, 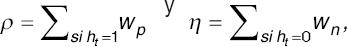 siendo ht el resultado de la red neuronal. En este caso Wp = 2*VPPP para los resultados positivos y Wn=VPN para los negativos.
siendo ht el resultado de la red neuronal. En este caso Wp = 2*VPPP para los resultados positivos y Wn=VPN para los negativos.
− Votación ponderada por razón de verosimilitud (likelihood ratio, LR): se efectuó obteniendo un valor que ponderaba por igual los resultados positivos o negativos de cada red neuronal; el factor de ponderación se obtenía de dividir el LR positivo sobre el LR negativo.
Para la ecuación 1, 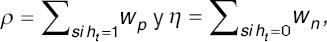 en este caso Wp=Wn=LR+/LR-.
en este caso Wp=Wn=LR+/LR-.
− AdaBoost: consiste en una votación ponderada cuyos pesos se obtenían a través del algoritmo de boosting más popular; entrenado a partir de la maximización de ɛt, la suma ponderada del error para los puntos mal clasificados:
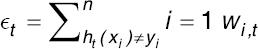 ; donde ht(Xi) es el resultado dado por cada una de las redes neuronales para cada caso (Xi) del entrenamiento, yi son las salidas esperadas para cada caso y wi,t son los pesos para cada uno de los clasificadores en el momento de entrenamiento t.
; donde ht(Xi) es el resultado dado por cada una de las redes neuronales para cada caso (Xi) del entrenamiento, yi son las salidas esperadas para cada caso y wi,t son los pesos para cada uno de los clasificadores en el momento de entrenamiento t.
Luego se calcula αt a partir de la fórmula 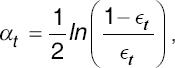 , con lo que se procede a actualizar los pesos Wi,t+1=Wi,te-yiαtht(xi).
, con lo que se procede a actualizar los pesos Wi,t+1=Wi,te-yiαtht(xi).
El análisis estadístico se realizó en el paquete estadístico STATA 12. La descripción de las variables continuas se hizo mediante medidas de tendencia central y de dispersión, mientras que las variables categóricas con frecuencias absolutas y relativas. Se calcularon las características operativas (sensibilidad, especificidad, valores predictivos y exactitud) para el pronóstico de muerte a 30 días de cada una de las redes y de los sistemas de ensamble. Se realizó el cálculo de los respectivos intervalos de confianza del 95% para cada uno de los resultados obtenidos.
Resultados
La base de datos de los pacientes estuvo constituida por 462 pacientes con promedio de edad de 72.4 (± 12.7) años, de los cuales 240 (51.9%) fueron mujeres; las comorbilidades que se presentaron con mayor frecuencia fueron hipertensión arterial crónica (80.5%), enfermedad pulmonar obstructiva crónica (43.7%) y diabetes mellitus tipo 2 (23.3%) (Tabla 1). La mortalidad a 30 días fue del 13.8% (64 pacientes). En promedio, la presión arterial sistólica al ingreso fue de 131.6 mmHg, 375 (81.1%) tuvieron una frecuencia cardiaca superior a 70 lpm. Entre los hallazgos de laboratorio relevantes, 47 (10.2%) presentaron niveles de creatinina mayor de 2 mg/dl y 98 (21.2%) hiponatremia.
Tabla 1 Descripción de las características de la población
| Característica | ||
|---|---|---|
| Edad en años, promedio (DE) | 72.4 | (12.7) |
| Sexo femenino, n (%) | 240 | (51.9) |
| Comorbilidades, n (%) | ||
| Hipertensión arterial | 372 | (80.5) |
| Enfermedad coronaria | 87 | (18.8) |
| Diabetes mellitus tipo 2 | 108 | (23.3) |
| Enfermedad renal crónica | 66 | (14.2) |
| Enfermedad pulmonar obstructiva crónica | 202 | (43.7) |
| Arritmia cardiaca | 84 | (18.1) |
| Hallazgos paraclínicos | ||
| Creatinina, mediana (RIQ) mg/dl | 1.0 | (0.8-1.4) |
| Creatinina > 2 mg/dl, n (%) | 47 | (10.2) |
| Sodio, promedio (DE) meq/l | 138.1 | (5.5) |
| Hiponatremia, n (%) | 98 | (21.2) |
| BUN, mediana (RIQ) mg/dl | 24 | (18-35) |
| Troponina I, mediana (RIQ) µg/dl | 0.04 | (0.015-0.09) |
| Troponinas positivas, n (%) | 41 | (9.7) |
| NTproBNP, mediana (RIQ) pg/ml | 4630 | (1780-12068) |
| NTproBNP > 125 pg/ml, n (%) | 426/438 | (97.2) |
| Hemoglobina, promedio (DE) g/dl | 13,6 | (2.9) |
| Hemoglobina menor 12 g/dl, n (%) | 144 | (31.1) |
| FEVI menor del 40%, n (%) | 143 | (32.9) |
| Clase funcional ingreso (%) | ||
| II | 26 | (5.6) |
| III | 167 | (36.1) |
| IV | 269 | (58.2) |
| Hospitalización previa por IC (%) | 223 | (47.3) |
| Medicación previa al ingreso (%) | ||
| Betabloqueador | 190 | (41.1) |
| ARA II | 163 | (35.2) |
| IECA | 155 | (33.5) |
| Antagonista de la aldosterona | 107 | (23.1) |
| Marcapaso/Cardiodesfibrilador (%) | 12/461 | (2.6) |
DE: desviación estándar; RIQ: rango intercuartílico; BUN: nitrógeno ureico; NTproBNP: fracción N terminal del propéptido natriurético auricular tipo B; IECA: inhibidores de la enzima convertidora de angiotensina; ARA II: antagonistas de los receptores de angiotensina II; IC: insuficiencia cardiaca; rpm: respiraciones por minuto; FEVI: fracción de eyección del ventrículo izquierdo.
En la población de pruebas, las redes neuronales individuales mostraron resultados de precisión entre 66 y 81%, sensibilidad entre 25 y 50% y especificidad entre 68 y 90% (Tabla 2). La mejor red neuronal alcanzó una exactitud del 81%, con una sensibilidad del 90% y una especificidad del 25% en la población de validación.
Tabla 2 Características operativas de las once mejores redes neuronales entrenadas por el algoritmo genético (los resultados expresan el comportamiento en las diferentes poblaciones así: entrenamiento/pruebas/validación)
| Red neuronal artificial | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | |
| Entradas | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 |
| Neuronas en capa oculta | 12 | 8 | 12 | 10 | 10 | 8 | 8 | 10 | 6 | 8 | 12 |
| Sensibilidad | 41/40/45 | 27/53/40 | 58/46/35 | 55/66/50 | 37/46/60 | 51/20/15 | 31/46/35 | 34/40/30 | 31/33/35 | 44/46/45 | 17/33/25 |
| Especificidad | 73/80/77 | 78/82/87 | 75/80/78 | 71/71/68 | 71/78/70 | 85/90/89 | 79/80/77 | 75/80/79 | 82/81/83 | 71/73/79 | 90/93/90 |
| VPP | 18/27/25 | 16/36/34 | 25/30/21 | 21/30/21 | 16/28/25 | 34/27/18 | 18/30/20 | 16/27/20 | 20/25/25 | 18/24/27 | 20/50/25 |
| VPN | 88/89/88 | 88/90/89 | 92/89/87 | 91/92/89 | 88/88/91 | 92/86/86 | 88/89/87 | 88/88/87 | 89/87/88 | 89/88/89 | 88/88/87 |
| Exactitud | 69/74/72 | 72/78/80 | 73/75/71 | 69/71/66 | 67/73/69 | 80/79/78 | 73/75/71 | 69/74/72 | 75/74/76 | 68/69/74 | 80/84/81 |
VPP: valor predictivo positivo; VPN: valor predictivo negativo.
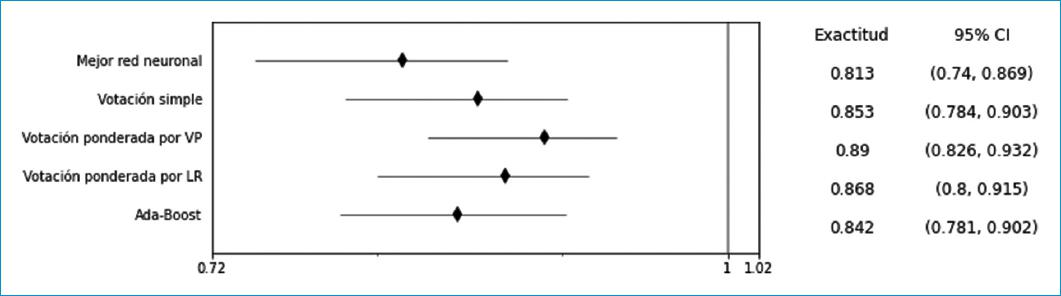
Los diversos métodos de ensamble obtuvieron un mejor rendimiento pronóstico que el de cada una de las redes que lo componían. La votación ponderada por valores predictivos mostró una tendencia hacia un mejor desempeño, con una exactitud del 89%, una sensibilidad del 26% y una especificidad del 99% en la población de validación; aunque existe una amplia superposición entre los intervalos de confianza de las diferentes herramientas de sistemas inteligentes (Tabla 3 y Fig. 1), se debe anotar que tuvo la mayor razón de disparidad diagnóstica, con 41.4.
Tabla 3 Características operativas de las herramientas evaluadas (en porcentajes con sus respectivos intervalos de confianza)
| Mejor red neuronal | Sistemas de ensamble | ||||
|---|---|---|---|---|---|
| Votación simple | Ponderada por valores predictivos | Ponderado por LR | AdaBoost | ||
| Número de entradas | 15 | 11 | 11 | 11 | 11 |
| Características operativas, % (IC 95%) | |||||
| Sensibilidad | 25.0 (11.2-46.9) | 31.6 (15.4-54.0) | 26.3 (11.8-48.8) | 42.1 (23.1-63.7) | 25.0 |
| Especificidad | 90.8 (84.2-94.8) | 94.0 (88.2-97.1) | 99.1 (95.3-99.8) | 94.0 (88.2-97.1) | 94.1 |
| VPP | 31.3 (14.2-55.6) | 46.2 (23.2-70.9) | 83.3 (43.6-97.0) | 53.3 (30.1-75.2) | 41.7 |
| VPN | 87.8 (80.9-92.5) | 89.4 (82.8-93.7) | 89.2 (82.7-93.5) | 90.0 (84.5-94.8) | 88.2 |
| Exactitud | 81.3 (74.0-86.9) | 85.3 (78.4-90.3) | 89.0 (82.6-93.2) | 86.8 (80.0-91.5) | 84.2 (78.1-90.2) |
LR: likelihood ratio; VPP: valor predictivo positivo; VPN: valor predictivo negativo; IC: intervalo de confianza.
Discusión
Los sistemas inteligentes se definen como aquellos intentos de emular la inteligencia humana, mientras favorecen el razonamiento y aprendizaje llevado a cabo en ambientes inciertos o con alto grado de imprecisión11; es un término que es sinónimo, hasta cierto punto, con los de inteligencia computacional y reconocimiento de patrones. Los sistemas basados en ensamble han sido postulados como una solución teórica para varios problemas de las reglas de predicción, principalmente la capacidad de generalización, pero también en aquellas situaciones en las que se cuenta con datos muy escasos12.
En la tabla 4 se presentan los resultados de los diez estudios hallados en la literatura que evalúan diversos modelos de predicción de mortalidad intrahospitalaria y a 30 días mediante el uso de sistemas inteligentes4,6,13-20. Se encuentra, con frecuencia, el uso de árboles de decisiones (en 6 casos)4,6,15-17,20 incluyendo 4 casos con ramdom forest14,15, un modelo innovador (Patient specific Markov blanket global structure algoritm19), dos casos de Boosting15,18 y dos utilizaron máquinas de vectores de soporte14,15; las redes neuronales fueron aplicadas en dos casos13,14. Tres estudios compararon varios modelos de inteligencia artificial6,14,15, mientras que en 5 casos fueron comparadas con regresiones logísticas4,6,14,15,19. Dos trabajos contaron con una población inferior a 500 pacientes13,16. El mejor desempeño lo alcanzó DAHF, un modelo de red neuronal profunda (3 capas ocultas con 33 neuronas) desarrollado a partir de un gran registro multicéntrico coreano por el grupo de Kwong14 en 2019, que alcanzó un AUC de 0.88.
Tabla 4 Estudios que evalúan diversos modelos de predicción de mortalidad en insuficiencia cardiaca mediante el uso de sistemas inteligentes
| Autor y fecha | Herramienta de sistemas inteligentes | Desenlace | Tiempo | BD u hospital | n | C (o AUC) |
|---|---|---|---|---|---|---|
| Gambarte, 202113 | Red neuronal (perceptrón multicapa con dos capas ocultas) | Mortalidad a 30 días | 2005-2019 | Hospital Alemán de Buenos Aires, Argentina | 483 | 0.82 |
| Kwon, 201914 | Deep neural network (DAHF, con tres capas ocultas) | Mortalidad intrahospitalaria | 2016-2017 | Korean Acute Heart Failure (KorAHF) registry | Entrenamiento: 6724 Pruebas: 4.759. | 0.880 |
| Ramdom forest | 0.756 | |||||
| Logistic regression | 0.720 | |||||
| Support vector machine | 0.723 | |||||
| Bayesian network | 0.730 | |||||
| Panahiazar, 201515 | Ramdom forest | Mortalidad a 1 año | 1993-2013 | Mayo Clinic | Entrenamiento: 1.560 Pruebas: 3.484 | 0.62 (0.80) |
| Support vector regression | 0.56 (0.46) | |||||
| Decision tree | 0.6 (0.66) | |||||
| Ada boost | 0.59 (0.74) | |||||
| Logistic regression | 0.68 (0.81) | |||||
| Zhang, 201316 | Chi-square automatic interaction detector (CHAID) decision trees | Muerte y/o hospitalización por empeoramiento de la ICC a 1 año (muerte a 1 año) | ND | Trans-European Network-Home-Care Management System (TEN-HMS) Study | Entrenamiento: 284 Pruebas: 160 | 0.797 (0.892) |
| LR | 0.738 (0.858) | |||||
| Tomcikova, 201317 | classification and regression tree analysis (CART) | Muerte intrahospitalaria | 2006-2009 | Acute Heart Failure Database–Main registry | Entrenamiento: 2.543 Pruebas: 1.387 | 0.823 |
| 0.832 | ||||||
| Austin, 201118 | Boosted classification trees (AdaBoost) | Muerte a 30 días | 1999-2001 | EFFECT study | 8.240 | Sens: 13% Espec: 98% |
| Austin, 20106 | Cinco modelos de regresion logística | Mortalidad intrahospitalaria | 1999-2001 | EFFECT study | Entrenamiento: 8.236 Pruebas: 7.608 | 0.747-0.775 |
| Tres modelos de árboles de regresión | 0.620-0.651 | |||||
| Visweswaran, 201019 | Patient specific Markov blanket global structure algorithm (PSMBI-MS) | Muerte a 90 días | 1999 | ND | Entrenamiento: 7.453 Pruebas: 3.735 | |
| PSMBg-MA | ||||||
| LR | ||||||
| Abraham, 200820 | Classification and regression tree analysis (CART) | Muerte intrahospitalaria | ND | OPTIMIZE HF | 37.548 | 0.683 |
| Fonarow, 20054 | Classification and regression tree analysis (CART) | Mortalidad intrahospitalaria | 2001 2003 | ADHERE | Entrenamiento: 33.046 Pruebas: 32.229 | 0.687 |
| 0.668 | ||||||
ND: no hay datos disponibles. El artículo de Visweswaran et al. no describe los resultados con las características operativas sino por el error.
Aunque no pueda ser calificado del todo como un modelo de inteligencia artificial, un trabajo de 2010 presenta un modelo que realiza el ensamble mediante bootstrapping de un conjunto de regresiones logísticas con 16 variables procedente del análisis de 1.372 pacientes; así mismo, demostró buena discriminación de la mortalidad a 30 días (estadístico C de 0.86) y la readmisión (estadístico C de 0.72), que fue mejor que la regla del ADHERE21.
Los resultados sugieren que el sistema desarrollado tiene un buen comportamiento en la determinación del pronóstico de mortalidad de la IC a 30 días, con un rendimiento comparable al de los sistemas con mejor desempeño encontrados en la revisión bibliográfica. A diferencia de ellos, se incluyó como entrada la medición del péptido natriurético de tipo B (NT-proBNP), que podría ser una de las posibles explicaciones de dicho resultado. En un trabajo realizado en esta misma población se evaluó el desempeño de tres de las reglas de predicción clínica más conocidas, con resultados muy pobres, con AUC de 0.63 (IC 95% 0.53-0.73) para el OPTIMIZE, de 0.57 (IC 95% 0.49-0.65) para el GWTG y de 0.58 (IC 95% 0.47-0.68) para el árbol de decisiones del ADHERE22. Los resultados obtenidos mostraron un patrón inverso en cuanto a las sensibilidades y especificidades, siendo en el presente ensayo más alta la especificidad con baja sensibilidad, lo cual podría ser importante en la toma de decisiones al definir la disposición de los pacientes.
En un trabajo anterior, se describió una nueva estrategia de ensamble que se basaba en el desempeño estadístico a través de las características operativas de una prueba, aplicado al diagnóstico del infarto agudo de miocardio23. En esa oportunidad se obtuvieron resultados similares a los de este trabajo, con rendimientos superiores de los ensambles al de los componentes individuales, pero no se comparó con otras herramientas populares de ensamble. Esta vez se utilizó boosting como comparador, que es reconocido ampliamente como una de las estrategias más difundidas de ensamble, y se obtuvo un resultado muy similar.
Es preciso aceptar que existen mejores algoritmos de entrenamiento para las redes neuronales que el algoritmo genético; aquí, su uso se explica por la posibilidad de entrenar un número mayor de redes en cada corrida de éste. Además, en nuestro trabajo la investigación se centraba en la comparación de los mecanismos de ensamble y, para poder hacer visible el efecto de la combinación, se requería que los elementos constituyentes tuvieran un desempeño regular.
Como limitaciones del presente trabajo se reconoce que la procedencia de los pacientes haya sido de un único centro, y que, además, puede ser posible que el número de desenlaces (13.8%) fuera pequeño para la elaboración de un modelo predictivo, con lo cual se pudieron dejar subrepresentadas poblaciones de interés, pero precisamente esta es una de las ventajas teóricas de las estrategias de ensamble.
Se convierten en fortalezas el uso de un amplio número de experimentos para la construcción y selección de las redes neuronales (a diferencia de la conducta a priori que suele usarse), así como la comparación de diferentes mecanismos de ensamble, que incluyó al AdaBoost.
Como trabajo futuro se deberá buscar la inclusión del modelo en una herramienta para la toma de decisiones aplicable en la práctica diaria de la disposición de los pacientes que consultan por descompensación de la IC, comparándolo con otras escalas o la decisión del médico tratante.
Conclusiones
El ensamble de redes neuronales mediante un sistema de votación ponderada centrado en las características operativas de la prueba mediante los valores predictivos demostró un adecuado rendimiento para el pronóstico de muerte a 30 días en IC descompensada, mejorando el desempeño de cada unas de las redes neuronales que la componían; el desempeño se comportó de forma similar al del sistema de ensamble por AdaBoost.