Introducción
La aterosclerosis sigue siendo el principal problema de la enfermedad cardiovascular en el mundo1. Algunos estudios anteriores mostraron que la placa aterosclerótica no proviene solo del colesterol, sino que la respuesta inflamatoria también desempeña un papel en la formación de la placa2. La inflamación tiene un papel esencial en cada fase, desde la aterosclerosis hasta la formación de la placa y la facilitación del proceso de ruptura aguda3,4. La placa vulnerable es propensa a la ruptura, lo cual provoca la formación de un trombo que lleva a la oclusión del área de la arteria coronaria involucrada, seguida por necrosis del tejido miocárdico subtendido1,2. Este evento se denomina síndrome coronario agudo (SCA), e incluye el infarto de miocardio sin elevación del segmento ST (IAMSEST) y el infarto agudo de miocardio con elevación del segmento ST (IAMCEST).1,5. La activación plaquetaria es uno de los principales contribuyentes al proceso de formación de trombos y eventos coronarios agudos6. La formación de plaquetas es una fuente de mediadores inflamatorios con un gran efecto en la patogénesis del SCA, incluyendo la formación de aterotrombosis7. En el proceso de la aterosclerosis, los linfocitos tienen un rol en la modulación de la respuesta inmunológica en cada etapa del proceso7,8. En tal sentido, un estudio previo ha descrito la correlación entre un recuento linfocitario bajo y consecuencias cardiovasculares adversas serias9. Por tanto, se ha sugerido que la relación plaquetas-linfocitos (RPL) es un nuevo indicador protrombótico e inflamatorio1,10.
En la práctica clínica, el puntaje del Global Registry of Acute Coronary Events (GRACE) [Registro Global de Eventos Coronarios Agudos] y el puntaje de Thrombolysis in Myocardial Infarction (TIMI) [Trombólisis en el Infarto de Miocardio] pueden utilizarse para determinar el desenlace adverso en el SCA a un bajo costo, con un desempeño diagnóstico alto en países con muchas limitaciones2. El propósito de este trabajo es explorar la correlación entre la RPL y los puntajes GRACE y TIMI en pacientes con SCA.
Materiales y método
Para este estudio se reclutaron 1.000 pacientes diagnosticados con SCA que fueron hospitalizados en el Departamento de Cardiología y Medicina Vascular del Dustira Army Hospital entre enero del 2019 y junio del 2020. En el estudio se incluyeron pacientes adultos (mayores de 18 años) con SCA con IAMSEST e IAMCEST diagnosticados según los criterios de la ESC 2015. Los criterios de exclusión fueron los siguientes: pacientes con enfermedades inflamatorias agudas y crónicas (por ejemplo, enfermedades cardíacas, artritis reumatoidea, etc.), neoplasias, pacientes con infecciones agudas o crónicas, insuficiencia renal y/o hepática; enfermedades hematológicas, enfermedades hematológicas previas, antecedentes de trauma o cirugías recientes (30 días), o antecedente de embarazo o lactancia.
Los datos se recolectaron a través de una revisión de la información demográfica (edad, sexo e IMC) y las características clínicas. El estudio fue revisado por el Comité de Ética del Dustira Hospital, Cimahi, y se le otorgó la carta de autorización ética número Etik.RSD/051/XII/2021. Todos los pacientes recibieron consentimiento informado y accedieron a participar en el estudio, lo cual fue evidenciado con su firma en el formato de consentimiento informado.
Los pacientes que refirieron dolor torácico por más de 20 minutos fueron clasificados como IAMCEST. La elevación de la troponina T/I o la banda miocárdica de creatinina cinasa, junto con la elevación del segmento ST en al menos dos derivaciones consecutivas de un ECG de 12 derivaciones permiten diagnosticar el IAMCEST. El infarto agudo de miocardio sin elevación del segmento ST (IAMSEST) se refería a la inversión de la onda T, depresión del segmento ST y enzimas cardíacas positivas en individuos con angina o una condición relacionada. La angina inestable (AI) se definía por la depresión del segmento ST, inversión de la onda T, y enzimas cardíacas negativas en el paciente.
En todos los pacientes se obtuvo una muestra de sangre venosa dentro de la primera hora después de su ingreso a la sala de urgencias. Los aspectos hematológicos se analizaron como parte del cuadro hemático automatizado realizado antes de suministrar cualquier tratamiento. El recuento absoluto de plaquetas se dividió por el recuento de linfocitos para determinar la RPL. Los indicadores bioquímicos en ayunas, como triglicéridos, colesterol total, valores de lipoproteínas de alta densidad, glicemia y ácido úrico, se midieron un día después del ingreso. En este trabajo se hizo solo una prueba del marcador cardíaco troponina I, y se consideró un valor igual o mayor a 002 ng/ml como significativo.
Las personas diagnosticadas con SCA se clasificaron por grupos con base en su riesgo, utilizando los puntajes GRACE y TIMI. Este es el riesgo de sufrir un evento cardíaco en los siguientes catorce días o de morir dentro de los próximos seis meses a tres años. Algunos factores, incluyendo el nivel promedio de creatinina, la presión arterial sistólica, la edad, la frecuencia cardíaca, la clase Killip de insuficiencia cardíaca, los marcadores cardíacos elevados, los antecedentes de paro cardíaco y la desviación del segmento ST se utilizaron para determinar el puntaje GRACE. Para los pacientes con IAMCEST, el puntaje de riesgo TIMI se basa en su frecuencia cardíaca, edad, hipertensión arterial, tensión arterial sistólica, insuficiencia cardíaca de Killip y peso. También incluye los antecedentes de elevación ST previo o (bloqueo de rama izquierda) BRIHH y cuánto tardaron en recibir tratamiento anteriormente. A su vez, las variables para el SCASEST abarcan edad, antecedentes de enfermedad coronaria (EC), hipertensión, tabaquismo, EC reciente (estenosis del 3 al 50%), uso de ácido acetilsalicílico (ASA) en la última semana, angina grave (32 episodios en 24 horas), cambios de 30.5 mm en el segmento ST del ECG y un marcador cardíaco positivo. Existen tres niveles de RPL: baja (75), moderada (75-199) y alta (> 199).
Las variables se dividen en dos variables independientes y dependientes. La RPL era la variable dependiente, mientras que los puntajes de riesgo GRACE y TIMI eran factores independientes. Los datos recolectados se evaluaron con el apoyo del programa estadístico SPSS 22.0. Para los datos numéricos continuos, el análisis descriptivo constó de la media DE/mediana (Q1-Q3) y la distribución de la frecuencia porcentual para los datos categóricos. La correlación de Pearson se utilizó para determinar si había una relación entre los datos. Para la RPL, se utilizó un análisis de la curva de la característica operativa del receptor.
Resultados
En el estudio se incluyeron 1.000 pacientes con SCA; 562 (56.2%) de los pacientes eran hombres, y 438 (43.8%) eran mujeres. En total, 205 (20.5%) de los pacientes fueron tratados con un código diagnóstico de IAMCEST, 351 (35.1%) con un código diagnóstico de IAMSEST y 444 (44.4%) con un código diagnóstico de AI. Con base en las características clínicas y demográficas en la tabla 1, no se observan diferencias significativas entre los tres grupos respecto a edad, IMC, antecedente de EC conocido, ICP previo, IAM previo, CABG previo, hipertensión, antecedentes familiares de EC y tabaquismo (p < 0.000, p = 0.64, p = 0.464, p = 0.856, p = 0.963, p = 0.714, p = 0.517, p = 0.864 y p = 0.225, respectivamente). De acuerdo con los antecedentes de los pacientes, la frecuencia de accidente cerebrovascular previo (8.2%, 3.9%, 2.9%, p = 0.036, respectivamente) y DM (9.2%, 7.2%, 1.4%, p = 0.098, respectivamente) es significativamente más alta en el grupo de RPL alta, comparado con los grupos de RPL moderada y baja.
Tabla 1 Características demográficas de pacientes con síndrome coronario agudo
| RPL | RPL baja (< 75) n = 70 | RPL moderada (75-199) n = 746 | RPL alta (> 199) n = 184 | Valor p |
|---|---|---|---|---|
| Edad, años | ||||
| Mediana (Q1-Q3) | 57 (47.75-62.25) | 55 (49-63) | 64 (54.25-70) | < 0.000 |
| Sexo | ||||
| Masculino, n (%) | 34 (48.6%) | 425 (57%) | 103 (56%) | 0.399 |
| Femenino, n (%) | 36 (51.4%) | 321 (43%) | 81 (44%) | 0.399 |
| IMC, kg/m2 | 25.03 (22.32-26.85) | 24.46 (22.19-26.89) | 24.44 (21.86-27.86) | 0.64 |
| Antecedentes | ||||
| EC conocida, n (%) | 26 (37.1%) | 244 (32.7%) | 54 (29.3%) | 0.464 |
| ICP previo, n (%) | 4 (5.7%) | 32 (4.3%) | 8 (4.3%) | 0.856 |
| IAM previo, n (%) | 6 (8.6%) | 58 (7.8%) | 15 (8.2%) | 0.963 |
| CABG previo, n (%) | 0 (0%) | 6 (0.8%) | 1 (0.5%) | 0.714 |
| Accidente cerebrovascular/AIT previo, n (%) | 2 (2.9%) | 29 (3.9%) | 15 (8.2%) | 0.036 |
| Factores de riesgo cardiovascular, n (%) | ||||
| Hipertensión, n (%) | 19 (27.1%) | 164 (22%) | 45 (24.5%) | 0.517 |
| Diabetes mellitus, n (%) | 1 (1.4%) | 54 (7.2%) | 17 (9.2%) | 0.098 |
| Antecedentes familiares de EC, n (%) | 25 (35.7%) | 260 (34.9%) | 68 (37%) | 0.864 |
| Tabaquismo, n (%) | 32 (45.7%) | 284 (38.1%) | 80 (43.5%) | 0.225 |
| Exámen físico | ||||
| Frecuencia cardíaca | 95 (81.75-109) | 102 (89-109) | 105 (95-114.75) | < 0.000 |
| Presión arterial sistólica (mmHg) | 120 (110-140) | 120 (110-130) | 120 (110-130) | 0.539 |
| Presión arterial diastólica (mmHg) | 80 (70-90) | 80 (80-90) | 80 (80-87.5) | 0.058 |
| Parámetros bioquímicos | ||||
| Glucemia (mg/dl) | 120 (99.75-140.5) | 120 (98-148) | 121.5 (100-156) | 0.417 |
| Colesterol total (mg/dl) | 156 (124.75-182.75) | 165 (134-189.25) | 169.5 (143-203) | 0.027 |
| Colesterol LDL (mg/dl) | 119.5 (86.25-145) | 108 (89-136) | 123 (96.5-153.25) | 0.003 |
| Colesterol HDL (mg/dl) | 33 (30-40.25) | 32 (28-38) | 32 (28-38) | 0.286 |
| Triglicéridos (mg/dl) | 122.5 (96.75-173) | 127 (95-171) | 120 (95.25-159.75) | 0.448 |
| Creatinina (mg/dl) | 0.8 (0.6-1.1) | 0.8 (0.6-1) | 0.9 (0.6-1.1) | 0.06 |
| Urea (mg/dl) | 28 (22-34.25) | 27 (23-34) | 27.5 (22.25-36.75) | 0.664 |
| Troponina I (ng/ml) | 0.01 (0.01-0.04) | 0.03 (0.01-0.07) | 0.26 (0.01-1.5) | < 0.000 |
| Sodio (mmol/l) | 138 (137-140) | 138 (137-141) | 139 (137-141) | 0.151 |
| Potasio (mmol/l) | 3.9 (3.77-4) | 3.9 (3.7-4) | 3.8 (3.6-4) | 0.388 |
| Parámetros hemolíticos | ||||
| Hemoglobina (g/l) | 13.25 (12.35-14.3) | 13.2 (12.1-14.3) | 13.2 (12.1-14.4) | 0.557 |
| Eritrocitos | 4.5 (4.2-5.12) | 4.7 (4.3-5.3) | 4.7 (4.3-5.3) | 0.235 |
| Hematocrito, % | 37.6 (34.5-41.4) | 36.9 (33.7-41.12) | 38 (35.4-42.6) | 0.023 |
| Leucocitos | 8.8 (7.6-9.8) | 8.4 (7.1-9.6) | 8.4 (7.1-9.8) | 0.179 |
| Recuento de linfocitos | 2597.8 (2356.37-3242.85) | 1855.2 (1512-2197.8) | 1154.15 (897.9-1449.7) | < 0.000 |
| Recuento de monocitos | 485.9 (354.65-742.85) | 545.5 (389.85-715) | 636.5 (438.87-900.57) | < 0.000 |
| Recuento de basófilos | 41.85 (19.3-59.82) | 46.4 (22.3-71.02) | 32.1 (14.75-54.6) | < 0.000 |
| Recuento de eosinófilos | 149.05 (66.52-277.57) | 106.8 (63.15-220.9) | 90.75 (28.95-169.8) | 0.004 |
| Recuento de neutrófilos | 5423.9 (4066.42-6758.52) | 5835.3 (4528.3-6973.2) | 6342.8 (4823.02-7871.55) | 0.004 |
| Plaquetas | 164 500 (154 000-183 000) | 228 000 (174 000-287 000) | 318 500 (253 250-352 500) | < 0.000 |
| VCM (fL) | 82.1 (75.75-85.47) | 81.2 (73-84.8) | 81.9 (75.1-84.7) | 0.219 |
| HCM (fL) | 27.5 (26.32-30.12) | 27.9 (23.5-30.1) | 28 (24.3-29.95) | 0.659 |
| CHCM (fL) | 34.25 (31.45-35.3) | 33.8 (32-35) | 33.95 (32.1-35.2) | 0.645 |
| RNL | 2.02 (1.38-2.84) | 3.2 (2.27-4.10) | 5.14 (3.95-7.98) | < 0.000 |
| ADE | 12.55 (10.55-14.2) | 12.85 (10.8-14.3) | 14.9 (12.6-18.07) | < 0.000 |
| Desviación del segmento ST, n (%) | 56 (80%) | 605 (81.1%) | 161 (87.5%) | 0.112 |
| Clase Killip | ||||
| I | 58 (82.9%) | 610 (81.8%) | 143 (77.7%) | 0.803 |
| II | 7 (10%) | 70 (9.4%) | 22 (12%) | 0.803 |
| III | 4 (5.7%) | 39 (5.2%) | 10 (5.4%) | 0.803 |
| IV | 1 (1.4%) | 27 (3.6%) | 9 (4.9%) | 0.803 |
| Puntaje de riesgo GRACE | 125 (107.5-144.25) | 134 (115-156) | 155 (132.5-178) | < 0.000 |
| TIMI | ||||
| AI | 3 (3-3) | 3 (3-4) | 3 (3-4) | 0.001 |
| IAMSEST | 4.5 (4-5) | 4 (4-5) | 5 (4-5) | < 0.000 |
| IAMCEST | 6 (5.5-6) | 6 (5-6) | 6 (5-7) | 0.003 |
Los datos se presentan como medianas (rango intercuartílico) o n (%). EC: enfermedad coronaria; ICP: intervención coronaria percutánea; CABG: coronary artery bypass graft (cirugía de revascularización miocárdica); IAM: infarto agudo de miocardio; LDL: liproteína de baja densidad; HDL: lipoproteína de alta densidad; VCM: volumen corpuscular medio; HCM: hemoglobina corpuscular media; CHCM: concentración de hemoglobina corpuscular media.
Las características de laboratorio de los participantes se encuentran en la tabla 1; estas no mostraron ninguna diferencia significativa entre los tres grupos, incluyendo glicemia, triglicéridos, urea, creatinina, sodio, potasio, hemoglobina, eritrocitos, hematocrito y leucocitos (p = 0.417, p = 0.448, p = 0.06, p = 0.664, p = 0.151 y p = 0.388, respectivamente). La troponina I (0.26 [0.01-1.5], 0.03 [0.01-0.07], 0.01 [0.01-0.04], p < 0.000), los monocitos (636.5 [438.87-900.57], 545.5 [389.85-715], 485 [354.65 742.85], p < 0.000) y las plaquetas (318,500 [253,250-352,500], 228,000 [174,000-287,000], 164,500 [154,000-183,000], p < 0.000) se encontraron significativamente más altos en el grupo de RPL alta. Comparado con los grupos de RPL moderada y alta, el grupo de RPL baja tenía un recuento linfocitario mayor (2597.8 [2356.37-3242.85], 1855.2 [1512-2197.8], 1154.15 [897.9-1449.7], p < 0.000).
Comparado con los individuos con una RPL moderada o baja, las personas con RPL alta tenían puntajes de riesgo GRACE considerablemente más altos (158 [144-174], 130 [114.5-149], y 124 [104-147.75], respectivamente [p < 0.000]). Los datos se dividieron de acuerdo con los códigos diagnósticos de TIMI para AI, TIMI para IAMSEST y TIMI para IAMCEST. Los resultados indicaron que los puntajes de riesgo TIMI para AI fueron parecidos en los grupos de RPL alta, moderada o baja (3 [3-4], 3 [3-4], y 3 [3-3], p = 0.001). El puntaje de riesgo TIMI para IAMSEST fue mayor en el grupo con RPL alta (5 [4-5], 4 [4-5], y 4.5 [4-5], p < 0.000). El puntaje de riesgo TIMI para IAMCEST tuvo puntajes similares en los grupos de RPL alta, moderada o baja (6 [5-7], 6 [5-6], y 6 [5.5-6], p = 0.003).
Además, los puntajes de riesgo GRACE (r = 0.291, p < 0.000), TIMI para AI (r = 0.365, p < 0.000), TIMI para IAMSEST (r = 0.314, p < 0.000) y TIMI para IAMCEST (r = 0.227, p = 0.001) indican una relación positiva con RPL (tabla 2).
Tabla 2 Análisis de correlación para pacientes con síndrome coronario agudo
| RPL | ||
|---|---|---|
| r | p | |
| Puntaje GRACE | 0.291 | < 0.000 |
| Puntaje TIMI | ||
| AI | 0.365 | < 0.000 |
| IAMSEST | 0.314 | < 0.000 |
| IAMCEST | 0.227 | 0.001 |
De acuerdo con la evaluación de la característica operativa del receptor (ROC, por su sigla en inglés), el punto de corte óptimo para RPL es 199. Se encontró que el área bajo la curva (AUC, por su sigla en inglés) para predecir la mortalidad utilizando GRACE fue 0.642 y el punto de corte óptimo fue 121.5 (sensibilidad: 80.91%, especificidad: 36.14%), con un valor predictivo positivo del 42.87% y un valor predictivo negativo del 76.17%. El análisis del puntaje de riesgo GRACE se puede apreciar en la figura 1.
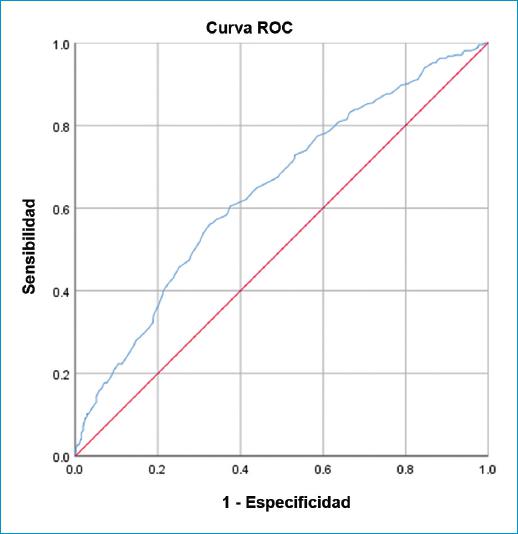
Figura 1 Análisis de la curva de la característica operativa del receptor (AUC = 0.642) del puntaje de riesgo GRACE para la mortalidad intrahospitalaria.
A su vez, en la figura 2, el AUC del puntaje de riesgo TIMI para predecir la mortalidad en pacientes con AI fue 0.633 (sensibilidad: 96.8%, especificidad: 3.11%) con un valor predictivo positivo del 25% y un valor predictivo negativo del 71.42%.
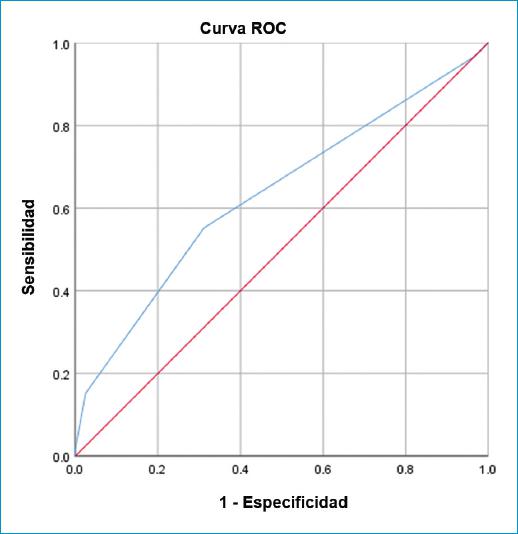
Figura 2 Análisis del puntaje de riesgo TIMI (AUC = 0.633) para la mortalidad intrahospitalaria basado en la curva de la característica operativa del receptor.
La figura 3 muestra que el puntaje de riesgo TIMI tenía un AUC de 0.665 (sensibilidad: 92.85%, especificidad: 5.74%), un valor predictivo positivo del 39.75% y un valor predictivo negativo del 54.54% para predecir la mortalidad en pacientes con IAMSEST.
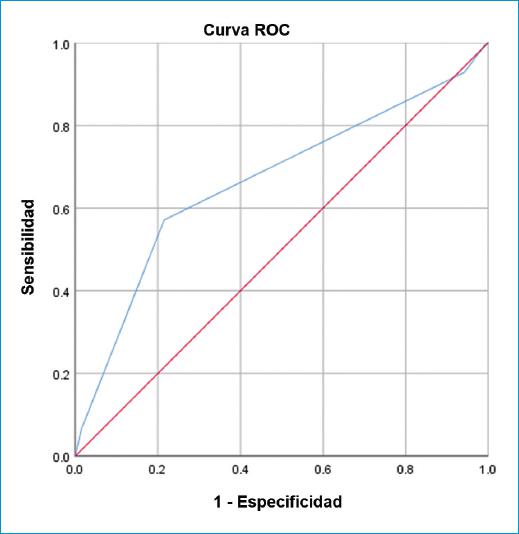
Figura 3 Análisis de la curva de la característica operativa del receptor para la mortalidad intrahospitalaria utilizando el puntaje de riesgo TIMI para IAMSEST (AUC = 0.665).
El AUC del puntaje de riesgo TIMI para predecir la mortalidad en pacientes con IAMCEST fue 0.634 (sensibilidad: 93.45%, especificidad: 15.30%), con un valor predictivo positivo del 54.64% y un valor predictivo negativo del 68.18%. El análisis del puntaje de riesgo TIMI para IAMCEST se puede apreciar en la figura 4.
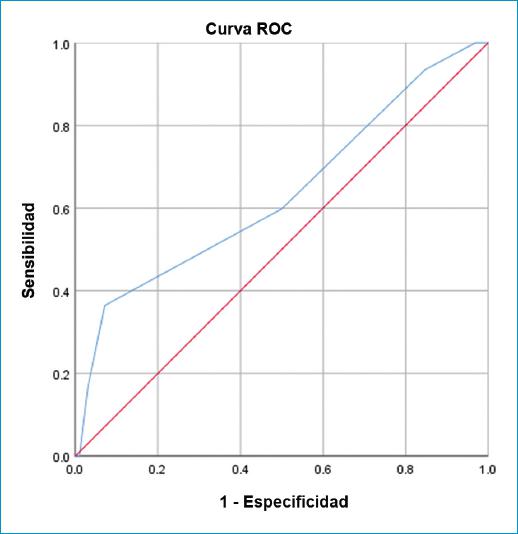
Figura 4 Análisis del puntaje de riesgo TIMI para IAMCEST (AUC = 0.634) para la mortalidad intrahospitalaria basado en la curva de la característica operativa del receptor.
Los puntajes de riesgo, incluidos el GRACE y el TIMI para AI, IAMSEST y IAMCEST, se describen en la tabla 3.
Tabla 3 Análisis ROC de los puntajes de riesgo GRACE, TIMI para AI, TIMI para IAMSEST y TIMI para IAMCEST
| AUC | SE | Valor p | IC 95% | Especificidad | Sensibilidad | VPN | VPP | Punto de corte | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Límite inferior | Límite superior | |||||||||
| GRACE | 0.642 | 0.018 | < 0.000 | 0.607 | 0.667 | 36.14 | 80.91 | 6.17 | 2.87 | 21.5 |
| TIMI AI | 0.633 | 0.031 | < 0.000 | 0.573 | 0.694 | 3.11 | 96.8 | 71.42 | 25 | 3 |
| TIMI IAMSEST | 0.665 | 0.031 | < 0.000 | 0.605 | 0.726 | 5.74 | 92.85 | 54.54 | 39.75 | 4 |
| TIMI IAMCEST | 0.634 | 0.039 | 0.001 | 0.558 | 0.710 | 15.30 | 93.45 | 68.18 | 54.64 | 5 |
Discusión
En los últimos años, los parámetros inflamatorios obtenidos de la sangre periférica se han convertido en marcadores importantes por su conveniencia y bajo costo como herramienta para diagnosticar e informar el pronóstico1. Se ha afirmado que los puntajes RPL son los nuevos marcadores de pronóstico para varias enfermedades, entre ellas las cardiovasculares, las pulmonares, las neoplasias, los accidentes cerebrovasculares y los ataques isquémicos transitorios. Este estudio se enfocó en el área de la EC7. Algunos estudios previos mostraron la correlación entre la RPL y la gravedad de la EC. El puntaje RPL medido en el momento del tratamiento representa un predictor independiente de un resultado adverso en pacientes con SCA11. Existe una relación entre la RPL y la placa vulnerable correlacionada con las vías inmunológicas e inflamatorias1. La conexión entre la RPL y la EC grave en 1.016 pacientes con IAMSEST informó que la RPL tiene una correlación positiva con el puntaje SS (p < 0.001), de modo que el aumento de la RPL se convierte en un predictor independiente para un SS alto en pacientes con IAMSEST (OR = 1.018; IC 95% = 1.013-1.023; p < 0.001)11.
En términos del mecanismo fisiológico, un puntaje alto en el recuento plaquetario se relaciona con la inflamación subyacente porque el mediador inflamatorio estimula la proliferación de los megacariocitos y genera un estado protrombótico relacionado con la trombocitosis2. Los linfocitos forman parte del sistema de inmunidad adaptativa que obra contra la inflamación y suprime la inflamación; así, un recuento bajo de linfocitos se relaciona con la progresión de la aterosclerosis y tiene malos resultados clínicos12.
En este estudio se observan datos de correlación entre el puntaje RPL y los puntajes de riesgo GRACE y TIMI en pacientes con SCA, que incluyen AI, IAMSEST e IAMCEST. Los hallazgos principales son los siguientes:
- Los análisis de correlación muestran una correlación positiva entre el puntaje RPL y el puntaje de riesgo GRACE (r = 0.291; p < 0.000) y el puntaje de riesgo TIMI para AI, IAMSEST e IAMCEST, respectivamente (r = 0.365, p < 0.000; r = 314, p < 0.000; r = 0.227, p = 0.001).
- La RPL tiene alta sensibilidad (80.91%) y baja especificidad (36.14%) para predecir el puntaje de riesgo GRACE.
- La RPL tiene alta sensibilidad (96.8%) y baja especificidad (3.11%) para predecir el puntaje de riesgo TIMI para AI.
- La RPL tiene alta sensibilidad (92.85%) y baja especificidad (5.74%) para predecir el puntaje de riesgo TIMI para IAMSEST.
- La RPL tiene alta sensibilidad (93.4%) y baja especificidad (15.30%) para predecir el puntaje de riesgo TIMI para IAMCEST.
El análisis de correlación mostró una correlación positiva entre el puntaje RPL y los puntajes de riesgo GRACE y TIMI. Así, un alto recuento plaquetario y un bajo recuento linfocitario mostrarán valores altos en los mencionados puntajes. Por lo tanto, la RPL con un puntaje de sensibilidad alto y una especificidad baja se puede utilizar como predictor de resultados adversos en pacientes con SCA basado en el puntaje de riesgo GRACE y el puntaje de riesgo TIMI. El valor predictivo negativo es mayor que el valor predictivo positivo, de acuerdo con el análisis ROC del puntaje de riesgo GRACE, con un umbral de 121.5. Los pacientes con SCA que tenían un puntaje de riesgo GRACE bajo tenían un mejor pronóstico y tasa de supervivencia que aquellos con un puntaje de riesgo GRACE alto.
Los análisis ROC del puntaje de riesgo TIMI con puntos de corte de 3, 4 y 5 para AI, IAMSEST e IAMCEST tienen un mayor valor predictivo negativo que positivo. Los pacientes con SCA y un puntaje de riesgo TIMI bajo tenían un mejor pronóstico y tasa de supervivencia que los que tenían un puntaje de riesgo TIMI alto.
Conclusión
Los marcadores inflamatorios tienen un papel importante en el proceso de aterosclerosis, desde la formación de la placa hasta la ruptura de la misma. En un país lleno de limitaciones para diagnosticar y determinar el pronóstico de un caso específico de SCA, se requiere de un marcador conveniente, económico y reproducible. La RPL es un indicador de laboratorio conveniente, económico y reproducible en un entorno de práctica clínica habitual, que se podría utilizar como predictor de un resultado adverso en pacientes con SCA, basado en los puntajes de riesgo GRACE y TIMI.














