Introducción
La fibrilación auricular (FA) resulta de la excitación de múltiples focos auriculares que crean una activación y contracción auricular excesiva y mal coordinada. Es la arritmia sostenida más común en el mundo y se asocia con un incremento del riesgo de accidente cerebrovascular (ACV), tromboembolia periférica, insuficiencia cardíaca (IC), demencia y deterioro de la calidad de vida1. Además, representa mayor riesgo de muerte y de ingreso hospitalario, a lo cual se le atribuye un 10 a un 40% de pacientes con FA hospitalizados cada año2. Existe una tendencia al incremento de la incidencia y prevalencia de la FA, que se asocia al envejecimiento general de la población, a una mayor prevalencia de obesidad, a la mejoría en la supervivencia tras un primer evento cardiovascular y a las nuevas tecnologías para la detección de esta entidad y otras arritmias3. Con la población en crecimiento, será inevitable que los médicos que se encuentran en los servicios de urgencias y en la primera línea de atención para esta enfermedad (médicos generales, internistas, geriatras, urgenciólogos, cardiólogos clínicos) estén expuestos a su diagnóstico y tratamiento. Con la evidencia abrumadora que se ha obtenido en los últimos veinte años, se tienen cada vez más pruebas de que los pacientes seleccionados con FA pueden tratarse de forma segura en el servicio de urgencias sin necesidad de ingreso hospitalario. Por lo tanto, los facultativos deben estar preparados para el abordaje inicial, identificar potenciales complicaciones, realizar un tratamiento oportuno y adecuado, así como tener conocimientos que les permitan la prevención de desenlaces adversos a futuro. El manejo de pacientes con FA recién diagnosticada implica controlar la frecuencia cardiaca, encontrar causas reversibles, prevenir ACV y, a menudo, restaurar el ritmo sinusal mediante cardioversión. Por ende, cuando se enfrenta un paciente con esta arritmia, los principales objetivos son aliviar los síntomas por los que el paciente ingresa (controlando la frecuencia cardiaca o restaurando el ritmo sinusal), además de prevenir y evitar complicaciones a corto (deterioro hemodinámico, fenómenos tromboembólicos) y largo plazo (desarrollo de taquicardiomiopatía, demencia, etc.). Para alcanzar estos objetivos generales el facultativo se debe realizar los siguientes cuestionamientos:
– ¿Hay indicación de control del ritmo en forma urgente?
– ¿Se necesita controlar el ritmo cardiaco?, ¿hay que realizar cardioversión?
– ¿Se necesita controlar la FC?
– ¿Hay una causa secundaria o predisponente?
– ¿Cuáles son los factores precipitantes o agravantes de la FA?
– ¿Se necesita anticoagular en forma “electiva”?, ¿cómo hacerlo?
– ¿Se necesita hospitalizar al paciente?
– ¿Cómo se hará el seguimiento?
Esta revisión analiza el manejo de la FA en el servicio de urgencias con base en la evidencia disponible. Se revisará el impacto clínico, la utilidad de las clasificaciones, las distintas formas de presentación, las opciones terapéuticas de acuerdo con las diferentes estrategias, la identificación de los pacientes de mayor riesgo para eventos trombóticos y la mejor forma de optimizar los recursos económicos del sistema de salud.
Impacto
Es probable que la FA afecte a 1 de cada 4 adultos de mediana edad en los EE.UU. y los países europeos1. En Europa, la FA afecta actualmente a 8 millones de personas y se espera que aumente dramáticamente 2.3 veces para 20504. En Colombia, se estima que la prevalencia de esta enfermedad es del 1.8% en adultos entre los 60 y 69 años, del 4.6% en los de 70 a 79 años, del 8.2% en los de 80 a 89 años y del 11% en los mayores de 90 años5. En los EE.UU. cada año hay más de 500 000 ingresos por FA6; es responsable de más del 3% de las urgencias generales y de alrededor del 10% de los ingresos en las unidades de cardiología. Se ha demostrado que la tasa de hospitalización tras el ingreso a urgencias es mucho mayor en los pacientes cuyo diagnóstico principal fue la FA, cuando se compara con los pacientes que acuden a urgencias por otros motivos7. Adicionalmente, las visitas al servicio de urgencias por FA han aumentado en los últimos años y, con ello, los costos de atención. Una publicación reciente demostró que tener un diagnóstico nuevo de FA representa un alto costo para el sistema de salud8, el cual se dividirá entre los que serán diagnosticados por primera vez y entre los que acuden para control de síntomas recurrentes o por complicaciones secundarias de la enfermedad. Por lo anterior, un diagnóstico temprano y oportuno, implica un menor costo en comparación a cuando se tratan pacientes sintomáticos o con complicaciones8.
Clasificación
La clasificación de la FA se debe iniciar una vez se logre detectar y registrar, desde el punto de vista electrocardiográfico, un primer episodio. Según las guías de la Sociedad Europea de Cardiología (ESC) desarrolladas en colaboración con la Asociación Europea de Cirugía Cardiotorácica (EACTS9), se recomienda la siguiente clasificación de FA:
– FA diagnosticada por primera vez: la FA no ha sido diagnosticada antes, independientemente de la duración de la arritmia o la presencia y gravedad de los síntomas relacionados con ella.
– FA paroxística: se detecta la FA que revierte de manera espontánea en menos de 7 días (la mayoría de los episodios duran menos de 24 horas).
– FA persistente: los episodios de FA que duran más de siete días, incluidos aquellos que se terminan por cardioversión farmacológica o eléctrica tras más de siete días.
– FA persistente a largo plazo: la FA dura más de 12 meses.
– FA permanente: el paciente y el médico deciden abortar las estrategias de restauración después de una consulta clínica compartida.
También recomiendan abolir términos usados previamente, como FA valvular o no valvular, FA aislada o FA crónica. De igual forma, existen otras clasificaciones de la FA que pueden ser útiles en el contexto clínico:
– FA asintomática: se diagnostica con un ECG de 12 derivaciones realizado de forma oportunista en pacientes asintomáticos.
– FA posoperatoria: nueva aparición de FA (por lo general autolimitada) después de una cirugía mayor (típicamente cardíaca) en pacientes que estaban en ritmo sinusal antes de la cirugía y no tenían antecedentes de FA.
La clasificación de la FA basada en factores desencadenantes subyacentes (FA secundaria a cardiopatía estructural, FA focal, FA monogénica, FA poligénica, FA posoperatoria, FA en pacientes con prótesis mecánica o estenosis mitral, FA en atletas)9 podría aportar información para el tratamiento, pero hasta la fecha y por falta de utilidad clínica, viene en desuso.
Es muy poco probable encontrar una clasificación única e integral de la FA ya que, además de su complejidad, se encuentran múltiples factores clínicos, herramientas de monitorización, distintos instrumentos para valorar el riesgo y múltiples escenarios de presentación que influyen en su tratamiento y evolución.
Presentación clínica
La pérdida del aporte hemodinámico de la contracción auricular podría explicar algunos síntomas de los pacientes con FA. Esta entidad varía en las formas de presentación clínica, desde un curso silente, identificado únicamente por métodos diagnósticos, hasta palpitaciones, limitación de la clase funcional, aturdimiento, limitación para el ejercicio o malestar torácico. De forma menos usual, se pueden encontrar eventos embólicos como primera manifestación o síntomas más graves, como disnea en reposo, angina, presíncope o, rara vez, síncope. Cualesquiera de las presentaciones clínicas o síntoma asociado a la FA debe ser registrado en la historia clínica; de la misma forma, se deben incluir su inicio o la forma y fecha de presentación, los posibles factores desencadenantes, la frecuencia y duración, la gravedad y las características. En general, la historia natural de la FA está caracterizada por un empeoramiento gradual con el tiempo, con la autoperpetuación de la arritmia desde estados paroxísticos a estados persistentes. En consecuencia, los casos en los que se presentan más síntomas se asocian a reciente comienzo (hasta un 90% de casos)10. La gravedad y duración de los síntomas se ven afectadas por la rapidez y regularidad de la respuesta ventricular, por el compromiso estructural basal y por la presencia de comorbilidades, como la diabetes mellitus (DM)11. El dolor torácico puede estar hasta en el 20% de los pacientes que presentan FA y aunque por lo general no se debe a un evento isquémico primario, siempre será un reto diagnóstico que necesita suspicacia para poder diferenciar o descartar un síndrome coronario agudo (SCA)12. Los pacientes sin cambios significativos del segmento ST tienen bajo riesgo de infarto agudo de miocardio. Zimetbaum et al.12 sugieren que el dolor torácico y la depresión del segmento ST de 2 mm (mm) son hallazgos comunes en la FA, pero tienen una capacidad limitada para diagnosticar o predecir el SCA; demostraron también que la elevación o depresión del segmento ST ≥ 2 mm era un predictor confiable de isquemia concomitante. En consecuencia, aquellos con cambios significativos de ST después del tratamiento del ritmo en FA, requieren consideración de un SCA como diagnóstico adicional.
Tratamiento en el servicio de urgencias
Generalmente, en los servicios de urgencias la FA recibe un tratamiento orientado hacia el control de la frecuencia, lo que deja las estrategias de control del ritmo en manos de cardiólogos clínicos o electrofisiólogos. No obstante, el futuro del manejo de la FA depende de las decisiones de los médicos de urgencias o atención inicial respecto a las estrategias de control del ritmo temprano o tardío con cardioversión eléctrica o farmacológica. Cuando un paciente se presenta en el servicio de urgencias, representa una oportunidad única para remodelar el curso de la FA y ofrecer intervenciones tempranas que, en última instancia, ayudarían a reducir las hospitalizaciones innecesarias, mejorar la calidad de vida, disminuir la carga de la enfermedad a futuro, evitar el daño estructural y reducir los costos de atención.
En la evaluación inicial se debe determinar si el paciente con FA está estable o inestable, si existen precipitantes, si se trata de FA persistente vs. paroxística, el tiempo de inicio de los síntomas, las comorbilidades asociadas, el uso o necesidad de anticoagulación (ver más adelante) y el uso de tratamientos previos para manejo de la arritmia. Las principales herramientas para responder estos cuestionamientos serán una historia clínica completa, la evaluación del riesgo trombótico/hemorrágico (CHA2DS2VASc/HASBLED), un EKG de 12 derivaciones, la realización de pruebas bioquímicas básicas (hemograma, función renal y tiroidea, electrolitos), antecedentes médicos (presencia de cardiopatía subyacente) y un ecocardiograma transtorácico9. No se recomiendan de forma rutinaria pruebas como péptido natriurético cerebral (BNP) o troponina; la solicitud de estos estudios dependerá de la situación clínica particular. Así mismo, se recomienda la prueba de embarazo en mujeres en edad reproductiva13. Los precipitantes a identificar son:
– Insuficiencia cardiaca
– Enfermedad coronaria
– Otras formas de cardiopatía: hipertrófica, dilatada, valvular, reumática, etc.
– Infección
– Hipertiroidismo
– Desequilibrio hidroelectrolítico
– Intoxicación por medicamentos o alcohol
– Sepsis
En caso de identificar una causa precipitante, el primer paso será tratar la causa secundaria14.
La inestabilidad hemodinámica, según la definición de la American Heart Association, incluye: presión arterial sistólica < 90 mm Hg, estado mental alterado e isquemia cardíaca o insuficiencia cardíaca gravemente descompensada debido al ritmo subyacente15. En estos casos, los esfuerzos iniciales deben estar dirigidos a restaurar el gasto cardiaco y la perfusión tisular, que generalmente se logra posterior a la cardioversión eléctrica emergente.
Es fácil caer en la trampa de ver a un paciente hipotenso en FA con respuesta ventricular elevada (RVE) y asumir que la arritmia es la causa de la inestabilidad hemodinámica; si bien esto puede ser lo más usual, se debe recordar que otros procesos subyacentes pueden estar causando la hipotensión y la arritmia puede solo ser un espectador inocente. La hipotensión y la taquicardia pueden no deberse únicamente a la FA, sino, más bien, a sepsis, infarto de miocardio, hemorragia gastrointestinal, abstinencia de alcohol, embolia pulmonar, etc.16 Esto puede ser cierto si el paciente tiene antecedentes conocidos de FA. Por tanto, hay que asegurarse de tratar otras causas de inestabilidad, ya que el tratamiento de la taquicardia compensatoria puede empeorar la situación en estos escenarios y una estrategia basada en el control del ritmo o la frecuencia solo empeorará los desenlaces cardiovasculares13.
Por su parte, el riesgo de tromboembolia aumenta cuando la FA dura más de 12 horas, cuando falta anticoagulación, ante edad avanzada y con comorbilidades como diabetes e IC17.
Después de la evaluación inicial, ante una exacerbación de la FA, la decisión crítica después de estabilizar al paciente en el servicio de urgencias es admitirlo o enviarlo a casa. Al lograr la estabilidad clínica, habitualmente se ingresarán pacientes que, de forma concomitante, cursen con síndrome coronario agudo como causa o consecuencia o exacerbación de insuficiencia cardíaca congestiva18. Otros pacientes que necesitarán atención especial y, por ende, no se podrán dar de alta de forma segura serán aquellos con FA preexcitada (porque necesitan ablación de la vía accesoria), FA lenta con pausas mayores a 3 segundos con síntomas, o mayores a 6 segundos con o sin síntomas (para valorar la necesidad de marcapaso), bradicardia sinusal grave poscardioversión (evaluar riesgo de bloqueo AV o disfunción sinusal), los que tienen una causa secundaria no controlada de la FA (tales como crisis tirotóxica, sepsis, embolia), hipotensión persistente (descartar otras causas), los que requieren iniciación de antiarrítmicos (para evaluar tolerancia) y aquellos con dificultad para el control de la FC (fracaso en las terapias)19.
Se pueden dar de alta con seguridad aquellos pacientes en quienes se puede establecer un plan de anticoagulación adecuado, los que no tengan cardiopatía subyacente o diagnósticos alternativos, los que toleren el tratamiento y los que no tengan barreras de acceso para un control y seguimiento cardiológico.
Control del ritmo/control de la frecuencia
El estudio clínico AFFIRM condujo a la cultura entre muchos médicos de favorecer el control de la frecuencia sobre una estrategia temprana de control del ritmo debido a la falta de beneficios de supervivencia y la reducción asociada de los efectos secundarios de la terapia farmacológica20. El enfoque razonable para un primer episodio de FA consiste en la evaluación cuidadosa de los síntomas y la enfermedad cardíaca subyacente; un intento de restaurar el ritmo sinusal puede resultar apropiado y, en algunos casos seleccionados, hasta imperativo. Un análisis posterior del estudio AFFIRM sugiere que con la mejoría en la supervivencia, relacionada con el uso de anticoagulantes para el tratamiento de la FA, una estrategia de control de ritmo sinusal y la falta de impacto en la sobrevida de los antiarrítmicos actuales, cualquier efecto antiarrítmico beneficioso se verá contrarrestado por sus efectos adversos en el largo plazo. Si estuviera disponible un método eficaz para mantener el ritmo sinusal con menos efectos adversos, podría ser beneficioso21.
La cardioversión mediante una descarga eléctrica de corriente continua sincronizada (cardioversión eléctrica, CVE) o mediante la aplicación de fármacos antiarrítmicos (cardioversión farmacológica, CVF), hace parte fundamental del tratamiento de la FA en pacientes con un primer episodio o en aquellos sintomáticos que requieren una estrategia de control del ritmo. El objetivo es controlar los síntomas, disminuir las tasas de hospitalización y mejorar el rendimiento y la tolerancia al ejercicio22,23. Por el contrario, en los pacientes con remodelado auricular o atriopatía, con FA persistente de larga duración o en los que previamente se haya definido FA permanente, es razonable simplemente controlar la frecuencia ventricular. Sin importar la estrategia, es obligatoria la elección cuidadosa para no conducir a desenlaces adversos asociados a inercia terapéutica.
Con los criterios ideales, más de un tercio de los pacientes atendidos en el servicio de urgencias serán elegibles para la cardioversión en este servicio24. El método de cardioversión elegido, CVE vs. CVF debe estar basado en la experiencia del centro y el tratante, la estabilidad clínica, la carga de FA, el riesgo de eventos adversos para cada uno de los procedimientos y la elección del paciente. La CVE requiere más recursos de personal de urgencias y conlleva mayor riesgo de complicaciones debido a sedación, hipotensión, fibrilación ventricular a causa de una sincronización inadecuada de las descargas, bradicardia, taquicardia, liberación de biomarcadores cardíacos y elevación transitoria del segmento ST.
En la CVF la principal consecuencia son los eventos adversos de cada uno de los antiarrítmicos, tales como hipotensión, prolongación del intervalo QT y arritmias; por lo tanto, los pacientes deben ser monitorizados continuamente en telemetría por intervalos específicos de acuerdo con cada agente. La CVE finaliza la FA en más del 90% de los casos y la CVF convierte principalmente la FA de inicio reciente o paroxística, es decir, controla el ritmo en el 50 al 70% de los casos en unas pocas horas, cuando se usan bloqueadores de los canales de sodio (principalmente propafenona o flecainida) o vernakalant25.
No son buenos candidatos para realizar cardioversión, sin importar la estrategia, los siguientes pacientes26,27:
– Cardioversión previa fallida.
– Pobre pronóstico: comorbilidad importante, edad avanzada.
– FA que ha estado presente de forma continua durante más de un año.
– FA con causa secundaria corregible.
– Dilatación auricular grave (vol. > 48 ml/m2 o diámetro > 60 mm).
– Insuficiencia mitral grave.
– Hipertiroidismo no compensado.
– Trombo en valoración ecocardiográfica.
– Recurrencia a pesar de antiarrítmico.
– Duración desconocida de la FA.
– Alto riesgo de ACV: válvula cardíaca mecánica, cardiopatía reumática.
– Alto riesgo de arritmia ventricular: anomalía electrolítica, como hipomagnesemia o hipopotasemia graves o toxicidad por digoxina.
Muchos pacientes con FA de inicio reciente pueden pasar a ritmo sinusal en pocas horas, lo que elimina la necesidad de una cardioversión. El ensayo RACE 7 ACWAS (Rate Control vs. Electrical Cardioversion Trial 7–Acute Cardioversion vs. Wait and See) mostró que entre los pacientes que acudieron al servicio de urgencias con FA sintomática de aparición reciente (< 36 horas), la estrategia de esperar y ver no fue inferior a la cardioversión temprana para obtener el ritmo sinusal a las cuatro semanas de la visita inicial. La conversión espontánea a ritmo sinusal ocurrió con frecuencia en los pacientes del grupo de cardioversión tardía y redujo la necesidad de cardioversión eléctrica o farmacológica inmediata. A las 48 horas y a las 4 semanas después de la FA índice, el número de pacientes en ritmo sinusal fue similar, es decir, superior al 90% en ambos grupos28. Para fines prácticos, este protocolo requiere un seguimiento clínico y electrocardiográfico estrecho, en el que se evalue el retorno a ritmo sinusal y, en caso contrario, ofrecer una estrategia más acorde con la situación clínica.
De manera opuesta, el “Protocolo Agresivo de Ottawa” ofreció control del ritmo agudo y alta domiciliaria para pacientes hemodinámicamente estables con FA rápida de inicio reciente (< 48 h). Stiell et al.24 evaluaron este protocolo en 660 visitas de pacientes, con una edad media de 64.5 años, usando procainamida intravenosa (IV) o CVE, y observaron que el 96.8% de fueron dados de alta a casa y el 93.3% permaneció en ritmo sinusal normal. Por consiguiente, la elección cuidadosa de la estrategia de control del ritmo y el mejor candidato, serán los principales determinantes del éxito.
El control de la frecuencia en la FA (definido como la frecuencia adecuada para suministrar el gasto cardíaco necesario para demandas fisiológicas específicas y prevenir consecuencias adversas) es fundamental para el tratamiento de la FA, incluso para los pacientes que finalmente requieren el control del ritmo. El objetivo en pacientes con FA es que la FC esté por debajo de 110 latidos por minuto (lpm). En el ensayo RACE II29 no se demostraron diferencias en los resultados finales compuestos negativos, como arritmia y muerte cardiovascular, cuando se compararon la FC objetivo de 110 lpm (control no estricto de la FC) y la FC objetivo de 80 lpm (control estricto de la FC).
Van Gelder et al. proponen una ventana de oportunidad para el control de la FC, y demuestran las principales ventajas y desventajas del control de la FC lenta y rápida durante la FA. Se resalta que a controles más estrictos, hay mayor tasa de eventos adversos, mayor necesidad de implante de marcapaso y aumento del costo de la atención. De manera opuesta, un control inadecuado, con una FC > 110 lpm, produce más síntomas, peor calidad de vida y mayor riesgo de desarrollar IC o sufrir un ACV, adicional a un aumento del costo de la atención30. Para buscar esta ventana, los bloqueadores beta y los bloqueadores de los canales de calcio no dihidropiridínicos (excepto en IC) son los agentes más utilizados en la sala de urgencias. Otros fármacos a considerar según la disponibilidad incluyen digoxina; esta se puede utilizar en quienes el tratamiento con bloqueadores beta o bloqueadores de los canales de calcio no es eficaz, especialmente con insuficiencia cardíaca descompensada9,31. Varios estudios han comparado la eficacia de la clase de medicación (bloqueador de los canales de calcio vs. betabloqueante) en el control de la frecuencia; sin embargo, estas comparaciones distan de los objetivos de esta publicación. En la tabla 1 se resumen los medicamentos disponibles, las dosis y las principales precauciones a tener en el servicio de urgencias.
Tabla 1 Fármacos para el control de la falla cardiaca
| Medicamento | Vía IV | Vía oral (mantenimiento) | Precauciones o contraindicaciones |
|---|---|---|---|
| Metoprolol tartrato | 2.5-5 mg (máx. 4 x) | 25-100 mg c/12 h | Asma (usar selectivo) ICC aguda Broncoespasmo grave |
| Metoprolol succinato | ND | 50-300 mg/d | |
| Bisoprolol | ND | 1.25-10 mg/d | |
| Carvedilol | ND | 3.12-50 mg c/12 h | |
| Verapamilo | 2.5 a 10 mg (en 5 min) | 40 mg c/12 h a 120 mg c/8 h | ICC Ajustar en ERC |
| Diltiazem | ND | 60 mg c/8 h | |
| Digoxina | 0.5 mg bolo IV (0.75 a 1.5 mg en 24 h) | 0.06-0.25 mg | C. plasmática ERC |
| Amiodarona | 150 a 300 mg bolo 1 mg/min x 6 h 0.5 mg/min x 18 h | 400 mg c/12 h x 5 días, luego 200 mg día (carga 4 a 8 g) | Hipo/hipertiroidismo Vigilar QTc Vigilar electrolitos |
Estrategias de cardioversión
Cardioversión farmacológica
La CVF tiene una limitante importante y está relacionada con la disponibilidad de medicamentos intravenosos para el control del ritmo. Flecainida, ibutilida y vernakalant (con eficacia demostrada en la restauración de ritmo sinusal) no son accesibles en la mayoría de los servicios de urgencias. La amiodarona, rara vez utilizada en la fase aguda en los países de altos ingresos, se ha utilizado como alternativa a los medicamentos no disponibles en casos de FA paroxística o cuando hay antecedentes de cardiopatía estructural14.
Flecainida o propafenona serán la elección (donde esté disponible y no coexista enfermedad del sistema de conducción) a menos que haya evidencia de enfermedad coronaria o disfunción sistólica del ventrículo izquierdo o la duración de la FA sea mayor a siete días, en cuyo caso los betabloqueadores o la ibutilida deberían ser la elección14. Los pacientes que fallan en la CVF generalmente se derivan para una CVE.
Cardioversión eléctrica
La CVE es un procedimiento que está ampliamente disponible y que una vez se logra protocolizar es fácil de aplicar. Al elegir la estrategia de control de ritmo como terapia inicial y la CVE como elección principal, se deben considerar varios factores que impactarán en la experiencia del paciente, el éxito de la estrategia y, posiblemente, en la recurrencia. Entre estos, se destaca el momento de la cardioversión, el riesgo embólico, el uso adecuado de terapia anticoagulante y la terapia farmacológica (periprocedimiento y a largo plazo).
Una vez obtenido el consentimiento informado y explicados al paciente los beneficios y los potenciales riesgos asociados a este procedimiento, la CVE se realizará bajo sedación breve con solución intravenosa de midazolam, propofol, o ambos, y monitorización continua de la presión arterial y oximetría durante el procedimiento32. Será más eficaz cuando se utiliza un desfibrilador bifásico o cuando se ha usado un antiarrítmico previo al procedimiento y se logra mantener posterior a la cardioversión33. Se ha demostrado que la descarga de energía fija y máxima desde el inicio es más efectiva en comparación con las descargas de energía de baja que se suben de forma escalonada, sin encontrar diferencias en la seguridad34. En portadores de un desfibrilador automático implantable (DAI), la CVE anteroposterior parece ser segura y evita el daño del dispositivo, incluso, puede ser preferible a la cardioversión interna realizada con el DAI sin necesidad de una interrogación inmediata del dispositivo35. En algunas publicaciones, como el RAFF2, se realizó una comparación aleatoria, ciega y controlada con placebo de cardioversión eléctrica previa terapia farmacológica. Se administró procainamida intravenosa (15 mg/kg durante 30 min) seguida de cardioversión eléctrica (hasta tres descargas, cada una de ≥ 200 J) si era necesario, vs. infusión de placebo seguida de cardioversión eléctrica. Este estudio evaluó pacientes estables que presentaban un diagnóstico primario de fibrilación auricular de al menos tres horas de duración, en quienes los síntomas requerían un tratamiento temprano y para quienes la cardioversión farmacológica o eléctrica era una opción adecuada. Cabe resaltar que en este estudio fueron excluidos los pacientes hemodinámicamente inestables y que requirieron cardioversión inmediata (incluidos aquellos con hipotensión –presión arterial sistólica < 100 mm Hg–, preexcitación ventricular rápida, síndrome coronario agudo o enfermedad pulmonar). Los autores concluyen que, tanto la estrategia de CVE con fármacos como la CVE con placebo, fueron altamente efectivas, rápidas y seguras para restaurar el ritmo sinusal de los pacientes en el servicio de urgencias. La infusión del fármaco funcionó para aproximadamente la mitad de los pacientes y evitó la sedación necesaria para la CVE; por tanto, el control inmediato del ritmo para pacientes en el servicio de urgencias con fibrilación auricular aguda conduce a excelentes resultados36.
En cuanto a la posición de los electrodos, se ha discutido y en algunas publicaciones sugieren beneficio de la posición anteroposterior (mejor que anteroapical)25; sin embargo, otras publicaciones niegan dicho beneficio37 o concluyen que el posicionamiento de las almohadillas requiere estudios adicionales38.
Los estudios que comparan la CVE vs. CVF son limitados. Las razones para preferir la CVE en lugar de la CVF incluyen evitar los efectos secundarios de los medicamentos, la necesidad de monitorización estricta y eficacia superior. Por el contrario, los beneficios potenciales de un enfoque farmacológico incluyen evitar los riesgos de la sedación y que se evalúe la tolerancia al fármaco en quien se ha decidido continuar con la terapia con antiarrítmicos orales a largo plazo. Si bien la cardioversión es una estrategia usual y efectiva en el entorno agudo, a largo plazo las recurrencias de la FA son comunes después de esta y menos de la mitad permanecen en ritmo sinusal después de un año39. Es importante identificar a los pacientes que se beneficiarán de la cardioversión; en la literatura se han descrito algunos predictores clínicos, electrocardiográficos y ecocardiográficos que aumentan el riesgo de recurrencia o favorecen el mantenimiento del ritmo sinusal después de una cardioversión exitosa. Se ha demostrado que la FA probablemente reaparecerá después de la cardioversión en los pacientes mayores de 80 años27, o si la FA ha estado presente durante tres o más años40, en aquellos con cardiopatía subyacente (especialmente enfermedad reumática)41 y en quienes tengan duración de la onda P > 135 ms42, fracción de eyección < 50%42, diámetro auricular aumentado43 o volumen de la aurícula izquierda indexado (VAIi)44 > 46 ml/m2. Los predictores de éxito a mediano plazo de la terapia de cardioversion electrica son: edad menor de 65 años45, episodio FA con una duración menor a un mes al momento de la cardioversión46, el mantenimiento del ritmo sinusal un mes después del procedimiento de cardioversión37, el uso previo de inhibidores de la enzima convertidora de angiotensina o de bloqueadores del receptor de angiotensina47, el volumen auricular izquierdo menor a 30 ml/m248 y el uso de fármacos antirarrítmicos antes y despues de la cardioversión49.
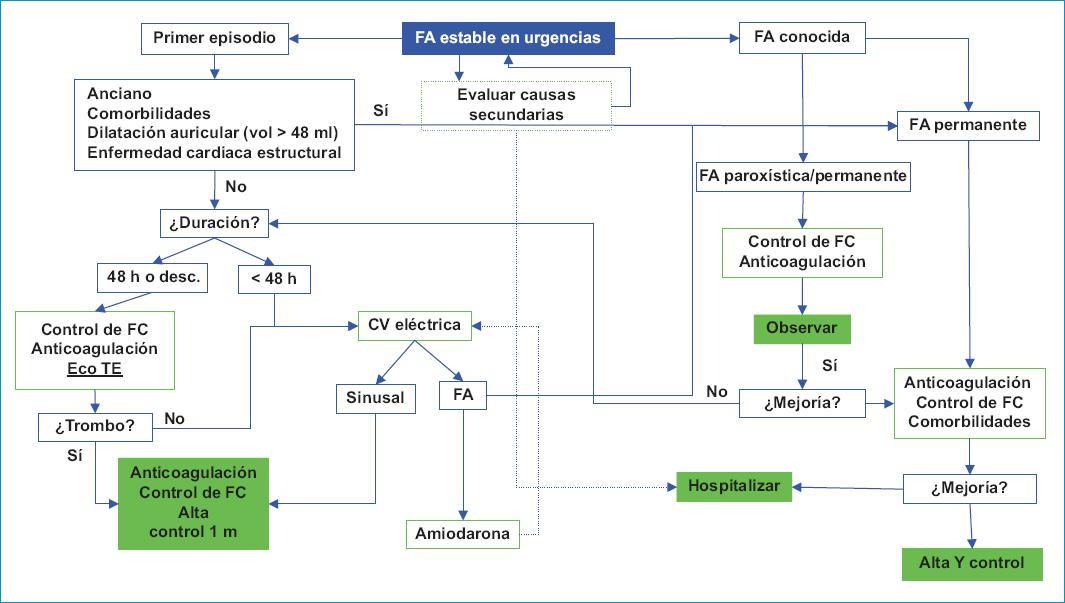
Un estudio desarrolló y validó una puntuación fácil de usar para estimar la probabilidad individual de conversión espontánea a sinusal en pacientes adultos con FA sintomática no permanente hemodinámicamente estable que acuden al servicio de urgencias. El ReSinus score utiliza variables clínicas y de laboratorio de rutina (A: duración de síntomas de FA < 24 h, B: Sin CVE previa, C: FC > 125 lpm, D: potasio sérico ≤ a 3.9 mmol/l, E: NT-ProBNP < 1.300 pg/ml, F deshidrogenasa láctica < 200 U/l) para predecir la conversión espontánea a ritmo sinusal y muestra buena calibración, discriminación y evaluación clínica50. A pesar de la falta de validación en Latinoamérica, puede ser una herramienta útil para implementar en la práctica diaria. En la figura 1 se presenta un algoritmo que resume estas consideraciones en el servicio de urgencias.
Cuando la CVE falla se debe distinguir entre dos situaciones: retorno transitorio a ritmo sinusal, con fibrilación auricular refractaria posterior, y ausencia completa de retorno al ritmo sinusal. Cuando ocurre el primer escenario, hay diferentes momentos para evaluar la recurrencia y su causa. Inmediatamente después de la descarga puede ser evidente que no se observe un solo latido sinusal (sin conversión y falla de la descarga), lo que puede deberse a la falla de la captura completa de las aurículas por la descarga de corriente continua. En el minuto siguiente puede ocurrir una recurrencia inmediata de la FA, que puede estar relacionada con una hipervulnerabilidad instantánea posterior a la descarga y a las 24 horas por aturdimiento; a la semana se presentan las recurrencias subagudas debido a la remodelación inversa eléctrica que aumenta la inestabilidad eléctrica de las aurículas. Después de la semana, una vez que se completa el remodelado eléctrico inverso, la tasa de recurrencias disminuye, lo que está representado por la fase posterior de recurrencias tardías durante la cual las recurrencias de FA aparecen a una tasa mucho más baja25,41,51. En estos casos, el tratamiento con medicamentos antiarrítmicos puede aumentar la probabilidad de mantener un ritmo normal. En el segundo escenario, la principal estrategia a emplear es aumentar la carga de choque34.
Riesgo trombótico y anticoagulación
Entre las obligaciones que se tienen en el servicio de urgencias está la necesidad de prevenir la aparición de eventos isquémicos o embólicos asociados con la cardioversión y poder identificar aquellos pacientes de alto riesgo que necesitarán estrategias de anticoagulación a largo plazo. El riesgo de tromboembolia periprocedimiento en pacientes sometidos a cardioversión puede exceder el 5 al 7% cuando la anticoagulación es inadecuada52. La anticoagulación reduce la incidencia periprocedimiento de eventos tromboembólicos entre 0.5 y 1.6%. Los anticoagulantes orales directos (ACOD) son la primera línea de tratamiento para la prevención a largo plazo del ACV en pacientes con FA no asociada a prótesis mecánica o estenosis mitral53-56. Además, análisis post hoc del RE-LY, ARISTOTELE, ROCKET-AF y ENGAGE-AF han encontrado que los ACOD son seguros y efectivos en los pacientes sometidos a cardioversión cuando el período de anticoagulación previo a la cardioversión es prolongado57-60.
El riesgo embólico está directamente relacionado con el tiempo de evolución de la arritmia; en los pacientes con FA de duración comprobada menor a 48 horas, se considera que hay un riesgo bajo de eventos tromboembólicos después de la cardioversión17. Sin embargo, es muy difícil determinar el tiempo exacto del inicio de síntomas con la presentación clínica y, usualmente, la atención inicial se hace una vez ha pasado este tiempo. Para los casos en los que se realiza cardioversión por presencia de inestabilidad hemodinámica, se recomienda un bolo de heparina no fraccionada de 10.000 unidades previo al procedimiento61.
En los escenarios de estabilidad clínica, en los que se estime una duración de la FA ≥ 48 h o no se pueda determinar el inicio de la arritmia (la mayoría de los casos), existen varias opciones a considerar que serán elegidas con base en la experiencia del personal, la disponibilidad de recursos y con un paciente enterado de los riesgos y beneficios. Se puede decidir entre: a) definir la estrategia de control exclusivo de frecuencia cardiaca, en cuyo caso la anticoagulación está determinada por el riesgo en el largo plazo, para lo cual se recomienda usar el puntaje de CHA2DS2VASc; b) anticoagular (con ACOD o AVK) durante un mínimo de tres semanas y realizar la cardioversión de forma electiva; y c) realizar un ecocardiograma transesofágico para detectar trombos en la orejuela izquierda y cardiovertir después del examen62.
En todos los casos, los pacientes deben recibir anticoagulación posterior al procedimiento de cardioversión durante al menos cuatro semanas, ya que se ha identificado un mayor riesgo cardioembólico al pasar al ritmo sinusal después de una cardioversión exitosa63. Para evaluar la eficacia y seguridad de los ACOD en pacientes sin anticoagulación que requieren cardioversión inmediata se llevaron a cabo los estudios X-Vert (con rivaroxabán), ENSURE-AF (con edoxabán) y EMANATE (con apixabán) con resultados favorables64-66. Adicionalmente, en el EMANATE otro de los objetivos pretendió evaluar el rol de las imágenes para guiar la cardioversión. En este estudio, 840 pacientes fueron estudiados mediante ETE preprocedimiento hallándose trombo auricular en 61 de ellos. Todos estos pacientes fueron cardiovertidos posterior a una terapia anticoagulante efectiva y ninguno de ellos sufrió eventos durante el seguimiento.
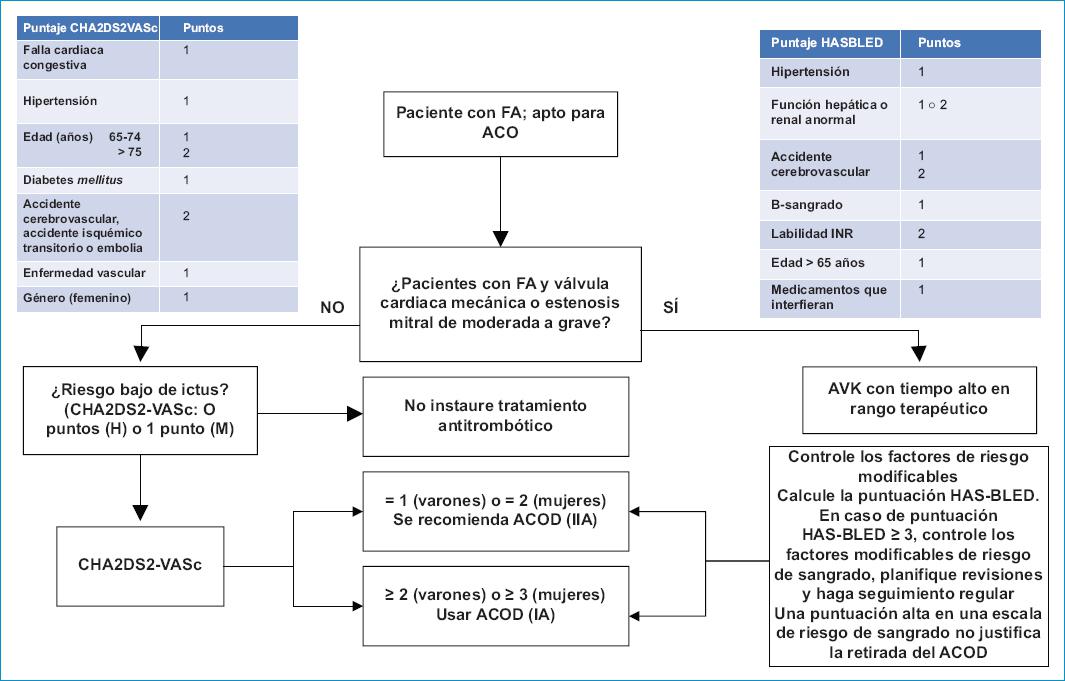
En el largo plazo, para todos los pacientes, los factores de riesgo habituales para la valoración del riesgo de ACV se resumen en la escala clínica de riesgo CHA2DS2VASc (insuficiencia cardiaca congestiva, hipertensión, edad > 75, diabetes mellitus, ACV, enfermedad vascular, edad entre 65 a 74 años y género femenino)67. En las guías actuales se propone identificar a los pacientes de bajo riesgo considerando que, como cualquier otra escala basada en factores de riesgo clínicos, el rendimiento de dicha escala es discreto al momento de identificar a los pacientes con riesgo alto que pueden sufrir complicaciones tromboembólicas. Por ende, los pacientes identificados como en riesgo bajo (CHA2DS2VASc de 0 puntos en hombres o 1 punto en mujeres) coinciden en tasas bajas de ACV isquémico o mortalidad (< 1%/año) y no requieren tratamiento anticoagulante a largo plazo9. En contraposición, se debe considerar la anticoagulación indefinida con AVK (en estenosis mitral o prótesis valvular mecánica) o ACOD (en todos los demás) para todos los pacientes con FA y una puntuación CHA2DS2VASc ≥ 2 en hombres o ≥ 3 en mujeres con una indicación IA. Para los pacientes con una puntuación CHA2DS2VASc ≥ 1 (en hombres) o ≥ 2 (en mujeres) la indicación es IIA-B9.
Adicionalmente, se debe controlar cualquier factor de riesgo modificable y evaluar de forma conjunta y estructurada una puntuación que estime el riesgo hemorrágico, como la puntuación HAS-BLED68. El principal objetivo de esta escala será evaluar los factores de riesgo hemorrágico no modificables y, sobre todo, tratar los factores de riesgo modificables de todos los pacientes con FA. En la figura 2 se integra la evaluación de los factores de riesgo para ictus y su aplicabilidad al elegir el inicio de ACOD.
Conclusión
La FA representa un importante problema para el clínico en los servicios de urgencias. En la actualidad se dispone de diferentes estrategias viables para ejecutar y para comprender que estas pueden conducir a un egreso seguro del servicio hospitalario y a disminuir los costos de atención. La estrategia de control del ritmo o frecuencia cardiaca debe ser individualizada y estar basada en variables clínicas, duración de la arritmia, riesgo trombótico, alteraciones estructurales y experiencia del facultativo, y, adicionalmente, se debe tomar de forma conjunta con el paciente. Disminuir los riesgos de tromboembolia en el servicio de urgencias y a largo plazo, será uno de los objetivos fundamentales de la atención de la FA.