Introducción
La fibrilación auricular (FA) es la arritmia más prevalente y está relacionada con un aumento significativo de morbilidad, mortalidad y pérdida de años productivos1. La incidencia y prevalencia de la FA viene en aumento; para 2010, se estimaba una prevalencia global de más de 30 millones de individuos, cifra que sugiere un aumento progresivo debido al incremento concomitante de los factores de riesgo y la longevidad de la población2. En pacientes con FA, la embolia (ya sea cerebral o sistémica) es una de las principales causas de morbilidad y mortalidad, de ahí que los esfuerzos terapéuticos actuales se centren en la prevención de esta complicación3,4. Esto es particularmente importante en pacientes de edad avanzada, ya que el número de accidentes cerebrovasculares (ACV) relacionados con FA aumenta de manera progresiva con la edad: en pacientes con edad entre 50-59 años, la FA es responsable del 1.5% de los ACV isquémicos, cifra que aumenta al 23.5% en pacientes con edades entre 80 a 89 años5. Adicionalmente, la existencia de otros factores de riesgo (como hipertensión, enfermedad aterosclerótica, falla cardíaca, antecedente de fenómenos embólicos, diabetes mellitus, entre otros) acrecientan de manera significativa el riesgo de embolia, en cuyo caso el uso de anticoagulantes orales (warfarina o anticoagulantes orales directos) disminuye de manera significativa el riesgo de ACV6,7, con mayor impacto en pacientes de elevado riesgo. Pese a ello, el riesgo de embolia y sangrado está elevado de manera simultánea en la mayoría de personas, lo cual dificulta, en ocasiones, el uso de anticoagulantes orales.
El cierre percutáneo de orejuela (CPO) es una estrategia que ha demostrado, a lo largo de los años, ser eficaz en la prevención de embolia en pacientes con FA con alto riesgo de sangrado asociado al uso de anticoagulantes8. Un estudio aleatorizado reciente demostró la no inferioridad del CPO en comparación con apixabán en un desenlace compuesto de eventos embólicos (ACV, evento isquémico transitorio o embolia sistémica), muerte cardiovascular, sangrado clínicamente relevante y complicaciones relacionadas con el dispositivo o el procedimiento9. Los resultados de los estudios y su seguimiento han mostrado que la terapia puede ser una alternativa razonable para pacientes con contraindicación para anticoagulación o con riesgo prohibitivo de sangrado y pronóstico favorable a mediano plazo4. En la actualidad, la mayor parte de los CPO son realizados mediante ecocardiografía transesofágica para guiar el procedimiento10, con base en la amplia experiencia con esta modalidad de imagen, la facilidad para quien realiza el cierre (ya que no está a cargo de las imágenes) y la experiencia inicial en los estudios pivotales11. No obstante, hasta en 2% de los pacientes no es posible hacer el examen, ya sea por variantes anatómicas o por falta de cooperación del paciente12,13. En el caso de procedimientos largos, esto conlleva la necesidad de anestesia general o sedación profunda, lo cual incrementa la posibilidad de complicaciones durante el procedimiento y el requerimiento de personal altamente entrenado (ecocardiografista y anestesiólogos) en la sala. De manera reciente, el CPO guiado por ecocardiografía intracardíaca ha cobrado importancia, ya que permite al operador obtener imágenes similares a las de la ecocardiografía transesofágica sin necesidad de anestesia general o personal adicional en la sala. El objetivo de esta revisión sistemática es determinar el impacto del uso de ecografía intracardíaca en los desenlaces de seguridad y eficacia durante los procedimientos de cierre percutáneo de orejuela.
Materiales y método
Se realizó una búsqueda en Embase, PubMed y Cochrane usando los términos “left atrial appendage” AND (closure OR occlusion) AND “intracardiac echocardiography”, sin restricción de idioma. Las listas de referencias de los artículos seleccionados fueron revisadas manualmente para buscar estudios adicionales. Se incluyeron estudios clínicos que compararon desenlaces entre ecocardiografía intracardíaca y ecocardiografía transesofágica. Se excluyeron artículos de revisión, resúmenes de congreso y cartas al editor. Los artículos fueron revisados manualmente de manera independiente por dos autores (OB, JCD) para determinar su elegibilidad, y su calidad fue determinada de acuerdo con la Escala Newcastle-Ottawa (ENO). Un puntaje ≥ 7 se consideró indicativo de buena calidad del estudio. Ambos autores debían estar de acuerdo con la inclusión o exclusión de un estudio al igual que con la calificación de calidad; las diferencias fueron resueltas mediante consenso. Esta revisión sistemática es acorde con la directriz PRISMA del 202014. El desenlace primario evaluado fue la efectividad (definido como la presencia de cierre exitoso), seguida de la seguridad (definido como ausencia de complicaciones mayores asociadas al procedimiento, incluyendo taponamiento cardiaco, embolización del dispositivo, sangrado mayor, muerte). Los desenlaces secundarios evaluados incluyeron tiempo de procedimiento, tiempo de fluoroscopia, costos asociados al procedimiento y fugas peridispositivo durante el seguimiento.
Resultados
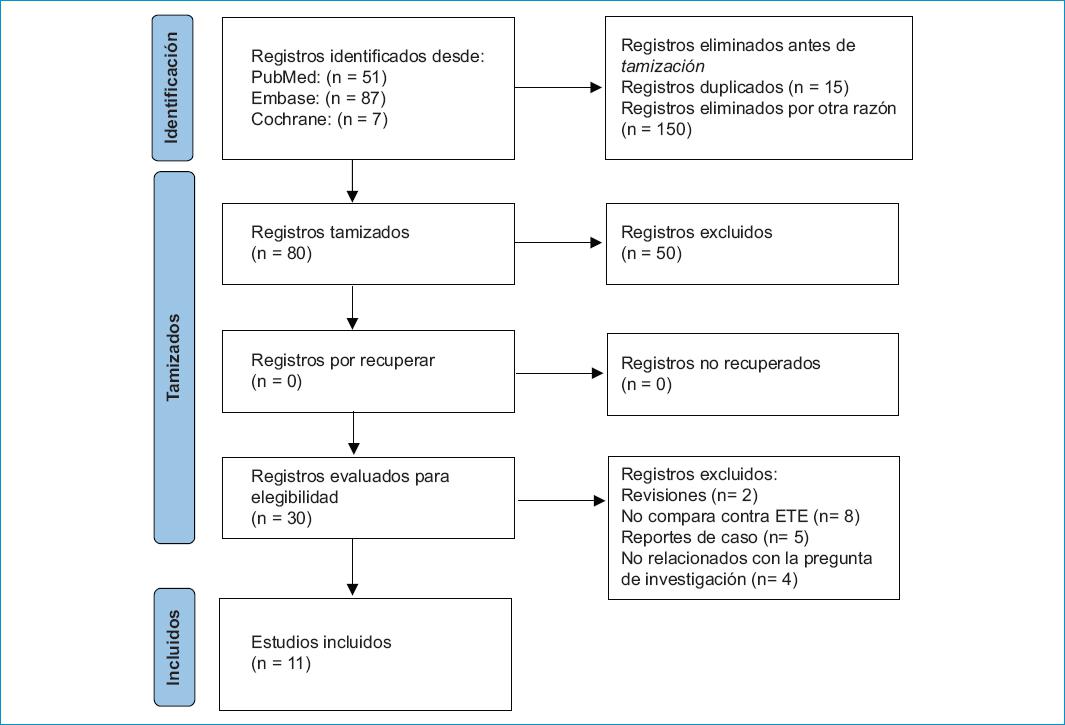
Se incluyeron 11 estudios observacionales con 3.034 pacientes (2.058 con cierre percutáneo de orejuela guiado por ecografía transesofágica y 976 guiados por ecografía intracardíaca)15-25 (Fig. 1, Tabla 1). La mayoría fueron retrospectivos, a excepción de los estudios de Frangieh et al19, Nielsen-Kudsk et al, Pommier et al.24 y Streb et al.25 De acuerdo con la ENO, la mayoría de los estudios fueron de buena calidad (puntaje > 7). Dos estudios fueron catalogados como de baja calidad: en el estudio de Heman et al.,17 los controles fueron seleccionados sin establecer un criterio claro, mientras que el estudio de Berti et al.15 incluyó pacientes de un registro italiano sin especificar claramente el criterio de selección (consecutivos vs. seleccionados de acuerdo con un criterio específico) (Tabla 2). En varios estudios, los casos utilizados como controles (es decir el grupo de ecografía transesofágica) fueron realizados antes que los casos con ecografía intracardíaca o no se estableció la temporalidad de su realización, introduciendo la posibilidad de que la mayor experiencia del operador en el procedimiento de cierre percutáneo de orejuela influyera en los resultados más que el tipo de imagen usado como guía. Esto se ve reflejado en el apartado de comparabilidad, en el que ningún estudio tuvo un puntaje de 2 (puntaje máximo). No hubo diferencias significativas en las características basales de los pacientes. En la mayoría de los casos, se utilizaron imágenes previas al procedimiento (ecografía transesofágica o tomografía computarizada) para descartar trombos y planear los procedimientos.
Tabla 1 Características de los estudios incluidos
| Autor | n | País | Dispositivo usado | Diseño | Edad | Sexo (femenino) | FEVI | Seguimiento |
|---|---|---|---|---|---|---|---|---|
| Frangieh et al., 2016 | 76 (ecografía intracardíaca: 32 ecografía transesofágica: 44) | Suiza | Watchman | OP | Ecografía intracardíaca: 74.3 ± 9.3 Ecografía transesofágica: 80.3 ± 7.7 (p = 0.007) | Ecografía intracardíaca: 6 (18.8%) Ecografía transesofágica: 19 (43.2%) (p = 0.03) | ecografía intracardíaca: 52.7 ± 14.7% ecografía transesofágica: 59.3 ± 6.1% (p = 0.1) | 2 días |
| Korsholm et al., 2017 | 216 (ecografía intracardíaca: 109, ecografía transesofágica: 107) | Dinamarca | ACP/Amulet | OR | Ecografía intracardíaca: 73 ± 7.8 Ecografía transesofágica: 73 ± 9.7 (p = 0.99) | Ecografía intracardíaca: 41 (38%) Ecografía transesofágica: 28 (26%) (p = 0.07) | ecografía intracardíaca: 56.7 ± 7.5% ecografía transesofágica: 58.3 ± 3.7% (p = 0.08) | 56.3 ± 13.4 días |
| Kim et al., 2018 | 144 (ecografía intracardíaca: 41, ecografía transesofágica: 103) | Korea | ACP/Amulet/Watchman | OR | Ecografía intracardíaca: 71.4 ± 9.3 Ecografía transesofágica: 72.3 ± 9.2 (p = 0.586) | Ecografía intracardíaca: 17 (41.5%) Ecografía transesofágica: 52 (50.5%) (p = 0.428) | NR | 23.2 ± 17.1 meses |
| Reis et al., 2018 | 82 (ecografía transesofágica: 56, ecografía intracardíaca: 26) | Portugal | Amulet/ACP/Watchman | OR | 74 ± 8 (All) | 33 (40.2%) (All) | NR | 23 ± 1 meses |
| Berti et al., 2018 | 604 (187 ecografía intracardíaca, 417 ecografía transesofágica) | Italia | ACP/Amulet | OR | Ecografía intracardíaca: 76 ± 8 Ecografía transesofágica: 74 ± 7 (p = 0.045) | Ecografía intracardíaca: n = 64 (34%) Ecografía transesofágica: n = 146 (35%) (p = 0.89) | ecografía intracardíaca: 53 ± 9% ecografía transesofágica: 52 ± 11% (p = 0.654) | 451 días, IQR 162-899. |
| Hemam et al., 2019 | 104 (51 ecografía transesofágica, 53 ecografía intracardíaca) | EE.UU. | Watchman | OR | Ecografía transesofágica: 77 Ecografía intracardíaca: 76 (p = NS) | Ecografía transesofágica: 20 Ecografía intracardíaca: 20 (p = NS) | NR | NR |
| Nielsen-Kudsk et al., 2019 | 1085 (ecografía intracardíaca: 130, ecografía transesofágica: 955) | Global | Amulet | OP | Ecografía transesofágica: 75 ± 8 Ecografía intracardíaca: 75 ± 9 (p = 0.62) | Ecografía intracardíaca: n = 52 (40%) Ecografía transesofágica: n = 335 (35%) (p = 0.28) | NR | 1 año [IQR 0.97-1.0] |
| Streb et al., 2019 | 23 (ecografía intracardíaca: 11, ecografía transesofágica: 12) | Polonia | Amulet | OP | Ecografía transesofágica: 73 Ecografía intracardíaca: 77 (p = 0.69) | Ecografía transesofágica: 66.6% Ecografía intracardíaca: 55.55% (p = NS) | ecografía transesofágica: 53.5% ecografía intracardíaca: 55% (p = 0.54) | 30 días |
| Alkhouli et al., 2020 | 286 (ecografía intracardíaca: 90, ecografía transesofágica: 196) | EE.UU. | Watchman | OR | Ecografía intracardíaca: 75.7 ± 8.0 Ecografía transesofágica: 75.2 ± 7.8 (p = 0.62) | Ecografía intracardíaca: 34 (37.8%) Ecografía transesofágica: 87 (44.4%) (p = 0.31) | ecografía transesofágica: 58% ecografía intracardíaca: 55% (p = 0.04) | 45 días |
| Gianni et al., 2021 | 190 (ecografía intracardíaca: 122, ecografía transesofágica: 68) | EE.UU. | Watchman | OR | Ecografía intracardíaca: 72 ± 8 Ecografía transesofágica: 75 ± 9 (p = 0.03) | Ecografía intracardíaca: 41 (34%) Ecografía transesofágica: 27 (40%) (p = NS) | NR | 8.7 ± 3 semanas |
| Pommier et al., 2021 | 224 (49 ecografía transesofágica, 175 ecografía intracardíaca) | Francia | ACP/Watchman | OP | Ecografía transesofágica: 75 Ecografía intracardíaca: 76 (p = 0.622) | Ecografía transesofágica: 14 Ecografía intracardíaca: 53 (p = NS) | ecografía transesofágica: 57% ecografía intracardíaca: 57% (p = 0.942) | NR |
OR: observacional retrospectivo; OP: observacional prospectivo; NR: no reportado; NS: no significativo.
Tabla 2 Calidad de los estudios de acuerdo con la escala Newcastle-Ottawa. Para esta revisión, un puntaje final ≥ 7 se consideró como de buena calidad
| Primer autor, año | Selección | Comparabilidad | Desenlace | Puntaje total | |||||
|---|---|---|---|---|---|---|---|---|---|
| Representatividad de casos (EIC) | Selección de controles (ecografía transesofágica) | Evaluación de exposición | Demostración que el desenlace no estaba al inicio | Evaluación de desenlace | Seguimiento suficientemente largo | Seguimiento adecuado | Puntaje máximo = 9 | ||
| Frangieh et al., 2016 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 8 |
| Korsholm et al., 2017 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 8 |
| Kim et al., 2018 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 8 |
| Reis et al., 2018 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 8 |
| Berti et al., 2018 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 6 |
| Hemam et al., 2019 | 1 | 0 | 1 | 1 | 0 | 1 | 1 | 1 | 6 |
| Nielsen-Kudsk et al., 2019 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 8 |
| Streb et al., 2019 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 8 |
| Alkhouli et al., 2020 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 8 |
| Gianni et al., 2021 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 8 |
| Pommier et al., 2021 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 8 |
Efectividad y seguridad de la ecografía intracardíaca en el cierre percutáneo de orejuela
Once estudios evaluaron el desenlace primario de efectividad y de seguridad, sin diferencia alguna en el desenlace de efectividad (Tabla 3). En el desenlace de seguridad, solo el estudio de Reis et al.22 encontró una diferencia significativa en la tasa de eventos adversos mayores con menor probabilidad de complicaciones en el grupo de cierre percutáneo de orejuela guiado por ecografía intracardíaca (11.5 vs. 16.1% para el cierre guiado por ecografía intracardíaca vs. ecografía transesofágica, respectivamente; p = 0.001). Es preciso resaltar que se trata de un estudio pequeño (n = 82) y los casos de cierre percutáneo de orejuela guiado por ecografía intracardíaca fueron hechos cuando ya se habían realizado los casos con ecografía transesofágica, por lo cual la experiencia de los operadores podría explicar esta diferencia.
Tabla 3 Desenlace primario y desenlaces secundarios en los distintos estudios evaluados
| Autor | Efectividad | Seguridad | Tiempo en sala | Tiempo de fluoroscopia | Fugas | Defectos SIA |
|---|---|---|---|---|---|---|
| Frangieh et al., 2016 | Ecografía transesofágica: 100% Ecografía intracardíaca: 100% (p = NS) | Ecografía transesofágica: 2.3% Ecografía intracardíaca: 0% (p = NS) | NR | Ecografía transesofágica: 7.9 Ecografía intracardíaca: 9.8 (p = 0.51) | NR | NR |
| Korsholm et al., 2017 | Ecografía transesofágica: 99.1% Ecografía intracardíaca: 99.1% (p = 0.99) | Ecografía transesofágica: 4.7% Ecografía intracardíaca: 1.8% (p = 0.28) | Ecografía transesofágica: 116 Ecografía intracardíaca: 87 (p < 0.001) | Ecografía transesofágica: 14 Ecografía intracardíaca: 15 (p = 0.63) | Ecografía transesofágica: 20% Ecografía intracardíaca: 23% (p = 0.34) | Ecografía transesofágica: 26% Ecografía intracardíaca: 35% (p = 0.21) |
| Kim et al., 2018 | Ecografía transesofágica: 97.1% Ecografía intracardíaca: 100% (p = 1.0) | Ecografía transesofágica: 6.8% Ecografía intracardíaca: 2.4% (p = 0.734) | NR | Ecografía transesofágica: 7.6 ± 3.7 Ecografía intracardíaca: 8.3 ± 10.8 (p < 0.001) | NR | NR |
| Reis et al., 2018 | Ecografía transesofágica: 94.6% Ecografía intracardíaca: 100% (p = 0.08) | Ecografía transesofágica: 16.1% Ecografía intracardíaca: 11.5% (p = 0.001) | NR | Ecografía transesofágica: 35.1 ± 16.5 Ecografía intracardíaca: 30.4 ± 17 (p < 0.001) | Ecografía transesofágica: 8.9% Ecografía intracardíaca: 7.6% (p = 0.06) | Ecografía transesofágica: 35.4% Ecografía intracardíaca: 29.3% (p = 0.09) |
| Berti et al., 2018 | Ecografía transesofágica: 93.5% Ecografía intracardíaca: 95.8% (p = 0.587) | Ecografía transesofágica: 6.5% Ecografía intracardíaca: 4.2% (p = 0.327) | Ecografía transesofágica: 108 ± 33 Ecografía intracardíaca: 92 ± 34 (p < 0.001) | Ecografía transesofágica: 20 ± 11 Ecografía intracardíaca: 25 ± 12 (p < 0.001) | NR | NR |
| Hemam et al., 2019 | Ecografía transesofágica: 100% Ecografía intracardíaca: 100% (p = NS) | Ecografía transesofágica: 0% Ecografía intracardíaca: 0% | Ecografía transesofágica: 116 ± 54 Ecografía intracardíaca: 95 ± 28 (p = 0.03) | Ecografía transesofágica: 7.3 ± 4.7 Ecografía intracardíaca: 4.8 ± 2.7 (p = 0.004) | Ecografía transesofágica: 30% Ecografía intracardíaca: 28% (p = NS) | NR |
| Nielsen-Kudsk et al., 2019 | Ecografía transesofágica: 99% Ecografía intracardíaca: 99% (p = 1.0) | Ecografía transesofágica: 10.4% Ecografía intracardíaca: 10.7% (p = 0.93) | NR | Ecografía transesofágica: 24 ± 19 Ecografía intracardíaca: 19 ± 10 (p = 0.64) | NR | NR |
| Streb et al., 2019 | Ecografía transesofágica: 100% Ecografía intracardíaca: 100% (p = NS) | Ecografía transesofágica: 0% Ecografía intracardíaca: 0% (p = NS) | NR | Ecografía transesofágica: 7.69 ± 3.21 Ecografía intracardíaca: 9.91 ± 4.01 (p = 0.16) | Ecografía transesofágica: 16.7% Ecografía intracardíaca: 9.09% (p = 0.59) | NR |
| Alkhouli et al., 2020 | Ecografía transesofágica: 97.4% Ecografía intracardíaca: 97.8% (p = 0.88) | Ecografía transesofágica: 4.1% Ecografía intracardíaca: 3.3% (p = 0.76) | Ecografía transesofágica: 113.6 ± 18.1 Ecografía intracardíaca: 78.7 ± 19.5 (p < 0.001) | Ecografía transesofágica: 36.6 ± 15.6 Ecografía intracardíaca: 35.2 ± 11.3 (p = 0.67) | Ecografía transesofágica: 21.6% Ecografía intracardíaca: 14.6% (p = 0.28) | Ecografía transesofágica: 34.8% Ecografía intracardíaca: 46.5% (p = 0.12) |
| Gianni et al., 2021 | Ecografía transesofágica: 100% Ecografía intracardíaca: 100% (p = NS) | Ecografía transesofágica: 0% Ecografía intracardíaca: 3% (p = NS) | NR | Ecografía transesofágica: 10 Ecografía intracardíaca: 11 (p = NS) | Ecografía transesofágica: 31% Ecografía intracardíaca: 27% (p = NS) | NR |
| Pommier et al., 2021 | Ecografía transesofágica: 100% Ecografía intracardíaca: 97% (p = 0.895) | Ecografía transesofágica: 10% Ecografía intracardíaca: 5% (p = 0.689) | Ecografía transesofágica: 110 ± 27 Ecografía intracardíaca: 66 ± 21 (p = 0.004) | Ecografía transesofágica: 24 ± 12 Ecografía intracardíaca: 21 ± 11 (p = 0.803) | Ecografía transesofágica: 20% Ecografía intracardíaca: 23% (p = 0.349) | NR |
NR: no reportado; NS: no significativo.
Tiempo en sala y tiempo de fluoroscopia
En cinco estudios que evaluaron el impacto de la ecografía intracardíaca en el tiempo de ocupación de sala, se encontró una reducción significativa en este apartado. Tal hallazgo se explica por el uso de anestesia local y sedación ligera en todos los casos, en comparación con el uso de anestesia general en los casos de ecografía transesofágica. Adicionalmente, los 11 estudios evaluaron el impacto en tiempo de fluoroscopia. Aunque en la mayoría no se encontró diferencia significativa en el tiempo de fluoroscopia, en los estudios de Hemam et al.17, Reis et al.22 y Kim et al.23. se observaron reducciones significativas en el grupo de cierre percutáneo de orejuela guiado por ecografía intracardíaca. Solo en el estudio de Berti et al, el uso de ecografía intracardíaca se asoció a mayor tiempo de fluoroscopia.
Presencia de fugas peridispositivo y defectos septales residuales
Siete estudios evaluaron las fugas peridispositivo durante el seguimiento, sin que existiese diferencia significativa entre los procedimientos guiados por ecografía intracardíaca vs. ecografía transesofágica. Tres estudios evaluaron, además, la presencia de defectos residuales, sin hallar diferencia alguna entre ambas técnicas.
Discusión
La ecografía intracardíaca ha ganado terreno como técnica imagenológica para la realización de procedimientos estructurales, incluidos cierres de defectos interauriculares y reemplazos valvulares aórticos transcatéter26,27. Su mayor uso en la actualidad se registra en los laboratorios de electrofisiología, en los que se ha convertido en una herramienta fundamental como guía para la ablación de varios tipos de arritmias, permitiendo, incluso, la realización de procedimientos sin necesidad de fluoroscopia28. En la ablación de FA, procedimiento que requiere una punción transeptal, el uso de ecografía intracardíaca permite reducir (e incluso eliminar) la fluoroscopia y la tasa de complicaciones29. No obstante, el empleo de ecografía intracardíaca durante los procedimientos de cierre percutáneo de orejuela es infrecuente, y solo es usado por grupos altamente especializados. Los motivos por los cuales no se ha popularizado su práctica están relacionados con la disponibilidad de recursos, la percepción de mayor riesgo de procedimiento y mayor costo en comparación con el uso de cierre guiado por ecografía transesofágica, el temor a no lograr un cierre adecuado, la falta de familiaridad y el entrenamiento en la técnica.
En esta revisión sistemática, el desenlace primario (efectividad y seguridad del procedimiento) fue similar en los procedimientos de cierre percutáneo de orejuela con ecografía intracardíaca vs. los procedimientos con ecografía transesofágica. Dichos resultados están en línea con los de metaanálisis previamente publicados30-33. De manera importante, varios de los estudios evaluados incluyeron pacientes llevados a procedimientos de cierre percutáneo de orejuela con dispositivos antiguos (por ejemplo, Amplatzer cardiac plug, St Jude Medical; y Watchman 2.5, Boston Scientific) que eran técnicamente más difíciles de liberar y podían tener mayor riesgo de perforación. Con la nueva generación de dispositivos (Amulet y Watchman FLX), la tasa de complicaciones y de éxito del procedimiento han mejorado de manera significativa34-36, hecho que podría facilitar la adopción del cierre con ecografía intracardíaca. De manera interesante, aunque se hace una manipulación extensa del septo interauricular (en muchas ocasiones, introduciendo por la misma punción tanto la sonda de ecografía intracardíaca como el sistema de liberación del dispositivo), durante el seguimiento (en general a mediano plazo) no hay mayor prevalencia de defectos residuales del tabique interauricular. Los riesgos potenciales relacionados con la punción venosa o manipulación de la sonda de ecocardiografía intracardíaca son similares a los de otros catéteres y resultan infrecuentes en la práctica cotidiana.
Además de demostrar su seguridad y efectividad, el cierre percutáneo de orejuela guiado por ecografía intracardíaca brinda beneficios adicionales, incluyendo la reducción del tiempo en sala y la disminución de exposición a radiación ionizante a un mayor número de personas en sala. El tiempo en sala (el cual comprende desde el momento que el paciente entra a sala hasta que la abandona) es un medidor importante en cuanto a la optimización del tiempo de uso de laboratorio y fue significativamente menor en todos los estudios que reportaron esta medida. En lo que atañe al uso de fluoroscopia, en los procedimientos con ecografía transesofágica, es frecuente la presencia en sala de un anestesiólogo, un ecocardiografista y uno o dos ayudantes adicionales al personal de sala. Es particularmente preocupante la exposición a fluoroscopia que recibe el ecocardiografista, quien debe ubicarse a poca distancia del tubo de fluoroscopia y con frecuencia inserta sus manos en el campo de radiación. Bien se sabe que la exposición a radiación ionizante aumenta de manera significativa el riesgo de neoplasias y que dicha exposición está directamente relacionada con la distancia a la que la persona se encuentra de la fuente37. Aunque en este análisis no se encontró una disminución en la exposición a fluoroscopia, el desarrollo de nuevas técnicas ha permitido hacer con seguridad la punción transeptal sin fluoroscopia utilizando ecografía intracardíaca38. De esta manera, es posible que en la actualidad la dosis de radiación usando ecografía intracardíaca sea mucho menor en centros de alta experiencia, con algunos reportes de caso de cierre percutáneo de orejuela sin fluoroscopia que usaron ecografía intracardíaca39.
Por último, existe preocupación acerca de los sobrecostos percibidos con el uso de ecografía intracardíaca en comparación con la ecografía transesofágica, los cuales se atribuyen al costo elevado de la sonda de ecografía intracardíaca en comparación con el costo de una ecografía transesofágica como guía de procedimiento. No obstante, tales análisis han omitido otros factores que aumentan los costos, como la necesidad de personal adicional (incluyendo auxiliares y anestesiólogos), mayor tiempo en sala (lo cual reduce la cantidad de procedimientos realizables y genera un gasto adicional de recursos, que muchas veces es obviado de manera errónea) y la necesidad de mayor tiempo de recuperación; al reducir este último, es posible establecer una estrategia de altas tempranas, intervención que puede llegar a disminuir aún más los costos de atención sin aumentar los riesgos de complicaciones para los pacientes40. En los estudios evaluados, solo los de Hemam et al. y Alkhouli et al. hicieron una evaluación de costos: el primero, encontró una reducción significativa de los costos de procedimiento y hospitalización con el uso de ecografía intracardíaca ($132.202 vs. $141.468 USD, p < 0.001), mientras que el segundo no encontró diferencia significativa ($79.020 vs. $77.147 USD, p = 0.15) en comparación con los cierres guiados por ecografía transesofágica16,17. En nuestras instituciones, después de un análisis de todos los costos (incluyendo el valor del tiempo de sala) se ha llegado a la conclusión de que el cierre percutáneo de orejuela guiado por ecografía intracardíaca es al menos igual en costos que el cierre percutáneo de orejuela guiado por ecografía transesofágica.
Los resultados de esta revisión sistemática pueden aportar a la práctica actual médica. Aunque se considera por lo general segura, se ha reportado que hasta el 6% de los pacientes llevados a ecografía transesofágica como guía para la realización de procedimientos estructurales cardíacos presenta algún tipo de complicación asociado al uso de la sonda de ecografía transesofágica, con 1.5% de los pacientes presentando una complicación mayor (incluyendo sangrados gastrointestinales y lesiones que requieren intervenciones adicionales)41. Si se realiza de manera rutinaria una endoscopia digestiva superior a todos los pacientes que son llevados a ecografía transesofágica como guía de procedimientos cardíacos estructurales, hasta el 86% tendrá lesiones, de las cuales el 40% se consideran complejas42. Esta mayor incidencia (en comparación con la reportada en ecografía transesofágica electivos) probablemente se deba a que los pacientes sometidos a dichos procedimientos son de mayor edad y tienen mayor número de comorbilidades, con lo cual aumentan los riesgos de dichos procedimientos; adicionalmente, durante éstos, el tiempo de manipulación de la sonda en el esófago es más prolongada, y por tanto se eleva el riesgo de complicaciones. Al comparar procedimientos guiados por ecografía intracardíaca vs. ecografía transesofágica, se demuestra la seguridad de la primera dada que no se observa un aumento significativo en la tasa de complicaciones vasculares ni en el riesgo de perforación cardíaca43. Es decir, ni la necesidad de un acceso vascular adicional aumenta el riesgo de complicaciones vasculares, ni la manipulación de la sonda aumenta el riesgo de taponamiento. Por las razones expuestas, el cierre con ecografía intracardíaca está ganando terreno entre grupos con alta experiencia en cierre percutáneo de orejuela. De acuerdo con la alta disponibilidad de esta herramienta en los laboratorios de electrofisiología y la amplia experiencia para guiar procedimientos con ecografía intracardíaca, se espera que, en el futuro próximo, el número de procedimientos realizados bajo esta modalidad imagenológica sea mayor.
Limitaciones
Todos los estudios incluidos son de tipo observacional, lo cual introduce sesgos inherentes a este tipo de estudios. Aunque el uso de la escala Newcastle-Ottawa facilita al lector el análisis crítico de dichos estudios, se debe tener en cuenta que esta escala también tiene un componente subjetivo que influye en los resultados finales44. De manera importante, buena parte de los procedimientos de cierre percutáneo de orejuela con ecografía intracardíaca fueron realizados por operadores con amplia experiencia en el uso de ecografía intracardíaca y en procedimientos de cierre percutáneo de orejuela, de modo que los resultados no son extrapolables a todos los operadores.
Conclusión
El cierre percutáneo de orejuela guiado por ecografía intracardíaca es una estrategia segura y efectiva, que se asocia con menores tiempos de procedimiento y, posiblemente, menores tiempos de fluoroscopia confrontado con el método tradicional guiado por ecografía transesofágica. Teniendo en cuenta que el cierre percutáneo de orejuela guiado por ecografía intracardíaca no requiere anestesia y que se puede realizar aún en pacientes con contraindicación para ecografía transesofágica, un mayor número de pacientes puede ser llevado a este tipo de terapia, sin que se aumenten los costos al incluir todos los gastos en los que se incurre al utilizar ecografía transesofágica. Con base en estos argumentos, la ecografía intracardíaca está imponiéndose en grupos con alta experiencia en el cierre percutáneo de orejuela como la primera opción para guiar este tipo de procedimientos.