Introducción
La punción transeptal fue introducida originalmente en 1959 para la medición de las presiones auriculares izquierdas1,2 y rápidamente evolucionó como ruta de acceso para el manejo de la valvulopatía mitral. No obstante, el desarrollo de las técnicas para la medición indirecta de la presión auricular izquierda a través de catéteres de balón, sumado a la disminución en la prevalencia de valvulopatía mitral reumática, llevaron a la rápida desaparición de la técnica de los laboratorios de cardiología intervencionista. Hacia finales de los ochenta, la técnica era poco utilizada y los programas de entrenamiento en cardiología intervencionista ya no tenían suficiente volumen para brindar un adecuado entrenamiento a sus fellows, aumentando de manera significativa la tasa de complicaciones3. Con el advenimiento de la ablación de fibrilación auricular a finales de los noventa4, la técnica tuvo un resurgir: en tan solo cinco años, el número de punciones transeptales aumentó sesenta veces5, y en la actualidad es un procedimiento común en las salas de electrofisiología. Esta experiencia ha sido aprovechada en las intervenciones de cierre percutáneo de orejuela6 y, de manera más reciente, en las intervenciones percutáneas de la válvula mitral7,8. No obstante, la punción transeptal continúa siendo un procedimiento de alto riesgo que debe ser realizado por personal altamente entrenado. En el análisis de causas de derrame pericárdico durante los procedimientos de cierre de orejuela, hasta un 9% de los derrames ocurrieron al momento de la punción9,10 con lo cual se demuestra la importancia de la técnica adecuada durante este procedimiento.
En este artículo se repasa, paso a paso, la técnica para realizar una punción transeptal de manera segura a través de distintas ayudas imagenológicas, así como el manejo del abordaje difícil y de complicaciones.
Entrenamiento y experiencia del operador
Es importante que los programas de formación incluyan tanto el aspecto teórico como práctico de la punción transeptal. La revisión de la anatomía, los posibles riesgos y las complicaciones, así como el uso de simuladores en compañía de un operador experimentado pueden ayudar a mejorar la capacidad del fellow en formación para efectuar estos procedimientos. A medida que la experiencia del operador aumenta (valorada por número de punciones transeptales realizadas al año), disminuye de manera significativa el riesgo de complicaciones. Se ha establecido que un operador debe hacer al menos 50 punciones transeptales para tener un nivel «aceptable»11, mientras que realizar más de 45 punciones al año se considera un volumen alto, lo cual, a su vez, se traduce en una reducción significativa en los tiempos para obtener acceso transeptal y en la tasa de complicaciones12. Por ende, se sugiere que los procedimientos que involucren punción transeptal sean realizados por operadores de alto volumen.
Antes de la punción transeptal: la importancia de la anticoagulación
Aunque en los primeros años se consideró el uso de anticoagulantes como una contraindicación absoluta para la punción transeptal, en la actualidad se recomienda que dicho procedimiento se lleve a cabo sin interrumpir la anticoagulación13. Esto también aplica para los pacientes tratados con anticoagulantes orales directos (ACOD), en quienes, aunque la evidencia permite establecer que el uso ininterrumpido de estos podría ser igual o incluso más seguro que el uso ininterrumpido de warfarina14, la mayoría de electrofisiólogos (63%) omiten al menos una dosis antes del procedimiento13. Si bien existe temor de que el uso de anticoagulantes previo al procedimiento podría aumentar la mortalidad, el tiempo y el volumen de sangrado en caso de presentarse un taponamiento cardíaco, la evidencia disponible apunta en sentido contrario15.
Adicional al anticoagulante previo, se recomienda administrar heparina antes de la punción transeptal, ya que tanto las guías como las camisas transeptales son altamente trombogénicas. En nuestra práctica, se infunden 10.000 unidades de heparina no fraccionada antes de realizar las punciones femorales (con el fin de evitar la formación de trombos en las guías e introductores femorales), y posterior a la punción transeptal otras 3.000 unidades con el fin de mantener un ACT > 300 segundos. Administrar heparina solo después de haber realizado la punción transeptal no disminuye los riesgos de sangrado, pero sí aumenta de manera significativa el riesgo de formación de trombos en la aurícula izquierda y, por tanto, debe evitarse.
Herramientas para realizar una punción transeptal
Existen diferentes introductores transeptales que pueden ser útiles de acuerdo con el procedimiento a realizar. Para ablaciones, se prefiere el uso de introductores deflectables (Agilis, Abbot; Vizigo, Biosense Webster) ya que facilitan la manipulación de los catéteres en la aurícula izquierda. Para procedimientos que involucran intercambio de introductores (por ejemplo, en el caso de cierre percutáneo de orejuela) se prefiere el uso de un introductor SL0 (Abbot), ya que por su curvatura (50°) permite canular fácilmente la vena pulmonar superior izquierda y dejar una guía de alto soporte en ese punto. Al utilizar distintos introductores, es importante tener en cuenta que su longitud varía y que se debe seleccionar una aguja de punción transeptal de tamaño adecuado (es decir, no usar una aguja larga en un introductor corto, ya que con facilidad se pueden perforar de manera inadvertida distintas estructuras vasculares).
Existen herramientas adicionales que por el momento no se encuentran disponibles en Colombia, como la guía SafeSept (Pressure products) y el Versacross (Bayliss). Ambas disminuyen el riesgo de complicaciones y el tiempo para obtener acceso transeptal12, por lo cual, de ser posible, podrían ser consideradas.
Punción transeptal guiada por reparos fluoroscópicos
El uso de reparos fluoroscópicos para la realización de la punción transeptal es la forma más básica para guiar el procedimiento. Aunque la fosa oval no es directamente visible en la fluoroscopia, el uso de otros reparos anatómicos y la colocación adecuada de catéteres de referencia permite ubicarla de manera sencilla. Los reparos anatómicos que ayudan en la ubicación de la fosa oval son:
– El seno coronario, el cual se puede ubicar insertando un catéter de electrofisiología en él.
– La cúspide no coronaria de la aorta, la cual se puede ubicar con un catéter vía arterial retroaórtica.
– El bronquio fuente izquierdo, que marca la posición del techo de la aurícula izquierda.
– El sistema de conducción, que se ubica fácilmente con un catéter de electrofisiología y se relaciona directamente con la posición de la aorta (haciendo innecesario el uso de un catéter en la aorta).
– Las vértebras torácicas.
Técnica para la realización de la punción transeptal guiada por fluoroscopia (Fig. 1)
– Paso 1: ubicar la orientación del septo interauricular introduciendo un catéter de electrofisiología hacia el ventrículo derecho. El equipo de fluoroscopia se ubica en una angulación izquierda que permita ver el catéter ubicado en el His de frente; dicha angulación pone el rayo de fluoroscopia en paralelo con el septo interauricular. La mayor parte del procedimiento se realizará en oblicua izquierda.
– Paso 2: avanzar la camisa transeptal hasta la vena cava superior, utilizando una guía. La guía posteriormente se retira y se avanza la aguja de punción transeptal. Al insertar la aguja, es importante hacerlo con la guía interna, ya que esto evita que se arrastren fragmentos de plástico que pueden ser embolizados. Aunque es una práctica común, sugerimos no modificar manualmente la curvatura de la guía ya que una curvatura excesiva puede generar dificultad en el avance (e incluso perforación) de la aguja dentro del introductor. La punta de la aguja se debe ubicar a 1 cm de la punta del dilatador transeptal, alineando la curvatura de la camisa y la aguja (Fig. 2) y orientándolas hacia la posición de las 4 o 5 en las manecillas del reloj.
– Paso 3: en oblicua izquierda, retirar lentamente la camisa observando las caídas (se ven como saltos hacia el lado derecho de la pantalla); la primera caída corresponde a la entrada de la aurícula derecha (es muy sutil y no siempre visible) y es seguida por una caída mayor que corresponde al ingreso a la fosa oval. Aunque este pareciera ser el sitio adecuado, en este punto se debe retirar ligeramente la camisa, observando una tercera caída. Esta corresponde a la parte baja de la fosa oval.
- Paso 4: evaluar la posición de la punta del dilatador en oblicua derecha. La angulación que se necesita para hacerlo está dada por una ubicación perpendicular a la oblicua izquierda que se obtuvo en la evaluación del septo: si el septo se encontró a 40° de la oblicua izquierda, la perpendicular es 50° de derecha. Esto permite ver el septo interauricular perpendicularmente y apreciar su extensión. En esta proyección se evalúa que la punta del dilatador no se encuentre apuntando hacia la aorta, ni hacia las vértebras.
– Paso 5: volver a la oblicua izquierda y retirar 2 cm la aguja. Esto deja la punta del dilatador sin soporte. Se empuja suavemente la camisa con el dilatador observando el comportamiento de la punta y la curvatura: cuando se encuentra en la fosa oval, la punta tiende a permanecer fija (en el eje vertical) y la curvatura de la camisa tiende a levantarse, aumentando la curva. Si la punta sube y baja libremente, esta probablemente esté en una pared lisa (por ejemplo, hacia el torus aórtico o hacia la pared posterior) y se debe reposicionar. La inyección de contraste en este punto ayuda a identificar el “tenting” del septo; incluso en algunos casos queda un tatuaje (Fig. 3). En caso de tener un catéter en el seno coronario, la posición de las 3 p.m. en el seno corresponderá aproximadamente a la ubicación de la fosa oval (siempre y cuando el catéter haya sido avanzado hasta el borde cardíaco).
– Paso 6: avanzar la aguja hasta que se encuentre por fuera del dilatador en oblicua izquierda. La punción del septo interauricular se sentirá como una pérdida súbita de la resistencia; si se hizo demasiado tenting, el dilatador puede “saltar” hacia el otro lado de manera incontrolada, por lo cual no es aconsejable hacer mucho tenting de entrada. Antes de avanzar el dilatador, se debe inyectar contraste para confirmar la ubicación de la aguja en la aurícula izquierda, determinar la posición de la pared de la aurícula y establecer cuanto se puede avanzar tanto la camisa como el dilatador.
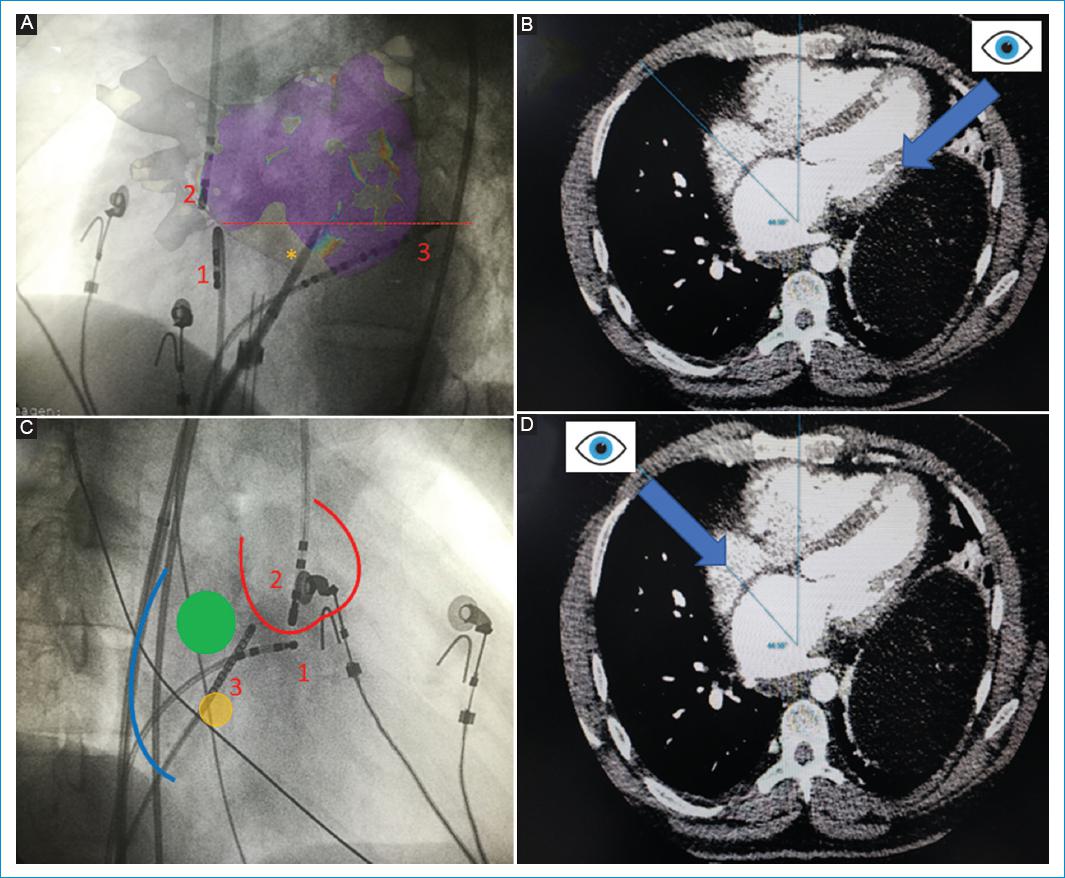
Figura 1 Ubicación de las referencias anatómicas fluoroscópicas para la realización de la punción transeptal. A: imagen en oblicua anterior izquierda que muestra las referencias fluoroscópicas y su relación con la aurícula izquierda (transparencia superpuesta). Se observa un catéter ubicado en el ventrículo derecho (1), un catéter en la aorta (2), un catéter en el seno coronario (3) y el introductor transeptal. Se puede observar la relación entre la punta del catéter del seno coronario y el sitio de punción (línea roja punteada). B: al ubicar el catéter del ventrículo derecho orientado directamente hacia el operador, se logra estar en paralelo al septo interauricular. C: imagen en oblicua anterior derecha que muestra las referencias fluoroscópicas; observe la estrecha relación entre el catéter ubicado a nivel del haz de His (1) y el catéter de la aorta (2), por lo cual no es necesaria la ubicación de un catéter en la aorta (silueta roja) si se logra ubicar uno en el His. La fosa oval (círculo verde) está ubicada por encima del ostium del seno coronario (círculo amarillo), que está marcado por un catéter (3). El borde de la aurícula (borde azul) está en relación con las vértebras. Al realizar la punción, el introductor no debe estar apuntando hacia la aorta ni hacia las vértebras. D: ubicando una angulación a 90° de la oblicua izquierda, se estará perpendicular al septum interauricular y se podrá determinar su extensión claramente.
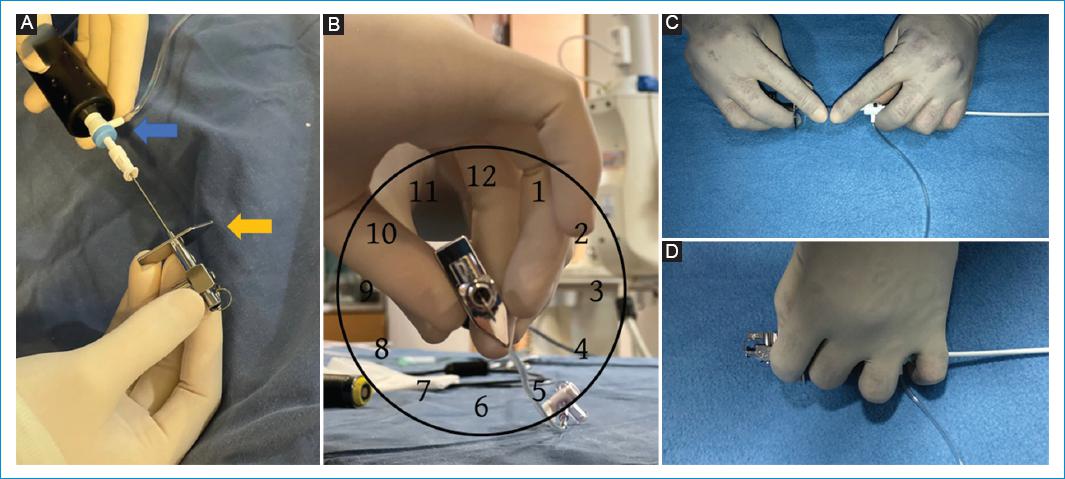
Figura 2 A: es importante alinear el introductor y la aguja antes de comenzar a bajar desde la vena cava superior hacia la fosa oval. Para ello, se debe alinear el puerto de irrigación de las camisas (flecha azul) con el marcador de punta de la aguja (flecha amarilla). B: una vez están alineadas la camisa y la aguja, se ubican apuntando hacia las 4 o 5, en el sentido de las manecillas del reloj. C: posición de las manos para asegurar la alineación de la aguja con el introductor: usando ambas manos, se alinean el puerto de irrigación de la camisa transeptal con el marcador de la aguja. Poner los dedos índices tocándose impide que la aguja protruya de manera accidental. D: cuando un solo operador realiza la punción transeptal manipulando la sonda de EIC, la mano derecha se encarga de la sonda mientras la mano izquierda manipula en simultáneo la camisa (ubicando el puerto entre el 4.° y 5.° dedos) y la aguja (ubicando el marcador entre el 1.° y 2.° dedos).
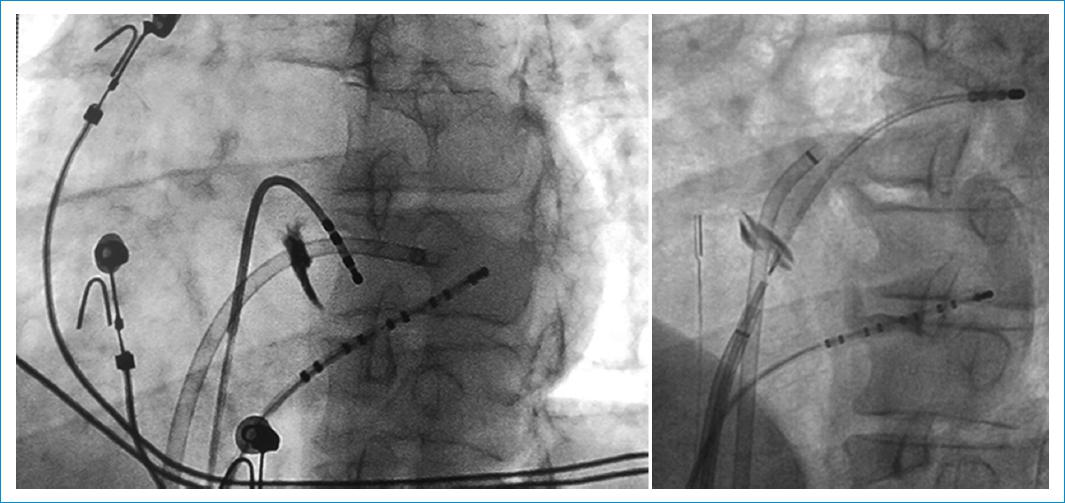
Figura 3 Ejemplos de tatuajes realizados en la fosa oval, marcando un sitio adecuado de punción. Observe que, en la imagen de la izquierda, el catéter del ventrículo derecho no se encuentra dirigido directamente al observador, por lo que se puede definir que no se está en paralelo al septo interauricular. Una mayor angulación izquierda sería necesaria en este caso para estar en paralelo.
No obstante, en lo posible la punción guiada solamente por reparos fluoroscópicos debería evitarse, ya que aumenta de manera significativa el riesgo de complicaciones en comparación con las punciones transeptales realizadas bajo guía ecocardiográfica12.
Punción transeptal guiada por ecocardiografía
Además de aumentar la seguridad del procedimiento, el uso de ecocardiografía (ya sea transesofágica o intracardíaca) para guiar la punción transeptal tiene varios beneficios:
– Permite la identificación de variantes anatómicas del septum interauricular que modifican su configuración fluoroscópica, incluyendo rotación marcada del corazón16,17.
– Permite la detección inmediata de trombos previamente formados o aquellos que se puedan formar durante el procedimiento18.
– Facilita la manipulación y la colocación adecuada del introductor transeptal en la ubicación deseada dentro de la fosa oval.
– Detecta de manera temprana el taponamiento cardíaco, ya que permite monitorizar en tiempo real el espacio pericárdico.
Ecocardiografía transesofágica vs. intracardíaca: ¿cuál es mejor?
En general, la selección se basa en la experiencia del operador con una u otra modalidad más que en la disponibilidad (ambas están ampliamente disponibles en el país). La mayoría de los electrofisiólogos prefiere el uso de ecocardiografía intracardíaca (EIC), mientras que los cardiólogos intervencionistas prefieren el uso de ecocardiografía transesofágica (ETE). Para procedimientos de cierre de orejuela, la mayoría (tanto electrofisiólogos como intervencionistas) usan ETE, y son pocos los grupos que usan EIC exclusivamente. Aunque hay reportes de caso de reemplazo transcatéter de válvula aórtica y de cierre de defectos del tabique interauricular usando EIC19,20, su uso es infrecuente en el mundo.
Para la realización de punción transeptal consideramos que la EIC es la mejor opción. En comparación con la ETE, la EIC ofrece imágenes de una calidad igual o incluso superior21; no requiere anestesia general (lo que, a su vez, disminuye costos y riesgos para el paciente), y disminuye el número de personas requeridas en sala. Este último punto es particularmente importante, ya que al ser manejada por el mismo operador se evita que tres o más personas (anestesiólogo, auxiliar de anestesiología y ecocardiografista) ingresen a la sala. Un menor número de personas en sala se asocia a menor riesgo de infección22 y a menor cantidad de personas expuestas a radiación ionizante (la cual es particularmente alta en el caso del ecocardiografista, por la posición que debe tomar respecto a la fuente de radiación y la necesidad que tiene de insertar sus manos en el campo de radiación).
Punción transeptal guiada por ecografía intracardiaca y sin fluoroscopia (Fig. 4)
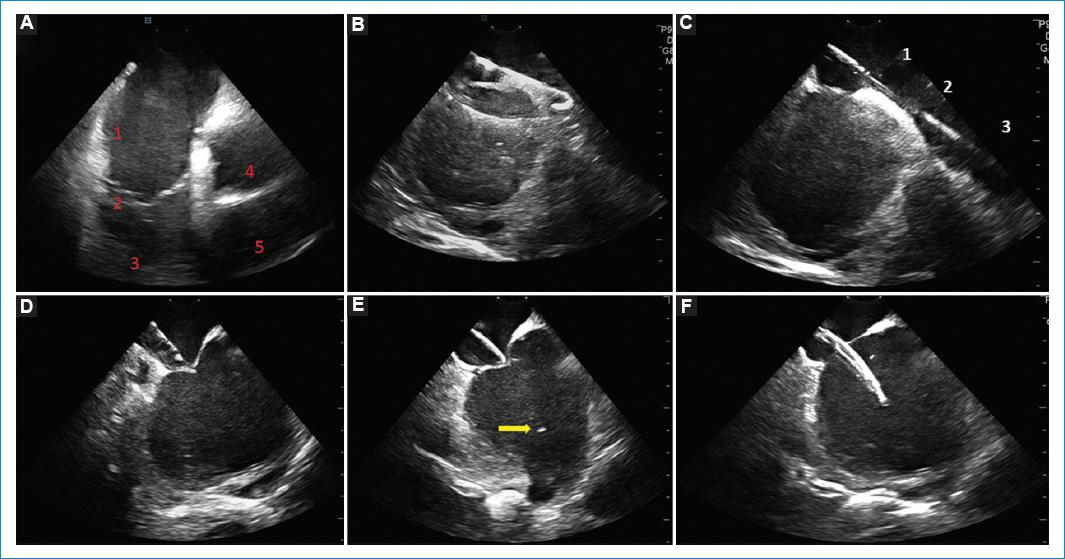
Figura 4 Secuencia de imágenes durante la punción transeptal guiada por EIC. A: home view derecho. Se observa la aurícula derecha (1), la válvula tricúspide (2), el tracto de entrada del ventrículo derecho (3), la aorta (4) y el tracto de salida del ventrículo derecho (5). B: imagen de la VCS con la guía en su interior. C: avance de la camisa (3), dilatador (2) sobre la guía (1) hacia la VCS. D: imagen del tenting sobre el septum interauricular. E: paso de la aguja hacia la aurícula izquierda, la cual es visible como un punto blanco brillante. F: paso de la camisa a través del septo.
Ya para el año 2011, el 50% de los electrofisiólogos utilizaban de manera rutinaria la EIC en los procedimientos de ablación de fibrilación auricular23, lo cual ha permitido acumular a lo largo de los años una amplia experiencia en el manejo de este equipo. De manera importante, todos los pasos utilizados para guiar la punción transeptal con EIC pueden ser realizados sin necesidad de usar fluoroscopia24, lo que ha llevado a que en laboratorios con alta experiencia la punción transeptal se haga “fluoroless”. No obstante, los pasos descritos a continuación pueden ser unidos a la referencia fluoroscópica para facilitar la punción transeptal hasta que se tenga suficiente confianza con la secuencia guiada exclusivamente por EIC:
– Paso 1: se ubica la sonda de EIC en la mitad de la aurícula derecha (AD), orientada hacia la válvula tricúspide. Esto se denomina «home view derecho» (para diferenciarlo del «home view» izquierdo, usado en los procedimientos de cierre de orejuela con EIC); a partir de esta posición, se da giro en el sentido de las manecillas del reloj a la sonda hasta que las venas pulmonares estén en el campo visual.
– Paso 2: usando el manubrio de la sonda, se da inclinación posterior hasta ver la vena cava superior (VCS). En algunos casos, se debe dar un poco de inclinación derecha, para visualizar la VCS en toda su extensión. En esta posición, se observa fácilmente el paso de la guía y la camisa transeptal hacia la VCS.
– Paso 3: se retira lentamente la camisa, observando cómo se desliza de la VC hacia la AD. A medida que se acerca a la fosa oval, se retiran progresivamente las inclinaciones derecha y posterior de la sonda. La posición anterior o posterior de la punción se puede evaluar girando la sonda en contra o a favor de las manecillas del reloj, respectivamente. Para procedimientos de ablación de arritmias y cierre de orejuela, se prefieren punciones inferiores, pero hacia el centro (en sentido anteroposterior) de la fosa oval.
– Paso 4: una vez en posición, se hace la punción (la verificación de la posición de la aguja en la aurícula izquierda se puede hacer inyectando solución salina) y se avanza todo el sistema como ya se describió.
Escenarios difíciles y cómo resolverlos (Fig. 5)
Trombosis de vena cava superior
En pacientes con trombosis de vena cava superior, la técnica tradicional que involucra arrastrar el sistema de punción transeptal desde la cava superior hasta su caída en la fosa oval no es posible. En esta situación, se prefiere la realización de una técnica «de abajo hacia arriba»: utilizando un catéter de electrofisiología como guía se avanza la camisa de punción transeptal hasta el punto deseado en la fosa oval. Una vez ubicada, se retira el catéter y se avanza el dilatador y la aguja de punción (no expuesta), sin perder la posición de la camisa en la fosa oval. Se debe ser muy cuidadoso al avanzar el dilatador por fuera de la camisa, para no perder la posición. Una vez ubicada la punta del dilatador sobre la fosa oval, se procede a realizar la punción transeptal mediante la técnica convencional.
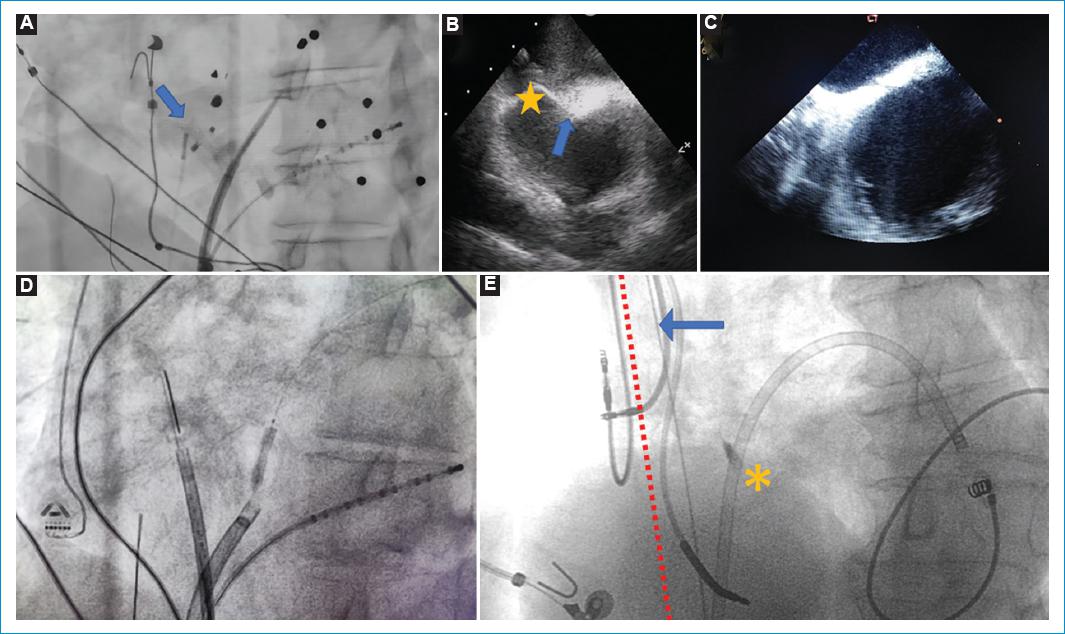
Figura 5 Situaciones especiales que implican cambios en la metodología durante la realización de una punción transeptal. A: en pacientes con dispositivos de cierre de defectos del septum interauricular (flecha azul), se prefiere la realización de una punción transeptal más inferior y posterior. Aunque también se podría puncionar a través del dispositivo, ello acarrea riesgo de atrapamiento del catéter. B: en algunos pacientes, la distancia entre la cava inferior y la fosa oval hace que sea difícil realizar tenting en el sitio deseado (estrella amarilla) ya que al empujar la camisa esta se desliza hacia arriba (flecha azul) en lugar de hacer tenting. C: ejemplo de septum interauricular engrosado. Estos pueden requerir el uso de radiofrecuencia para facilitar el paso de la aguja. D: en pacientes con septos rígidos/gruesos que no permiten el paso de la camisa transeptal, puede ser necesario dilatar el orificio con balones de angioplastia periférica (6 mm), después de lo cual se puede avanzar fácilmente la camisa transeptal. E: ejemplo de la ubicación adecuada de la guía en un paciente con cables de estimulación. La guía (flecha azul) debe pasar entre el trayecto del electrodo (marcado en este caso por una línea punteada) y el septo interauricular, con el fin de evitar que al caer en la fosa oval la camisa disloque el cable. Observe el tatuaje a nivel de la fosa oval de una punción previa (asterisco amarillo).
Presencia de dispositivos para cierre de defectos del tabique interauricular (Fig. 5A)
En pacientes con dispositivos de cierre de defectos del tabique interauricular, existen dos opciones: puncionar a través del dispositivo o puncionar por debajo de él. En lo posible, se debe evitar la punción a través del dispositivo, ya que hay riesgo de atrapamiento de los catéteres25 y se debe preferir la punción en una posición posterior e inferior al dispositivo. Si se punciona a través del dispositivo, se debe dilatar el acceso lo suficiente (mediante el uso de balones) para facilitar el movimiento de camisas y catéteres.
Dificultad para lograr «tenting» adecuado
En pacientes con dilatación grave de la AD, la distancia entre la vena cava inferior y el septum interauricular aumenta, lo cual dificulta el tenting; al empujar, la camisa se desliza hacia arriba sin ejercer suficiente presión en la fosa oval (Fig. 5B). En estos casos, una vez se logra posicionar la punta del dilatador en una zona adecuada para la punción, se procede a empujar la aguja antes de hacer tenting. Esto permite que la aguja actúe como un anclaje y evite que la camisa se deslice hacia arriba. Si aun así no se logra hacer tenting, se puede avanzar una guía 0.014” por su extremo rígido, para puncionar el septo y que sirva de anclaje antes de empujar la camisa para lograr tenting.
Septo laxo o rígido/grueso
Los pacientes con septos laxos tienen mayor riesgo de perforación inadvertida de la aurícula, ya que el septo puede desplazarse hasta la pared posterior o lateral de la aurícula izquierda al momento de hacer tenting. En estos casos, se recomienda hacer la punción apuntando hacia las venas izquierdas (con el fin de tener mayor distancia para desplazar el septo) y siempre con visualización mediante EIC. Si con eso no se logra pasar, se sugiere aplicar radiofrecuencia a la aguja (utilizando un electrobisturí) para facilitar su paso.
En pacientes con septo interauricular rígido/grueso, también se puede usar electrobisturí para facilitar el paso de la aguja (Fig. 5C). De manera alternativa, se puede avanzar una guía 0.014” por su extremo rígido para facilitar la punción del septo. Avanzar camisas en pacientes con este tipo de septo (particularmente camisas deflectables que tienen un mayor calibre en comparación con el dilatador), puede ser difícil. En estos casos, intercambiar por una camisa no deflectable puede facilitar el paso transeptal. Si esto no es posible, se debe estar preparado para dilatar la entrada a través del septo interatrial con un balón de angioplastia periférica de 6 mm (Fig. 5D).
Presencia de cables de dispositivos de estimulación cardíaca
Los pacientes con cables de dispositivos de estimulación cardíaca (DEC), particularmente aquellos que han sido implantados en el último año, tienen mayor riesgo de dislocación de cables al momento de hacer la punción transeptal, ya que al deslizar la camisa hacia abajo desde la cava, se puede enredar con el cable. Esto sucede más frecuentemente con el atrial, ya que generalmente discurre desde la VCS hacia la orejuela derecha, con un asa que, la mayoría de veces, se ubica a la altura de la fosa oval. En estos pacientes es importante asegurarse de que la guía pasa entre el asa del cable y la fosa oval (Fig. 5E), para evitar que al caer hacia ella haga tracción sobre el asa y disloque el cable.
Complicaciones asociadas a la punción transeptal
Existen varios factores que aumentan el riesgo de complicaciones durante la realización de una punción transeptal, entre los que se incluyen experiencia del operador (< 45 punción transeptal al año), edad avanzada del paciente, hacer la punción transeptal sin guía ecocardiográfica y fallar el primer intento de punción transeptal12. Las complicaciones de la punción transeptal pueden ser letales, por lo que se deben identificar y manejar con prontitud.
Taponamiento cardíaco
El taponamiento cardíaco es la complicación más temida durante la punción transeptal; tiene una incidencia global de 1.6%12. No obstante, cuando se utiliza guía ecocardiográfica, esta incidencia disminuye de manera significativa, siendo tan baja como 0.2%26. En caso de taponamiento, se sugiere la reversión de la dosis de heparina con protamina, así como el drenaje percutáneo. Por lo general, esto es suficiente para detener la mayoría de los sangrados. En caso de ser necesario, se puede considerar la reversión de la anticoagulación con concentrado de complejo protrombina de 4 factores (para pacientes manejados con antagonistas Xa o warfarina; dosis de 50 UI/kg)27 o idarucizumab (para pacientes manejados con dabigatrán)28. En la mayoría de los casos, este manejo puede ser suficiente para detener el sangrado sin llegar a requerir manejo quirúrgico29, particularmente si el derrame fue producido solo por la aguja transeptal.
Formación de trombos
Es más fácil prevenir la formación de trombos, que darle manejo a un trombo formado. Al retrasar la dosis de heparina hasta después de realizada la punción transeptal, hasta un 10% de los pacientes pueden presentar trombos visibles en las guías y camisas transeptales30-32. Conectar las camisas a un flujo continuo de solución salina heparinizada también puede ser útil ya que evita la formación de trombos al interior del lumen de la camisa. En casos en los cuales ya se formó un trombo, se sugiere aspirar vigorosamente a través de la camisa, buscando la captura del trombo.
Punción inadvertida de otras estructuras
La punción de la pared posterior de la aurícula derecha generalmente no reviste gravedad siempre y cuando no se haya avanzado el dilatador y la camisa, ya que es una cavidad de baja presión. Por lo general, se puede continuar el procedimiento sin complicaciones vigilando de manera continua el espacio pericárdico. Si se avanzó el dilatador y la camisa, estos no se deben retirar hasta no tener drenaje pericárdico y todo listo para toracotomía urgente. Si la punción se realiza muy anterior, hay riesgo de puncionar la aorta. La mayoría de estas punciones comunican la AD con la cúspide no coronaria de la aorta o la unión sinotubular, y rara vez a la aorta ascendente33. Por lo general, las dos primeras no revisten riesgo de taponamiento, mientras que la punción de la aorta ascendente (al involucrar paso por el espacio pericárdico) sí. En caso de presentarse, no se debe retirar lo que se haya introducido en la aorta (aguja, dilatador o camisa). Se debe realizar un aortograma para determinar el sitio exacto del ingreso a la aorta, avisar al cirujano cardiovascular y tener preparado al paciente para un drenaje pericárdico urgente. En el caso de las punciones de la cúspide o de la unión sinotubular, estas tienden a cicatrizar por completo sin ningún tipo de intervención durante el seguimiento, incluso si se avanzó el dilatador. Aunque existen algunos casos descritos de cierre del defecto en la aorta ascendente usando dispositivos oclusores de ductus34-36, esto solo se debe intentar cuando ya se tiene soporte de cirujano cardiovascular. Vale la pena recalcar que, en la mayor serie de casos de punción inadvertida de la aorta, no se utilizó guía ecocardiográfica para las punciones y que los autores reconocen que con su uso se pudo haber evitado esta complicación.
Conclusión
La punción transeptal es una técnica cuyo uso viene en aumento con los avances en ablación de arritmias complejas y manejo percutáneo de condiciones cardíacas. A pesar de tener riesgos considerables, estos se pueden reducir de manera significativa con una adecuada técnica, el uso de guía ecocardiográfica y en manos de un operador experimentado. El dominio de la ecocardiografía intracardíaca facilita mucho este abordaje e incluso permite la realización de procedimientos sin fluoroscopia.














