Introducción
La prevalencia de falla cardiaca avanzada viene en aumento y representa hasta el 10% de todos los pacientes con insuficiencia cardiaca1. Previamente, la única terapia definitiva para estos pacientes era el trasplante cardiaco, pero los dispositivos de asistencia ventricular izquierda (más conocidos como LVAD, su sigla en inglés por left ventricular assist device) han aparecido en los últimos treinta años como una alternativa para pacientes a la espera de un trasplante e incluso como terapia definitiva o paliativa en aquellos con contraindicación para este2. Sin embargo, no es una terapia inocua y se ha estimado que alrededor del 70% tendrán un reingreso hospitalario en el primer año después del implante3. Estos dispositivos son una realidad en Colombia y ante el panorama supuesto de más de 40 000 personas con falla cardiaca avanzada en el país, la cantidad de posibles candidatos no es despreciable y será cada vez mayor, así como también será frecuente su consulta a los servicios de urgencias4. Por todos estos motivos es necesario que el personal de este servicio reciba entrenamiento en estos y que conozca el diagnóstico y manejo de sus principales complicaciones. En respuesta a lo anterior, a continuación, se hace una descripción de los LVAD, sus complicaciones, abordaje y manejo en este escenario.
Historia de los dispositivos de asistencia ventricular izquierda
En 1953, John Gibbon inició la era del soporte mecánico circulatorio al finalizar la primera cirugía cardiaca abierta usando con éxito una máquina de bypass cardiopulmonar en una mujer de 18 años5. En 1963, Michael DeBakey y Domingo Liotta implantaron por primera vez un dispositivo paracorpóreo en un paciente llamado George Washington tras un reemplazo valvular aórtico; sin embargo, este paciente falleció tras cuatro días6,7. El advenimiento de estas técnicas también trajo consigo el desafío de dar soporte a aquellos pacientes a quienes no era posible sacar de bomba tras cirugías cardiacas y allí nació la idea de dar asistencia al ventrículo de forma prolongada y llevó a que en 1964 el Instituto Nacional de Salud de los Estados Unidos instaurara el programa para la creación del corazón artificial total (CAT)8. Durante esta misma década, DeBakey y Liotta lograron implantar de forma exitosa un dispositivo paracorpóreo en una paciente incapaz de salir de bomba tras una cirugía de reemplazo aórtico y mitral, y posterior a diez días este se pudo retirar y la paciente fue dada de alta, constituyéndose así en el primer caso exitoso de soporte transitorio hasta el egreso. Por otro lado, hacia 1969, se implantó la primera versión de un CAT en un hombre de 47 años, quien sobrevivió durante 64 horas hasta recibir un trasplante cardiaco, pero falleció posteriormente debido a complicaciones infecciosas7,8.
En 1972, se fundó el programa para el desarrollo de LVAD en Estados Unidos y se inició su investigación formal, a medida que se mejoraba el desarrollo de los CAT. En la década de los ochenta se logró sostener a los pacientes a la espera de un trasplante con un CAT hasta por 620 días; sin embargo, las complicaciones hemodinámicas, infecciosas, hemorrágicas y la muerte fueron el común denominador8. En 1984 se implantó el primer LVAD y fue en este mismo año que se desarrollaron los proyectos que demostraron su utilidad en pacientes como terapia intrahospitalaria puente hasta un trasplante. No obstante, la posibilidad de que un paciente egresara con uno de estos dispositivos aún era una utopía8. Fue en 1994, treinta años después de su ideación, que se logró el egreso de un paciente con un LVAD implantado y portátil. Estos dispositivos, conocidos como de primera generación, tenían un flujo pulsátil que simulaba los flujos sistólicos y diastólicos del corazón nativo2,8.
En 2001, el estudio REMATCH demostró su beneficio en pacientes con falla cardiaca avanzada, incluso como terapia a largo plazo, al reducir del riesgo de muerte por cualquier causa un 48% y evidenciar una supervivencia de 52% al primer año9. A pesar de este avance, estos LVAD presentaban limitaciones: tenían corta duración, eran pesados y ruidosos, y requerían válvulas y múltiples componentes para su funcionamiento8.
A inicios del milenio, la investigación migró a dispositivos de flujo continuo con el advenimiento de dispositivos de segunda generación y flujo axial, como el HeartMate II en 20082,8. Dos años después, se demostró su superioridad en comparación con los LVAD de flujo pulsátil, con lo cual se aumentó la supervivencia del 24 al 58%10. Aunque prometedores, no dejaban de tener un gran tamaño hasta la aparición, la década pasada, de dispositivos de flujo continuo centrífugo. Estos son de menor tamaño, se implantan en el ápex y el motor es intrapericárdico. El primero de estos fue el HeartWare, el cual fue retirado en 2021 debido a que aumentaba la incidencia de accidente cerebrovascular (ACV)2.
Finalmente, en el último lustro apareció el primer dispositivo de tercera generación, de flujo continuo, centrífugo, y con un motor levitado, completamente magnético, lo cual reduce el riesgo de trombosis. Este dispositivo, el HeartMate III, demostró una reducción del 92 y 58% en el riesgo de trombosis del LVAD y de ACV, respectivamente11. Desde entonces, se convirtió en el dispositivo de elección.
Componentes básicos de los dispositivos de asistencia ventricular izquierda e impacto de los flujos continuos
Los tres LVAD utilizados en las últimas dos décadas han sido el HeartWare, el HeartMate II y el HeartMate III12. Todos estos tienen seis componentes en común: 1) una cánula de entrada implantada en el ápex, 2) una bomba que transfiere la sangre hacia un injerto de salida (3), que conduce la sangre hasta su unión en la aorta ascendente. Un cable percutáneo (4) se proyecta a través de la pared abdominal y comunica directamente la bomba con un controlador externo (5), el cual monitoriza los parámetros de funcionamiento del dispositivo y se conecta a una fuente de energía, que puede ser una batería portátil o fija (6)12 (Fig. 1).
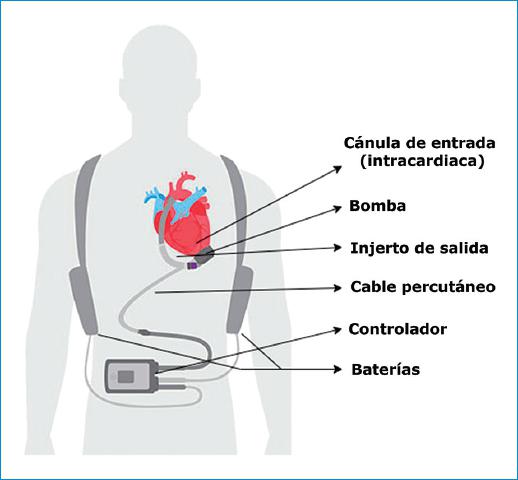
Figura 1 Componentes de los dispositivos de asistencia ventricular izquierda (adaptado de http://www.Who.Int/gho/publications/world_health_statistics/2012/en/index.Html).
Todos tienen cuatro parámetros básicos reportados por el controlador: a) la velocidad de la bomba, descrita en revoluciones por minuto, b) la potencia, medida en Watts y que indica la corriente aplicada a la bomba, c) el flujo, analogía al gasto cardiaco y es expresado en L/min, que en realidad es una estimación basada en la potencia y la velocidad de la bomba, y finalmente, d) el índice de pulsatilidad (IP), una medición indirecta de la magnitud de los cambios en el flujo y la velocidad a medida que se contrae el ventrículo izquierdo nativo12,13.
Impacto fisiológico del flujo continuo
El flujo continuo de los LVAD proporciona una circulación no fisiológica y trae impactos negativos en la fisiología. Resulta ilógico pensar que añadir un dispositivo con funcionamiento distinto al corazón, una bomba pulsátil con un proceso evolutivo de más de 750 millones de años, no traerá repercusiones a una circulación basada en pulsatilidad14. Esta estrecha relación entre el LVAD y el corazón es la responsable de complicaciones únicas de esta población. Esta interacción está descrita bajo el término «hemocompatibilidad»15.
Las áreas más afectadas con el flujo continuo son precisamente aquellas con mayor pulsatilidad. En estos sitios, la circulación pulsátil ejerce un efecto antitrombótico dado que son áreas de mayor recirculación y estasis, como los ventrículos y el arco aórtico. Esto explica el riesgo de trombosis en estos sitios, en pacientes con LVAD14.
Todos los dispositivos llevan a una tensión más allá de la tolerada por los glóbulos rojos, por lo que es común la hemólisis continua a bajo grado14. Otras implicaciones incluyen disfunción microvascular, liberación de factores angiogénicos, mayor rigidez vascular, tono simpático, riesgo de insuficiencia aórtica y liberación de citoquinas proinflamatorias15,16. También hay destrucción de polímeros del factor de Von Willebrand con el desarrollo de síndrome de Von Willebrand adquirido15.
Valoración inicial del paciente con dispositivos de asistencia ventricular izquierda
Existen aspectos únicos en la valoración inicial de los pacientes con LVAD. En la anamnesis es fundamental indagar por alarmas recientes del dispositivo, síntomas de falla cardiaca, cambios en el color de la orina que sugieran hemoglobinuria, fiebre o secreción alrededor del cable percutáneo u otros síntomas sugestivos de un proceso hemolítico o infeccioso.
Dado que todos los pacientes con LVAD deben estar anticoagulados con warfarina y antiagregados con aspirina, se debe confirmar la tolerancia a la medicación y la ausencia de efectos adversos secundarios a estos, como epistaxis, melenas o hematoquecia.
Estos pacientes carecen de pulso periférico palpable y los diferentes métodos convencionales de medición de presión arterial no son confiables. Por los métodos palpatorio y automático solo se logrará la medición de esta en menos del 10 al 50% de los casos, respectivamente. El método más confiable para la medición de la presión arterial media (PAM) en estos pacientes es el Doppler17, el cual consiste en el uso de un brazalete común mientras se insona la arteria radial. Se debe detectar el sonido del flujo a través de esta con el Doppler y, posteriormente, se debe insuflar el brazalete 20 mmHg por encima de la desaparición de este sonido. Finalmente, se desinfla y la PAM corresponderá a ese valor en el cual reaparece el sonido del flujo continuo18.
Algunos paraclínicos útiles en su valoración incluyen hemograma completo, tiempos de coagulación, perfil hepático y LDH como marcador de hemólisis. El electrocardiograma cambia posterior al implante del LVAD, y genera una interferencia en el trazado; sin embargo, sigue siendo útil en la detección de arritmias19.
Todo lo anterior ayuda a sospechar una de las diferentes complicaciones asociadas a los LVAD. Los autores proponen, entonces, la mnemotecnia A2B2C2D2 con el objetivo de recordar aquellas complicaciones potencialmente fatales o específicas durante la atención de estos pacientes (Tabla 1).
Complicaciones asociadas a los dispositivos de asistencia ventricular izquierda
A2: arritmias
Al menos un 30 a un 40% de los pacientes tendrán una hospitalización por una arritmia en los primeros dos años posteriores al implante13. Sus causas incluyen reentradas cicatriciales ventriculares, la zona de inserción de la cánula de entrada y la irritación mecánica alrededor de esta12,20,21.
Debido al soporte mecánico, existe mayor tolerancia a las arritmias; incluso se reportan casos de fibrilación ventricular (FV) recurrente durante días a semanas13,22. Al menos un 53% de los pacientes serán clínicamente asintomáticos20. No obstante, la caída del flujo debe alertar acerca de la posibilidad de una arritmia ventricular, ya que estas pueden causar caídas del flujo de hasta 32% y no son tan tolerables como se creía23.
Al menos el 50% de los adultos con LVAD tiene fibrilación auricular (FA) previo al implante y parte de ellos mejora gracias a las menores presiones en la aurícula izquierda13. En caso de una FA tras el implante, esta rara vez se manifestará clínicamente y dependerá de si hay o no disfunción del ventrículo derecho12,24. El manejo es similar en pacientes sin LVAD y es pautado según la sintomatología del paciente y su estabilidad, pero es preciso recordar que la anticoagulación está indicada en todos aquellos con LVAD21.
Las arritmias ventriculares se reportan en al menos el 20 al 50% de los pacientes y el riesgo es principalmente alto en las primeras semanas posteriores al implante. Si el paciente tenía previamente un CDI, una de sus manifestaciones serán las descargas de este dispositivo estando despierto; en caso contrario, producirá síntomas escasos e inespecíficos, como mareo, náuseas y desvanecimiento13,20.
El manejo de estas dependerá de la presentación clínica. En pacientes con CDI, este se debe inhibir de inmediato con imán, para evitar la generación de nuevas descargas. Si el paciente está inestable, se debe sedar y cardiovertir; si está estable, el abordaje dependerá del tiempo de arritmia. En caso de arritmias de duración larga o desconocida, se deben descartar trombos en el ventrículo derecho y la válvula aórtica. Si se descartan estos o la arritmia es de corta duración, se puede iniciar manejo con amiodarona IV o cardioversión en caso de falla de la primera12,13,21. Esta última no interfiere con el funcionamiento del dispositivo y no es necesario apagar el LVAD ni desconectar las baterías21.
Finalmente, si al realizar la ecocardiografía a la cabecera del paciente se observa un ventrículo izquierdo pequeño y colapsado, está indicado el paso de líquidos IV en bolo y, si hay hallazgos que sugieran un evento de succión o hipovolemia, se considera reducir la velocidad de la bomba13.
A2: accidente cerebrovascular
Junto con la falla cardiaca derecha, el ACV continúa siendo la principal causa de muerte en los primeros seis meses del implante y posterior a este periodo se convierte, por mucho, en la primera causa de muerte25. Se ha estimado que 10% de los pacientes harán al menos un ACV durante el seguimiento, siendo proporcionalmente similares los eventos isquémicos y hemorrágicos26. Sus principales factores de riesgo incluyen: sexo femenino, edad avanzada, hipertensión arterial, infección en curso, tiempo de soporte con LVAD y tipo de dispositivo implantado, entre otros26.
El HeartMate III se asocia con una reducción del 58% del riesgo de ACV comparado con los dispositivos de flujo axial (HeartMate II); sin embargo, pese a tales avances, la tasa de ACV aún continúa siendo de al menos 9.9% durante los dos primeros años11. Estos casos parecen comportarse en forma de una curva J, donde el mayor riesgo existe en los primeros tres meses desde el implante y posterior al primer año de seguimiento27.
ACCIDENTE CEREBROVASCULAR ISQUÉMICO
El ACV isquémico en pacientes con LVAD es, en su mayoría, de origen embólico, ya sea por el paso de un trombo desde el ventrículo izquierdo a través del dispositivo, así como por la formación de este dentro del sistema, la válvula aórtica, el cayado aórtico, el seno de Valsalva, etc. En algunos casos también puede ser el resultado de una embolia séptica en el contexto de una infección sistémica o una endocarditis asociada al dispositivo27.
Si bien un LVAD no es contraindicación absoluta para recibir trombólisis sistémica, sí es claro que la mayoría de pacientes tendrá contraindicaciones para recibirla. Igualmente, existe la consideración teórica de que esta sea menos efectiva dado que el material embólico en estos pacientes no solo está compuesto por fibrina, sino también por proteínas desnaturalizadas28. Tampoco es claro si, dado su flujo continuo, el tiempo de ventana para su uso sea diferente. Por lo anterior, la evidencia actual se remonta a reportes de caso y su uso se restringe a pacientes sin contraindicaciones y anticoagulación subóptima.
La trombectomía mecánica tiene las mismas indicaciones que para aquellos pacientes sin LVAD y es una intervención segura. A pesar de esto, existen ciertas consideraciones para su uso en este contexto27. La resonancia magnética está proscrita en pacientes con LVAD, en tanto que la tomografía computarizada cerebral con estudio de perfusión no está disponible en la mayoría de centros de alta complejidad del país y aun no es claro su rendimiento y la toma de decisiones con esta en pacientes con dispositivos de flujo continuo. Por tal motivo, el escenario de trombectomía mecánica queda relegado en nuestro medio a aquellos pacientes en tiempo de ventana con demostración mediante angioTC de un vaso grande afectado.
En cuanto a la presión arterial, se ha sugerido previamente mantener una PAM entre 70 y 130 mmHg en las primeras 24 horas29.
ACCIDENTE CEREBROVASCULAR HEMORRÁGICO
Existen muchas razones para pensar que la hemorragia intracerebral (HIC) y subaracnoidea (HSA) representan una catástrofe en el paciente con LVAD. Su aparición representa una contraindicación para el trasplante cardiaco. Además, la mortalidad aumenta de forma significativa a corto plazo y es mayor que en aquellos pacientes con ACV isquémico. De acuerdo con los datos del registro INTERMACS, la supervivencia posterior a un ACV hemorrágico es de 45.3, 34.8 y 30.3% a 1, 6 y 12 meses, respectivamente26.
La HIC y la HSA son de origen multifactorial en pacientes con LVAD. La anticoagulación es, sin duda alguna, uno de sus principales determinantes; también se ha descrito aumento de la fragilidad vascular en los vasos sanguíneos debido al flujo continuo, así como disminución de la presión de pulso. Por último, se ha documentado síndrome de Von Willebrand adquirido descrito previamente, ante la destrucción de este factor en la bomba28.
A pesar del entendimiento de sus principales factores de riesgo y estos cambios fisiopatológicos, su aparición aún no se entiende por completo. Con los últimos dispositivos se ha disminuido el riesgo, pero no se ha eliminado. Igualmente, se ha encontrado evidencia de hemorragias intracerebrales independiente del nivel de INR, así que la explicación va más allá de la sobreanticoagulación28,29. La característica más común en aquellos pacientes con sangrado intracerebral es el síndrome de Von Willebrand adquirido30.
La tomografía simple de cráneo es el método diagnóstico de elección y la angioTC es útil para evaluar la anatomía vascular y definir la fuente del sangrado. No existe contraindicación para realizar arteriografía, pero sí se recuerda que están contraindicadas las imágenes por resonancia magnética.
El tratamiento de la HIC y la HSA en pacientes con LVAD aún no es claro y, por el momento, se acoge a recomendaciones realizadas a pacientes sin estos dispositivos, tanto de manejo médico como quirúrgico. Existe consenso entre expertos y sociedades científicas en recomendar una PAM entre 70 y 90 mmHg en estos pacientes12,13.
Si bien está indicada la suspensión de anticoagulación y la reversión de esta con complejo protrombínico o plasma fresco congelado, existe riesgo de eventos trombóticos asociados al dispositivo12,28. Por consiguiente, se sugiere un manejo más conservador, que revierta la anticoagulación solo en casos de HIC pequeñas y sin déficit neurológico mayor, incluso manteniendo INR en rangos terapéuticos, mientras que en los demás casos se considera revertirla hasta lograr INR menor a 1.430. Aunque el panorama es prometedor, su seguridad no ha sido validada.
B2: sangrado (bleeding)
Los sangrados no intracerebrales son frecuentes en los pacientes con LVAD. Están representados por el sangrado quirúrgico en el periodo inmediato al implante y por episodios de sangrado gastrointestinal posterior a tres meses. Se estima que entre un 22 y un 32% de los pacientes tendrán episodios de sangrado significativo y, junto con la infección, es la segunda causa de reingreso hospitalario y explica el 2% de las muertes en esta población3,28.
La fisiopatología del sangrado en esta población es multifactorial e incluye la anticoagulación con cumarínicos y antiagregación con aspirina, el síndrome de Von Willebrand adquirido y los cambios en la anatomía de la pared vascular, que incluyen la angiogénesis secundaria al flujo continuo con la subsecuente aparición de malformaciones arteriovenosas, principalmente en las regiones gastrointestinal, nasofaríngea e intracerebral15,28.
El sangrado gastrointestinal es de presentación clínica variable, pero rara vez cursa con inestabilidad hemodinámica y usualmente es de origen superior. El abordaje diagnóstico es similar al de aquellos pacientes sin LVAD. La elección de estudio endoscópico dependerá de la región anatómica de la que se sospeche sea el origen, en cuyo caso la endoscopia digestiva superior es la más empleada. Si no se encuentra la fuente o hay inestabilidad hemodinámica se podría considerar la arteriografía, la cual podría ser diagnóstica y terapéutica28.
El manejo inicial del sangrado gastrointestinal es similar al de pacientes sin LVAD en cuanto a reanimación hídrica e intervención endoscópica temprana. El uso de inhibidores de la bomba de protones está indicado dado que el principal sitio anatómico de origen es la mucosa gástrica28. En caso de requerir transfusión de hemoderivados, se considera el uso de glóbulos rojos irradiados en aquellos candidatos a trasplante para evitar inmunización.
Se ha recomendado limitar la reversión de la anticoagulación solo a aquellos pacientes con sangrado mayor o que amenace la vida, reconociendo el riesgo de trombosis del dispositivo que esto conlleva, especialmente con el uso de complejo protrombínico. En los demás casos se recomienda solo suspender temporalmente la terapia doble anticoagulante y antiagregante, e incluso, de acuerdo con la gravedad, continuarla si hay sangrados menores y clínicamente no significativos12.
Se han reportado series de casos exitosos y resultados diversos con el manejo con octreotida, análogo de la somatostatina que incrementa la resistencia vascular, disminuye la angiogénesis y mejora la agregación plaquetaria, e igualmente estudios con aplicaciones mensuales de este para uso profiláctico28. Adicionalmente, hay reportes de la ingesta de omega 3 en este escenario; sin embargo, el uso de ambos queda sujeto al protocolo de cada institución.
B2: bomba trombosada
La trombosis de la bomba o del LVAD se caracteriza por la presencia de cualquier trombo dentro del flujo de cualesquiera de los componentes del dispositivo: cánula de entrada, bomba o injerto de salida12. Se considera un hecho potencialmente fatal, que condiciona un estado similar a una obstrucción del tracto de salida del ventrículo izquierdo y tiene manifestaciones clínicas que van desde disnea progresiva, a falla cardiaca aguda, choque cardiogénico e incluso muerte28. Su incidencia es cada vez menor con el advenimiento de dispositivos con levitación magnética (HeartMate III) que aportan una reducción del riesgo de trombosis de la bomba del 92% (1.4 vs. 13.9%; p < 0.001)11.
Este diagnóstico comprende dos escenarios: a) trombosis de la cánula interna o al interior de la bomba y b) trombosis del injerto de salida. El primero de estos se caracteriza por la tríada falla cardiaca aguda, hemólisis (LDH tres veces por encima del límite superior) y disminución rápida del flujo. La trombosis del injerto de salida no necesariamente se asocia con hemólisis y puede estar condicionada por compresiones externas o torsión del injerto, etc.12,28 En la tabla 2 se observan las principales diferencias clínicas e imagenológicas entre los dos sitios de obstrucción.
Tabla 2 Diferencias entre los espectros de trombosis de los LVAD
| Trombosis de la cánula o la bomba | Trombosis del injerto | |
|---|---|---|
| Signos y síntomas | Disnea progresiva | Disnea |
| Falla cardiaca aguda | Embolia distal | |
| Instauración | Corta | Progresiva |
| Hemólisis | Sí | No o escasa |
| Parámetros del dispositivo | Bajo flujo y potencia elevada | Potencia elevada |
| Hallazgos de laboratorio | LDH elevada Anemia Orina colúrica | Ausentes |
| Ecocardiografía a la cabecera | – VI dilatado | – VI dilatado |
| – Insuficiencia mitral grave | – Ausencia de trombos en VI | |
| –Flujo turbulento dentro de la cánula interna en Doppler | – Ausencia de flujo turbulento en la cánula interna | |
| – Trombo visible dentro del VI | – Turbulencia dentro del injerto al Doppler en un plano paraesternal izquierdo alto o paraesternal derecho | |
| AngioTC | Ausencia de obstrucción dentro del injerto | Confirma la obstrucción o estenosis del injerto e identifica su causa |
LDH: lactato deshidrogenasa, VI: ventrículo izquierdo. Adaptada de Ben Gal T et al., 202112.
El hallazgo de un cambio rápido en el flujo y la potencia junto con una LDH elevada es el hallazgo clásico en estos casos12. La angioTC es la imagen de elección para confirmar la trombosis del injerto de salida28. La ecocardiografía a la cabecera del paciente es de gran utilidad y puede evidenciar signos indirectos, como dilatación del ventrículo izquierdo, apertura de la válvula aórtica, insuficiencia mitral grave y presencia de flujos turbulentos, etc31.
No existe evidencia suficiente para recomendar una estrategia de manejo en pacientes con trombosis del dispositivo. Por consenso de expertos, se recomienda asegurar un INR entre 2.5 a 3.5. Si a pesar de esto hay trombosis o esta continúa, se debe iniciar anticoagulación con heparina no fraccionada. En casos más seleccionados y como último recurso, se ha descrito el uso de trombólisis sistémica con o sin inhibidores de la glicoproteína IIb/IIIa; sin embargo, el riesgo de sangrado es altísimo11,12,28. El uso de trombólisis en este escenario aún no es claro y tiene las mismas consideraciones expuestas en la sección de ACV isquémico. Recientemente, se describió un protocolo de administración de rTPA a dosis bajas y repetidas según respuesta clínica y paraclínica, alcanzándose una tasa de resolución del 69.2%32. No obstante, otros autores han reportado resoluciones menores con tasas de sangrado mayor elevadas usando esquemas de dosificación similares, por lo que su empleo queda condicionado al protocolo institucional33.
Finalmente, la trombosis del injerto de salida podría beneficiarse de terapia percutánea y, en caso de fallo de cualesquiera de las terapias anteriores o de pacientes con inestabilidad y choque cardiogénico, están indicados el soporte extracorpóreo, el recambio del dispositivo o el trasplante cardiaco12,28,32.
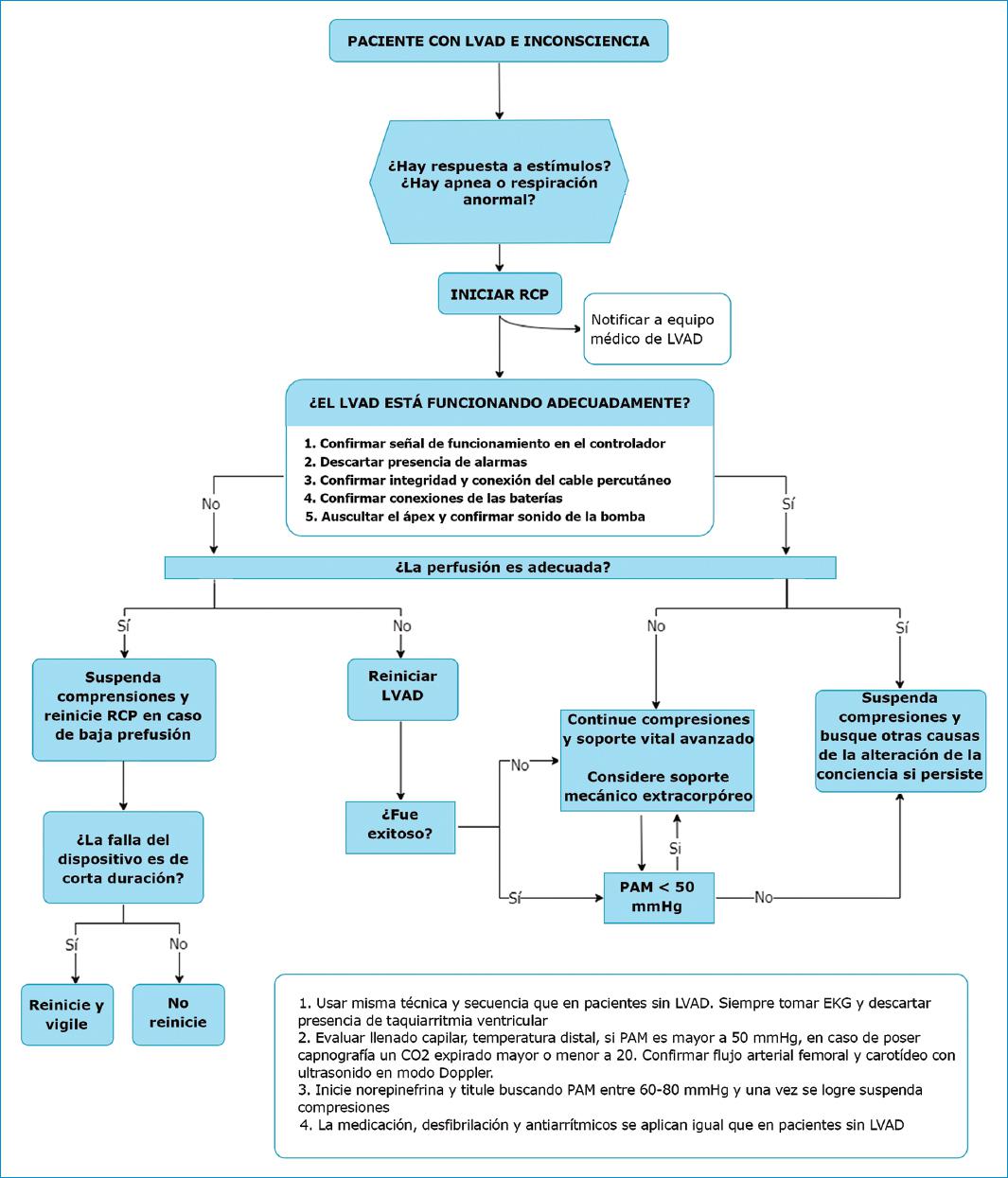
C2: conciencia alterada y RCP
Aproximadamente, el 13% de los pacientes con LVAD presentará algún episodio de pérdida de la conciencia, la cual corresponde, en la mayoría de los casos, a síncope de origen ortostático12. La escena es desafiante en su abordaje dado que la aceptación de la ausencia de pulso en estos pacientes puede llevar al retraso en el inicio de las compresiones en caso de una verdadera falla del LVAD. También hay controversia acerca de la posibilidad de desajuste de la cánula de entrada con las compresiones; sin embargo, se ha visto que esto es un evento raro y que las compresiones manuales son seguras34.
En el ámbito extrahospitalario, la cadena de supervivencia es similar. Si personal no entrenado evidencia un colapso súbito y hay ausencia de pulso, se deben iniciar, cuanto antes, compresiones torácicas y activar el sistema de emergencias35. Este último puede indicar, vía telefónica, el inicio de estas maniobras al transeúnte en caso de no estar entrenados en identificar pacientes con LVAD. Posteriormente, debe ser trasladado idealmente a un centro con experiencia en LVAD o donde este fue implantado35. En caso de contar con reanimadores entrenados, las dos principales acciones en un paciente con alteración de la conciencia son valorar si hay signos que indiquen ausencia de vida o pobre perfusión, y confirmar si el dispositivo funciona12.
La ausencia de signos de vida se valora respondiendo a las dos preguntas clásicas: ¿Hay ausencia de respuesta al estímulo? y ¿es la respiración ausente o anormal? Si la respuesta a ambas preguntas es “Sí”, los autores sugieren el inicio de compresiones ya que es mayor el beneficio de estas que el riesgo de hacerlas en caso de no cursar una parada cardiaca o de la bomba, e igualmente la confirmación de la función del dispositivo puede traer retrasos significativos en el inicio de las maniobras de reanimación. Otras medidas para evaluar perfusión incluyen PAM < 50 mmHg, caída en la capnografía a valores menores de 20 mmHg y, en caso de estar disponible, Doppler de arteria carotídea o femoral12,13.
Tras el inicio de maniobras, se debe interrogar el funcionamiento del LVAD. El controlador presenta una señal visual en su pantalla que indica su funcionamiento correcto. Las dos causas principales de falla intrínseca del dispositivo son la disfunción del cable percutáneo y la ausencia de batería; por ende, se debe auscultar el ápex para confirmar el sonido del dispositivo y verificar cada uno de sus componentes y conexiones.
Con estas dos valoraciones se podrá emitir una primera conclusión: en pacientes con LVAD que se encuentren perfundidos y cuyo dispositivo funcione adecuadamente, es muy poco probable que la causa de su alteración de la conciencia sea de origen cardiaco y en este escenario podrían suspenderse las compresiones, continuar el soporte ventilatorio y estudiar otras causas, como hipoxemia, ACV, hipoglicemia, intoxicaciones, etc12.
Si el paciente tiene pobre perfusión, pero el dispositivo funciona, se debe continuar con compresiones torácicas12,36. En este escenario es importante considerar el uso rápido de soportes de circulación extracorpórea de acuerdo con el tiempo de reanimación, la disponibilidad del recurso y el pronóstico del paciente35.
Durante el soporte vital avanzado, el uso de adrenalina, antiarrítmicos y desfibrilación externa tiene las mismas consideraciones que en pacientes sin LVAD36. Es necesario tener en mente la limitación del esfuerzo terapéutico y la presencia de signos inequívocos de muerte, como la fijación de las pupilas, la rigidez o la asistolia ecográfica intraparo, que son elementos para considerar el cese de los esfuerzos de reanimación.
Si el LVAD no funciona se debe intentar reiniciarlo y hacer recambio de las baterías, así como del controlador, si es necesario. Si a pesar de verificar todo el dispositivo e intentar su reinicio, esto no se logra, se continúan las compresiones torácicas y las medidas de soporte vital avanzado con las mismas consideraciones mencionadas12. La ecografía en el paciente crítico con LVAD es de gran utilidad, pues con esta es posible evaluar signos de disfunción ventricular derecha, buscar signos indirectos de obstrucción de la bomba o depleción de volumen, confirmar si la válvula aórtica se abre durante la sístole, así como identificar posibles causas de la parada cardiaca, etc.31 En la figura 2 se presenta un algoritmo que resume el abordaje del paciente con LVAD y alteración de la conciencia, así como las recomendaciones para el inicio de maniobras de reanimación cardiopulmonar.
C2: controlador y alarmas
Los LVAD tienen dos niveles de alarma: de advertencia y crítica. La primera de estas es de color amarillo, intermitente y requiere atención, pero no necesariamente emergente; entre estas se encuentran: batería baja, bajo flujo, baja velocidad, desconexión de uno de los cables de la batería, etc.37 Las alarmas rojas, por otro lado, son críticas, continuas y precisan acciones emergentes; entre estas se incluyen: paro de la bomba, desconexión del cable percutáneo, desconexión de ambas baterías, tiempo de batería menor a 5 minutos, flujo mínimo (menor a 2.5 l/min)37.
El paro de la bomba, aunque temido, es raro. En estos casos, ante la disminución del gasto cardiaco y la estasis es posible la formación de trombos intraventriculares, por lo que se debe ser cuidadoso al tomar la decisión de reiniciar el LVAD. Si hay inestabilidad hemodinámica se debe reiniciar independiente del tiempo de evolución, dado que sus beneficios superan los riesgos; también se debe considerar el inicio de anticoagulación con heparina12,37. Si el paciente está estable y el fallo del LVAD es solo por un par de minutos, se podría reiniciar; de lo contrario no y el paciente debe ser valorado en su centro de LVAD12.
La alarma de bajo flujo es otro escenario importante. Sus causas son múltiples e incluyen deshidratación, falla cardiaca derecha, obstrucción de la cánula, etc. El silencio de la alarma tras aplicar una posición de Trendelenburg es indicador de hipovolemia y en tal caso estaría indicada la administración de líquidos intravenosos13. La ecografía a la cabecera del paciente también podría ayudar a estrechar la causa de esta alarma36.
El enfoque inicial ante cualquier alarma una vez observada es confirmar cada uno de los elementos del controlador incluyendo la conexión del cable percutáneo, las dos diferentes baterías y su carga, así como la auscultación del ápex para confirmar el funcionamiento de la bomba; el manejo para cada alarma dependerá de su causa específica. En la tabla 3 se pueden encontrar otras alarmas posibles, sus eventuales causas y el abordaje específico.
Tabla 3 Complicaciones visibles en el controlador y su abordaje
| Complicación | Causas | Consideraciones | Manejo |
|---|---|---|---|
| Fallo de bomba | Ausencia de fuente de poder | Evaluar conexiones y batería | Valoración emergente por cardiología; en caso de choque, reinicio de esta, anticoagulación e inotropía |
| Baja potencia | – Batería sin carga – Cable percutáneo desconectado |
– Si la causa es por baja carga, conectar a la fuente fija de energía – En caso de falla primaria, instaurar medidas de soporte y considerar recambio de dispositivo. |
|
| Alta potencia | – Trombosis – Hipertensión – Falla eléctrica |
Ecocardiografía a la cabecera del paciente en búsqueda de signos directos o indirectos de trombosis del dispositivo | – Asegurar PAM 70-90 mmHg – Búsqueda activa de hemólisis incluyendo medición de LDH – Anticoagulación con HNF en caso de trombosis – Considerar cambio de dispositivo en caso de falla eléctrica |
| Alto flujo | Infecciones/sepsis | Evaluar la potencia; cuando esta es normal se asocia a vasodilatación y sepsis | Seguimiento estrecho, considerar búsqueda activa de infecciones específicas o asociadas al dispositivo |
| Bajo flujo | – Eventos de succión – Hipovolemia – Falla cardiaca derecha – Obstrucción de la cánula – Hipertensión – Obstrucción del injerto – Arritmias – Velocidad muy alta |
Ecografía a la cabecera del paciente: – Desviación del septo o ausencia de alineación de la cánula con la válvula mitral en eventos de succión – Flujo turbulento o regurgitación al Doppler en caso de obstrucción de la cánula o disfunción de la bomba – Presencia de coágulos – Bajo volumen telediastólico, vena cava colapsada en caso de hipovolemia |
– Realizar ECG y ecocardiografía – Anticoagulación en caso de trombosis – Inotropia en caso de choque – Cardioversión en caso de arritmias e inestabilidad hemodinámica o TV/FV de corta duración – Reanimación hídrica en caso de hipovolemia o eventos de succión |
ECG: electrocardiograma; FV: fibrilación ventricular; HNF: heparina no fraccionada; LDH: lactato deshidrogenasa; PAM: presión arterial media; TV: taquicardia ventricular. Adaptada de Long B et al., 201936 y Cook et al., 201737.
D2: falla cardiaca derecha
La falla cardiaca derecha (RHF, su sigla en inglés) es común y puede presentarse antes del egreso (RHF temprana) o posterior a este (RHF tardía). De acuerdo con el registro INTERMACS, su prevalencia en el primer mes posterior al implante alcanza un 24%, luego declina y se mantiene aproximadamente en 8 a 10% de forma crónica38. Esta tiene implicaciones pronósticas dado que su desarrollo se relaciona con menor supervivencia y mayor riesgo de presentar todas las complicaciones que se han descrito previamente39.
La fisiopatología de la RHF posterior al LVAD es multifactorial. Tras el implante hay aumento abrupto del gasto cardiaco y la precarga del ventrículo derecho; esto, asociado a la disminución de la presión dentro del ventrículo izquierdo, conlleva movilización del septo y aumento del trabajo del ventrículo derecho, el cual no es capaz de responder a esto y causa su disfunción, ya sea de novo o agudizando disfunciones crónicas40.
Los factores de riesgo asociados con su aparición temprana incluyen características clínicas y ecocardiográficas, como disfunción previa del ventrículo derecho, así como características hemodinámicas (PVC mayor a 15, índice de pulsatilidad de la arteria pulmonar menor a 1.85), entre otros41. Además, existen factores que favorecen la aparición de RHF tardía, como arritmias, valvulopatía, progresión de la disfunción del ventrículo derecho e hipertensión pulmonar40.
Siempre deben descartarse arritmias ventriculares en estos casos. El manejo ulterior de la falla cardiaca derecha es similar al de pacientes sin LVAD. Se debe optimizar la precarga del ventrículo derecho, por lo que están indicados los diuréticos en caso de congestión; si hay bajo gasto, el inicio de inotrópicos con efecto vasodilatador pulmonar debe ser temprano42. La ecocardiografía es útil para evaluar la posición del septo interventricular en pacientes con RHF y LVAD. Si existe una desviación significativa de este hacia la izquierda, se debe considerar disminuir el flujo a través del LVAD. Finalmente, el uso de asistencia ventricular derecha y soporte mecánico circulatorio estaría indicado en aquellos pacientes que continúan en choque a pesar de las terapias mencionadas42,43.
D2: driveline infectado
Las infecciones son un «talón de Aquiles» en los LVAD. Estas pueden ser específicas de los LVAD (infección de la cánula, la bomba, el injerto de salida o el cable) o relacionadas (endocarditis, bacteriemia, mediastinitis, etc.)12. Representan la principal causa de hospitalización en el primer año después del implante y alrededor de un 20% de los pacientes presentarán una infección del dispositivo durante el seguimiento3,12.
Todos los componentes del dispositivo son susceptibles de infectarse, la infección más común es la del cable percutáneo (49% de los casos), seguida por infecciones locorregionales y de la bomba, en un 37 y un 14%, respectivamente44. El germen más aislado es el Staphylococcus aureus, aproximadamente en 56% de los casos, pero la infección también puede ser causada tanto por gérmenes gram positivos como por gram negativos45,46.
Es imperativo evaluar la integridad y el sitio de salida del cable percutáneo en la pared abdominal. Ante la sospecha, se debe tomar un set de hemocultivos y procurar hacer cultivos de las colecciones locales para caracterizar el germen causante. En caso de enfermedad sistémica o sepsis, se deben iniciar antibióticos intravenosos empíricos que cubran cocos gram positivos y enterobacterias, teniendo presentes los perfiles de resistencia locales12.
Conclusiones
Los LVAD son una terapia cada vez más frecuente y que demanda entrenamiento del personal de urgencias. Son el resultado de más de cincuenta años de investigación en soporte mecánico circulatorio y son útiles en pacientes con falla cardiaca avanzada como puente al trasplante o terapia definitiva. Su atención es diferencial, incluyendo un método distinto para toma de presión arterial. Tienen complicaciones frecuentes asociadas a su funcionamiento, entre la que se incluyen accidente cerebrovascular isquémico y hemorrágico, trombosis, infección del dispositivo, sangrado significativo, RHF y alteración de la conciencia, reunidas en la mnemotecnia A2B2C2D2. Cada una tiene un abordaje específico, que incluye el inicio de compresiones torácicas en caso de ausencia de respuesta a estímulos y respiración ausente o anormal, mientras se confirma el funcionamiento del dispositivo. Finalmente, cada una de estas intervenciones debe ser balanceada con la consideración de redirigir los esfuerzos terapéuticos, si es necesario, en aquellos pacientes cuya indicación es netamente paliativa.