Introducción
La hipertensión arterial (HTA) es el desorden cardiovascular más común tanto en países desarrollados como en vías de desarrollo, con una prevalencia global aproximada de 17.5%1. En Latinoamérica, la prevalencia de HTA varía entre 9 a 29% y los porcentajes de pacientes tratados y controlados se mantienen inaceptablemente bajos2. En Colombia, el estudio Tornasol II describe una prevalencia de 27.3% en el año 20123.
Los malos resultados en el control de la HTA obedecen fundamentalmente a sistemas sanitarios inadecuados no enfocados en atención primaria, con recursos financieros limitados y falta de priorización en la atención de enfermedades crónicas4.
La HTA resistente (HTAR) se define como la presión arterial (PA) que se mantiene por encima de la meta, en pacientes en quienes se ha confirmado la toma de tres o más antihipertensivos a la máxima dosis tolerada (uno idealmente un diurético). La definición contempla excluir individuos con cifras de presión elevadas debido a efecto de bata blanca, inadecuada medida de la PA o incumplimiento de medicación5.
En los ensayos clínicos que describieron inicialmente la HTAR, fue posible la titulación progresiva de las dosis de antihipertensivos, el uso progresivo de asociaciones y el monitoreo estricto de la adherencia; reportan frecuencias de HTAR de 8.4 a 12.9%6.
En estudios poblacionales se ha estimado la prevalencia de HTAR evaluando el número de pacientes con presión no controlada, que toman tres o más antihipertensivos. Un estudio realizado por Falaschetti et al.7 en Inglaterra, determinó el número de pacientes no controlados con tres o más medicamentos antihipertensivos, lo sumó a los pacientes que reciben cuatro o más antihipertensivos y reportó una prevalencia de 12%7.
Finalmente, existen estudios poblacionales en los que específicamente se ha buscado identificar HTAR. Egan et al.8, encontraron una prevalencia de 11.8%8 mientras que Ma et al., encontraron en China una prevalencia de 1.9%9.
En el Perú, un estudio realizado en el Hospital de Policía, encontró una prevalencia de HTAR de 9.7%10.
La justificación de nuestro estudio es la variabilidad en la metodología y los resultados de los estudios respecto a la prevalencia estimada de HTAR, con limitaciones en cuanto a la representatividad de la muestra, la no evaluación del tratamiento óptimo y el efecto de bata blanca. Por tal razón, nuestra inquietud es estudiar la frecuencia de HTAR en una población de hipertensos atendidos en los establecimientos de EsSalud de la ciudad de Chimbote, evaluando, en primer lugar, el tratamiento óptimo y utilizando como herramienta la monitorización ambulatoria de presión arterial (MAPA), para evaluar con mayor precisión el control de HTA excluyendo el efecto de bata blanca. También pretendemos evaluar en los pacientes con HTAR el comportamiento circadiano de la PA, el riesgo cardiovascular global, la presencia de síndrome metabólico y la frecuencia de hipertrofia ventricular izquierda (HVI). Estos conocimientos permitirán determinar si la presencia de HTAR, es importante para establecer estrategias de manejo en este grupo de pacientes.
El objetivo del estudio fue determinar la frecuencia de HTA resistente en hipertensos atendidos en establecimientos de una Red Asistencial en la ciudad de Chimbote, Perú, y determinar la asociación de los siguientes factores con la presencia de HTA resistente: edad, sexo, comportamiento circadiano de la presión arterial, obesidad central, síndrome metabólico, riesgo cardiovascular global, riesgo de apnea del sueño e HVI.
Materiales y método
Se llevó a cabo un estudio transversal analítico, en el que se incluyeron 5.886 pacientes mayores de 18 años con diagnóstico de HTA esencial, atendidos en los consultorios de hipertensión arterial y cardiología de los establecimientos de EsSalud Chimbote, Perú (Hospital III, Hospital I Cono Sur y Policlínico Metropolitano).
Se obtuvo una muestra de 132 pacientes utilizando en la fórmula una prevalencia de HTAR de 9.7% con un nivel de confianza del 95% y un nivel de precisión del 5%.
Se realizó un muestreo aleatorio simple.
Se obtuvo el listado de pacientes con diagnóstico de hipertensión arterial (CIE 10 I10.X) y/o cardiopatía hipertensiva (CIE10 I11.9) de la unidad de informática de la red asistencial.
De la base de datos se seleccionó por números aleatorios a 152 pacientes (15% extra a la muestra, teniendo en cuenta llamadas no contestadas, no aceptación a participar y criterios de exclusión), Se procedió a llamarlos vía telefónica, a invitarlos a participar del estudio y a citarlos para la primera entrevista.
Se incluyeron pacientes mayores de 18 años con diagnóstico de HTA, atendidos en los consultorios de HTA y cardiología de los establecimientos de EsSalud Chimbote (Hospital III, Hospital I y Policlínico Metropolitano), y se excluyeron pacientes con diagnóstico de hipertensión secundaria, mujeres gestantes y mujeres en periodo de lactancia, así como pacientes con enfermedad renal crónica con estadios III b o más graves.
PROCEDIMIENTOS Y TÉCNICAS
Se hizo la evaluación y el seguimiento de los pacientes desde agosto del 2016 a septiembre del 2018.
Luego de contactar vía telefónica a los pacientes elegidos aleatoriamente y que aceptaron participar del estudio, se los citó al consultorio de cardiología del Hospital III o a los consultorios del programa de HTA en los establecimientos de atención primaria. En esta primera cita se revisó la historia clínica digital del paciente para determinar los criterios de exclusión.
Igualmente, en esta cita se solicitó el consentimiento informado y se procedió al llenado del formulario de recolección de datos en el que se consignaron: edad, sexo, tiempo en años desde el diagnóstico de hipertensión, presión arterial sistólica y diastólica, número de antihipertensivos en uso, tipo de antihipertensivos usados, diagnóstico previo de diabetes, enfermedad renal, enfermedad arterial periférica, enfermedad coronaria o enfermedad vascular cerebral y aneurisma abdominal aórtico. También se les tomó peso, talla, perímetro abdominal y presión arterial.
Adicionalmente, se les solicitaron a los siguientes exámenes de laboratorio: creatinina sérica, glucosa, colesterol total, HDL colesterol, triglicéridos, microalbuminuria en muestra de orina aleatoria y creatinina en orina aleatoria que fueron procesados en el laboratorio del Hospital III por métodos automatizados con el analizador de química clínica cobas c 501 de Roche. Posteriormente, fueron citados para una segunda evaluación en 15 a 30 días con los resultados de laboratorio.
La PA se tomó en ambos brazos con un monitor automático de presión arterial digital OMROM HEM-7130, validado según el protocolo internacional de la sociedad Europea de HTA11. Para la toma de PA se siguieron las recomendaciones de la Guía Europea de Hipertensión Arterial12.
En 15 a 30 días después de la primera evaluación, se citó a los pacientes para evaluar los exámenes solicitados y se determinó la presencia de enfermedad renal utilizando el valor de creatinina sérica en la ecuación CKD Epi para calcular la tasa de filtración glomerular13. Si el paciente presentó una depuración de creatinina menor a 35 ml/min/1.73 cm2 fue excluido del estudio, se optimizó la terapia antihipertensiva, así como sus otros factores de riesgo, y se le consiguió una cita en nefrología para continuar su tratamiento.
A los pacientes que continuaron el estudio, se les aplicó el cuestionario de Berlín para la valoración de riesgo de presentar apnea del sueño y se les programó una ecocardiografía.
Se determinó clínicamente si el paciente tenía HTA controlada (PA < 140/90 mmHg12 o no controlada, y si el tratamiento fue óptimo respecto al número de antihipertensivos y dosis.
En los pacientes con tratamiento adecuado y HTA controlada se procedió a programarlos para evaluación de adherencia y MAPA.
En los pacientes con tratamiento inadecuado y/o HTA no controlada, se optimizó el tratamiento de acuerdo con las recomendaciones de la guía Europea de HTA12 y fueron reevaluados cada dos semanas para determinar si se logró la meta de tratamiento antihipertensivo. Se definió dosis óptima a la prescripción del 50% o más de la dosis máxima de medicamento antihipertensivo14.
A todos los pacientes en cada cita se les brindó educación acerca de cambios de estilo de vida, asesoramiento nutricional e importancia de la adherencia al tratamiento.
Para evaluar la adherencia, a todos los pacientes se les aplicó el test de Morinsky-Green validado por Val Jiménez15.
Todos los pacientes, una vez optimizado su tratamiento y evaluada la adherencia, fueron programados para un MAPA.
Se utilizó el equipo de MAPA Ultralite 90217 de SPACELABS, validado por la Sociedad Europea de HTA16. Así mismo, se usó el protocolo señalado en la Guía de MAPA de la Sociedad Europea de Hipertensión Arterial. Con los resultados del MAPA se determinó el índice de presión noche/día que se calculó dividiendo el promedio de la presión sistólica y diastólica nocturna sobre diurna y se obtuvo el patrón circadiano de presión arterial del paciente de acuerdo con las siguientes opciones17:
– Normal o dipper: índice presión noche/día sistólico y diastólico < 0.9 y > 0.8 (caída de PA sistólica y diastólica promedio de 10 a 20% durante la noche).
– Dipper reducido: índice PA noche/día > 0.9 y < 1 (caída de la PA de 1 a 10% durante la noche).
– No dipper: índice PA noche/día ≥ 1 (no reducción o incremento de la PA durante la noche).
– Dipper extremo: índice PA noche/día < 0.8 (caída de más del 20% de la presión durante la noche).
Luego de la realización de todo este protocolo de evaluación, se definió como HTAR a la medida de la presión en consultorio ≥ 140/90 mmHg más un promedio de PA en 24 horas ≥ a 130/80 mmHg18 y/o un promedio de PA diurna ≥ 135/85 y/o un promedio de PA nocturna ≥ 120/70 mmHg19, en quienes se ha confirmado la toma de tres o más antihipertensivos en dosis óptimas y la adherencia al tratamiento. Se excluyeron de la definición, pacientes que en los exámenes de función renal obtuvieron una tasa de filtración glomerular menor a 45 ml/min/1.73 m2 (estadios IIIB a más) por asociarse a mecanismos secundarios de elevación de la presión arterial20.
Para estimar el riesgo global de enfermedad cardiovascular se utilizó la Sex Specific Pooled Cohort Equation, recomendada por el ACC/AHA en 201321. Se clasificó a cada sujeto como de riesgo bajo (< 7.5%) y riesgo alto (> 7.5%). Se incluyeron aquellos sujetos con condiciones de riesgo “equivalentes” de enfermedad coronaria en el estrato de alto riesgo, para lo cual se consideraron las siguientes condiciones de riesgo «equivalentes» de enfermedad coronaria: enfermedad vascular periférica, aneurisma abdominal aórtico y enfermedad de la arteria carótida22.
Se definió la presencia de síndrome metabólico con los datos de perímetro abdominal, colesterol HDL, triglicéridos, glucosa y PA obtenida clínicamente, según criterios ya señalados. Para definir síndrome metabólico se usó la definición del consenso de la International Diabetes Federation Task Force on Epidemiology and Prevention, National Heart, Lung and Blood Institute; American Heart Association, World Heart Federation; International Atherosclerosis Society and International Association for the Study of Obesity23, para lo cual el paciente debió presentar tres o más de los siguientes criterios:
– Triglicéridos ≥ 150 mg/dl o tratamiento farmacológico para hipertrigliceridemia.
– HDL colesterol < 40 mg/dl en hombres y < de 50 mg/dl en mujeres.
– Presión arterial ≥ a 130 mmHg de sistólica o ≥ 85 mmHg de diastólica o tratamiento farmacológico antihipertensivo.
– Glicemia en ayunas mayor de 100 mg/dl o tratamiento para la diabetes.
– Circunferencia abdominal: se consideró elevado ≥ 94 cm en hombres ≥ 92 en mujeres (Definición para la población latinoamericana basada en el estudio del Dr. Pablo Ashner)24.
Se determinó el riesgo de tener apnea del sueño a través del cuestionario de Berlín traducido y validado en población de habla hispana25.
Se realizó la ecocardiografía en la Unidad de cardiología del Hospital III EsSalud Chimbote. Los estudios fueron realizados por el staff de cardiólogos de la unidad con el ecocardiógrafo Toshiba Xario, siguiendo los lineamientos de la American Society of Echocardiography (ASE)26. Se realizaron las mediciones siguiendo los lineamientos del software de análisis de medidas y función ventricular del ecógrafo y se obtuvo automáticamente la masa ventricular indexada calculada por el equipo según la fórmula de Devereux, recomendada por ASE en su guía para cuantificación de cavidades cardiacas26.
Se utilizó como criterio para definir HVI la masa ventricular izquierda indexada por superficie corporal según la Sociedad Americana de Ecocardiografía (ASE); en mujeres una masa ventricular izquierda mayor a 95 mg/m2 y en varones26 mayor a 116 mg/m2.
El análisis estadístico se realizó con el software estadístico STATA MP 13. Se obtuvieron medidas descriptivas de frecuencia y proporción de HTAR, así como de las variables de comportamiento circadiano de presión arterial, síndrome metabólico, riesgo cardiovascular global, riesgo de apnea del sueño, hipertrofia ventricular izquierda y su gravedad, tanto en el grupo con HTAR como en el grupo sin HTAR. Para las variables masa ventricular izquierda y tiempo de hipertensión se obtuvo promedio y desviación estándar. Para el análisis inferencial se usó el test Chi2 o exacto de Fisher para evaluar diferencias entre variables categóricas y el test t para variables continuas. Se utilizó un test de regresión logística para determinar los factores asociados a HTAR con un nivel de significancia de 0.05.
ASPECTOS ÉTICOS
Tanto el proyecto como el formato de consentimiento informado, fueron evaluados y aprobados para su ejecución por el comité de ética de la Universidad Peruana Cayetano Heredia. Durante la ejecución del estudio se tuvo en cuenta el respeto por los participantes, así como el derecho de los sujetos a la privacidad y confidencialidad de los datos.
Resultados
Se evaluaron 146 pacientes, 4 de los cuales fueron excluidos por depuración de creatinina menor de 45 ml/min/1.73 m2, 9 abandonaron el estudio y uno fue excluido al no colaborar para realizarle el MAPA.
El promedio de edad fue de 70.4 ± 1.72 años, 57.6% fueron mujeres, 25% (33 pacientes) presentaba, además, diabetes mellitus 2; 63.6% (84 pacientes) tenía síndrome metabólico, 79.5% (105 pacientes) alto riesgo cardiovascular, 8.3% (11 pacientes) presentó enfermedad vascular cerebral (EVC), 5.3% (7 pacientes) enfermedad coronaria y 28% (37 pacientes) hipertrofia ventricular izquierda (HVI).
El tiempo promedio de tratamiento antihipertensivo recibido por los pacientes fue de 12.6 ± 1.62 años. El 75.8% (100 pacientes) tenía la PA controlada en la primera evaluación en el consultorio.
El 61.4% (81 pacientes) recibía monoterapia y el medicamento más usado fue losartán en 45.5% (60 pacientes); 28% (37 pacientes) recibió 2 fármacos antihipertensivos, 6.8% (9 pacientes) 3 fármacos, 3% (4 pacientes) 4 fármacos y 0.8% (1 paciente) 5 fármacos. El 27.3% (36 pacientes) recibía esquemas antihipertensivos inadecuados durante la primera evaluación, por lo que fue necesario optimizar el tratamiento antihipertensivo y realizarles seguimiento hasta lograr alcanzar las metas. En el 16.2% (21 pacientes) en los que se encontró presión arterial controlada en consultorio, se hallaron cifras de presión no controladas en el MAPA (patrón de hipertensión enmascarada), por lo que fue necesario optimizar el tratamiento (Fig. 1).
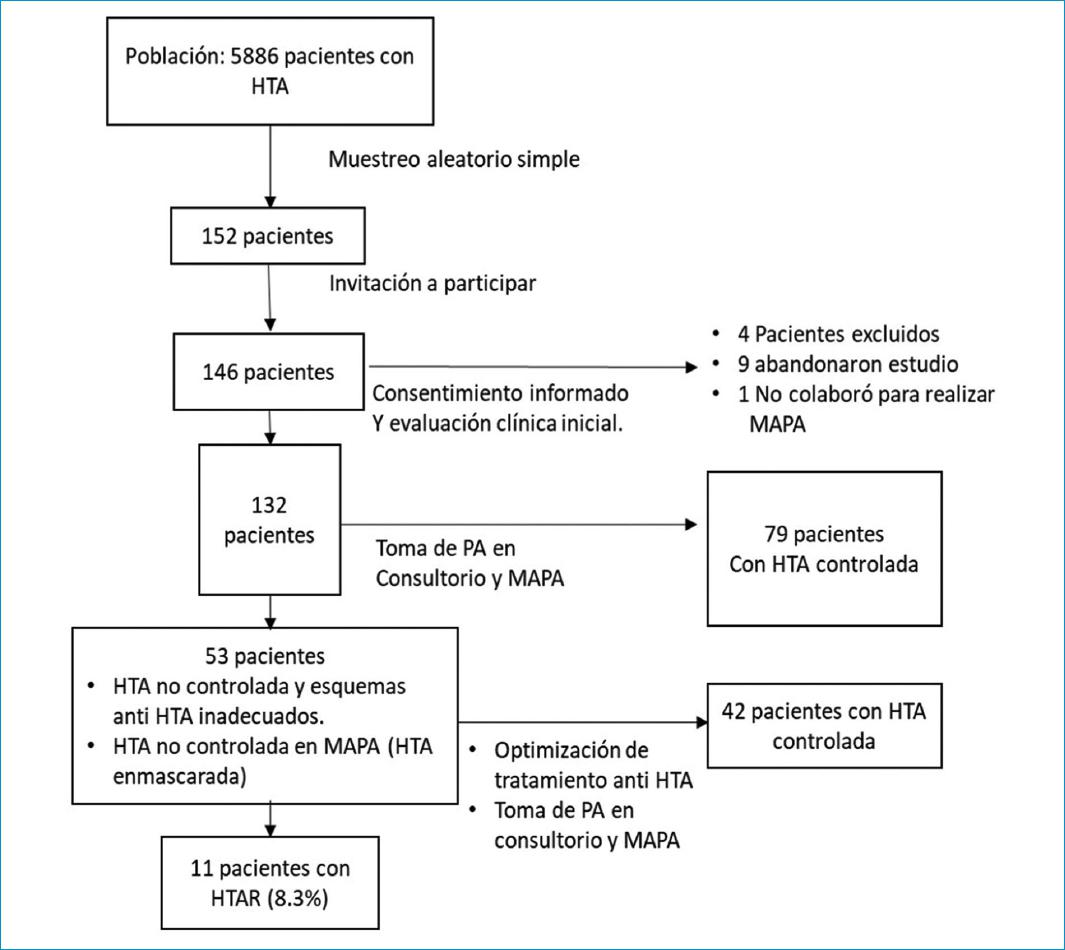
Figura 1 Flujograma de seguimiento a pacientes con diagnóstico de HTA en establecimientos de red asistencial para determinar HTAR.
En 42 (79.2%) de los 53 pacientes en quienes fue necesario optimizar el tratamiento, se logró el control de la PA. El 8.3% (11 pacientes) cumplió con los criterios de HTAR y sus características clínicas fueron las siguientes: 7 (63.7%) pacientes con HTAR presentaron un patrón circadiano no dipper en MAPA; 11 (100%) de los pacientes con HTAR tuvieron riesgo cardiovascular alto; 9 (81.8%) tuvieron criterios de síndrome metabólico; 9 (81.8%) tuvieron alto riesgo de presentar apnea del sueño; y 6 (54.5%) presentaron HVI.
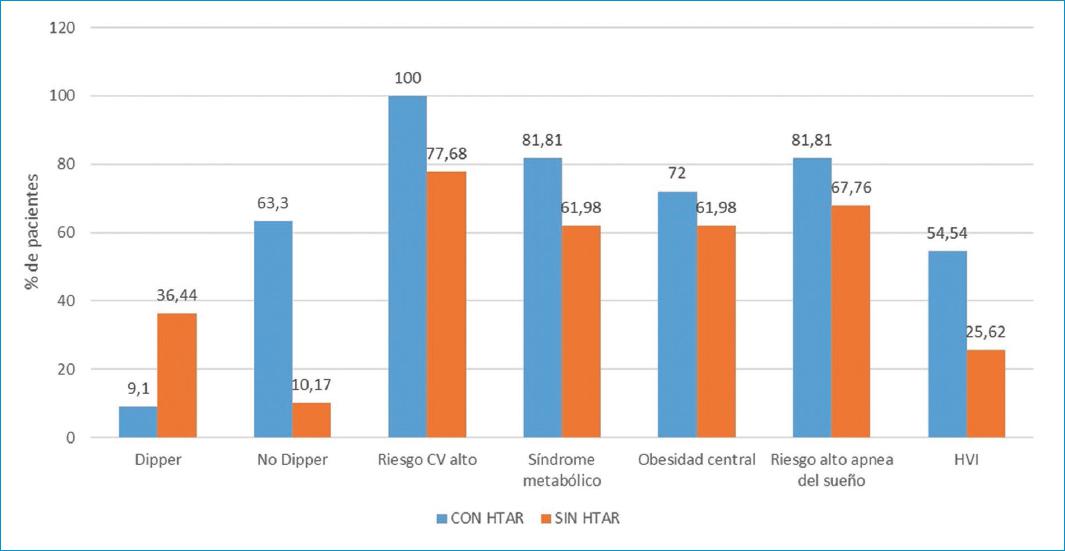
Las características clínicas y el análisis bivariado en los pacientes con HTAR o sin HTAR se aprecian en la tabla 1 y la figura 2. Se presentó mayor frecuencia de obesidad central, síndrome metabólico, riesgo cardiovascular alto, riesgo alto para apnea del sueño e hipertrofia ventricular izquierda en los pacientes con HTAR, pero sin significancia estadística.
Tabla 1 Características clínicas de pacientes con HTAR
| Características cínicas | Con HTAR% | Sin HTAR% | p |
|---|---|---|---|
| Edad | 76.73 | 69.85 | 0.029* |
| Comportamiento circadiano de PA | 0.0001† | ||
| Dipper (%) | 9.1 | 36.44 | |
| Dipper disminuido (%) | 27.27 | 50 | |
| No dipper (%) | 63.63 | 10.17 | |
| Dipper extremo (%) | 0 | 3.39 | |
| Riesgo cardiovascular (CV) global alto | 100 | 77.68 | 0.079† |
| Perímetro abdominal (cm) | 95.92 | 95.33 | 0.98* |
| Síndrome metabólico (%) | 81.81 | 61.98 | 0.19† |
| Obesidad central (%) | 72 | 61.98 | 0.746† |
| Riesgo alto de apnea del sueño | 81.81 | 67.76 | 0.335† |
| Hipertrofia ventricular izquierda (%) | 54.54 | 25.62 | 0.041† |
*Test t.
†Chi².
El análisis multivariado realizado con regresión logística se observa en la tabla 2. Se encontró relación solo entre HTAR y presencia de comportamiento circadiano no dipper.
Discusión
La población de hipertensos de nuestro estudio presenta una característica muy peculiar con una edad promedio de 70.43 ± 1.72 años, una edad superior al promedio de otros estudios. Gianattasio en Italia informa una edad promedio de 64.3 ± 10.5 años27, y Ma en China una edad promedio de 61 ± 12.3 años9.
Otra característica de la población de nuestro estudio es el elevado porcentaje de pacientes con alto riesgo cardiovascular (79.55%) y síndrome metabólico (63.64%).
En nuestro estudio, la frecuencia de HTAR fue del 8.33%, cifra similar a la de algunos estudios, pero dispar en otros. Por ejemplo, Noubiap et al.28, en un metaanálisis de estudios epidemiológicos de países de todos los continentes, encontraron una frecuencia de HTAR de 10.3%; Egan et al.8, utilizando datos de NHANES (National Health and Nutrition Examination Survey), encontraron una prevalencia de 11.8%8. Simm et al.29, al estudiar pacientes del Kaiser Permanente Southern California Health System, encontraron una prevalencia de 12.8%; en estos estudios no se contempló el efecto de bata blanca ni la optimización de la terapia. Sinnot et al.30, encontraron una prevalencia de 6.44% en un estudio de Cohorte en el Reino Unido utilizando una base de datos la National Clinical Practice Research Database (CPRD-GOLD)30. En este estudio tampoco se evaluó la optimización de terapia ni el efecto de bata blanca. Weng Ma et al.9, en un estudio realizado en China, encontraron una prevalencia de 1.9%9; en este estudio, a diferencia de los anteriores, se optimizó la terapia con un programa de cinco pasos en el que se titularon progresivamente los antihipertensivos, desde monoterapia con felodipino, hasta el uso de cuatro medicamentos en dosis máxima (felodipino, inhibidor de la enzima convertidora de angiotensina [IECA], hidroclorotiazida y metoprolol), pero se excluyeron pacientes con enfermedad cardiovascular. Optimizar el tratamiento antes de evaluar el control de la presión arterial da mayor validez para estimar la prevalencia de HTAR, pero la exclusión de pacientes con enfermedad cardiovascular puede subestimar la prevalencia. En el Perú, un estudio realizado en el Hospital de Policía encontró una prevalencia de HTAR de 9.7%. En este estudio no se seleccionó una muestra aleatoria y tampoco se evaluó el tratamiento óptimo, la adherencia ni el efecto de bata blanca10.
Nuestro estudio tiene la cualidad de selección aleatoria de la muestra; excluir pacientes con efecto de bata blanca, ha permitido confirmar la adherencia, el tratamiento óptimo y una mejor evaluación del comportamiento de la presión en 24 horas. Es así como, aproximadamente la mitad de los pacientes con HTA resistente presentó cifras de presión no controladas sólo durante la noche. Una limitación es que no se puede excluir a pacientes con apnea del sueño al no contar con estudio de polisomnografía. Con relación a este punto, está demostrada la relación entre apnea del sueño con HTAR31 y apnea del sueño como causa secundaria más común de HTAR32.
En nuestro estudio se encontró mayor perímetro abdominal, mayor frecuencia de síndrome metabólico, riesgo cardiovascular alto, riesgo alto para apnea del sueño e hipertrofia ventricular izquierda en los pacientes con HTAR, pero sin significancia estadística. Estos resultados confirman lo encontrado por otros autores, como Ma et al.32, quienes encuentran mayor frecuencia de obesidad y síndrome metabólico en los pacientes con HTAR. Por su parte, de la Sierra33 encuentra que los pacientes con HTAR tuvieron un peor perfil de riesgo cardiovascular y Gaozhen Cao34 reporta también mayor HVI en los pacientes con HTAR.
En nuestro estudio se halló relación entre HTAR y comportamiento circadiano no dipper, lo cual coincide con estudios como el de Irvin et al.35, quienes afirman que la que la HTAR está asociada a hipertensión nocturna y patrón circadiano no dipper.
Una limitación de nuestro estudio es el tamaño de la muestra obtenida para determinar la frecuencia de HTAR, muy pequeña para establecer la asociación entre variables.
Concluimos que nuestro estudio muestra una frecuencia de HTAR similar a la de la mayoría de estudios, pero con un porcentaje importante de pacientes con cifras de PA no controlada durante la noche (hipertensión nocturna) asociada a patrón circadiano no dipper.