Introducción
La amiloidosis cardiaca es una enfermedad caracterizada por el depósito de material amiloide en la matriz extracelular del miocardio1. La ATTR, por su parte, se caracteriza por el depósito de la proteína transtirretina, la cual puede estar desencadenada por la mutación del gen TTR o ser adquirida con la edad2. La prevalencia estimada de ATTR es de 1 en 100.000 personas en los Estados Unidos3. Su presentación clínica es heterogénea, en cuyo caso la arritmia auricular más frecuente es la FA4. A pesar de haber sido descrita hace más de 150 años, sigue siendo un reto diagnóstico, ya que pasa inadvertida en diferentes escenarios, como arritmias, valvulopatías, cardiopatía isquémica, hipertrofia ventricular izquierda, y es diagnosticada de manera tardía5-7. En conjunto con la presentación de este caso clínico, se hace una revisión de la literatura sobre la relación entre amiloidosis cardiaca, específicamente ATTR, y FA, con el fin de comprender más ampliamente esta asociación y lograr identificarla de modo fácil y oportuno.
Caso clínico
Paciente masculino de 68 años, con antecedente de liberación del túnel carpiano y engatillamiento del primero y quinto dedos de la mano derecha; hipotiroidismo e hipertensión arterial. Consultó al servicio de urgencias por cuadro de diez días de disnea de pequeños esfuerzos, ortopnea y bendopnea. Ingresó en buenas condiciones generales, presión arterial 154/117 mmHg, frecuencia cardíaca (FC) 107 lpm, frecuencia respiratoria 26 rpm, saturación de oxígeno del 96%. Electrocardiograma (ECG) en ritmo de FA. Se enfoca como insuficiencia cardiaca descompensada secundaria a FA de novo.
Se realizó un ecocardiograma transesofágico (ETE), el cual reportó ventrículo izquierdo de diámetros normales, con hipertrofia concéntrica moderada, fracción de eyección del ventrículo izquierdo (FEVI) del 36%, aurícula izquierda (AI) con dilatación moderada (41 mm) y ausencia de trombos en la orejuela izquierda.
Había sido estudiado dos meses atrás con ecocardiograma de estrés, el cual fue negativo para inducción de isquemia y reportó FEVI del 60%.
Ante la reducción de la FEVI, se sospechó posible taquicardiomiopatía por FA, por lo cual se llevó a cardioversión eléctrica con 200 Joules retornando a ritmo sinusal. Fue dado de alta con succinato de metoprolol 50 mg/día, espironolactona 25 mg/día, sacubitril/valsartán 50 mg cada 12 h, amiodarona 200 mg/día y apixabán 5 mg cada 12 horas.
Tres meses más tarde reingresó por disnea de esfuerzo y disconfort torácico, en ritmo de FA. El ecocardiograma trastorácico documentó una FEVI del 55% y septum interventricular de 13 mm, sin trastornos contráctiles. Se realizó nueva cardioversión eléctrica con 200 Joules y aislamiento eléctrico de venas pulmonares, retornando a ritmo sinusal. Fue dado de alta con sustitución de amiodarona por dronederona 400 mg cada 12 horas.
Cinco meses después consultó por cuadro de una semana de palpitaciones, disnea de pequeños esfuerzos y edema en miembros inferiores. El ECG nuevamente en ritmo de FA. Se realizó nuevo ecocardiograma transtorácico en el que se evidenció hipocinesia global grave y FEVI del 25%. Se ordenó angiotomografía cardíaca para valorar la integridad de las venas pulmonares con el objetivo de llevar a un segundo procedimiento de aislamiento eléctrico de venas pulmonares; sin embargo, esta última refirió hipertrofia de la pared septal de 17 mm y posible amiloidosis vs. miocardiopatía hipertrófica (Fig. 1). Ante el hallazgo tomográfico fue llevado a resonancia magnética (RM) cardiaca contrastada en la cual se documentó disfunción sistólica biventricular (FEVI 35% y TAPSE 8 mm), dilatación biauricular, alteración de la cinética entre el pool sanguíneo y el miocardio, realce subendocárdico difuso con distribución no coronaria con extensión al ventrículo derecho y ambas aurículas, y aumento grave del volumen extracelular (51%), hallazgos que fueron compatibles con amiloidosis cardiaca (Fig. 2).
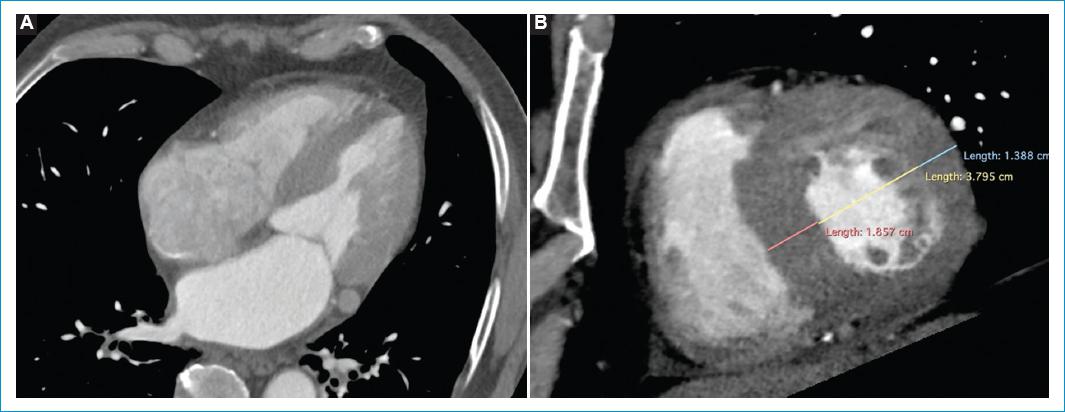
Figura 1 Angiotomografía de arterias coronarias en 75% del intervalo R-R con reconstrucción multiplanar en cuatro cámaras (A) y eje corto (B) demuestra dilatación biauricular e hipertrofia grave del septum interventricular y de la pared lateral del ventrículo izquierdo.
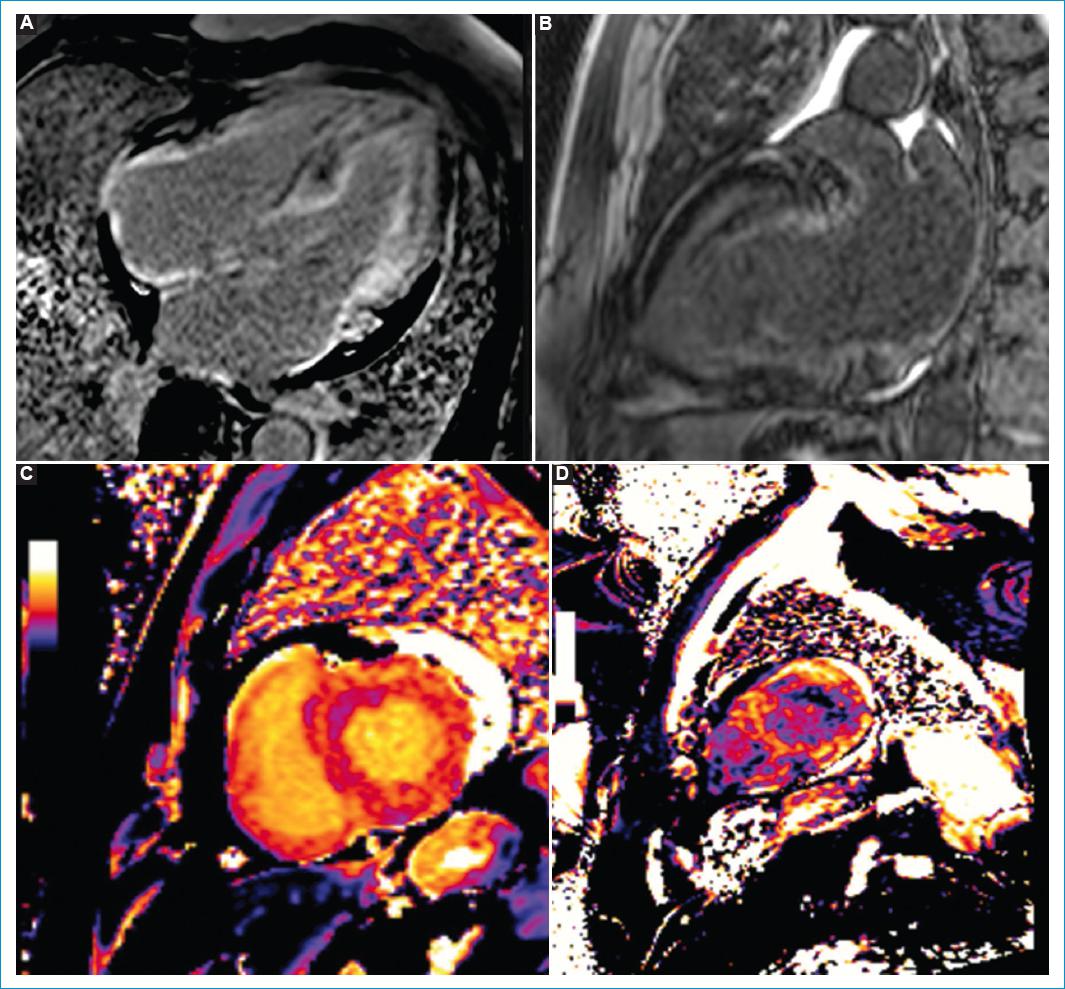
Figura 2 Las secuencias de realce tardío de resonancia magnética cardiaca a los 5 (A) y 10 minutos (B) demuestran: 1. Alteración en la cinética de gadolinio con disminución difusa de la señal del pool sanguíneo, incluso en las imágenes obtenidas de manera temprana. 2. Realce difuso de predominio subendocárdico biventricular y biauricular. Las imágenes de caracterización tisular con mapa T1 pre (C) y poscontraste (D) demuestran aumento difuso del T1 nativo y aumento grave del volumen extracelular cuantificado en 51%.
Los estudios de gammapatía monoclonal fueron negativos y la gammagrafía con tecnesio pirofosfato fue compatible con amiloidosis de tipo transtirretina por índice de Perugini de 3 (Fig. 3).
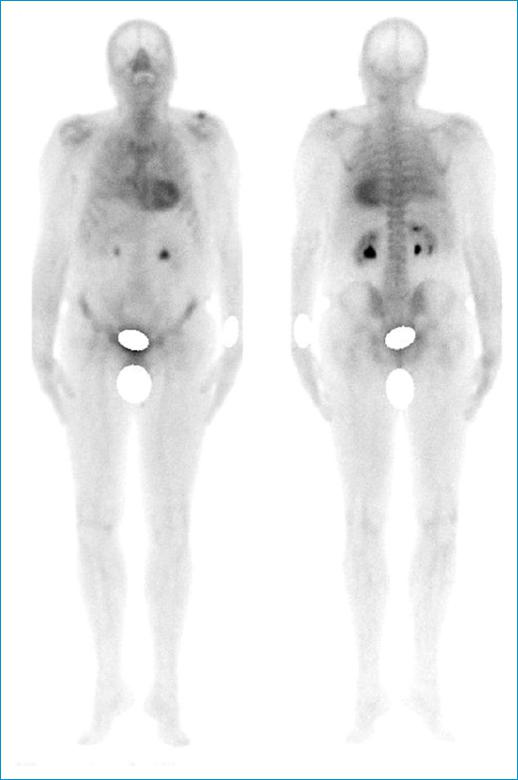
Figura 3 Gammagrafía con pirofosfato marcado con tecnecio-99m. Se observa relación entre la captación del miocardio y las costillas mayor a 2, compatible con índice de Perugini 3.
Se decidió llevar a ablación de haz de His e implante de resincronizador cardíaco como manejo definitivo de FA refractaria; sin embargo, previo al procedimiento retornó espontáneamente a ritmo sinusal, por lo cual se definió nuevo aislamiento eléctrico de venas pulmonares y del istmo cavotricúspide. El análisis molecular de la secuencia del gen TTR en busca de mutación fue negativo. Se dio egreso en ritmo sinusal, bajo anticoagulación, terapia antiarrítmica oral, manejo de falla cardiaca y tafamidis 61 mg cada día.
Discusión
“La miocardiopatía amiloide: una cebra que se esconde a simple vista”.
Frederick L. Ruberg8
La amiloidosis cardiaca hace parte de un grupo de enfermedades de origen hereditario o adquirido que se caracteriza por el depósito de amiloide en la matriz extracelular del miocardio1. Este depósito de material insoluble conlleva cambios en la anatomía miocárdica, entre ellos, aumento en el grosor de la pared del ventrículo izquierdo, alteración en la relajación y reducción de su función sistólica9. El término «amiloide» deriva de la palabra latina «amylym» que traduce almidón; fue el patólogo alemán, Rudolf Ludwing Carl Virchow quien, en 1854, la introdujo por primera vez en la literatura médica debido a sus características de tinción con yodo similar al almidón2,10. En décadas posteriores, con la introducción de la tinción rojo Congo, se descubrió que tenía una birrefringencia verde manzana bajo luz polarizada, con una estructura de pliegues beta, determinándose así que el «amiloide» era de origen proteico11.
Se han descrito más de treinta proteínas implicadas en la amiloidosis cardiaca, caso en el que el depósito de transtirretina (ATTR) y de cadenas ligeras de inmunoglobulina (amiloidosis AL) son los causantes de más del 95% de todas las amiloidosis cardiacas2. La ATTR puede estar relacionada con una mutación del gen TTR (también llamada ATTR hereditaria, variante mutante, familiar o ATTRv, por su sigla en inglés) o ser de tipo salvaje (también llamada ATTR senil, no hereditaria o ATTRwt, por su sigla en inglés)2.
Si bien la rareza de la miocardiopatía amiloidótica es innegable y es reconocida por diversos autores como una “cebra que se esconde a simple vista”, poco a poco se ha tornado mucho más común de lo que se piensa3. Es por esto que esta revisión está enfocada en la ATTR y su asociación con FA, al ser la taquiarritmia auricular más frecuente.
Epidemiología
Se estima que la prevalencia de ATTRv en Estados Unidos es de 1 en 100.000 personas11. La FA es la arritmia sostenida más común en adultos y está presente entre un 104 a un 70% de los pacientes con amiloidosis cardiaca (AC), lo cual la convierte en la alteración del ritmo más común12. Se ha estimado que la incidencia de FA en pacientes con AC es del 2.1% persona/año, siendo la edad, la dimensión y la presión media de la aurícula izquierda, al igual que el compromiso renal, variables independientes para su aparición4. La ATTRwt generalmente está confinada al corazón; no obstante, el síndrome del túnel del carpo y algunos trastornos musculoesqueléticos pueden preceder los síntomas cardiacos por 10 a 15 años13. La AC se ha relacionado con insuficiencia cardiaca con fracción de eyección preservada hasta en el 13 al 17% de los pacientes y 1 de cada 7 pacientes con estenosis aórtica sintomática grave que se someten a reemplazo valvular14. Existen datos de mayor riesgo de choque cardiogénico en pacientes con AC y FA en comparación con pacientes en ritmo sinusal15 y, a su vez, una fuerte asociación con insuficiencia cardiaca NYHA III-IV4.
Fisiopatología
El envejecimiento y las mutaciones amilogénicas desestabilizan las estructuras cuaternarias nativas de la transtirretina e inducen cambios conformacionales que conducen a la disociación de los tetrámeros en subunidades parcialmente desplegadas que, posteriormente, pueden autoensamblarse en fibrillas amiloides, depositándose en los tejidos2. La FA en la AC se debe a diversos mecanismos que incluyen daño celular inflamatorio, degradación celular y separación de los miocitos por las fibras de amiloide9. La miopatía auricular y el desarrollo de FA se deben al depósito de amiloide que interrumpe la conducción electroanatómica homogénea auricular; su toxicidad conlleva al desarrollo de fibrosis y estrés oxidativo, y la infiltración perivascular de los pequeños vasos desencadena isquemia miocárdica9. Además, su citotoxicidad produce disregulación de la señalización de calcio intracelular, que provoca la prolongación del potencial de acción junto con la denervación simpática cardiaca temprana, lo cual puede contribuir a la arritmogénesis14. Todos estos cambios secundarios a infiltración amiloide conllevan engrosamiento de la pared, no solo auricular sino también ventricular, alteración en la relajación y llenado restrictivo que conduce a dilatación auricular y predispone a la perpetuación y formación permanente de FA16. Estudios han demostrado deterioro de los tres componentes fásicos de la función auricular izquierda, correlacionándose con el deterioro progresivo y simultáneo de la función del ventrículo izquierdo17.
Factores de riesgo para el desarrollo de fibrilación auricular
En un estudio retrospectivo de 262 pacientes con AC, realizado por Longhi et al.4 se encontró que los pacientes con ATTRv que tenían mayor edad, clase funcional más avanzada (Clase III-IV NYHA), tasa de filtración glomerular (TFG) más baja, mayor diámetro auricular, mayor diámetro de fin de sístole y menor FEVI tuvieron mayor incidencia de FA, mientras que para la ATTRwt el único factor de riesgo asociado fue la edad avanzada, sin diferencias significativas en otros parámetros. En otro estudio retrospectivo de 133 participantes con AC18, se identificó que el índice de masa corporal y la TFG son factores de riesgo independientes para el desarrollo de FA, y que la sola presencia de ATTR es un fuerte predictor de FA, con un riesgo aumentado de hasta diez veces, por lo que se ha recomendado un cribado para FA oculta en pacientes con ATTR.
Manifestaciones clínicas
El espectro clínico de la ATTR puede ir desde pacientes asintomáticos diagnosticados incidentalmente, hasta pacientes con manifestaciones de insuficiencia cardiaca o trastornos de la conducción; el diagnóstico en etapas avanzadas es un factor importante para mortalidad19. En estados asintomáticos, la FA puede estar presente hasta en un 12.7% y tiene una probabilidad hasta del 11% de manifestarse a tres años20. El diagnóstico incidental de ATTR se ha descrito en estudios anatomopatológicos de valvulopatía mitral, cribado familiar, como vigilancia cardiaca en pacientes con polineuropatía5,20 e incluso en pacientes con FA refractaria, como en el caso descrito.
Cuando es sintomática se puede presentar con disnea de esfuerzo, ortopnea, disnea paroxística nocturna, distensión abdominal y edema de miembros inferiores19. El síncope puede deberse a bloqueo cardiaco o arritmias y es un indicador de mortalidad19. La muerte súbita cardiaca probablemente se deba a disociación electromecánica en lugar de arritmias ventriculares19. La ausencia del cuarto ruido cardiaco (secundario a disfunción mecánica auricular), la hipotensión, los mareos, la disfunción autonómica y la neuropatía periférica, así como la “normalización” de hipertensión previa, el síndrome de túnel carpiano, la estenosis espinal lumbar y la ruptura del tendón del bíceps2 pueden ayudar a sospechar ATTR.
Manifestaciones electrocardiográficas y electrofisiológicas
El depósito de amiloide interrumpe la conducción eléctrica auricular homogénea traduciéndose, desde el punto de vista electrocardiográfico, con una prolongación de la onda P17. Un estudio que comparó pacientes con AC con FA vs. pacientes sin AC con FA, encontró que los pacientes con AC tenían un intervalo AH y HV prolongado, y que la prolongación era mayor en ATTRwt en comparación con AL, además de la atenuación del voltaje eléctrico y la alta tasa de recurrencia de FA posablación21. Los bajos voltajes del QRS (amplitud del QRS < 0.5 mV en las derivaciones de las extremidades o índice de Sokolow < 1.5 mV) están presentes en un 20 a un 25% de los pacientes con ATTR. La sensibilidad de estos hallazgos es baja, de ahí que su ausencia no excluye el diagnóstico; el cociente del voltaje QRS/masa del VI puede ser una señal de alerta clínica para el diagnóstico22. Las ondas Q anchas y el patrón de pseudoinfarto en las derivaciones anteroseptal e inferior pueden presentarse hasta en un 70% de los casos22. En un estudio observacional, el aumento en la duración de la onda P (≥ 120 ms) estuvo presente en el 54% de los pacientes con ATTR; de estos el 16% tenía un bloqueo interauricular típico y un 10% era atípico23. Adicionalmente, por infiltración del sistema de conducción pueden presentarse bloqueos de primer grado, segundo grado o avanzados19. También se ha descrito un patrón isquémico con ondas T negativas y un electrocardiograma que puede ser normal24.
Riesgos asociados a ATTR
Riesgo trombótico
Donnellan et al.25, en un estudio de cohorte retrospectivo de 100 pacientes con ATTR que se sometieron a ETE antes de la cardioversión de la FA, documentaron persistencia de trombos en la orejuela auricular izquierda del 30%, porcentaje similar para aquellos con FA paroxística y persistente (24 y 29% respectivamente) y mayor en presencia de FA permanente (47%). El 32% eran pacientes con ATTRwt, mientras 24% presentaban amiloidosis ATTRv. Los trombos auriculares tuvieron una relación independiente con el puntaje de CHA2DS2-VASc; el 87% de los pacientes con evidencia de trombos auriculares ya recibían anticoagulación25, lo que denota el alto grado trombogénico de esta entidad. Un análisis multivariado identificó que la FA, el deterioro de la función diastólica del ventrículo izquierdo y la disfunción mecánica de la AI –indicada por una baja velocidad de vaciado de la AI–, fueron predictores independientes de trombosis intracardiaca26. En un estudio pequeño de 21 pacientes, de los cuales el 43% tenían ATTR, se observó trombosis persistente de la orejuela izquierda en 57% de los casos, aun en metas de anticoagulación, lo cual plantea la importancia de descartar trombosis auricular previo a cardioversión eléctrica a pesar de estar bajo terapia anticoagulante óptima27. Así mismo, en una población de 89 pacientes con amiloidosis cardiaca, 8.9% presentaron un accidente cerebrovascular (ACV) isquémico (6 AL y 2 ATTRwt) durante un seguimiento de 18 a 19 meses, 5 de estos estaban en ritmo sinusal (4 AL y 1 ATTRwt) y los 3 restantes tenían FA y recibían terapia anticoagulante28, por lo que se observa cómo, aún en ritmo sinusal y a pesar de terapia anticoagulante, el riesgo de ACV está latente. Por estos datos se plantea que, dadas las altas tasas de miopatía y trombosis auricular, se debe prescribir anticoagulación a todos los pacientes con amiloidosis cardiaca y FA, independiente de la puntuación de CHA2DS2-VASc14, no tan claro en pacientes con ritmo sinusal, aunque autores informan que ante alteración en la contractilidad auricular debería iniciarse anticoagulación por riesgo de trombosis in situ29.
Riesgo de sangrado
Los datos sobre la evaluación del riesgo hemorrágico son menos sólidos para ATTR que para amiloidosis AL21. En general, la anticoagulación suele tolerarse bien en estos pacientes29 y no hay datos claros en nuestra revisión de que la ATTR, por sí misma, aumente el riesgo de sangrado, así que consideramos que deberían seguirse las recomendaciones de las guías internacionales.
Diagnóstico
La presentación clínica y los hallazgos electrocardiográficos previamente expuestos son pasos iniciales al diagnosticar amiloidosis cardiaca. Recuérdese que el debut de la AC es heterogéneo y puede presentarse con manifestaciones cardiacas floridas, esconderse tras las sombras de una FA refractaria30 o tratarse de un hallazgo incidental en pacientes con arritmias auriculares que serían llevados a ablación con catéter7.
En cuanto a pruebas de imágenes, con el strain longitudinal relativo apical por ecocardiografía se ha reportado una sensibilidad del 93% y una especificidad del 82% para AC. Otros hallazgos ecocardiográficos incluyen dilatación biauricular, engrosamiento de la pared y del septum ventricular, engrosamiento valvular, disminución de la función diastólica y apariencia granular brillante del tejido miocárdico19. El realce con gadolinio por resonancia magnética cardiaca ha reportado una sensibilidad del 85% y una especificidad del 92% para el diagnóstico de AC30. Un hallazgo útil por resonancia magnética cardiaca para diferenciación de ATTR y amiloidosis AL es que en la primera hay valores más bajos en mapas de T1, junto con valores más altos en mapas de volumen extracelular (VEC) en comparación con amiloidosis AL31. A pesar de la precisión relativamente alta de estas pruebas, el diagnóstico puede pasarse por alto, principalmente en las primeras etapas de la enfermedad, de ahí que la biopsia endomiocárdica con tinción de rojo Congo sea el estándar de oro, aunque no siempre está disponible30.
En pacientes con AC sin diagnóstico previo de FA se ha sugerido la monitorización electrocardiográfica a través de Holter, con el fin detectar la FA de manera temprana e iniciar cuanto antes la terapia anticoagulante9.
Las imágenes obtenidas con pirofosfato marcado con tecnecio-99m, se utilizan para la detección de AC, con una sensibilidad mayor al 90% para el diagnóstico de ATTR32. Así mismo, el diagnóstico por este método se hará con una medición de la relación miocardio-contralateral en imágenes planares obtenidas 1 hora después de inyectar el trazador, siendo ≥ 1.5 positivo para ATTR1. El segundo método (Índice de Perugini) se basa en la comparación visual de la captación del miocardio y las costillas en imágenes adquiridas tres horas después de la inyección del trazador, lo cual arroja diferentes grados de resultados: grado 0, que se define como captación miocárdica ausente; grado 1, como captación miocárdica inferior a las costillas; grado 2, como captación miocárdica similar a las costillas; y grado 3, como captación superior a las costillas. Un puntaje mayor o igual a 2 se considera positivo para ATTR, mientras que un grado 0 se considera negativo para la enfermedad; la puntuación grado 1 podría representar ATTR o AL1.
Dada la alta prevalencia de cardiopatía hipertensiva puede pasarse por alto el diagnóstico de AC; incluso se hace un diagnóstico erróneo hasta en un 35% de los casos6. A pesar de esto, los hallazgos previamente descritos, más el engrosamiento ventricular derecho, la ausencia de signos de hipertrofia ventricular izquierda en el electrocardiograma y los hallazgos clínicos de insuficiencia cardiaca derecha, particularmente si hay antecedente de síndrome de túnel carpiano, deben sugerir el diagnóstico de AC13.
Tratamiento
FÁRMACOS UTILIZADOS EN FA Y ATTR PARA EL CONTROL DEL RITMO, LA FRECUENCIA O AMBOS
Los antagonistas betaadrenérgicos son una estrategia útil para controlar la frecuencia; no obstante, se ha sugerido el uso de dosis bajas por la alta sensibilidad a sus efectos cronotrópicos e inotrópicos negativos, recomendándose dosis de metoprolol de 50 a 100 mg por día33. La amiodarona es una estrategia útil para controlar la frecuencia, aunque se deben monitorizar sus efectos adversos y evitarse en enfermedad del sistema de conducción33. Los bloqueadores de los canales de calcio no dihidropiridínicos están contraindicados en AC por su efecto cronotrópico/inotrópico negativo y el alto riesgo de hipotensión9. Por otro lado, el papel de la digoxina es controvertido. Previamente se había demostrado in vitro que la digoxina es capaz de unirse a las fibrillas de amiloide, mecanismo que sugería un mayor riesgo de toxicidad digitálica9; no obstante, un estudio evaluó su utilidad en el control de la frecuencia (61% con ATTR) sin encontrar ninguna muerte atribuida a toxicidad, aunque con un total de eventos adversos caracterizados por arritmias y eventos tóxicos del 12%, siendo mayor en aquellos pacientes con ATTR (62%) vs. amiloidosis AL (38%)34. Por tanto, la digoxina a dosis bajas y con monitorización estrecha puede ser una opción terapéutica, especialmente cuando hay limitación terapéutica con otros fármacos por hipotensión9. Si se prefiere la estrategia farmacológica para el control del ritmo, la amiodarona es el medicamento de elección22. El control de ritmo mediante cardioversión eléctrica de corriente continua ha tenido tasas de éxito hasta del 90% y tasa de recurrencia anual similar en grupos con AC y no AC (48 vs. 55%, p = 0.75), pero mayor frecuencia de complicaciones asociadas al procedimiento, como bradiarritmias significativas con necesidad de implantación de marcapasos y arritmias ventriculares inesperadas en pacientes con AC (14 vs. 2%, p = 0.007), lo que probablemente refleja la alteración miopática y eléctrica avanzada subyacente observada en la AC35. En la evaluación por subtipos de AC, la tasa de éxito fue mayor para pacientes con ATTR en comparación con los pacientes con amiloidosis AL (21 de 21; 100%; vs. 17 de 21; 81%; p = 0.04)35. En cuanto a los desenlaces de supervivencia, un estudio retrospectivo sugiere que no hay diferencias en pacientes seleccionados para estrategia de control del ritmo vs. control de la frecuencia36. A diferencia de esto, Donellan et al.37, a través de un estudio retrospectivo con mayor número de pacientes (256 pacientes) específicamente con ATTR y FA, mostraron que en el grupo que se sometió a cardioversión eléctrica de corriente continua y que permanecieron en ritmo sinusal al cabo de un año (42%), se asociaron con una menor mortalidad (43 vs. 69%; p = 0.003). Si bien la tasa de recurrencia posterior a la cardioversión es alta, esta estrategia parece ser un enfoque atractivo en etapas tempranas de la enfermedad, ya que tiene un posible beneficio sobre la mortalidad anual9,37. En cuanto a la ablación con catéter, Donellan et al.37, documentaron una tasa de recurrencia global de 58%, con tasas más altas (90%) para estadio 3 propuesto por Gillmore en ATTR vs. (36%) en estadios 1 o 2, así como menores tasas de recurrencia en los pacientes que recibieron tafamidis, lo que reafirma que la intervención temprana es útil para el restablecimiento y mantenimiento del ritmo sinusal.
Anticoagulación en FA asociada a amiloidosis ATTR
Diferentes autores afirman que si hay evidencia de falta de contractilidad auricular se justificaría la anticoagulación, incluso en ritmo sinusal, ya que existe alto riesgo de formación de trombos en la orejuela y en la aurícula izquierda con posterior embolización, secundario a estasis sanguínea y estado de hipercoagulabilidad consecuente22,29, aunque sin tener los mejores niveles de evidencia. Los trombos en la orejuela izquierda en contexto de FA no fueron adecuadamente predichos por la puntuación de CHA2-DS2-VASc, por lo que los pacientes con FA y ATTR deben ser anticoagulados en ausencia de contraindicaciones independiente del puntaje22. La elección del fármaco anticoagulante no está claramente establecida. En una cohorte de 66 pacientes con FA llevados a cardioversión eléctrica, el 74% recibió anticoagulantes orales directos (DOAC, su sigla en inglés); el apixabán fue el más utilizado. En el seguimiento imagenológico se encontró una tasa de trombos auriculares izquierdos del 14% previo a la cardioversión eléctrica a pesar de tres semanas de terapia anticoagulante, sin documentarse diferencias estadísticamente significativas en cuanto a un DOAC en particular o uso de un DOAC comparado con un antagonista de la vitamina K (AVK)38. Otros estudios han reportado una tasa de persistencia de trombos en la aurícula izquierda de 28% antes de cardioversión eléctrica planificada en pacientes tratados con AVK o heparina35. Esta diferencia podría explicarse por un menor tiempo en rango terapéutico con el uso de AVK debido a las limitaciones para lograr niveles óptimos de INR en pacientes con AC38. Es pertinente, dada la alta tasa de trombosis auricular persistente, realizar estudios de imagen cardiaca previo a la cardioversión eléctrica35,38.
Pronóstico
El pronóstico de pacientes asintomáticos con ATTR es bueno; se ha observado una supervivencia del 90 y del 82% a los 3 y 5 años, respectivamente20. Hasta un tercio de los pacientes desarrollarán síntomas de insuficiencia cardiaca a los 3.7 años20. Un estudio encontró que los subtipos de FA (permanente o no permanente) no tienen un impacto significativo en mortalidad total y mortalidad cardiovascular en AC, independiente del tipo de amiloidosis (AL o ATTRwt)39. La aparición de insuficiencia cardiaca congestiva por amiloidosis cardiaca se ha correlacionado de forma independiente con mal pronóstico y aumento de mortalidad; adicionalmente, la presencia de arritmias, incluida la FA, son precipitantes conocidos para exacerbación de insuficiencia cardiaca y pueden contribuir de forma indirecta a un aumento en la mortalidad por todas las causas40.
Conclusiones
La infiltración cardiaca por tejido amiloide en ATTR se manifiesta por síntomas congestivos y/o arritmias. De las arritmias auriculares, la más frecuente es la FA, la cual puede pasar inadvertida principalmente en etapas tempranas, lo que conlleva subdiagnóstico y progresión de la enfermedad. Cuando se documenta la FA en estadios avanzados de AC, se ha asociado con una menor respuesta al manejo y aumento de la morbimortalidad. Es por esto que se debe tener un bajo umbral de sospecha diagnóstica, tanto para la búsqueda de FA en pacientes con AC y de tener presente la posibilidad de AC en pacientes con FA, lo anterior, para un abordaje temprano e integral de nuestros pacientes.














