Introducción
El cáncer de próstata es la segunda neoplasia más frecuente en hombres, con una tasa de progresión a metástasis del 10 al 30%. En estos pacientes, la terapia de deprivación adrongénica (TDA) tiene un impacto favorable en la morbimortalidad1-3, pero en algunos casos progresa por resistencia a esta, con lo cual se configura CPRCm. En este caso, la combinación con nuevas terapias, como abiraterona, representa una alternativa de manejo con buena respuesta y sobrevida2.
En las últimas décadas el advenimiento de nuevas terapias oncológicas con mejoría en la sobrevida ha conducido a la creación de una nueva área clínica conocida como cardio-oncología. Esta especialidad busca hacer énfasis en la relación entre la patología oncológica, su tratamiento (quimioterapia, hormonoterapia, inmunoterapia y radioterapia) y el riesgo de presentar eventos cardiovasculares4,5. En particular, la abiraterona (inhibidor de síntesis de andrógenos mediante el bloqueo de CYP17) se relaciona con riesgo de desarrollar o empeorar la hipertensión arterial, hiperglicemia, eventos cardiovasculares mayores y trastornos del ritmo cardiaco, como síndrome de QT largo adquirido. Este último puede explicarse por su efecto en la disminución de testosterona y 17B estradiol, o generando hiperaldosteronismo, disminución de cortisol e hipocalemia. Para minimizar estos efectos adversos, los pacientes pueden recibir suplencia esteroidea, con las implicaciones adicionales que tiene la terapia prolongada con esteroides en el riesgo de enfermedad aterosclerótica cardiovascular3,6,7. Se reporta el caso de un hombre con CPRCm tratado con abiraterona que desarrolló síncope y torsade de pointes.
Caso clínico
Hombre de 81 años que acudió al servicio de urgencias por cuadro de síncope de tres minutos de duración, sin pródromo, sin dolor precordial, disnea, palpitaciones u otro síntoma asociado. Sus antecedentes médicos incluían hipertensión arterial, diabetes mellitus, dislipidemia y CPRCm de diagnóstico reciente. El tratamiento farmacológico previo era metformina 1.000 mg dos veces al día, enalapril 20 mg dos veces al día, rosuvastatina 40 mg una vez al día, acetato de leuprolide 22.5 mg cada 3 meses, prednisolona 5 mg una vez al día y abiraterona acetato 1.000 mg dos veces al día (iniciado 15 días antes de su presentación). Al examen físico de ingreso, la presión arterial era 178/110 mmHg, frecuencia cardiaca de 76 latidos por minuto, saturación del 94% al ambiente y ruidos cardiacos arrítmicos. El electrocardiograma inicial evidenció bloqueo completo de rama derecha, con prolongación QTc (585 ms corregido por fórmula de Bazzet y 563 ms corregido por fórmula de Fridericia) (Fig. 1). Durante la monitorización presentó deterioro hemodinámico en el que se documentó TdP (Fig. 2) con requerimiento de desfibrilación (200 J) y sulfato de magnesio 2 gramos intravenoso en bolo.

Figura 1 Electrocardiograma de 12 derivaciones al ingreso. Ritmo sinusal frecuencia cardíaca 72 latidos por minuto, bloqueo completo de rama derecha y QTc prolongado (563 ms por fórmula de Fridericia).
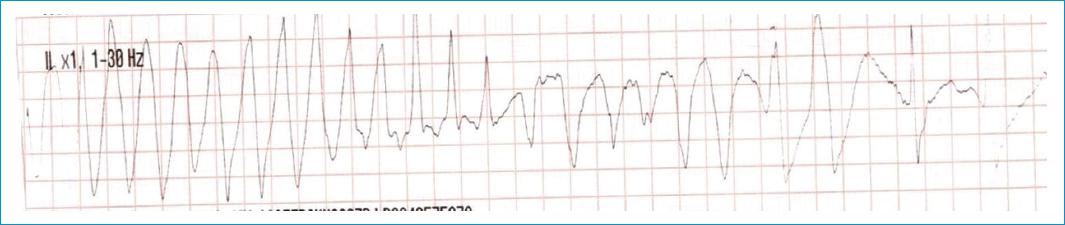
Figura 2 Electrocardiograma derivación DII control. Taquicardia de 200 latidos por minuto de complejos QRS anchos con alternancia de la amplitud compatible con torsade de pointes.
Los resultados de laboratorio mostraron múltiples alteraciones electrolíticas dadas por hipocalemia grave (K: 2 mEq/L, referencia: 3.5-5), hipomagnesemia (Mg: 1 mg/dl, referencia: 1.6-2.6) e hipocalcemia (Ca: 7.56 mg/dl, referencia: 8.5-10.2). Su creatinina fue 1.2 mg/dl con un basal de 0.8 mg/dl configurando lesión renal aguda; la troponina I y el dímero D estaban elevados. El resto de bioquímica sanguínea, al igual que la radiografía de tórax, estaban dentro de los límites normales. Se le realizó una angiotomografía de tórax, que descartó embolia pulmonar, y una arteriografía coronaria que mostró enfermedad no significativa de la arteria coronaria derecha y circunfleja. El ecocardiograma evidenció disfunción sistólica del ventrículo izquierdo con fracción de eyección del 40%, remodelación concéntrica del ventrículo izquierdo y dilatación auricular leve.
Después de estabilizarlo se le realizó reanimación hídrica con lactato de Ringer y reposición de electrolitos por vía endovenosa. Una vez corregidas las alteraciones electrolíticas, el QTc disminuyó a valores normales. En su abordaje para determinar la causa de la hipocalemia se descartaron pérdidas gastrointestinales, alcalosis metabólica o deshidratación. Los niveles de ACTH se encontraban elevados en 148 pg/ml (referencia: 7.2-63.3 pg/ml), con cortisol bajo 4 mcg/dl (referencia: 5-25 mcg/dl) y niveles de aldosterona normales en 3.69 ng/dl (referencia: 2.52-39.2 ng/dl). Con el fin de realizar un análisis de relación temporal, se consultaron los registros médicos previos, en los que documentaron niveles séricos de potasio normales (4.0 mEq/L) antes de iniciar la abiraterona. La escala de Naranjo era de 8 puntos8, lo cual sugiere una fuerte asociación entre el medicamento y el episodio de hiperaldosteronismo secundario. Con base en lo anterior, se aumentó la dosis de prednisolona 25 mg una vez al día y se suspendió la abiraterona. A las 72 horas de haber ajustado la terapia, los niveles de cortisol y ACTH se normalizaron. El paciente egresó asintomático para continuar su manejo oncológico de forma ambulatoria.
Discusión
El cáncer de próstata corresponde al 15% de todos los cánceres, con lo que ocupa el quinto lugar en causa de muerte por cáncer en el mundo. El 76% es diagnosticado en estadio localizado e incluso muchos son indolentes, con una progresión a un componente metastásico entre el 10 al 30%1. La alta tasa de receptores androgénicos le da un carácter hormonosensible, por lo que la TDA, inductora de hipogonadismo, sigue siendo la primera línea de tratamiento. A pesar de lo anterior, en algunos casos puede desarrollar resistencia a esta terapia, configurando CPRCm, con una sobrevida de apenas 30% a cinco años6,9.
La abiraterona es un metabolito activo de la abiraterona acetato, aprobado por la FDA para el tratamiento del CPRCm, con buenos resultados en combinación con TDA2,3. Es un inhibidor potente, selectivo e irreversible de la CYP17, que conduce a la disminución de andrógenos en tejido prostático, adrenal y testicular. Por lo general, se administra en combinación con esteroides para disminuir los efectos del exceso mineralocorticoide6,10.
El bloqueo de la 17a hidroxilasa y C17-20 liasa evita el paso de pregnenolona y progesterona a dehidroepiandrosterona y androstenediona, suprimiendo consigo los niveles de cortisol. Esto activa la retroalimentación positiva del eje con elevación de la ACTH e inducción de un estado de hiperaldosteronismo3. En consecuencia, el exceso de deoxicorticosterona aumenta el riesgo de hipocalemia (20%), retención de líquidos, hipertensión, hiperglucemia, prolongación del QTc y arritmia ventriculares11,12. También se han descrito efectos secundarios gastrointestinales (6%) e infecciosos (5%). En algunos registros se ha encontrado que el 90% de los eventos adversos por abiraterona son graves, incluso 14% con desenlace fatal, identificando grupos de riesgo, como los pacientes mayores de 85 años13. De acuerdo con un metaanálisis que incluyó 7 artículos con 8.660 pacientes, el tratamiento con abiraterona se asocia con 41% mayor riesgo de cualquier evento de cardiotoxicidad y 2.2 veces más riesgo de eventos de cardiotoxicidad de alto grado, comparado con placebo14. No se encontró interacción entre la dosis de prednisolona (5 vs. 10 mg/día) y el riesgo de cardiotoxicidad con abiraterona.
El mecanismo fisiopatológico en la afectación cardiovascular es diverso, con un rol importante de la diminución de la testosterona, 17B estradiol, receptores scavenger de los macrófagos y mayor expresión de la apolipoproteína E. Esto se traduce en mayor riesgo de arteriosclerosis, alteración en la adiposidad, resistencia a la insulina, síndrome metabólico, hipertensión y disfunción endotelial7. Específicamente, para los trastornos del ritmo, los bajos niveles de testosterona se asocian con prolongación de intervalo QTc y arritmias ventriculares, que pueden exacerbarse por las alteraciones electrolíticas.
La TdP es una taquicardia ventricular polimórfica, secundaria a síndrome de QT largo congénito (principalmente canalopatías) o adquirido, como el que se relaciona con el caso. Es más frecuente en mujeres debido a la influencia de hormonas sexuales en la regulación de canales iónicos cardiacos. Su principal etiología es secundaria a medicamentos que interactúan con el gen HERG o canal Ikr, desórdenes electrolíticos (hipocalemia, hipomagnesemia, hipocalcemia), hipotiroidismo, hipotermia, bradicardia anticuerpos anti SSa/Ro y enfermedades autoinmunes. Se estima que entre el 5 al 7% de las arritmias ventriculares o muertes súbitas son secundarias a medicamentos15. Específicamente, el uso de abiraterona lleva a la supresión de la testosterona, disminuyendo las corrientes de despolarización de los canales de potasio IKr-IKs y reduciendo la corriente de despolarización de calcio tipo L16. Adicionalmente, se ha visto una disminución del QTc al aumentar los niveles de testosterona17,18.
En el caso expuesto, la terapia de deprivación hormonal androgénica, sumada a hiperaldosteronismo secundario y alteraciones electrolíticas (hipocalemia grave e hipomagnesemia) contribuyeron a la TdP. La evaluación con la escala de Naranjo con un puntaje de 8 puntos8 hace muy probable la asociación causal entre la abiraterona y la TdP en este paciente. Particularmente, el inicio reciente de la terapia, la dosis baja de esteroide, la resolución después de haberlo suspendido y la ausencia de otras posibles etiologías, sugieren que la abiraterona fue la causa de la arritmia. Este efecto adverso es infrecuente; en la literatura se han reportado sólo 9 casos de TdP en pacientes en tratamiento con abiraterona11. El caso que se presenta cuenta con la medición de las hormonas del eje esteroideo, lo que permitió confirmar el estado de hiperaldosteronismo con niveles de aldosterona normales (al comparar con el grado de hipocalemia), ACTH elevada y cortisol suprimido.
A pesar de ser una complicación poco frecuente, la TdP secundaria a QTc largo adquirido representa una urgencia cardiovascular potencialmente fatal. En este caso la monitorización electrocardiográfica continua permitió identificarlo y tratarlo de forma oportuna con cardioversión eléctrica y sulfato de magnesio. Una vez se estabiliza el paciente, debe abordarse de forma sistemática para determinar los factores desencadenantes o perpetuadores del trastorno del ritmo. En general, la población CPRCm suelen ser hombres adultos mayores con múltiples comorbilidades, polifarmacia o alteración estructural cardiaca de base, los cuales deben tenerse en cuenta para prevenir las recurrencias19.
Conclusión
El caso reportado es una complicación cardiovascular rara, pero potencialmente fatal del tratamiento hormonal del CPRCm. A pesar de los beneficios en la sobrevida para pacientes con CPRCm que son tratados con abiraterona, es importante hacer una adecuada suplencia esteroidea de forma concomitante y evaluar de manera integral el componente cardiovascular y metabólico.














