Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Ingeniería Universidad de Antioquia
Print version ISSN 0120-6230On-line version ISSN 2422-2844
Rev.fac.ing.univ. Antioquia no.36 Medellín Apr./June 2006
Rev. Fac. Ing. Univ. Antioquia N.° 36. pp. 110-121. Marzo, 2006
Extracción líquido - líquido de bario con DEPHA: equilibrio químico
Liquid-liquid extraction of barium with DEPHA: chemical equilibrium
Gladis Duperly Yaruro, Dionisio Antonio Laverde, Humberto Escalante*
(Recibido el 29 de julio de 2005. Aceptado el 8 de noviembre de 2005)
Grupo de Investigaciones en Minerales, Biohidrometalurgia y Ambiente GIMBA. Facultad de Físico-Químicas. Escuela de Ingeniería Química. Universidad Industrial de Santander. A. A.678, Bucaramanga, Colombia.
Resumen
El objetivo de este trabajo fue evaluar el proceso de extracción líquido-líquido para separar bario presente en fase acuosa mediante una fase orgánica compuesta de DEPHA (bis-2-ethylhexyl phosphate), disuelto en queroseno y con alcohol isopropílico como agente modificador. Se estudiaron diferentes variables: a) concentración del metal en la fase líquida, b) pH de la solución, c) concentración del portador orgánico d) relación de volumen de fase orgánica y acuosa. Se obtuvo una eficiencia de recuperación de 89.5% usando una solución orgánica de 30% (V/V), 30% (V/V) isopropil alcohol. La extracción de bario ocurre a pH 11. La fase acuosa consistió de 100 mg/L de BaCl2.2H2O. Se describió el equilibrio químico del sistema y se obtuvo KqE = 0,338. Este parámetro es útil para establecer la viabilidad del proceso industrial para la separación de bario en fase acuosa.
---------- Palabras clave: bario, metales pesados, extracción líquido-líquido, DEPHA.
Abstract
The objective of this work was to evaluate a liquid - liquid extraction process to separate barium in aqueous phase by means of an organic phase consisting of DEPHA (bis-2-ethylhexyl phosphate) in kerosene and isopropyl alcohol as modifying agent. Different variables were studied: a) metal concentration in the liquid phase, b) pH of the solution, c) concentration of the organic carrier and d) ratio of the organic to aqueous phase volume. A recovery efficiency of 89.5% was obtained using an organic solution based on DEPHA, 30% (V/V) and isopropyl alcohol, 30% (V/V) as selective extraction medium. The extraction of barium occurs at pH 11. A solution containing 100 mg/L of BaCl2.2H2O was used as aqueous phase. The chemical equilibrium present in the system was described and the parameter KqE = 0.338 was obtained. This parameter is useful for establishing the viability of the industrial barium separation process in the aqueous phase.
---------- Key words: barium, heavy metals, liquid–liquid extraction, DEPHA.
Introducción
El bario es un metal pesado que ha sido denominado como nocivo por la Organización Mundial de la Salud [1] y como peligroso por la Agencia de Protección Ambiental Americana (EPA). La exploración minera, petrolera y la industria de la galvanoplastia, los plásticos, los curtiembres, la farmacéutica, y la petroquímica, incluyen operaciones que generan desechos sólidos y líquidos, los cuales poseen concentraciones significativas de bario.
Estudios realizados por la industria del petróleo [2, 3, 4, 5] indican que en algunas estaciones de recolección se producen efluentes líquidos contaminados con bario, con niveles de concentraciones que oscilan entre 8 y 50 ppm, y que superan el nivel de vertimiento establecido por la legislación colombiana.
La reducción de la concentración del bario, presente en efluentes líquidos, ha sido abordada mediante el uso de precipitación química con ácido sulfúrico, con KOH y con NaOH [2, 4]. En el campo biológico se ha experimentado con filtros biológicos [3] y la utilización de manglares [5]; sin embargo, estas tecnologías han resultado ser poco efectivas, debido a problemas de seguridad industrial, elevados costos y complejidad, debido a los grandes volúmenes de aguas que deben ser tratadas.
La tecnología físico-química convencional de extracción líquido-líquido con solventes consigue extraer y concentrar un soluto presente a bajas concentraciones en una fase acuosa, usando un agente extractante selectivo. Los compuestos organofosforados como: bis (2-etilhexil) fosfato (DEPHA), bis (2-etilhexil) fosfórico (D2EPHA), debido a su estabilidad química, su extremadamente baja solubilidad y su alta selectividad han sido utilizados en un amplio rango de condiciones de operación para la extracción y separación de metales como: cadmio, cinc, níquel, cobre y paladio [6], europio [7], estroncio [8], uranio [9], cobre [10], plomo [11] y vanadio [12]; así como para especies metálicas que se encuentran en forma catiónica [13].
Cuando entran en contacto las fases se permite que el extractante, presente en la fase orgánica, reaccione intercambiando su catión por el soluto, disuelto en la fase acuosa. La reacción que se lleva a cabo es de intercambio iónico y se forma un complejo extractante-metal. El equilibrio de extracción tipo DEPHA o DEPHA2, para metales divalentes, ha sido propuesto por Huang and Tsai [14] y corresponde a una reacción reversible como se esquematiza en la siguiente ecuación:

Miyake y colaboradores [15] han propuesto que los extractantes organofosforados acídicos son interfacialmente activos, existen en el bulbo de la fase orgánica principalmente como dímeros, debido al enlace intermolecular de hidrógeno. Sin embargo en la interfase orgánica-acuosa se encuentran como monómeros, ya que el enlace intermolecular de hidrógeno, dentro del extractante, es destruido por la preferencia de la molécula de agua, en la zona interfacial, hacia los enlaces de hidrógeno. Las consideraciones anteriores permiten establecer que la extracción de bario mediante DEPHA se describe por la ecuación:
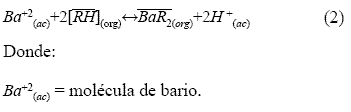

La descripción completa del mecanismo de extracción del bario por el DEPHA sólo es completa una vez ha sido definida la constante de equilibrio. El mecanismo del extractante tipo DEPHA o D2EPHA corresponde a una reacción de intercambio iónico entre el metal, procedente de la fase acuosa, con el protón de la fase orgánica. Termodinámicamente el equilibrio se describe en función de las actividades de las especies implicadas así:

Siendo ap1 y ap2 los productos de la reacción y ar1 y ar2 los correspondientes reactivos y Ke la constante de equilibrio químico del sistema. Debido a que la presión tiene poco efecto sobre las propiedades de los líquidos, la actividad se puede definir como:

Siendo γ1 el coeficientes de actividad y χ 1 la fracción molar de las diferentes especies. Por consiguiente la constante de equilibrio estará expresada como el producto de las concentraciones en equilibrio (Kc) y la constante de los coeficientes de actividad (Kγ ):

A su vez el equilibrio de la extracción de metales, con extractantes orgánicos, puede ser descrito por la ley de acción de masas [16]; considerando que la mezcla en equilibrio es una disolución ideal, en cuyo caso γ i = 1, obteniéndose que Ke = Kc.
En la interfase acuosa-orgánica los extractantes existen principalmente como especies monoméricas [5], por consiguiente se puede establecer la constante de equilibrio (Ke) para la extracción de metal, representada en la ecuación (2), así:

Los parámetros del equilibrio de la reacción son importantes para la descripción exacta y completa del proceso de extracción, así como para una etapa posterior de diseño del proceso a mayor escala.
Para determinar los mejores valores de las variables involucradas en el proceso de extracción del bario con DEPHA, se seleccionó como variable respuesta el porcentaje de extracción del metal, definido como:
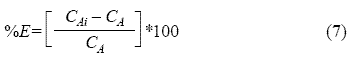
Siendo:
CAi = concentración inicial de Ba (mg/l).
CA = concentración final de Ba después de cada extracción (mg/l).
%E = porcentaje de extracción de bario.
Desarrollo experimental
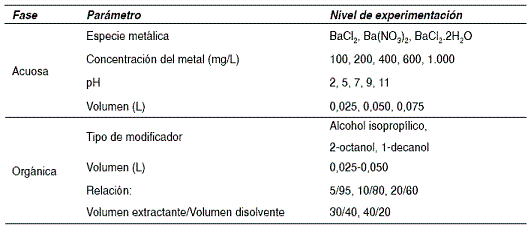
En los efluentes acuosos industriales el bario puede existir como sulfato, cloruro, carbonato y nitrato, en este trabajo de investigación se optó por estudiar el metal en sus formas de: BaCl2, BaCl2. 2H2O, Ba(NO3). La fase acuosa se preparó disolviendo la forma metálica del bario en agua desionizada y utilizando reactivos analíticos de alta pureza suministrados por Sigma Chemical Co.
Para la preparación de la fase orgánica se empleó el DEPHA, suministrado por Sigma Chemical Co. y Merck Co.; que es un ácido orgánico de alto peso molecular (322,43 g/mol), constituido por 95% del ácido bis (2-etilhexil) fosfórico y con una solubilidad en agua extremadamente baja (0,1-1%). Debido a que la extracción del metal es controlada por el transporte de masa, para facilitar la transferencia de las especies se requiere disminuir la tensión superficial y la viscosidad del DEPHA [17]. Por consiguiente el extractante se disolvió en queroseno comercial, suministrado por Terpel, y de esta forma se permiten elevados parámetros de transporte. Adicionalmente para evitar la formación de terceras fases se adicionó a la fase orgánica un modificador; para tal fin se estudió el efecto del alcohol isopropílico (IPA), el 2-octanol y el 1-decanol, reactivos de alta pureza suministrados por J. T. Baker Chemical y Merck Co.
El pH de la fase acuosa se ajustó mediante la adición de HCl 1M o NaOH (1 - 3 M). Los experimentos se realizaron por triplicado colocando en tubos de vidrio, de 250 mL con tapa plástica, un volumen de fase orgánica y un volumen de fase acuosa. Los experimentos de extracción líquido-líquido se llevaron a cabo en un equipo contactor rotatorio de giro completo, que permitió el contacto directo y homogéneo de las fases acuosa y orgánica, a una velocidad de 65 rpm Después de 30 minutos de contacto, las fases se separaron por decantación. La concentración del metal en la fase acuosa se determinó mediante espectrofotometría de absorción atómica, utilizando un espectrofotómetro de absorción atómica Perkin Elmer PE 2380, y a partir de un balance de materia se calculó la concentración del metal presente en la fase orgánica.
Las variables estudiadas fueron: formulación más adecuada de la fase orgánica, concentración del bario en la fase acuosa, tipo de especie metálica y pH, así como el tiempo de mezclado y relación de volumen de fase acuosa a volumen de fase orgánica.
Para la determinación de la constante de equilibrio químico, se realizaron experimentos de extracción del bario con DEPHA, a las mejores condiciones de operación, previamente definidas. Con el objeto de cargar la fase orgánica con el metal, se realizaron extracciones sucesivas, bajo las mismas condiciones de operación. Se mantuvo siempre la misma fase orgánica y se varió en cada ensayo la fase acuosa, por un volumen de disolución fresca.
En la tabla 1 se indican los niveles de experimentación estudiados para cada una de las variables del proceso de extracción de bario con DEPHA.
Análisis de resultados
Influencia de la forma metálica del bario
Se realizaron experimentos de extracción empleando una fase orgánica compuesta de 20 % de DEPHA y 80% de queroseno, ya que a concentraciones elevadas del extractante no se requiere de agente modificador. La relación volumen de fase orgánica a volumen de fase acuosa fue de 1. Los resultados de la experimentación se resumen en la tabla 2.
Tabla 1 Condiciones de experimentación para la extracción líquido-líquido de bario con DEPHA
El comportamiento del DEPHA ante las diferentes formas metálicas de bario está influenciado por la solubilidad del compuesto en agua, así mismo la extracción es altamente dependiente del pH de la fase de acuosa. Como se observa en la tabla 2 el BaCl2.2H2O, forma metálica muy predominante en las aguas industriales, presentó el mejor porcentaje de extracción; por consiguiente esta especie de bario en forma cloruro se seleccionó para el estudio.
Formulación de la fase orgánica
Selección del agente modificador
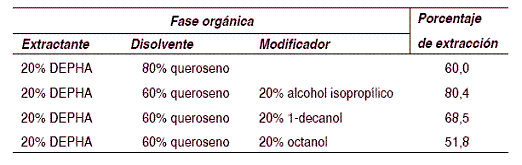
Diferentes autores han considerado que el porcentaje de modificador, en la fase orgánica, debe ser igual al porcentaje de agente extractante [18]. Se realizó una serie de experimentos de extracción líquido-líquido para seleccionar el tipo de agente modificador. Se utilizó una fase acuosa compuesta de BaCl2.2H2O, a concentración de 200 ppm. Se experimentaron fases orgánicas, en las que se varió el tipo de agente modificador. En la tabla 3 se reportan los porcentajes de extracción obtenidos.
La extracción del bario con DEPHA se ve favorecida al adicionar 20% de alcohol isopropílico (IPA) como agente modificador de la fase orgánica. El IPA incrementa el grado de solubilidad del extractante, y además es compuesto comercial de bajo costo.
Efecto de la concentración del extractante
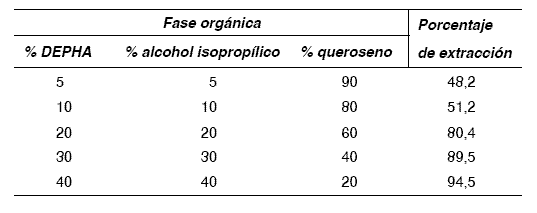
Una fase orgánica con elevada concentración de DEPHA garantiza buenos porcentajes de extracción del metal, sin embargo llega a presentar dificultades para el transporte de masa, debido a su alta viscosidad y tensión superficial. Así mismo Galán [19] para la extracción de cromo y Escalante [20] para la extracción de fenilalamina concluyen que una fase orgánica compuesta de un 30% de extractante permite obtener buenos porcentajes de extracción del soluto. Los experimentos de extracción de bario se realizaron utilizando fases orgánicas en las cuales se varió la concentración de DEPHA en 5, 10, 20, 30 y 40% en volumen. Los resultados se presentan en la tabla 4.
Tabla 2 Comportamiento de la forma metálica del bario durante su extracción con DEPHA
Tabla 3 Influencia del agente modificador en la extracción de bario con DEPHA
Tabla 4 Efecto de la concentración de DEPHA en la fase orgánica
El porcentaje de extracción del metal está directamente relacionado con la concentración del extractante en la fase orgánica. Un incremento de 10% en DEPHA sólo garantiza aproximadamente aumento de 5% en la extracción. Por el contrario, el aumento de la concentración de extractante, incrementa significativamente la viscosidad de la fase orgánica, dificulta en parte el flujo de masa, y por ende los costos del proceso. Por consiguiente la mejor fase orgánica es la compuesta de 30% de DEPHA, 30% de IPA y 40% de queroseno.
Influencia del pH en la fase acuosa
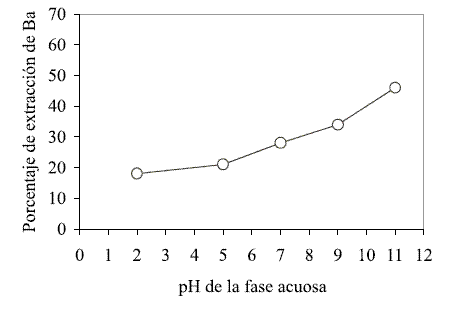
En un efluente líquido que contenga trazas de metales en la misma forma iónica, la extracción selectiva, por parte de un extractante orgánico, es altamente dependiente del pH de la fase acuosa. Para el estudio de esta variable se utilizó una fase acuosa a concentración de 200 ppm de BaCl2.2H2O, y mediante la adición de NaOH o HCl 1M se ajustaron los valores del pH a 2, 5, 7, 9 y 11. Como fase orgánica se empleó la definida en la etapa anterior. Los porcentajes de extracción del metal con respecto a la variación de pH en la fase acuosa se reportan en la figura 1.
El proceso de extracción del metal se ve favorecido cuando la fase acuosa presenta un carácter básico. Por consiguiente el mejor grado de extracción líquido-líquido del Ba, mediante una fase orgánica compuesta de DEPHA-alcohol isopropílico y queroseno, se lleva a cabo a pH de 11.
Figura 1 Influencia del pH de la fase acuosa durante la extracción de bario con DEPHA
Efecto de la concentración del metal en la fase acuosa
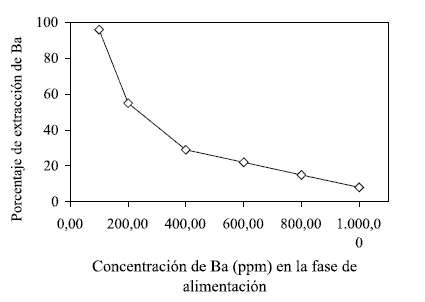
Se llevaron a cabo experimentos de extracción líquido-líquido utilizando fases acuosas cuyas concentraciones de bario se definieron en la tabla 1, y a pH de 11. Como fase orgánica se utilizó la definida en la etapa anterior. En la figura 2 se muestran los porcentajes de extracción obtenidos para la serie de concentraciones de fase acuosa estudiadas.
Se observa en la figura 2 que a menor concentración del bario, en la fase acuosa, mayor es el porcentaje de extracción por parte del DEPHA; este hecho es una ventaja cuando se desea utilizar esta tecnología para tratar efluentes que posean concentraciones de metales bajas, de forma tal que imposibilitan su recuperación por precipitación.
Relación volumen de fase acuosa a volumen de fase orgánica (VA/VO)
Esta relación hace referencia a los volúmenes de las fases que se mezclan durante el proceso de de extracción líquido-líquido. La capacidad que tiene de reaccionar una determinada masa de extractante con el metal presente en la fase acuosa, es función de la acumulación del bario, en la fase orgánica; y por consiguiente condiciona la velocidad de extracción. A partir de las condiciones de operación definidas en los apartados anteriores, se llevaron a cabo experimentos con 4 diferentes relaciones de volumen de fase acuosa (VA) a volumen de fase orgánica (VO). Los resultados del estudio se reportan en la tabla 5.
Se observa en la tabla 5 que el proceso de extracción del bario con DEPHA se ve favorecido cuando se incrementa la cantidad de extractante, es decir cuando se aumenta el volumen de fase orgánica. Sin embargo por problemas de costos, en una aplicación industrial lo ideal es utilizar un volumen de fase orgánica menor que el volumen de fase acuosa. Otra opción es emplear una fase orgánica a una concentración de extractante más elevada, pero desafortunadamente esto ocasiona un incremento en la viscosidad de la fase orgánica, y por consiguiente dificulta la solubilidad del metal y genera problemas de transferencia de masa.
Tabla 5 Influencia de la relación volumétrica de las fases, durante la extracción líquido–líquido de bario con DEPHA
Figura 2 Influencia de la concentración de Ba en la fase de acuosa, durante la extracción con DEPHA
Equilibrio de la extracciónde bario con DEPHA
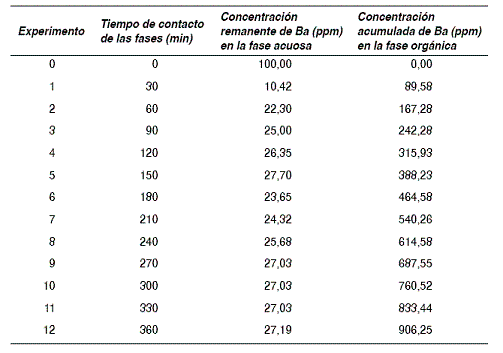
Para saturar por completo la fase orgánica con el bario se realizaron 12 experimentos de extracción líquido-líquido consecutivos con la misma fase orgánica. En la tabla 6 se indican las concentraciones de bario fase orgánica, las cuales se obtuvieron a partir de un balance de masa.
La reacción de intercambio iónico que se lleva a cabo entre el catión bario, presente en forma de cloruro, y el catión del extractante se representa de acuerdo con la ecuación (2), para la cual la “ley de acción de masas” permite describir laconstante de equilibrio Ke de acuerdo con la ecuación (6).
Examinando la relación existente entre los volúmenes, de experimentación, de las fases y teniendo en cuenta el balance de masa, que permite calcular las concentraciones de las especies no determinadas durante la experimentación, la constante de equilibrio representada en la ecuación (6) puede ser reescrita como:
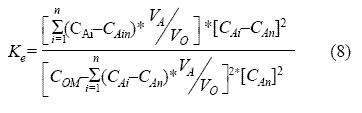
Donde:
Ke : constante de equilibrio.
CAi : concentración inicial de bario en la fase acuosa y alimentación, mg/l.
CAin : concentración de bario en la fase de alimentación, durante el contacto n, mg/l.
COM : concentración máxima de extractante en la fase orgánica, mg/l.
Tabla 6 Acumulación de bario en la fase orgánica, durante extracciones sucesivas
n: contactos a que se sometió la fase orgánica.
VA: volumen de fase acuosa, mL.
VO: volumen de fase orgánica, mL.
La ecuación (8) se puede linealizar, de acuerdo a un modelo matemático logarítmico así:
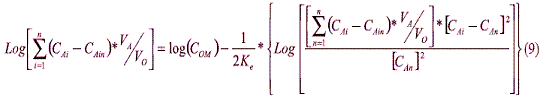
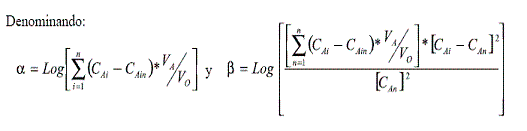
La ecuación puede reescribirse como:
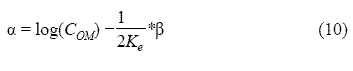
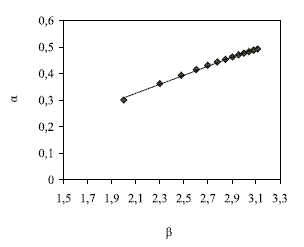
La ecuación anterior representa una línea recta con pendiente ½ Ke y corte log (COM). En la figura 3 se esquematiza la regresión matemática de los datos experimentales a partir de la ecuación (10).
A partir de la pendiente, de la regresión lineal de los datos experimentales de extracción, se calculó el valor de la constante de equilibrio Ke = 0,338 y a partir del corte de la ordenada se encontró el valor de la concentración máxima de extractante en la fase orgánica COM = 1,07 mol/l, con un valor de correlación de 0,99.
Figura 3 Regresión lineal de los datos experimentales de extracción de bario con DEPHA, para determinar parámetros de equilibrio
Conclusiones
La extracción del bario se ve favorecida a elevadas concentraciones de DEPHA y con la adición de un modificador, para evitar la formación de terceras fases; por consiguiente se formuló una fase orgánica compuesta de 30% de DEPHA, 30% de alcohol isopropílico y 40% de queroseno, a fin de evitar problemas de solubilidad.
Utilizando una fase acuosa a concentración de 100 ppm de BaCl2.2H2O, especie metálica que más predomina en los vertimientos industriales, se obtuvo un rendimiento de extracción del metal con DEPHA del 89,5%, a pH de 11; dado que la solubilidad del bario está directamente relacionada con el pH.
El mecanismo de la extracción del bario por parte del DEPHA es el intercambio iónico y el proceso está directamente influenciado por la concentración del extractante y del soluto por extraer; obteniéndose una constante de equilibrio Ke = 0,338 y una concentración máxima de extractante en la fase orgánica COM = 1,07 mol/L.
Referencias
1. World Health Organization. Barium environmental health criteria. N.o 107. IPCS. 1990. p. 148. [ Links ]
2. J. I. Mogollón, R. Rodríguez, V. Larrota, R. Torres. “Remoción biológica de bario de aguas de producción utilizando asociaciones microbianas estratificadas”. Ciencia Tecnología y Futuro. Vol. 1. N.o 2. 1996. pp. 35-41. [ Links ]
3. J. Medina, E. Silva. Filtro biológico para la depuración del bario en las lagunas de estabilización de una estación de recolección de crudo. Universidad Industrial de Santander. Bucaramanga, Colombia. 1993. p. 38. [ Links ]
4. C. L. Hawes, “Simple method finds Barium in oil-field brisnes”, Oil & Gas Journal, 1985, pp. 130-132. [ Links ]
5. J. Groso, V. Restrepo y L. Sánchez. “Evaluación preliminar de la participación de especies de mangle en el control de metales pesados en aguas de producción”. En: Ciencia, tecnología y Futuro (CT&F). Ecopetrol-ICP. Vol. 1. N.o 2. 1996. pp. 55-65. [ Links ]
6. U. A. Daiminger, A. G. Geist, W. Nitsch, y P. K. Plucinski. Efficiencyy of Hollow Fiber Modules for Nondispersive Chemical extraction. Ind. Chem. Res. N.o 35. 1996. pp. 184-191. [ Links ]
7. T. Hung, C. Lee. Retardation of the transport of Eu(II) through supported di-(2ethylhexil) phosphoric acid-kerosene liquid membrane, in solvent extraction. Ed. T. Sekine. Elsevier Science Publishers. 1992. pp. 1505-1510. [ Links ]
8. W. R. Dwoezak, A. J. Nasser. “Pilot-scale evaluation of supported liquid membrane extraction”. Sep. Sci. Technol. N.o 22. 1987. pp. 677-689. [ Links ]
9. C. Huang, T. Huang. “Kinetics of the extraction of uranium (IV) from nitric acid solutions with D2EPHA”. Ind. Chem. Res. N.o 27. 1988. pp. 1675-1680. [ Links ]
10. P. R. Danesi. “The relative importance of diffusion an chemical reaction in liquid-liquid extraction kinetics”. Solv. Extr. Ion Exch. N.o 2. 1984. pp. 29-44. [ Links ]
11. R. S. Juang, S. H. Lee. “Extraction equilibrium of lead (II) from nitrate solutions with acidic organophosphorus compounds”. J. Chem. Tech. Biotechnol. N.o 60. 1994. pp. 61-66. [ Links ]
12. R. Juang, R. Lo. “Kinetic of the coupled transport of vanadium (IV) from sulfate solutions through supported liquid membranes”. Ind. Eng. Chem. Res. N.o 33. 1994. pp. 1011-1016. [ Links ]
13. M. N. Hudson. “An Introduction to some aspects of solvent extraction chemistry in hydrometallurgy”. Hydrometallurgy. N.o 9. 1982. pp. 149-168. [ Links ]
14. T. Huang, T. Tsai. Separation of Cobalt and Nickel ions with 2-ethylhexyl phosphoric acid mono-2-ethylexyl ester dissolvend in kerosene. Ed. T. Sekine. Elsevier Science Publishers. 1992. pp. 1529-1534. [ Links ]
15. Y. Miyake, H. Matsuyama, M. Nishida. “Kinetics and mechanicsm of metal extraction with acid organophosphorus extractans (I). Extraction rate limited by diffusion process”. Hydrometallurgy. N.o 23. 1990. pp. 19-35. [ Links ]
16. A. I. Alonso, A. Urtiaga, S. Zamacona, A. Irabien, I. Ortiz. « Kinetic modelling of cadmium renoval from phosphoric acid by mondispersive solvent extraction”. J. Memb. Sci. Vol. 130. N.o 1. 1997. pp. 193-203. [ Links ]
17. M. Cerná, V. Bizek, J. Stastora, V. Rod. “Extraction of nitric acid with quaternary ammonium bases”. Chem. Eng. Sci. N.o 48. 1993. pp. 99-103. [ Links ]
18. H. Escalante, A. I. Alonso, I. Ortíz, A. Irabien. “Separation of L-phenylalanine by nondispersive extraction and backextraction. Equilibrium and kinetic parameters”. Separation Science and Technology. Vol. 33. N.o 1. 1998. pp. 119-139. [ Links ]
19. B. Galán. Separación-concentración de Cr(VI) en módulos de fibra hueca. Tesis doctoral. Universidad de Cantabria. Santander, España. 1994. p. 250. [ Links ]
20. H. Escalante. Análisis y modelado de la separación-concentración de L-fenilalanina mediante extracción no dispersiva. Tesis doctoral. Universidad de Cantabria. Santander, España. 1997. p. 85. [ Links ]
* Autor de correspondencia. Teléfono: +57+7+634 47 46, fax: +57+4+645 11 56, Correo electrónico: escala@uis.edu.co (H.Escalante).