Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Facultad de Ingeniería Universidad de Antioquia
versão impressa ISSN 0120-6230versão On-line ISSN 2422-2844
Rev.fac.ing.univ. Antioquia n.37 Medellín jul.set. 2006
Revista Facultad de Ingeniería N.o 37. pp. 9-20. Julio, 2006
Resumen
La gran dificultad que se presenta en la disolución del oro por cianuración, cuando se encuentra en minerales sulfurados, es un hecho ampliamente conocido en la metalurgia extractiva. En este trabajo se evaluó la interferencia del ión sulfuro (S-2), así como el efecto del catalizador LeachWell 60X® (LW) y del ión Pb+2 en el comportamiento electroquímico del proceso de disolución de oro con cianuro. Se emplearon métodos potenciodinámicos de barrido lineal y cíclico para estudiar la oxidación anódica del oro y la reducción catódica del O2 bajo condiciones de cianuración convencional (1.000 p. p. m. de CN- y O2 ambiental 5,2 p. p. m.) y de cianuración intensiva (25.000 p. p. m. de CN- y saturado de O2 24 p. p. m.).
Los resultados indican que el Pb+2 y el LW se comportan de manera similar y que incluso bajas concentraciones de S-2 (entre 0,5 y 10 p. p. m.) tienen un efecto negativo en la disolución anódica del oro. La velocidad de disolución del metal precioso se predijo aplicando la teoría del potencial de mezcla. El incremento significativo en la velocidad total de la reacción se atribuye principalmente al aumento en la velocidad de reducción del O2.
---------- Palabras clave: catalizadores, cianuración intensiva, oro, sulfuro, LeachWell 60X®.
Abstract
Extraction of gold from sulfur minerals by cyanidation is a difficult process. The effect of a catalyst (LeachWell 60X® LW) and Pb2+, as well as the inhibiting effect of S2-, on the performance of the extraction of gold by cyanation was studied. The anodic oxidation of gold and the cathodic reduction of oxygen, both under conventional cyanidation (1.000 p. p. m. of CN- and a oxygen-deficient environment, 5,2 p. p. m.) and enhanced cyanidation (25.000 p. p. m. of CN- and oxygensaturated environment, 24 p. p. m.) were studied by linear- and cyclic-scan potentiodynamic methods. Results indicate that Pb2+and LW display similar behavior, and confirm a significant inhibiting effect of S-2even at low concentrations (0,5 – 10 p. p. m.). The significant increase in the overall dissolution rate was attributed mainly to the increase in the rate of oxygen reduction.
---------- Key words: >catalyst, intensive cyanidation, gold, sulphide, LeachWell 60X®.
Introducción
La búsqueda de acelerantes efectivos para la disolución de oro en soluciones de cianuro y su aplicación a la extracción del metal a partir de minerales refractarios a la lixiviación, ha impulsado el desarrollo comercial de productos como el LeachWeell 60X® (LW) para ser empleados como catalizadores de cianuración. El LW es una mezcla de sales sódicas orgánicas e inorgánicas, con un contenido de plomo de 1,14%. Se ha señalado al plomo como un ingrediente activo y también como su único componente peligroso. Su desempeño ha sido evaluado con diferentes resultados, destacándose su efectividad en circuitos de cianuración intensiva (altas concentraciones de CN- y de O2 disuelto) de concentrados sulfurados refractarios de alta ley; donde la cianuración convencional no ofrece una respuesta favorable [1].
Generalmente se acepta que la disolución del oro en soluciones de cianuro es un proceso electroquímico que procede a través de varias etapas. El siguiente mecanismo ha sido propuesto por Kira y colaboradores para la reacción anódica [2].

Las curvas de polarización anódica del oro en soluciones de cianuro se caracterizan por mostrar tres zonas de actividad electroquímica. La primera se sitúa hacia -500 mV vs. el electrodo de calomel saturado (SCE) y corresponde a la formación de Au(CN)ads. Las dos restantes están ubicadas hacia 100 y 400 mV y corresponden a la formación del hidróxido Au(OH)3 y del óxido Au2O3, adsorbidos respectivamente [3].
Por otro lado, la reacción catódica involucra la reducción del oxígeno disuelto a través de una transferencia directa de 4 electrones (ecuación 4) o en dos pasos consecutivos con la transferencia de 2 electrones cada uno (ecuaciones 5 y 6) [3].


El ión S-2 es un producto de descomposición de los sulfuros metálicos en soluciones alcalinas de cianuro, que inhibe de manera significativa la formación del complejo aurocianuro Au[(CN)2]-. Bajo las condiciones de pH en que se desarrolla el proceso de cianuración, el ión S-2 se encuentra en equilibrio químico con el ión hidrosulfuro (HS-) [4].

La influencia del plomo sobre la cinética de la reacción anódica de disolución de oro en soluciones de cianuro, también ha sido ampliamente documentada y su estudio aparece ligado al del ión sulfuro. Se ha observado que el plomo puede neutralizar el efecto negativo del sulfuro, por tal razón es considerado un catalizador de cianuración y además porque su presencia acelera significativamente la velocidad de disolución del oro [5].
Este trabajo está dirigido hacia la exploración del mecanismo de acción del catalizador comercial LW y también hacia el mejor entendimiento y discusión del efecto del plomo como catalizador de la disolución del oro en soluciones de cianuro.
La presencia de los iones S-2 simula el ambiente químico generado por la descomposición de minerales sulfurados. Algunas consideraciones cinéticas y del rendimiento de la reacción, se hacen con base en la teoría del potencial de mezcla. Además, se hace una interpretación global del modo como transcurre la reacción.
Detalles experimentales
Reactivos
Todas las soluciones se prepararon con reactivos de grado analítico y agua destilada. El catalizador LW fue suministrado por la compañía australiana Gekko. Las cantidades de sulfuro y plomo añadidas al sistema se tomaron de soluciones de 1.000 p. p. m. de S-2y Pb+2, preparadas a partir de Na2S.9H2O y Pb(NO3)2, respectivamente. Como fuente de cianuro se empleó NaCN. El pH de las soluciones se ajustó con NaOH 0,1 M. Los experimentos se realizaron empleando una solución de KNO3 0,5 M como electrolito soporte.
Electrodos
Los experimentos se efectuaron en una celda electroquímica convencional de tres electrodos, de 200 mL de capacidad, fabricada en pyrex, y equipada con un capilar “luggin”. Como electrodo de referencia se usó el electrodo de plata/cloruro de plata (Ag/AgCl) 3M de KCl y como contraelectrodo se empleó un alambre de platino, separado de la solución por una membrana porosa de vidrio. El electrodo de trabajo utilizado fue un electrodo de disco rotatorio de oro, fabricado por PINE Instrument Company, con un área de 0,196 cm2. Previo a cada experimento, el electrodo fue pulido hasta brillo de espejo. Luego se dejó en una solución de HNO3 al 5% durante 10 min, para remover posibles contaminantes. Finalmente se lavó con abundante agua destilada.
Mediciones potenciométricas
Las mediciones electroquímicas se realizaron con un bipotenciostato AFCBP1 PINE Instrument Company, controlado por el software PineChem 2.7.5 y dotado de un rotor MSRX PINE Instrument Company. Todos los potenciales se reportan con respecto al electrodo Ag/AgCl. Las curvas de polarización anódica fueron registradas en soluciones libres de oxígeno (< 0,1 p. p. m.), mediante la desoxigenación con N2 (99,999%) durante 30 min. Los barridos de potencial se hicieron entre -1.000 y 1.000 mV, en la dirección anódica.
Las curvas de reducción de O2 se tomaron en soluciones libres de cianuro y bajo tres condiciones diferentes de oxígeno disuelto: oxígeno ambiental, saturada con aire y saturada con O2 99,999%. Los barridos catódicos se hicieron entre 100 y -1.000 mV en la dirección catódica. Una vez puesto el electrodo de trabajo en la solución electrolítica, se hicieron las respectivas adiciones de S-2 y Pb+2. Luego se dejó equilibrar el sistema durante 5 min, para así iniciar las mediciones. En los casos donde se evaluó el LW, fue necesario preparar las soluciones correspondientes con anterioridad, debido principalmente a problemas de solubilidad. Todo el equipamiento de la celda electroquímica fue cuidadosamente lavado entre los experimentos.
Resultados y discusión
Comportamiento anódico del oro en soluciones de cianuro
En la figura 1se presentan los voltagramas de barrido lineal anódico del oro en soluciones de cianuro, en donde se pueden observar tres regiones de potencial en que se manifiesta la actividad anódica. El perfil anódico obtenido bajo estas condiciones experimentales es similar al presentado por Aghamirian [6] y Cerovic [7]. Las curvas registradas bajo condiciones de cianuración convencional y de cianuración intensiva difieren en la magnitud de densidad de corriente (I). Con respecto al primer pico anódico (hacia -500 mV) relacionado con la formación de Au[(CN)2]-, se observa que la variación de la corriente no es tan significativa, si se tiene en cuenta la enorme diferencia entre las concentraciones de cianuro. Lo anterior se relaciona con una limitación en el transporte del cianuro hacia la superficie del electrodo.
Específicamente se trata de la formación de una capa pasiva de Au(CN)ads que limita el transcurso de la reacción en la región de potencial de mayor interés [3].
Las siguientes dos corrientes de oxidación obtenidas en la dirección del potencial anódico corresponden a fenómenos superficiales similares de formación de hidróxido y óxido de oro, respectivamente. Cabe aclarar que bajo estas condiciones, sólo es posible la formación de dichas especies en fase adsorbida y no se debe esperar que se formen bajo las condiciones normales de la operación de cianuración.
Figura 1 Curvas de polarización anódica del oro en soluciones puras de cianuro.
KNO3 0,5 M, pH 10,5, 450 r. p. m., 5 mV/s
Efecto de los iones S-2 y Pb+2
El fuerte efecto negativo sobre la oxidación del oro causado por los iones S-2 se observa en la figura 2, donde se puede apreciar que una concentración mínima de iones sulfuro (0,5 p. p. m.), bloquea el pico anódico correspondiente a la generación de Au[(CN)2]-. Lo anterior también se manifestó con adiciones superiores de S-2 y en cualquiera de las concentraciones de cianuro estudiadas.
También es importante anotar que la presencia de los iones sulfuro, genera una fuerte corriente de oxidación en la región de potencial entre -300 y +100 mV, donde generalmente la actividad anódica es muy baja. Lo anterior es más significativo a bajas concentraciones de cianuro.
Es muy probable que debido a la alta electronegatividad del oro, aniones con alta densidad de carga como los iones sulfuro e hidrosulfuro, se descarguen sobre la superficie de este metal [6].
El resultado de este proceso debe corresponder a la generación de una monocapa constituida por fuertes interacciones AuS y con carácter insoluble, ya que termodinámicamente no es posible la obtención de algún compuesto Au-S estable en estas condiciones. Las ecuaciones 8 y 9 ilustran el posible mecanismo mediante el cual, el ión S-2, en equilibrio con HS-(ecuación 7), es adsorbido sobre el oro. En el transcurso de la reacción anódica es posible que se formen capas poliméricas de Au(Sx+1) [8].

Es de resaltar que el efecto del ión S-2prevalece a pesar de una concentración tan elevada de cianuro, como la utilizada en la cianuración intensiva (figura 2b). Esto es una muestra interesante del tipo de interacción existente y de la manera tan compleja como el ión sulfuro puede modificar la superficie del oro.
Por otra parte y con respecto al efecto del plomo, los voltagramas presentados en lasfiguras 2(a) y 2(b), dejan ver su marcada influencia en la región de potencial donde se genera el complejo Au[(CN)2]-, la cual es mucho más pronunciada en condiciones de cianuración intensiva. Asimismo, el plomo no modifica significativamente las otras regiones de actividad anódica. Experimentalmente se observó que el efecto catalítico del plomo está sujeto a su concentración y parece aumentar hasta la adición de 2 p. p. m.. Concentraciones mayores generan disminución en el efecto catalítico, debi
Figura 2 Curvas de polarización anódica del oro en soluciones de cianuro, en presencia de iones S-2y Pb+2. (a)
1.000 p. p. m. de CN-. (b) 25.000 p. p. m. de CN-. KNO3 0,5M, pH 10,5, 450 r. p. m., 5 mV/s
do probablemente a la formación de películas de hidróxido de plomo. Es de suponer que el efecto del Pb+2 está relacionado con la remoción de las capas pasivas o con el impedimento de su formación. Sin embargo, a pesar del cambio revelador en la corriente, la acción del plomo sobre la superficie del oro no puede detener la formación de la película de Au[(CN)x]ads, que limita el libre transcurso de la reacción en un amplio rango de potencial.
Para el caso donde se adicionaron el plomo y el sulfuro simultáneamente, se observó que existe estrecha relación recíproca entre las concentraciones de cada ión y sus correspondientes efectos pasivador o catalítico. Es decir, que cada uno de estos agentes puede modificar la superficie de oro, en la medida en que lo permita su concentración relativa con respecto al otro. Lo anterior lleva a suponer que el plomo y el sulfuro reaccionan sobre la superficie del oro y también en el seno de la solución, para formar PbS, de acuerdo con la ecuación 10 y así ser removidos de la superficie del electrodo.

Cabe aclarar que aunque la condición de pH favorece la precipitación del PbS, los iones de azufre y de plomo aún permanecen en solución según el valor del Kps. De ser así, el fenómeno que se está presentando es un proceso dinámico de precipitación-solubilización del PbS sobre la superficie del electrodo, permitiendo así que se debilite o se fortalezca la fuerte capa pasiva de Au(Sx)ads.
Efecto del LW
En la figura 3se presentan los voltagramas correspondientes a la polarización anódica del oro en presencia del catalizador LW. Las principales diferencias entre los perfiles anódicos registrados con LW y sin él, son expuestas con base en lo que se conoce de su composición química.
Figura 3 Curvas de polarización anódica del oro en soluciones de cianuro, en presencia del catalizador LW. (a) 1.000 p. p. m. de CN-, LW 0,5%. (b) 25.000 p. p. m. de CN-, LW 0,25 y 0,5%. KNO3 0,5 M, pH 10,5, 450 r. p. m., 5 mV/s
La presencia de una corriente importante de reducción, proporcional a la concentración del LW (figura 3b), en la región de potencial entre -1.000 y -500 mV, es atribuida a su contenido de especies químicas reducibles sobre el oro. La actividad anódica manifestada en la región de potencial hacia -500 mV es probablemente inducida por su contenido de plomo (1,14 %). La región de potencial entre 0 y 1.000 mV conserva un perfil similar al mostrado cuando no hay LW.
Efecto del LW y S-2
La fuerte influencia sobre la superficie del oro, manifestada por los iones sulfuro, no pudo ser anulada en una solución de cianuro de 1.000 p. p. m. que contiene el 0,5% en peso de LW. En la figura 3(a)se aprecia que 5 p. p. m. de S-2, perturban considerablemente el perfil anódico de polarización del oro. Es de esperar, que el plomo contenido en el LW bloquee la acción del sulfuro.
Sin embargo este efecto sólo fue observado en condiciones de cianuración intensiva (figura 3b), incluso cuando el sulfuro está en concentraciones superiores.
Para comprobar si el sulfuro efectivamente está impidiendo la formación del complejo Au[(CN)2], aun en presencia del LW, se registraron los correspondientes voltagramas cíclicos.
En la figura 4se compara el efecto del catalizador LW en presencia y ausencia de S-2, para un sistema de cianuración convencional. El comportamiento electroquímico del sistema en el barrido cíclico, reveló que sí hay pasivación del oro, al suprimirse el pico anódico correspondiente a la formación del complejo aurocianurado.
Figura 4 Voltametría cíclica de oro en soluciones de cianuro 1.000 p. p. m. y LW 0,5%. Efecto del sulfuro. KNO3 0,5 M, pH 10,5, 450 r. p. m., 5 mV/s
Comportamiento catódico. Reducción de O2 sobre oro
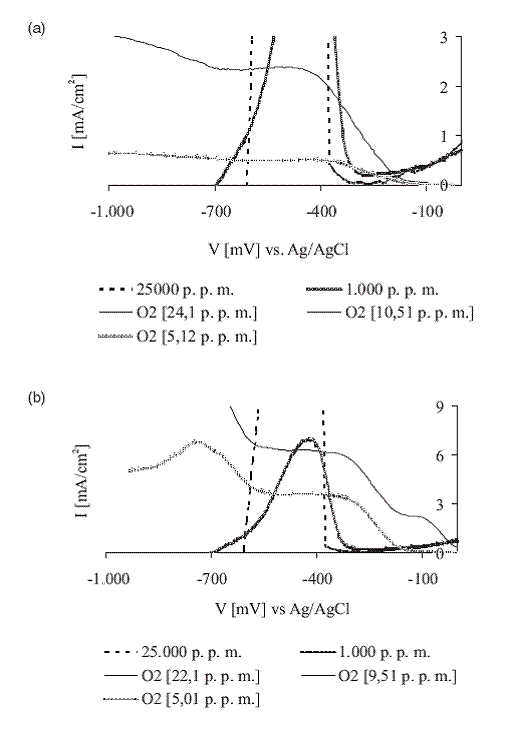
La figura 5(a)representa la reducción del O2 sobre el oro en soluciones puras y contaminadas con iones S-2 y Pb+2. Cuando la forma de la onda de reducción es sencilla, se cree que la reducción transcurre en un sólo paso y con la transferencia directa de 4 electrones. Si la forma de la onda no es regular, se cree que dicho proceso transcurre en dos pasos consecutivos [9]. Este último mecanismo describe mejor las curvas de reducción de oxígeno obtenidas y los resultados concuerdan con los presentados por Guan [10] y Kongkanand [11]. Los voltagramas obtenidos en la presencia de Pb+2, dejan ver que el plomo pronuncia la forma de la onda y genera un máximo de corriente catódica (-480 mV). Este resultado se asocia a un efecto catalítico y es contrario a lo observado en presencia del S-2, donde se registra una disminución en la corriente de reducción de O2.
Efecto del LW
En la figura 5(b) se presenta el efecto del LW sobre la reducción de O2, donde se logra observar su fuerte influencia en el perfil catódico.
Figura 5 (a) Voltagramas de reducción de O2 (24,1 p. p. m.) sobre oro. (b) Efecto de LW (0,5%) sobre la reducción de O2 (22,1 p. p. m.). KNO3 0,5 M, pH 10,5, 450 r. p. m., 5 mV/s
Los voltagramas claramente muestran que la reducción de oxígeno bajo estas condiciones, es un proceso electroquímico bastante complejo. La densidad de corriente aumenta con la concentración de O2 y a medida que avanza el barrido, se pueden ver tres regiones definidas de activación por transferencia de carga (sección de las curvas con alta pendiente) y dos regiones controladas por transferencia de masa (mesetas de las curvas).
Lo anterior indica que hay como mínimo dos especies diferentes susceptibles de reducirse sobre el oro. Además, el LW activa la reducción de oxígeno, ya que sumado al evidente aumento en la corriente, hay un inicio más temprano de la actividad catódica.
Combinación de las reacciones anódica y catódica
De acuerdo con la teoría del potencial de mezcla,el potencial de disolución y la velocidad de disolución (corriente de mezcla Imez); pueden ser obtenidos a partir de la combinación de las dos reacciones. La anterior consideración está fundamentada, en que en el punto de corte, la corriente de reducción es igual a la corriente de oxidación y que la corriente neta medida en ese punto de potencial es igual a 0 [3, 10].
Las figura 6corresponde a la intersección de las curvas anódica y catódica obtenidas bajo diferentes condiciones. En los voltagramas se observa que hay más de un punto de corte entre las curvas, indicando la complejidad de las interacciones.
Los puntos de corte seleccionados corresponden a los puntos ubicados en la región de activación de las curvas anódicas (pendiente positiva), es decir donde se promueve la actividad anódica. Las mayores velocidades de disolución o de Imez se presentaron bajo las condiciones de cianuración intensiva y en presencia de LW, lo cual indica la agresividad de la reacción. El efecto de la cianuración intensiva en presencia del LW, también se vio reflejado en una inspección macroscópica del electrodo, donde se pudo observar la fuerte corrosión de la superficie del electrodo de oro. Este resultado está asociado a un aumento significativo en la cinética de la lixiviación del metal.
Figura 6 Combinación de los voltagramas anódico y catódico para el oro. (a) Sin LW y Pb+2 0,5 p. p. m. (b) Con LW 0,5%. KNO3 0,5 M, pH 10,5, 450 r. p. m., 5 mV/s
Para seguir evaluando la influencia del LW sobre la reducción del oxígeno, se calculó el orden de la reacción con respecto a la concentración de O2 disuelto, para el sistema de cianuración intensiva y cianuración convencional en presencia de LW y de Pb+2.
A partir de la superposición de las curvas anódica y catódica, presentadas en las figuras 6(a) y 6(b), se obtuvieron las Imez para tres concentraciones diferentes de O2 disuelto. Luego, si se grafican los valores del logaritmo de Imez, contra el logaritmo de la concentración de O2, como se muestra en la figura 7, puede verse que existe una relación lineal entre log (Imez) vs. log [O2]. La pendiente de estas curvas está relacionada con el orden de la reacción.
Figura 7 Cálculo teórico del orden de reacción con respecto a la concentración de oxígeno disuelto
Para el caso donde no se empleó el LW, el orden de la reacción hallado fue 0.9938 y 0.9959 para la cianuración intensiva y convencional, respectivamente. Los anteriores valores cercanos a la unidad, indican que la constante de velocidad de la reacción sólo depende de la concentración de oxígeno.
Con la participación del LW en la reducción de O2, se hallaron órdenes de reacción de 0,3555 y 0,3516 para la cianuración intensiva y convencional, respectivamente. Estos valores indican que se ha modificado el mecanismo de participación de O2 en la disolución del oro. La interpretación de este valor numérico de orden de reacción, es un poco compleja desde el punto de vista cinético y electroquímico, pero es importante resaltar que es una muy buena aproximación teórica para valorar y explorar los cambios que sufre una superficie electroactiva.
Conclusiones
Los efectos inhibidor y catalítico correspondientes a los iones S-2 y Pb+2, sobre el comportamiento anódico del oro en soluciones cianuradas, son dependientes de su concentración relativa sobre la superficie del metal.
La influencia del catalizador LW sobre el comportamiento anódico del oro es muy similar a la influencia efectuada por los iones Pb+2, la cual se manifiesta en el aumento de la corriente de oxidación hacia -500 mV vs. Ag/AgCl.
El catalizador LW modifica favorablemente los perfiles de polarización anódica y catódica del oro en soluciones de cianuro. Este efecto está asociado con el aumento en la cinética de disolución del oro, observable tanto en soluciones concentradas de cianuro como en soluciones diluidas.
El efecto pasivador de la capa de sulfuro formada sobre el oro, no se puede contrarrestar por el LW en soluciones diluidas de cianuro. La obtención de los voltagramas cíclicos reveló que no hay formación del complejo Au[(CN)2]-. El efecto contrario se observó en condiciones de cianuración intensiva.
La reducción del catalizador LW sobre el oro refleja una intensa actividad catódica, la cual modifica el mecanismo y la cinética de reducción de oxígeno. Lo anterior se sustenta en las diferencias entre el orden de reacción con respecto al oxígeno, calculado en presencia y ausencia de LW respectivamente.
Agradecimientos
Los autores manifiestan sus agradecimientos a la Dirección de Investigaciones de la Facultadde Ingenierías Fisicoquímicas de la Universidad Industrial de Santander por la financiación de este trabajo.
Referencias
1. N. Grigg, S. Dorey. Preliminary investigation into gravity concentration, intensive cyanidation and electrowinning of Nezhdaninskoye. Rom Ore. Gekko Systems, Australia, 2002. http://www.celticresources.com/archive/Gekko%20Test%20ReportFeb%202002.pdf. Consultado el 20 de enero de 2005. [ Links ]
2. D. Kirk, W. Foulkes, F. R. Graydon. A study of anodic dissolution of gold in aqueous alkaline cyanide. J. Electrochem. Soc. Vol. 125. 1978. pp. 1436-1443. [ Links ]
3. X. Sun, C. Guan, K. Han. Electrochemical behavior of the dissolution of gold-silver alloys in cyanide solutions. Metallurgical and Materials Transactions B. Vol. 27B. 1996. pp. 355-367. [ Links ]
4. M. Jeffrey, P. Breuer. The cyanide leaching of gold in solutions containing sulfide. Minerals Engineering. Vol. 13. 2000. pp. 1097-1106. [ Links ]
5. O. May, S. Jin, E. Ghalie, G. Deschenes. Effects of sulfide and lead nitrate addition to a gold cyanidation circuit using potentiodynamic measurements. Journal of Applied Electrochemistry. Vol. 35. 2005. pp. 131-137. [ Links ]
6. M. Aghamirian, W. Yen. Mechanisms of galvanic interactions between gold and sulfide minerals in cyanide solution. En: Minerals Engineering, Vol. 18. 2005.pp. 393-407. [ Links ]
7. K. Cerovic, H. Hutchison, R. Sandenbergh. Kinetics of gold and a gold–10% silver alloy dissolution in aqueous cyanide in the presence of lead. Minerals Engineering. Vol. 18. 2005. pp. 585-590. [ Links ]
8. M. Aghamirian, W. Yen. A study of gold anodic behavior in the presence of various ions and sulfide minerals in cyanide solution. Minerals Engineering. Vol. 18. 2005. pp. 89-102. [ Links ]
9. M. Van Brussel, G. Kokkinidis, A. Hubin and C. Buess- Herman. Oxygen reduction at platinum modified gold electrodes. Electrochimica Acta. Vol. 48. 2003. pp. 3909-3919. [ Links ]
10. Y. Guan, K. Han. An electrochemical study on the dissolution of gold and copper from gold-copper alloys. Metallurgical and Materials Transactions B. Vol. 25B.1994. pp. 817-825. [ Links ]
11. A. Kongkanand, S. Kuwabata. Oxygen reduction at silver monolayer islands deposited on gold substrate. Electrochemistry Communications. Vol. 5. 2003. pp. 133-137. [ Links ]
* Autor de correspondencia: teléfono: 57+7+6550802, fax:57+7+6550802, correo electrónico: og91296@hotmail.com (O. G. Mendoza V.).