Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Ingeniería Universidad de Antioquia
Print version ISSN 0120-6230On-line version ISSN 2422-2844
Rev.fac.ing.univ. Antioquia no.37 Medellín JulySep. 2006
Revista Facultad de Ingeniería N.o 37. pp. 41-49. Julio, 2006
Resumen
Partiendo de óxido de magnesio comercial se preparó una suspensión acuosa, la cual se secó y calcinó para conferirle estabilidad térmica. El material, tanto fresco como usado, se caracterizó mediante DRX, área superficial BET y SEM-EPMA. El catalizador mostró una matriz de MgO tipo periclasa con CaO en la superficie. Las pruebas de actividad catalítica se efectuaron en lecho fijo empacado con partículas obtenidas mediante prensado, trituración y clasificación del material.
El flujo de reactivos consistió en mezclas gas natural-aire por debajo del límite inferior de inflamabilidad. Para diferentes flujos y temperaturas de entrada de la mezcla reactiva, se midieron las concentraciones de CH4, CO2 y CO en los gases de combustión con un analizador de gases tipo infrarrojo no dispersivo (NDIR). Para alcanzar conversión total de metano se requirió aumentar la temperatura de entrada al lecho a medida que se incrementó el flujo de gases reaccionantes. Los resultados obtenidos permiten desarrollar un sistema de combustión catalítica de bajo costo con un material térmicamente estable, que promueva la alta eficiencia en la combustión de gas natural y elimine los problemas de estabilidad, seguridad y de impacto ambiental negativo inherentes a los procesos de combustión térmica convencional.
---------- Palabras clave: Combustión catalítica, óxido de magnesio, gas natural, lecho empacado.
Preparation, characterization and evaluation of MgO for flameless combustion of natural gas
Abstract
A MgO catalyst was prepared by aqueous dispersion of commercial magnesium oxide followed by drying and calcination to obtain a thermally-stabilized material. Fresh and used solid samples were characterized by XRD, BET surface area, and SEM-EPMA, which revealed a MgO matrix with periclase structure containing CaO on the surface. Catalytic activity tests were conducted in a fixed-bed reactor packed with MgO particles. Natural gas – air mixtures fed to the reactor were maintained below the LFL. Different flow rates and inlet temperatures were evaluated, and CH4, CO2and CO concentrations in the effluent stream were measured with a NDIR analyzer. The temperature required to achieve total methane conversion was increased as the flow rate of the reacting mixture increased. A low-cost, thermally- stable catalytic combustion system aimed at highly-efficient combustion of natural gas can be developed based on the results of this study. Moreover, this system would eliminate problems related with stability, security and environmental effects inherent to conventional thermal combustion processes.
---------- Key words: catalytic combustion, magnesium oxide, natural gas, packed bed.
Introducción
La mayor parte de los requerimientos energéticos actuales se obtiene por combustión térmica de combustibles fósiles. La combustión térmica o de llama presenta problemas tanto energéticos como ambientales, destacándose los siguientes:
Las altas temperaturas de operación tienen efectos negativos sobre los materiales y propician la formación de óxidos de nitrógeno, los cuales son contaminantes perjudiciales para la salud humana, promotores de la lluvia ácida y del smog fotoquímico.
La combustión incompleta produce emisiones de hidrocarburos sin quemar y monóxido de carbono nocivos para la salud. Además reduce la eficiencia energética del sistema de combustión.
La seguridad de los procesos se ve comprometida por la inestabilidad inherente a los sistemas de combustión con llama.
Una de las alternativas propuestas para solucionar los problemas mencionados consiste en usar materiales catalíticamente activos para la oxidación total de hidrocarburos, los cuales facilitan la combustión completa de mezclas combustible-oxidante aun por debajo del límite inferior de inflamabilidad, sin presencia de llama, con mínima formación de contaminantes y sin problemas de inestabilidad y no homogeneidad observados en la combustión térmica [1].
Los materiales más usados para combustión sin llama de hidrocarburos son los metales nobles y los óxidos de metales de transición [1, 2]. Los catalizadores basados en metales nobles, muestran problemas de sinterización y volatilización a alta temperatura, además son de alto costo. Los óxidos de metales de transición son poco activos a baja temperatura y pierden sus propiedades mecánicas y sinterizan a alta temperatura.
Entre los materiales más estudiados para combustión a alta temperatura están los hexaaluminatos y óxidos de metales alcalinotérreos [1, 3]. De estos últimos el más promisorio es el óxido de magnesio (MgO) [1]. Los hexaaluminatos han mostrado ser un poco más activos que el óxido de magnesio pero de menor estabilidad térmica y de más difícil preparación [3,4].
Gran parte del trabajo en combustión sin llama ha sido enfocado al metano, por ser el principal componente del gas natural y el hidrocarburo de mayor estabilidad química.
La oxidación de metano sobre óxido de magnesio puro o dopado con otros elementos como litio, hierro, cobalto y calcio viene aumentando en interés [5-7]. El sistema litio-óxido de magnesio muestra mayor selectividad hacia etano y etileno, por acoplamiento oxidativo, que hacia dióxido de carbono por oxidación total [4-7]. Cuando el MgO se dopa con cobalto o hierro se da la oxidación total del metano promovida por la presencia del metal de transición [8-10].
En este trabajo se reportan resultados concernientes con la preparación, caracterización y desempeño del MgO comercial como material activo para la combustión sin llama de gas natural, bajo condiciones de exceso de aire.
Preparación del catalizador
Se preparó una suspensión de hidróxido de magnesio adicionando 500 g de óxido de magnesio comercial (MgO, 95,06%; CaO, 0,9%; SiO2, 1,20%; Fe2O3, 0,50%; Al2O3, 0,50%; inertes, 1,84%) a 2,0 L de agua y se mantuvo durante 1,5 h con agitación mecánica vigorosa en un recipiente plástico. Se suspendió la agitación y se dejó el sistema en reposo durante 12 h, luego el líquido claro sobrenadante se decantó y el sólido con un contenido de humedad aproximado del 50% se secó en estufa a 125 °C por 36 h. El sólido seco se trituró y se guardó en un recipiente tapado.
Para dar la forma deseada al catalizador que permitiera colocarlo dentro del reactor como lecho empacado, el sólido en partículas se sometió en una matriz de acero para herramientas con tratamiento térmico de temple, revenido y alivio de esfuerzos con una dureza de 60 Rocwell C. A las partículas se les aplicó una fuerza de
20 t sobre un área circular de 507 mm2 (diámetro 25,4 mm), correspondiendo a una presión de 387 MPa, para obtener pastillas de 25,4 mm de diámetro y aproximadamente 1,5 cm de espesor.
Las pastillas fueron posteriormente trituradas y tamizadas. Los granos que pasaron la malla 8 y fueron retenidos en la malla 10, con tamaños entre 2,00 y 2,36 mm, se utilizaron para empacar el lecho catalítico.
Las partículas obtenidas se sometieron al proceso de calcinación en mufla eléctrica con atmósfera de aire y control de temperatura en donde el catalizador, colocado en una bandeja de acero inoxidable, se calentó desde temperatura ambiente con una rampa de 6 °C/min hasta 300 °C y se mantuvo allí durante dos horas; con una nueva rampa de 5 °C/min se elevó hasta 1.200 °C donde se mantuvo por cuatro horas más. Se enfrió la muestra de manera natural hasta temperatura ambiente.
Caracterización
El área superficial BET de los sólidos fresco y usado en reacción se determinó con un Sortometro Quantachrome Nova 1000. Las muestras se evacuaron por 3 h a 300 oC antes de medir el área superficial. En los experimentos se seleccionaron 9 valores de presiones relativas en el rango de 6,67 a 33,33 Pa.
Los análisis de DRX se obtuvieron con un Instrumento XD-D1 Shimadzu empleando radiación CuKα. La velocidad de barrido fue de 1 oC min. Los difractogramas se adquirieron para un voltaje de 30 kV y una intensidad de 40 mA.
La morfología de los catalizadores tanto frescos como usados se estudió en un microscopio JEOL, modelo JSM- 35C, operado entre 20 y 25 kV. Para la obtención de las micrografías, se adhirieron porciones representativas de las muestras con cinta
de doble faz sobre portamuestras metálicos y posteriormente se recubrieron con oro depositado por sputtering, empleando un evaporador marca VEECO, modelo VE-300 operado en atmósfera de argón.
Para el análisis químico elemental, se adhirieron porciones representativas de las muestras en forma de pastilla con cinta doble faz de grafito sobre portamuestras del mismo material y posteriormente se recubrieron con grafito mediante evaporación empleando un evaporador marca VEECO, modelo VE-300 operado en alto vacío.
El análisis se llevó a cabo tratando el espectro de rayos X con el software del sistema EDAX.
Los resultados semicuantitativos se obtuvieron usando el método cuantitativo teórico, comúnmente denominado SEMIQ, que no requiere del empleo de estándares. Los espectros de rayos X se adquirieron con una tensión de aceleración de 20 kV. La metodología analítica empleada considera como el cien por ciento al total de elementos presentes detectados.
Resultados y discusión
Difracción de rayos x (DRX)
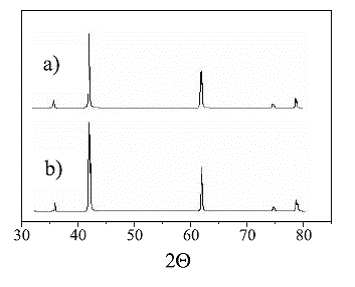
En la figura 1se muestran los difractogramas para las muestras de catalizador fresco (a) y usado (b). Para el caso (a) los picos de mayor intensidad se presentan a valores 2θ de 43,16; 62,50 y 78,82o correspondientes a intensidades relativas de 100, 53 y 14%, respectivamente. Las reflexiones corresponden a la fase periclasa del óxido de magnesio, lo cual es indicativo de la alta cristalinidad obtenida en la calcinación del hidróxido. Para el material usado (b) las principales reflexiones se presentan en ángulos 2θ de 43,06; 62,10 y 78,73o con intensidades relativas de 100, 55 y 16% respectivamente.
Esto indica que la fase cristalina presente es la periclasa. Al comparar los difractogramas (a) y (b) se observa que la cristalinidad no sufre mayores alteraciones para las condiciones bajo las cuales se usó el MgO en la combustión de metano, lo cual ratifica la alta estabilidad térmica del material.
Figura 1 Difractograma de los materiales fresco (a) y usado (b)
Área superficial BET
Las áreas superficiales de los materiales fresco y usado fueron 6,86 y 6,80 m2 g-1, respectivamente. Estas áreas resultan bajas si se comparan con las obtenidas por otros investigadores bajo unas condiciones de preparación diferentes y calcinadas a menor temperatura [3, 4]. Sin embargo, la alta estabilidad térmica del material permite que el área se conserve prácticamente inalterable después de evaluarlo en la combustión de metano donde se sometió a altas temperaturas
Micrografías y EPMA
La figura 2muestra las micrografías SEM del material tanto fresco como después de someterlo a condiciones de reacción. La figura 2(a)corresponde a la superficie del material fresco con una magnificación de 400X, donde se observa una estructura irregular con impurezas distribuidas de manera no uniforme y apariencia más clara que la matriz. En la figura 2(b)se tiene un detalle de la micrografía 2(a) con magnificación 9.400X, haciéndose más nítida la presencia de material segregado y acumulado en diferentes zonas. La micrografía 2 (c) es una vista del material usado en reacción, magnificación 400X, la cual no muestra cambios considerables en la morfología si se compara con el material fresco, figura 2(a), conservando la distribución similar de tamaños relativos y la presencia de impurezas superficiales. La figura 2(d)muestra un detalle de la superficie correspondiente a la figura 2(c)con magnificación 15.000X, en ésta se aprecia que la morfología superficial se conserva, confirmando de esta manera la alta estabilidad del óxido de magnesio sin presencia de depósitos carbonosos.
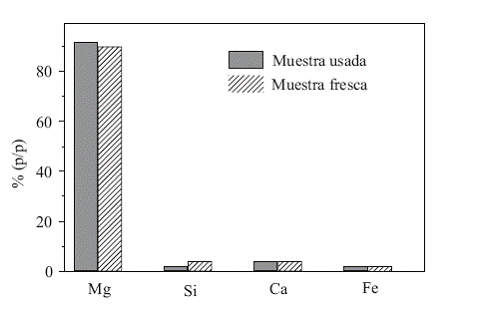
El microanálisis químico elemental por rayos X con sonda de electrones (EPMA), reveló una significativa heterogeneidad en la composición superficial de las partículas (figura 3).
Figura 2 Micrografías del material fresco (a) y (b) y material usado (c) y (d)
El principal componente es magnesio, con 90 y 92 % para el material fresco y usado respectivamente.
El calcio se conserva en 4%, indicando que el contenido de este elemento en la superficie no varía con el uso. El hierro permanece igualmente invariante en 2%. El silicio reduce su presencia en la superficie del 4% en el material fresco al 2% en el usado, lo cual se puede deber a la migración del elemento hacia el interior de la matriz de óxido de magnesio.
Las partículas blancas aglomeradas en la superficie (figura 2) pueden corresponder a óxido de calcio lo cual concuerda con los resultados del EPMA (figura 3) que muestra un contenido alto de calcio en la superficie mucho mayor que el presente en la materia prima original (0,63%). Otro indicio de que el aglomerado superficial es óxido de calcio es la tonalidad blanca observada; la segregación del calcio pudo haberse dado durante la calcinación; mejorando de esta manera la actividad del MgO en combustión del gas natural,
como lo reportan algunos estudios [7].
Figura 3 Microanálisis químico elemental por rayos X con sonda de electrones
Evaluación catalítica
Las partículas de catalizador se empacaron en el reactor tubular construido de material cerámico silicoaluminoso de 15 mm de diámetro interno, acoplado a un sistema de calentamiento eléctrico externo de 2 kW de potencia equipado con tres termopares tipo K y dos termopares tipo R que permiten sensar la temperatura a lo largo del lecho; la temperatura de entrada se mantuvo en los valores deseados con un controlador Autonics TZ4ST-14S. En las partes inicial y final del reactor, el lecho fue sostenido con discos de lana cerámica y empacado con secciones de partículas de carburo de silicio de la misma granulometría del catalizador con el fin de ayudar a homogeneizarla temperatura y composición de la mezcla reactiva.
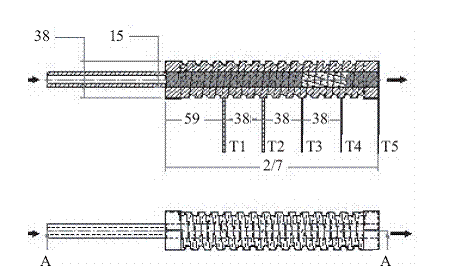
La longitud efectiva del lecho catalítico fue 38,0 mm y se ubicó entre dos secciones de carburo de silicio, donde se controló la temperatura de los gases de entrada a la zona de catalizador.
El diagrama de la figura 4muestra la ubicación de los termopares (T1 a T5) a lo largo del reactor y la región catalítica (sección clara del lecho) con las respectivas dimensiones en mm. El reactor se recubrió externamente con ladrillo refractario aislante silicoaluminoso (Erecos UA-20) de 30,0 mm de espesor y sobre éste con una manta cerámica aislante de 25,0 mm de espesor para minimizar las pérdidas de calor al ambiente.
El flujo de mezcla reactiva aire-gas natural de la Guajira(98% CH4; 0,25% C2H6; balance C3 - C6) alimentado se controló con un regulador de flujo másico Omega FMA2600. La concentración de los gases de alimentación y productos de reacción se midieron en línea con un analizador de gases tipo infrarrojo no dispersivo (NDIR) marca Maihak, tomando las muestras de gas del reactor con una sonda de acero inoxidable a la salida del lecho.
Las curvas se representaron de manera paramétrica con las relaciones masa de catalizador a flujo total (W/F) y masa de catalizador a flujo de metano (W/FCH4) como parámetros. El lecho catalítico consistió de 6,10 g de partículas con tamaños entre 2,00 y 2,36 mm; el flujo másico total de gas (medido como litros estándar por minuto, SLPM), se varió entre 2,5 y 4,7 y las concentraciones de metano estuvieron entre 1,5
Figura 4 Esquema del reactor utilizado para la evaluación catalítica (dimensiones en milímetros)
y 4,5% v/v, siempre por debajo del límite inferior de inflamabilidad. Se realizaron corridas de referencia empacando carburo de silicio en todo el reactor para estudiar la posibilidad de contribución de la conversión del gas natural por combustión térmica u otras reacciones, calentando el lecho desde 400 hasta 850 °C con incrementos de 25 °C con diferentes relaciones W/F y W/FCH4. En ningún caso se observó variación de las concentraciones de oxígeno o metano y tampoco se detectó la presencia de monóxido o dióxido de carbono como evidencia de oxidación del gas natural; es decir a temperaturas de hasta 850 °C y composiciones de alimentación por debajo del límite inferior de inflamabilidad de metano en aire (5,0% v/v) y exceso de oxígeno, no hubo combustión de gas natural bajo los regímenes de flujo ensayados, lo que permite garantizar que el carburo de silicio no interfirió en las mediciones de actividad de catalizador, comportándose como un componente químicamente inerte.
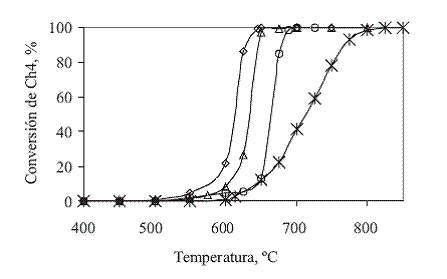
La actividad del catalizador para promover la reacción de oxidación del gas natural, se midió en función de la temperatura requerida para convertir el metano a dióxido de carbono y agua, los resultados se graficaron en la figura 5, como curvas de temperatura vs conversión de metano (Tvs vs. %XCH4).
Figura 5 Actividad catalítica del MgO para combustión de gas natural con oxígeno en exceso
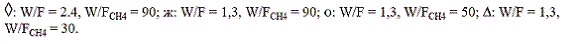
Las pruebas de actividad se realizaron después de someter el catalizador a la mezcla reaccionante por cerca de 6 h a 800 °C. El sistema se enfrió a 400 °C y se midió la concentración de los productos de reacción a la salida del lecho después de alcanzar una conversión constante con incrementos de temperatura de 50,0; 25,0 y 12,5 °C.
En la figura 5puede observarse que para relaciones W/F = 2,4 y W/FCH4 = 90,0 (flujo total y concentración de metano de 2,57 mL/min y 2,65% v/v; O2/CH4 = 7,0) el catalizador comienza a promover la reacción de combustión del gas natural a 500 °C y se alcanza conversión total de CH4 a 650 °C, es importante resaltar que la combustión fue completa dado que no se detectó la presencia de CO.
Con el fin de analizar la capacidad del catalizador para convertir el gas natural se realizaron pruebas adicionales variando tanto el flujo global como la concentración de metano. Inicialmente se aumentó el flujo global de gas de alimentación en un 80% para ver el efecto de la disminución del tiempo de contacto de los gases con el catalizador a W/F = 1,3; W/FCH4 = 90,0 (flujo total y concentración de metano de 4,5 L/min y 1,50% v/v; O2/CH4 = 12,6). Bajo estas condiciones se inicia la combustión a 550 °C, es decir 50 °C más que en el caso de W/F = 2,4 y W/FCH4 = 90,0; la conversión completa de metano se alcanza cuando la temperatura de entrada al reactor es de 800 °C; en este caso también la combustión mostró ser limpia, es decir sin la formación de monóxido de carbono.
El efecto de la concentración de gas natural en la alimentación se estudió a un flujo total constante de 4,57 mL/min, correspondiente a W/F = 1,3.
Las concentraciones de metano usadas fueron las correspondientes a W/FCH4 = 50,0 (flujo total 4,57 L/min y concentración de metano de 2,65% v/v; O2/CH4 = 7,0) y W/FCH4 = 30,0 (flujo total y concentración de metano de 4,57 mL/min y 4,50% v/v; O2/CH4 = 4,0). Se observó que a medida que aumentó la concentración de gas natural en la alimentación, la temperatura de entrada necesaria para lograr una conversión completa de CH4 disminuyó desde 800 hasta 675 °C al cambiar la relación W/FCH4 de 90,0 a 30,0 siendo de 700 °C para un W/FCH4 de 50,0.
Esta disminución de la temperatura podría estar relacionada con la menor relación entre la cantidad de calor desprendido por la reacción y calor disipado hacia el ambiente a medida que se aumenta la cantidad de gas natural quemado em el lecho, pues la reacción de combustión no se da completamente sobre la superficie del catalizador sino que el catalizador hace las veces de iniciador o generador de radicales que continúan reaccionando en la fase gaseosa hasta alcanzar una conversión completa, es decir que se tiene una combustión homogénea soportada catalíticamente; esto se evidenció con el hecho de que la temperatura de salida del lecho catalítico (T4) fue superior a la de entrada (T3) pero inferior a la temperatura de los gases a la salida del reactor (T5). Adicionalmente, dado que la zona final empacada con carburo de silicio es corta (25,0 mm) y la cantidad de calor liberado en ésta es grande, se puede asegurar que las velocidades de reacción son altas, características de reacciones en fase homogénea entre radicales libres. En ninguno de los casos estudiados se detectó la presencia de CO como producto de la combustión.
Se puede decir entonces, con base en los resultados obtenidos en las pruebas de actividad catalítica del MgO que para las condiciones bajo las cuales se trabajó, el catalizador muestra un excelente comportamiento para promover la combustión completa de gas natural.
Conclusiones
El MgO mostró excelente estabilidad térmica hasta 1.200 oC como revelaron los análisis de difracción de rayos X y adsorción BET en los cuales no se observó variación en la cristalinidad y área superficial entre materiales frescos y usados para combustión de gas natural.
Se desarrolló un método sencillo para la preparación de óxido de magnesio a bajo costo y con alta efectividad que promueve la combustión de gas natural en condiciones de exceso de aire, el cual es ambientalmente amigable. Se alcanza combustión completa sin emisiones de contaminantes como CO, CH4 y mediante el control adecuado de temperatura (menor a 1.400 oC) puede evitarse la formación de óxidos de nitrógeno. Podría escalarse a nivel industrial para alcanzar la potencia térmica requerida en diferentes procesos.
Se presume que las especies de óxido de calcio que emigraron hacia la superficie del catalizador, así como los óxidos de hierro allí presentes, son importantes en su desempeño para combustión soportada catalíticamente del gas natural em condiciones de exceso de aire.
Agradecimientos
Los autores agradecen el apoyo financiero del Comité para el Desarrollo de la Investigación (Codi) de la Universidad de Antioquia. A los integrantes de los grupos: Gas-URE y PFA por su asistencia técnica. Al Instituto de Investigaciones en Catálisis y Petroquímica (Incape), República Argentina.
Referencias
1. M. Zwinkels, S. G. Jaras, P. Menon. Catalytic materials for high temperature combustion. Catalysis Review - Science and Engineering. Vol. 35. 1993. pp. 319-358. [ Links ]
2. L. D. Pfefferle, W. C. Pfefferle. Catalysis in combustion. Catalysis Reviews – Science and Engineering. Vol. 29. 1987. pp. 219-267. [ Links ]
3. M. Berg, S. Jaras. Catalytic combustion of methane over magnesium oxide. Applied Catalysis A. Vol. 114. 1994. pp. 227-235. [ Links ]
4. M. Berg, S. Jaras. “High temperature stable magnesium oxide catalyst for catalytic combustion of methane: A comparison with manganese-substituted barium hexaaluminate”. Catalysis Today. Vol. 26. 1995. pp. 223-236. [ Links ]
5. J. L. Dubois, C. J. Cameron. “Common features of oxidative coupling of methane cofeed catalyst”. Applied Catalysis. Vol. 67. 1990. pp. 49-71. [ Links ]
6. T. Ito, J. Wang, C. Lin, J. Lunsford. “Oxidative dimerization of methane over Lithium-Promoted magnesium oxide catalyst”. Journal of American Chemical Society. Vol. 107. 1985. pp. 50-62. [ Links ]
7. J. B. Kimble, J. H. Kolts. Playing matchmaker with methane. Chemtech. Agosto. 1987. pp. 501-505. [ Links ]
8. J. M. Aigler, J. H. Lunsford. Applied Catalysis. Vol. 70. 1991. pp. 29. Citado en: M. Berg, S. Jaras. Catalytic combustion of methane over magnesium oxide”. Applied Catalysis A. Vol. 114. 1994. pp. 227-235. [ Links ]
9. I. Matsuura, Y. Hashimoto, O. Takayasu, K. Nitta, Y. Yoshida. Heat-stable ultafine single-crystal magnesium oxide and its character as a support material for hightemperature combustion catalysts. Applied Catalysis. Vol 74. 1991. pp. 273-280. [ Links ]
10. R. Spretz, S. G. Marchetti, M. A. Ulla E. A. Lombardo. Fe/MgO formulations for the catalytic combustion of methane. Journal of Catalysis. Vol. 194. 2000. pp. 167-174. [ Links ]
* Autor de correspondencia: teléfono: (97)+4+2105537, fax: (97)+4+2105537, correo electrónico: egomez@udea.edu.co (E. Gómez M.)