Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Ingeniería Universidad de Antioquia
Print version ISSN 0120-6230On-line version ISSN 2422-2844
Rev.fac.ing.univ. Antioquia vol.38 no.1 Medellín Jan./Jun. 2006
Estudio del efecto del pH sobre las propiedades morfológicas y eléctricas de polianilina obtenida electroquímicamente
Vanesa Alzate Restrepo, Diego Andrés Vasco Calle, Javier González Ocampo*
Universidad Nacional de Colombia Sede Medellín. Calle 59A N.º 63-20 Medellín, Colombia
(Recibido el 21 de abril de 2005. Aceptado el 8 de junio de 2006)
Resumen
En el presente trabajo se estudió el efecto del pH de la solución sobre la morfología y la conductividad de polianilina (pani) obtenida electroquímicamente, propiedades evaluadas mediante microscopía de barrido electrónico (SEM) e impedancia faradaica respectivamente. Aunque el crecimiento de la polianilina ocurre tanto en medios ácidos como básicos, se encontró que las películas obtenidas a pH, mayores de 2.0 sufren cambios estructurales que inciden en las propiedades conductoras de pani.
---------- Palabras clave: Polímeros conductores, polianilina, efecto del pH, morfología, propiedades eléctricas.
The effect of pH on morphology and electrical properties of polyaniline
AbstractThe effect of the solution pH on the morphology and conductivity of electropolymerized polyaniline was studied via scanning electron microscopy (SEM) and faradaic impedance. Although polyaniline grows in both acidic and basic media, it was found that films polymerized at pH higher than 2.0 suffer structural changes which affected polymer conductivity.
---------- Key words: conductive polymers, polyaniline, pH effect, morphology, electrical properties.
Introducción
La polianilina (pani) ha sido tema de numerosas investigaciones [1-5] debido a su facilidad de síntesis, estabilidad electroquímica y electroactividad [6]. Entre las aplicaciones encontradas para pani y otros polímeros conductores [7, 8] se encuentra la elaboración de electrodos modificados para la electroxidación de hidrógeno [9] y algunas moléculas orgánicas [10-12], biosensores [11], dispositivos electrocrómicos [12], capacitores [13], protección de metales contra la corrosión [14], baterías recargables de litio [15], actuadores (músculos artificiales) [16], etcétera.
La caracterización electroquímica de pani ha llevado a la identificación de cuatro (4) estados de oxidación: las formas totalmente oxidada (pernigranilina) y reducida (leucoesmeraldina), y los estados de oxidación intermedios (nigranilina y esmeraldina) [6]; el estado de oxidación intermedio esmeraldina ha sido reconocido como la forma del polímero que presenta mayor conductividad, y por lo tanto el de mayor interés por parte de algunos investigadores [4, 17, 18].
Durante la obtención potenciodinámica de pani se han identificado tres (3) procesos redox. El primero, el cual aparece alrededor de +0,2 V vs. Ag/AgCl, involucra los estados completamente reducido (leucoesmeraldina) y parcialmente oxidado (esmeraldina), mientras el segundo proceso redox de pani, alrededor de +0,8 V vs. Ag/AgCl, implica los estados completamente oxidado (pernigranilina) y parcialmente reducido (nigranilina). Mientras el tercer proceso redox, el cual se manifiesta alrededor de +0,5 V vs. Ag/AgCl, corresponde a los productos de degradación benzoquinona/hidroquinona [19].
Se ha encontrado que el pH de la solución tiene efecto sobre la velocidad de crecimiento de pani [20], las propiedades eléctricas [17] y la estructura de las cadenas de polímero [21]. Aunque el crecimiento de pani ocurre tanto en pH ácidos como básicos, se ha encontrado que pani obtenida a pH básicos no presenta electroactividad [20], sin embargo luego de caracterizar estas películas mediante voltametría cíclica en una solución libre de anilina a pH 0 se observó un incremento en la electroactividad.
El efecto del pH sobre la velocidad de crecimiento está ligado al anión presente en la solución; es así como luego de comparar las cargas catódicas de las películas obtenidas a diferentes pH y en presencia de los diferentes aniones, Duic et al. [20] observaron un decrecimiento de la carga al aumentar el pH para todos los aniones (Cl-, ClO4-, NO3- HSO4- /SO4=) en la región de pH de 0 a 3, a pH más altos para soluciones de perclorato y nitrato encontraron que al aumentar el pH aumenta la carga hasta que alcanza un valor constante a pH 6. Sin embargo, para los otros aniones la carga continúa disminuyendo.
En este trabajo se realiza el estudio del efecto del pH de la solución sobre las propiedades eléctricas y morfológicas de pani, para tal fin se utilizaron técnicas de caracterización electroquímica (voltametría cíclica e impedancia faradaica) y microscopía de barrido electrónico (SEM).
Procedimiento experimental
Antes de llevar a cabo la polimerización, la anilina grado reactivo fue destilada al vacío en presencia de óxido de zinc a una temperatura de 46 ºC, mientras los demás reactivos fueron utilizados sin purificación adicional.
La polimerización de la anilina se llevó a cabo en una celda de tres electrodos de un solo compartimiento a temperatura ambiente y bajo una atmósfera de N2. Se utilizó como referencia un electrodo de Ag/AgCl (todos los potenciales están referidos a este electrodo), el electrodo auxiliar fue un alambre de platino y como sustrato se empleó un electrodo de carbón vítreo pulido a espejo (0,0314 cm2).
El pH de las soluciones fue ajustado mediante la adición de una solución concentrada de NaOH a una solución 0,2 M de anilina y 1,0 M de ácido sulfúrico, los estudios se realizaron en el intervalo de 0 a 12. Pani se obtuvo mediante la técnica de barrido de potencial en una estación BAS 100,
aplicando 90 ciclos a una velocidad de barrido de 50 mV/s en el intervalo de potencial de –0,2 a +0,7 V, recomendado por diferentes autores [18, 22]. Para activar el crecimiento de pani se realizó previo a la polimerización, dos ciclos en un intervalo amplio (-0,2 a+0,9 V) de potencial.
El estudio de los efectos de las variables sobre las propiedades de pani (espesor, morfología y conductividad) se hizo por medio de la caracterización mediante voltametría cíclica (BAS 100), microscopía de barrido electrónico (SEM Jeol JSM-5910LV con microsonda EDS) e impedancia faradaica (IMGe BAS-ZAHNER).
Las pruebas de impedancia faradaica se realizaron en el intervalo de frecuencias de 100 kHz a 0,1 Hz a un potencial de +0,5 V y una amplitud de 10 mV. Antes de llevar a cabo las mediciones de impedancia los electrodos fueron sometidos al potencial de +0,5 V hasta alcanzar el equilibrio. Las pruebas se realizaron en solución 1,0 M de ácido sulfúrico libre de monómero. La caracterización por voltametría cíclica se llevó a cabo en soluciones 1,0 M de ácido sulfúrico a una velocidad de barrido de 10 mV/s y en el intervalo de –0,2 v a +0,7 V.
El espesor de las películas fue estimado mediante el uso de la relación 500 C/cm3 [23], utilizada cuando la activación del crecimiento se realiza mediante el método mencionado anteriormente.
Resultados y discusión
Efecto del pH sobre el crecimiento de pani
Los voltamogramas de obtención de pani a pH muy ácidos (pH < 2) muestran la forma típica, en la cual los picos permanecen alrededor del mismo potencial al aumentar el número de ciclos y prevalecen las corrientes faradaicas sobre las capacitivas. Sin embargo al observar el voltamograma de pani obtenido a pH = 1 (figura 1) y pH = 2 (figura 2), se nota cómo los picos correspondientes a los otros estados de oxidación de pani se van corriendo hacia potenciales menos positivos. Estas observaciones están de acuerdo a los resultados obtenidos por Focke [17], según el cual el potencial correspondiente al primer proceso redox de pani no depende del pH, mientras el potencial de pico, correspondiente al segundo proceso redox, es inversamente proporcional al pH.
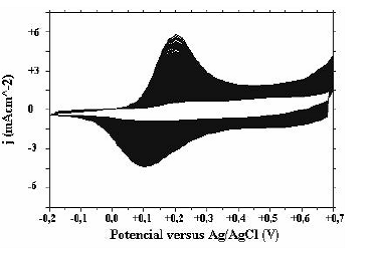
Figura 1. Voltamograma de obtención de pani solución pH=0.0, (-0.2V-+0.7V, 90 ciclos)
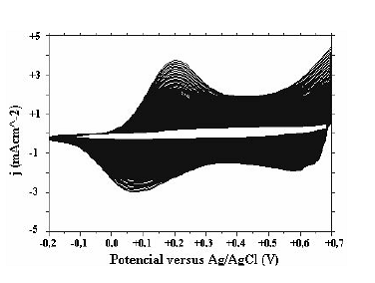 Figura 2 Voltamograma de obtención de pani solución pH=1.0, (-0.2V-+0.7V, 90 ciclos)
Figura 2 Voltamograma de obtención de pani solución pH=1.0, (-0.2V-+0.7V, 90 ciclos) A pH = 3 sólo se logra observar un par de picos (figura 3) los cuales, a diferencia del caso a pH 2, permanecen alrededor del mismo potencial con la aplicación sucesiva de ciclos. Sin embargo éstos no están ubicados en los potenciales usuales; es posible que debido a un cambio estructural de las cadenas de polímero, los picos correspondientes al primer proceso redox aparezcan a potenciales más positivos
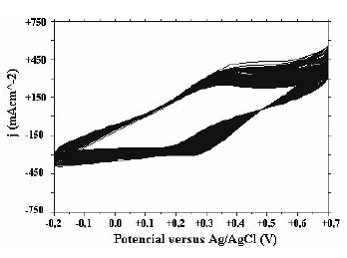
Figura 3 Obtención de pani solución pH=3.0, (-0.2V-+0.7V, 90 ciclos)
A pH mayores de 5,0 (figura 4) no se observó la presencia de picos y contrario a los casos en los cuales se obtuvo pani a pH bajos, con la realización sucesiva de ciclos hay disminución de las corrientes.
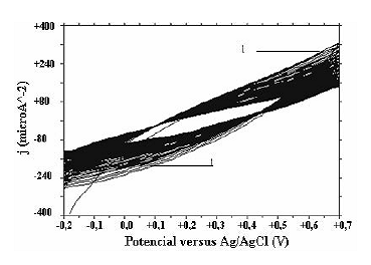
Figura 4 Obtención de pani solución pH=5.0, (-0.2V-+0.7V, 90 ciclos).
En la caracterización de las películas se observa cómo a partir de pH = 2 (figura 6) los picos redox se mueven hacia potenciales más positivos y además cambia la forma de los voltamogramas; esta observación ya había sido realizada [24] y explicada a partir de estudios de FTIR, en los cuales se compararon los espectros de pani obtenida a pH = 0,2 y pH = 3,7, a simple vista éstos no mostraron diferencias apreciables, pero con un estudio más detallado se logró identificar la presencia de enlaces N-N, los cuales corresponden a enlaces del tipo cabeza-cabeza. Aunque no se presenta un pico en la frecuencia correspondiente a los enlaces C=O, sí se observa un aumento de la absorbancia en esta región al aumentar el pH, esto fue atribuido a la presencia de compuestos de p-benzoquinona en las cadenas de polímero. Estudios similares fueron realizados a películas obtenidas a pH = 7 [21] en los cuales se observaron picos claramente definidos a estas frecuencias.
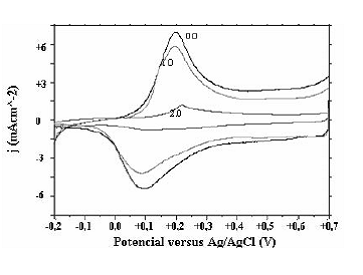
Figura 5 Voltamogramas de caracterización en solución 1.0M de H2SO4 para pani obtenida a diferentes pHs (0.0, 1.0, 2.0)
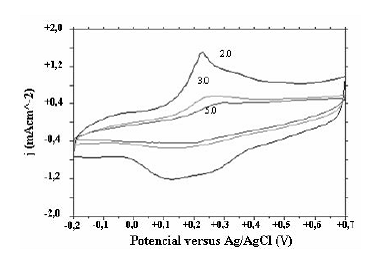
Figura 6 Voltamogramas de caracterización en solución 1.0M de H2SO4 para pani obtenida a diferentes pHs ( 2.0, 3.0, 5.0)
Los voltamogramas de caracterización de pani obtenida a pH básicos (ver Figura 7) son muy similares entre sí. Los picos aparecen alrededor del mismo potencial y las películas obtenidas son prácticamente del mismo espesor. Por lo tanto, luego de que el pH de la soslución sea mayor que 7 no se observarían cambios estructurales en las cadenas del polímero.
Dadas las observaciones de pani obtenida a pH básicos se deduce que el mecanismo de crecimiento es diferente. Debido a la deficiencia de iones H+ el polímero formado no es electroactivo [20], razón por la cual no se presenta la oxidación del monómero sobre el polímero sino sobre el sustrato. Por este motivo se observó que al aumentar el número de ciclos disminuían las corrientes.
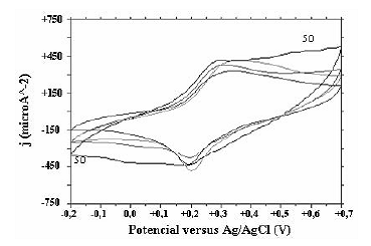
Figura 7 Voltamograma de caracterización de pani obtenida a diferentes pHs (5.0, 7.0, 9.0, 11.0)
Propiedades morfológicas
Las películas obtenidas a pH ácidos (figura 8), debido a su mayor velocidad de crecimiento, presentan estructuras más desarrolladas, visibles a menores aumentos. Las películas obtenidas a pH intermedios (figura 9) parece que comienzan a desarrollar una morfología similar a la observada en el caso anterior, sin embargo dada la menor velocidad de crecimiento esta se observa a mayores aumentos. A pH básicos se observa lo delgadas que son las capas de polímero formado, aun están visibles las rayas ocasionadas por el pulimento de la superficie del sustrato (figura 10); esto se confirma al comparar el área de los voltamogramas de caracterización a pH básicos y ácidos.

Figura 8 Imagen SEM (X1900), pani obtenida a pH = 0, (90 ciclos a 50 mV/s)

Figura 9 Imagen SEM (X5000), pani obtenida a pH = 6, (90 ciclos a 50 mV/s)

Figura 10 Imagen SEM (X3700), pani obtenida a pH = 11, (90 ciclos a 50 mV/s)
Estudios de impedancia faradaica
El análisis de los resultados obtenidos en las pruebas de impedancia, sugiere que el proceso que se lleva a cabo en el ánodo puede representarse por el circuito que se muestra en la figura 11 [18, 25]. R1 es la suma de la resistencia de la solución y la resistencia de la película de pani, el elemento de fase constante (EFC1) corresponde a la capacitancia de la película, R2 es la resistencia a la transferencia de carga y EFC2 la capacitancia de la doble capa.
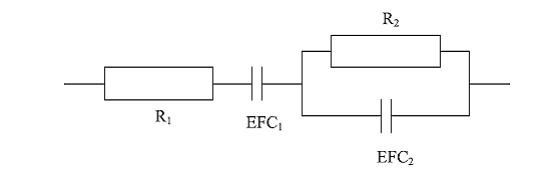
Figura 11 Circuito equivalente propuesto para pani parcialmente oxidada (DINH, 2000)
Para observar el comportamiento de la resistencia de las películas se considera la resistencia de la solución igual para todos los casos, por lo tanto las variaciones de R1 se atribuyen a la resistencia del polímero [25]. Para separar los dos componentes resistivos de R1, se determinó la resistencia de la solución realizando pruebas de impedancia sobre el sustrato sin polímero, utilizando la misma solución de trabajo (H2SO4 1,0 M) y tratando de mantener constante la distancia entre los electrodos de trabajo y referencia, de esta manera para carbón vítreo como sustrato se encontró un valor de 0,18 cm-2.
Los voltamogramas de caracterización de pani obtenida a pH intermedios (3-5) presentaron características similares, pero muy diferentes de las películas obtenidas a pH ácidos (0-1) (figuras 5 y 6). La diferencia entre estas películas se hace de nuevo evidente al observar las diferencias entre los diagramas de Bode; mientras en los correspondientes a películas obtenidas a pH ácidos sólo se hace evidente una constante de tiempo (figura 12), el diagrama de Bode propio de pani obtenida a pH = 4 (figura 13) presenta dos constantes de tiempo, lo que puede ser resultado de la presencia de diferencias estructurales en la película caracterizada. Tales diferencias se manifiestan en la región de alta frecuencia, por lo que estas diferencias estructurales deben concederle a la película una mayor resistencia óhmica. Una observación similar fue realizada en los diagramas de Bode correspondientes a pani en un estado intermedio de conducción [26].
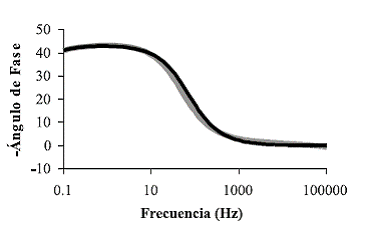
Figura 12 Diagrama de Bode pani obtenida a pH 0,0 (gris: resultados experimentales, negro: circuito equivalente)
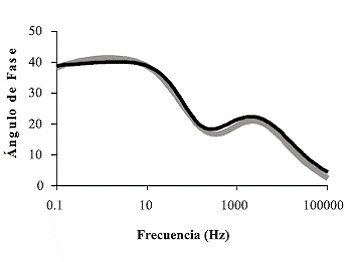
Figura 13 Diagrama de Bode pani obtenida a pH = 4 (gris: resultados experimentales, negro: circuito equivalente)
A pH básicos prevalecen las estructuras que disminuyen la conductividad de pani, tal como se observa en la figura 14, en la cual la segunda constante de tiempo se manifiesta en un mayor intervalo de frecuencias.
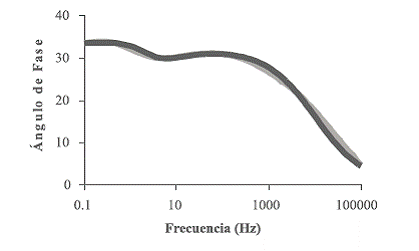
Figura 14 Diagrama de Bode pani obtenida a pH = 12 (gris: resultados experimentales, negro: circuito equivalente)
La capacitancia asociada al espesor de las películas obtenidas a pH altos no es ideal, n1 es mucho menor que 1,0 llegando incluso a valores más cercanos a 0,5 (tabla 1), correspondientes a los elementos de Warbug. Estos valores son un indicativo de la importancia de los procesos difusivos en estas películas asociados a la protonación. Como se observó anteriormente, para un mismo número de ciclos, la velocidad de crecimiento de pani disminuye con el pH, por lo tanto es más difícil que las películas obtenidas a pH altos presenten estructuras ramificadas. Esto es acorde a los resultados correspondientes a EFC2 en el circuito equivalente (tabla 1).
Tabla 1 Resultados de la simulación del circuito equivalente (CE) a las películas obtenidas a diferentes pH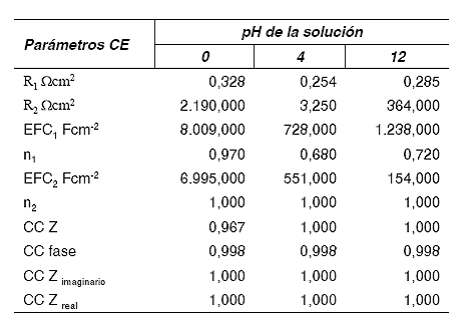
La resistividad de las películas aumenta con el pH de la solución (tabla 2), lo cual es acorde a las observaciones realizadas en los diagramas de Bode, en los cuales se encontró evidencia de estructuras diferentes dentro de la estructura del polímero. Estos resultados confirman las observaciones realizadas durante la caracterización de pani obtenida a pH básicos e intermedios y los estudios FTIR realizados por Ohsaka et al. [21].
Tabla 2 Resistividad estimada para las películas obtenidas mediante diferentes pH

Conclusiones
La velocidad de crecimiento de pani es evidentemente mayor a pH bajos (pH < 2,0). A pH mayores, durante el crecimiento de pani, se dan otros tipos de enlaces entre las moléculas formándose estructuras diferentes, las cuales evidentemente tienen como efecto el aumento de la resistencia óhmica del polímero, desfavoreciendo la oxidación del monómero sobre las cadenas y por lo tanto disminuyendo la velocidad de crecimiento de pani.
Aunque durante la formación de pani a pH mayores de 5,0 no se observaron picos en todo el intervalo de potencial, al realizar la caracterización en medio ácido se lograró observar los picos correspondientes al primer proceso redox, lo que es indicio de la protonación del polímero la cual tiene un efecto importante en el aumento de su electroactividad. También se encuentra que si el pH adquiere un carácter básico, después de la caracterización en medio ácido, el aumento de este no afecta la velocidad de crecimiento o la estructura del polímero.
Agradecimientos
Al Grupo de Protección y Corrosión de la Universidad de Antioquia por facilitar los medios para realizar los estudios de impedancia faradaica. A Alejandro Toro, Director del Laboratorio de Microscopía Avanzada de la Universidad Nacional Sede Medellín, por su colaboración en el estudio mediante el SEM.
Referencias
1. D.M. Mohilner, R.N. Adams, W. J. Argersinger, Jr. “Investigations of the kinetics and mechanism of the anodic oxidation of aniline in aqueous sulfuric acid solution at a platinum electrode”, Journal of. American. Chemistry Society. Vol. 84. 1962. pp. 3618-3622. [ Links ]
2. J. Bacon, R.N. Adams. “Anodic oxidation of aromatic amines”. Journal of. American. Chemistry Society. Vol. 90. 1968. pp. 6596-6599. [ Links ]
3. A. F. Diaz, J. A. Logan. “Electroactive polyaniline films”. Journal of Electroanalytical Chemistry. Vol. 111. 1980. pp. 111-114. [ Links ]
4. E. W. Paul, A. J. Ricco, M. S. Wrighton. Resistance of polyaniline films as a function of electrochemical potential and the fabrication of polyaniline –based microelectronic devices. Journal of Physical Chemistry. Vol. 89. 1985. pp. 1441-1447, [ Links ]
5. N. Gospodinova, L. Terlemezyan. “Conductive polymers prepared by oxidative polymerization: polyaniline”. Progress in Polymer Science. Vol. 23. 1998. pp. -1443-1484. [ Links ]
6. E. T. Kang, K. G. Neoh, K. L. Tan. “Polyaniline: A polymer with many interesting intrinsic redox states”. Progress in Polymer Science. Vol. 23. 1998. pp. 277-324. [ Links ]
7. M. J. Croissant, T. Napporn, J. M. Léger, C. Lamy. “Electrocatalytic oxidation of hydrogen at platinum modified polyaniline electrodes”. Electrochimica Acta. Vol. 43. 1998. pp. 2447-2457 [ Links ]
8. C. T. Hable, M. S. Wrighton. “Electrocatalytic oxidation of methanol and ethanol: A comparison of platinum-tin and platinum-ruthenium catalyst particles in a conducting polyaniline matrix”. Langmuir, Vol. 9. 1993. pp. 3284-3290 [ Links ]
9. L. Niu, Q. Li, F. Wei, X. Chen, H. Wang, “Formation optimization of platinum modified polyaniline films for the electrocatalytic oxidation of methanol”. Synthetic Metals. Vol. 139. 2003. pp. 271-276. [ Links ]
10. M. Gholamian, A. Q. Contractor. “Oxidation of formic acid at platinum microparticles dispersed in polyaniline matrix”. Journal of Electroanalytical Chemistry. Vol. 289. 1990. pp. 69-83. [ Links ]
11. A. Q. Contractor, T. N. Sureshkumar, R. Narayanan, S. Sukeerthi, R. Lal, R. S. Srinivasa. “Conducting polymerbased biosensors”. Electrochimica Acta. Vol. 39. 1994. pp. 1321-1324. [ Links ]
12. M. A. Habib, P. Maheswari. "Electrochromism of polyaniline: An in situ FTIR study". Jornal of Electrochemical Society. Vol. 136. 1989. pp. 1050-1053. [ Links ]
13. W. Chen, T. Wen, H. Teng. “Polyaniline deposits porous carbon electrode for supercapacitors”. Electrochimica Acta. Vol. 48. 2003. pp. 641-649. [ Links ]
14. J. L. Lu, N. J. Liu, X. H. Wang, J. Li, X. B. Ping, F. S. Wang. “Mechanism and life study of polyaniline anticorrosion coating”. Synthetic Metals. Vol. 135. 2003. pp. 237-238. [ Links ]
15. M.TCortés, “Polímeros conductores: materiales multifuncionales”. Química en Uniandes. Vol. 1. 2004. pp. 80-93. [ Links ]
16. K. Kaneto, M. Kaneko, Y. Min, A. G. MacDiarmid. Artificial muscle: electromechanical actuators using polyaniline films. Synthetic Metals. Vol. 71. 1995. pp. 2211-2212. [ Links ]
17. W. W. Focke, G. E. Wnek, Y. Wei. Influence of oxidation state, pH and counterion on the conductivity of polyaniline. Journal of Physical Chemistry. Vol. 91. 1987. pp. 5813-5818. [ Links ]
18. H. N. Dinh, P. Vanýsek, V. I. Birss. “The effect of film thickness and growth method on polyaniline film properties”. Journal of Electrochemical Society. Vol. 146. 1999. pp. 3324-3334. [ Links ]
19. T. Kobayashi, H. Yoneyama, H. Tamura. “Oxidative degradation pathway of polyaniline film electrodes”, Journal of Electroanalytical Chemistry. Vol. 177. 1984. pp. 293-297. [ Links ]
20. L. Dui , Z. Mandi . “Counter-ion and pH effect on the electrochemical synthesis of polyaniline”. Journal of Electroanalytical Chemistry. Vol 335. 1992. pp. 207-221. [ Links ]
21. T. Ohsaka, Y. Ohnuki, N. Oyama, G. Katagiri, K. Kamisako. “IR absorption spectroscopic identification of electroactive and electroinactive polyaniline films prepared by the electrochemical polymerization of aniline” Journal of Electroanalytical Chemistry. Vol. 161. 1984. pp. 399-405. [ Links ]
22. T. Kobayashi, H. Yoneyama, H. Tamura. "Electrochemical reactions concerned with electrochromism of polyaniline film-coated electrodes". J. Electroanal. Chem. Vol. 177. 1984. pp. 281-291. [ Links ]
23. H. N. Dinh, J. Ding, S. J. Xia, V. I. Birss. “Multitechnique sudy of the anodic degradaton of polyaniline films”. Journal of Electroanalytical Chemistry. Vol. 459. 1998. pp. 45-56. [ Links ]
24. H. Okamoto, T. Kotaka. “Structure and properties of polyaniline films prepared via electrochemical polymerization. I: Effect of pH in electrochemical polymerization media on the primary structure and acid dissociation constant of product polyaniline films”. Polymer. Vol. 39. 1998. pp. 4349-4358. [ Links ]
25. G. de T. Andrade, M. J. Aguirre, S. R. Biaggio. Influence of the first potential scan on the morphology and electrical properties of potentiodynamically grown polyaniline films. Electrochimica Acta. Vol. 44. 1998. pp. 633-642. [ Links ]
* Autor de correspondencia. Teléfono: +57+4+ 430 90 00, correo electrónico: jgonzale@unalmed.edu.co Javier González Ocampo.














