Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Facultad de Ingeniería Universidad de Antioquia
versão impressa ISSN 0120-6230versão On-line ISSN 2422-2844
Rev.fac.ing.univ. Antioquia n.39 Medellín jan./mar. 2007
Revista Facultad de Ingeniería N.o 39. pp. 7-20. Marzo, 2007.
Resumen
El desarrollo de organismos incrustantes o biofouling en ambientes marinos, afectan numerosas estructuras metálicas sumergidas fijas (boyas) o móviles (cascos de embarcaciones), e inducen procesos de corrosión del metal, reducen la velocidad de desplazamiento, incrementan el consumo de combustible y aumentan la frecuencia de entradas en dique seco para mantenimiento, con diversas consecuencias económicas. Las pinturas antiincrustantes se han desarrollado con el propósito de mitigar estos impactos, teniendo la capacidad de excluir los organismos marinos que se ponen en contacto con la superficie pintada, por medio de la liberación de un biocida. La evaluación del comportamiento de las pinturas antiincrustantes comprende la inmersión de paneles pintados sujetos en estructuras flotantes estáticas y el seguimiento periódico de su desempeño. Como paso previo, es indispensable realizar una caracterización fisicoquímica y biológica del medio marino en la zona de interés. Con este propósito, se realizó un completo estudio en la zona de Mamonal (bahía de Cartagena), incluyendo valoraciones de: radiación solar, disponibilidad de la luz, oxígeno disuelto, temperatura, pH, potencial redox, alcalinidad y salinidad, además de la determinación y conteo de los principales grupos de organismos recolectados.
Palabras clave: Bahía de Cartagena, pinturas antiincrustantes, caracterización del agua de mar.
Abstract
The incrustation of marine organisms (biofouling) affect several submerged metallic structures, like ship hulls. Biofouling frequently induces metal corrosion, reduces the speed of displacement, increases fuel consumption, and increases the frequency of dry-dock operations. Antifouling paints which have the capacity to prevent the marine organisms from contacting the painted surface (by means of biocide release), have been developed in order to mitigate these deleterious effects. Static tests of antifouling paints include immersing painted panels (attached to floating structures), and periodically evaluating its performance. Before conducting these static tests, it is important to characterize the local maritime environment by determining the range of values of the most significant physical, chemical and biological variables. A complete characterization of the sea water in the zone of Mamonal (Cartagena Bay) was conducted; variables such as solar irradiation, light availability, dissolved oxygen, temperature, pH, redox potential, alkalinity, and salinity were measured. In addition, the determination and quantification of the main biological entities present in the samples was also carried out.
Key words: biofouling, Cartagena Bay, antifouling paints, sea water characterization.
Introducción
en agua de mar, algunos de los problemas más relevantes tienen que ver con la formación de una biopelícula y la posterior fijación de organismos incrustantes sobre el metal (fenómeno denominado como biofouling). El biofouling comienza en el instante en que un sustrato duro se sumerge en un medio líquido con organismos. La secuencia de eventos sigue un orden universal: inmediatamente después del contacto inicial, la superficie metálica es modificada por adsorción de biopolímeros y luego ocurre la formación de una película primaria (bacterias, diatomeas, protozoos), seguida por la fijación de larvas de organismos incrustantes macroscópicos (algas, cirripedios, poliquetos, etc.) y el desarrollo de la comunidad de macroorganismos [1, 2].
El carácter de la comunidad resultante es determinado por la naturaleza del sustrato, la disponibilidad y diversidad de los colonizadores, la eficiencia de su fijación al sustrato y los eventos bióticos/abióticos (a menudo directamente influenciados por el hombre) que ocurren antes, durante y después de la fijación. En las embarcaciones, este fenómeno frecuentemente induce la corrosión del metal, reduce la velocidad de desplazamiento por la rugosidad que se genera, incrementa el consumo de combustible y aumenta la frecuencia de entradas en dique seco para mantenimiento, con diversas consecuencias económicas. El problema del biofouling varía de localidad en localidad. Por eso es necesario el conocimiento de la biología de sus organismos para aplicar medidas más efectivas de prevención y control. Su estructura muestra amplias variaciones temporales y regionales, las que son en general gobernadas por las condiciones hidrológicas y geográficas [3].Las pinturas antiincrustantes se han desarrollado con el propósito de hacer frente a este problema. Además de brindar una protección anticorrosiva general, estas pinturas deben tener la capacidad de excluir los organismos marinos que se ponen en contacto con la superficie pintada, por medio de la liberación de un biocida, el cual debe cumplir con normas medioambientales cada vez más estrictas [4].
La evaluación del comportamiento de las pinturas antiincrustantes comprende la inmersión de paneles pintados sujetos en estructuras flotantes estáticas (balsas o boyas) y el seguimiento periódico de su desempeño [5-7]. Bajo estas condiciones, se facilita el acceso y la fijación de los organismos marinos a las superficies metálicas, por lo que es la condición más crítica de evaluación. Como paso previo, es indispensable realizar una completa caracterización fisicoquímica y biológica del medio marino en la zona de interés. Con esta información, el formulador de la pintura determinará las características de los componentes de la misma y, en especial, del biocida [8, 9].
Los parámetros fisicoquímicos que más influencia tienen sobre las pinturas, las superficies a proteger y los organismos que afectan estas superficies son, entre otros: radiación solar, disponibilidad de la luz, oxígeno disuelto, temperatura, pH, potencial redox, alcalinidad y salinidad [7, 8].
La radiación solar, como energía lumínica, penetra en el agua de mar a determinada profundidad, según sea la inclinación de los rayos de la luz incidente y el coeficiente de atenuación de la luz, el cual depende de la absorción de la luz por parte del agua, los sólidos disueltos y los sólidos en suspensión. Mediante un estudio de perfiles que incluya un análisis de la absorción de la luz en la columna de agua (transparencia) es posible determinar las zonas fótica y afótica en determinado lugar [10].
La zona fótica es la que presenta una mayor actividad fotosintética; aquí se encuentra la mayor parte de la producción primaria realizada por las algas microscópicas (fitoplancton), ya que son éstas las que viven en la zona más cercana a la superficie, hasta donde penetra la luz [11].
En la zona afótica se encuentran organismos aerobios y facultativos, los cuales se alimentan con los residuos orgánicos (biomasa) que se precipitan de los organismos que viven en la zona fótica.
Las variaciones en la densidad del agua de mar son producto de los cambios de temperatura y de concentración de sales. Al mismo tiempo la temperatura se encarga de modular parte de los mecanismos que generan la circulación en los océanos [12]. La cantidad de oxígeno disuelto, por su parte, es determinante en el desarrollo de los organismos que lo utilizan para su subsistencia.
El potencial redox está relacionado con la conductividad y la salinidad. Estos factores, al igual que el pH, tienen gran influencia en la corrosividad del medio y en la interacción entre los procesos de corrosión metálica y el establecimiento del biofilm en la superficie del metal.
La salinidad se expresa como peso en gramos de sales inorgánicas disueltas por kilogramo de agua de mar. Su valor normal es de 35% y varía de 34 a 36 en los océanos. La salinidad cambia en la zona costera, debido a los aportes del agua dulce y la evaporación. La mayor parte de las sales disueltas están constituidas por minerales en forma de iones, de los cuales sólo seis (calcio, magnesio, potasio, sodio, sulfatos y cloruros), comprenden el 99,28% del peso total de la salinidad. Por su parte, la conductividad mide los electrolitos presentes en el agua, es decir los sólidos disueltos y los suspendidos [13].
En este trabajo se presentan los resultados de la caracterización fisicoquímica y biológica de la zona de Mamonal, en la bahía de Cartagena y se efectuó como un primer paso para la formulación y evaluación del desempeño de pinturas antiincrustantes en el mar Caribe, obteniéndose información de gran importancia para otras áreas del conocimiento por ser la primera vez que se realiza un estudio de estas características en esta zona.
Zona de estudio
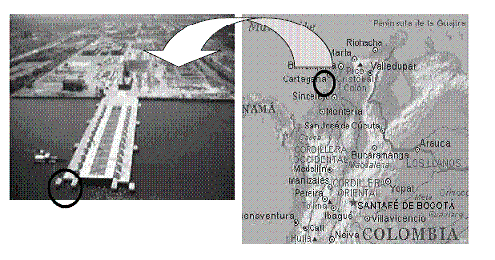
El sitio de evaluación se ubica en el muelle de la planta de COTECMAR en Mamonal, en la bahía de Cartagena, a 1,3 millas de la desembocadura del canal de agua dulce del Dique. El lugar geográfico exacto corresponde a las siguientes coordenadas, determinadas mediante el sistema GPS (sistema de posicionamiento global): N 10º 19’ 46’’, W 0,75º 30’ 52’’ (figura 1).
Figura 1 Ubicación del sitio de estudio en el mapa de Colombia y en la planta de COTECMAR en Mamonal
Metodología
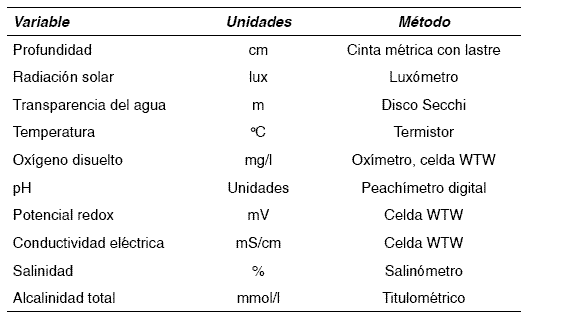
La evaluación fisicoquímica se realizó entre las 8:40 a. m. y las 3:40 p. m., el día 11 de julio de 2003, desde la superficie hasta una profundidad de 7,35 m (profundidad máxima en el sitio). En la tabla 1 se muestran las variables medidas y los equipos empleados.
Para la evaluación biológica se tomaron muestras de dos embarcaciones: una de ellas estuvo en movimiento constante en los dos últimos años, sin entrar al dique seco (“Mr. Nick”), mientras que la otra estuvo fondeada un año en la bahía y había estado otro año fondeada en Haití (“Hope”). Esta última presentaba un grado de corrosión severo.
Para el muestreo biológico se empleó una red de muestreo Surber, colocada en la porción sumergida del casco de cada embarcación. El material fue categorizado en los diferentes grupos de organismos y se hizo un conteo de cada grupo. Algunos ejemplares representativos se fijaron en alcohol al 70% y se transportaron para su determinación taxonómica en el laboratorio de bioensayos de la Universidad de Antioquia.
Además, se llevó a cabo un muestreo biológico adicional sobre paneles de acero naval sumergidos verticalmente durante 50 días en la zona de estudio. Se realizó un conteo de las especies incrustadas en una superficie de 1.200 cm2, en dos tipos de paneles: acero desnudo y acero pintado con una capa de pintura anticorrosiva más una capa de acabado (no antiincrustante).
Tabla 1 Variables medidas y sus correspondientes equipos de medida
Resultados y discusión
La profundidad total en el sitio fue de 7,35 m. A continuación se presentan y analizan los resultados de las determinaciones fisicoquímicas y biológicas realizadas.
Transparencia del agua
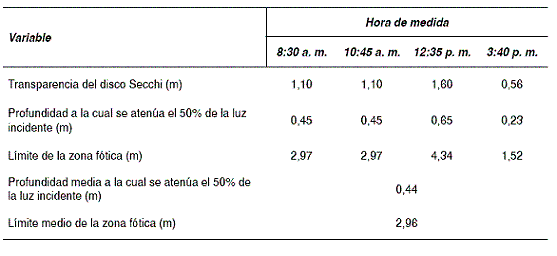
En la tabla 2 se muestran los resultados de las medidas de transparencia realizadas con el disco Secchi. Con base en los datos obtenidos, se procedió a determinar la zona fótica y la zona afótica. Primero se efectuó el respectivo análisis con la media aritmética de la transparencia Secchi y luego con cada una de las mediciones, para analizar el comportamiento de acuerdo con la hora y las condiciones climáticas.
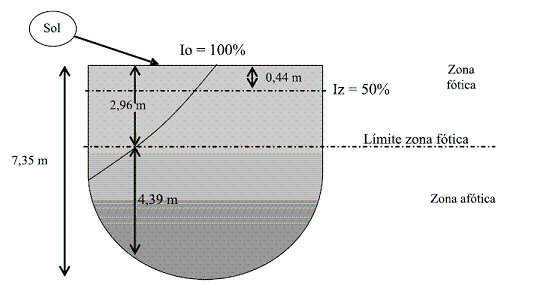
La media aritmética de la transparencia Secchi entre las 8:30 a. m. y las 3:40 p. m. fue 1,09 m. Así, se halló que la profundidad a la cual se atenúa el 50% de la radiación incidente (Iz = 50%) fue 0,44 m y el límite de la zona fótica fue 2,96 m (figura 2).
De acuerdo con la figura 2, se puede decir que en el sitio estudiado, desde la superficie hasta una profundidad de 2,96 metros, se tiene la zona con mayor actividad fotosintética.
Tabla 2 Datos y resultados de la transparencia del agua de mar
Las mediciones de transparencia Secchi a las 8:30 y las 10:45 a. m. arrojaron los mismos resultados, ya que se presentó nubosidad en el momento de medir. La zona fótica se encuentra desde la superficie hasta una profundidad de 2,97 m, y la zona afótica desde una profundidad desde 2,97 hasta los 7,35 m, para una altura en la columna de agua de 4,38 m. Teniendo en cuenta lo anterior, las profundidades de las zonas fótica y afótica con respecto a las profundidades promedio, en las horas de la mañana, no tienen una variación sustancial en la radiación solar absorbida.
Figura 2 Representación gráfica de la transparencia de la columna de agua en el mar entre las 8:30 a. m. y 3:40 p. m.
Durante la medición de la transparencia Secchi al mediodía (12:35 p. m.), se presentaron condiciones climáticas favorables con cielo despejado y brillo solar. La profundidad a la cual se atenúa el 50% de la radiación incidente es 0,65 m, y el límite de la zona fótica es 4,34 m, mucho mayor que las demás mediciones. La zona fótica se encuentra desde la superficie hasta una profundidad de 4,34 m, mientras que la zona afótica se ubica desde 4,34 hasta 6,40 m, para una altura en la columna de agua de 2,06 m. Se observaron variaciones sustanciales en la radiación solar absorbida; la profundidad de la zona fótica aumenta en 1,38 m, es decir, pasa de una zona fótica promedio de 2,96 a 4,34 m y la zona afótica disminuye de 4,39 hasta 2,06 m.
Cuando se realizó la medición de la transparencia Secchi en la tarde (3:40 pm), las condiciones climáticas fueron desfavorables, con cielo nublado y opaco. La profundidad a la cual se atenúa el 50% de la radiación incidente es 0,23 m, y el límite de la zona fótica es 1,52 m, mucho menor que las demás mediciones. Se aprecian las fluctuaciones de la profundidad a medida que cae el día, ya que la zona fótica disminuye en 2,82 m con respecto a la anterior medición, y así la zona afótica aumenta en 2,82 m, ocupando 4,98 m de la columna de agua.
En general, se encontraron variaciones importantes en la columna de agua en lo que a luz se refiere. La extensión de las zonas fótica y afótica es variable debido a la hora del día, las condiciones climáticas y en especial a la presencia de sólidos en los momentos en que la actividad del viento produce movimientos masivos del agua.
Temperatura y conductividad del agua
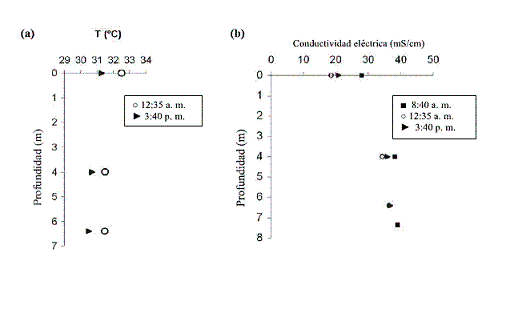
La variación de la temperatura del agua con la profundidad, a diferentes horas del día, se muestra en la figura 3 (a). Por su parte, la figura 3 (b) corresponde a la variación en la conductividad eléctrica.
En cada una de las mediciones que se realizaron desde las 8:40 am hasta las 3:40 pm, la temperatura permanece constante en toda la columna de agua y no se presentó una estratificación térmica. El agua se mezcla vertical y horizontalmente debido a las olas, vientos, corrientes.
Al igual que la temperatura, la conductividad permanece aproximadamente constante en la columna de agua. Esto se debe probablemente al efecto que ejerce el viento sobre la masa de agua y como consecuencia de la poca profundidad. Los valores de conductividad se acercan al valor promedio expresado en la literatura, que es de aproximadamente 30 mS/cm [14].
Este ambiente presenta turbulencia que genera mezclas verticales y horizontales de nutrientes y gases. Otro fenómeno importante es el generado con la entrada de las embarcaciones en el canal del Dique, donde las corrientes de agua dulce se mezclan con el agua salada, y coadyuvadas por las olas formadas por el viento, se establece un comportamiento similar al de los estuarios.
Oxígeno disuelto
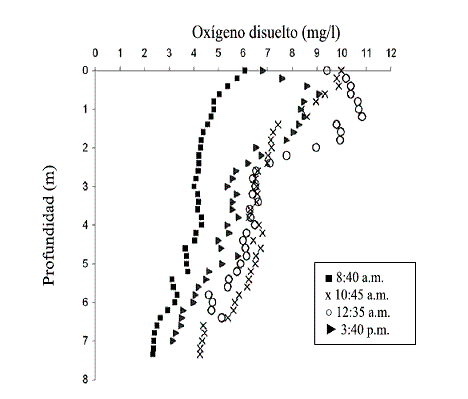
En la figura 4 se ilustra la variación del oxígeno disuelto con respecto a la profundidad, a diferentes horas del día
Es importante resaltar que, como no hay una estratificación térmica, el oxígeno se mezcla en toda la columna de agua. A pesar de que la zona afótica empieza desde una profundidad de 2,96 hasta los 7,35 m, hay presencia de oxígeno disuelto que es utilizado por los organismos presentes.
El oxígeno disuelto aumenta al mediodía tanto en la zona fótica como en la afótica, debido a que en ésta hora hay una mayor actividad fotosintética de las algas, con una alta producción de oxígeno, ya que la radiación solar es perpendicular y alcanza una mayor penetración. Los rayos luminosos llegan a una profundidad de 4,34 m, siendo éste el límite de la zona fótica.
El oxígeno presentó un comportamiento cambiante, con respecto a la profundidad, debido a que se mezclan las zonas fótica y afótica, hay intercambio de O2 y CO2 y hay consumo del oxígeno por los organismos presentes en la zona afótica. Los valores máximo y mínimo que se midieron corresponden a 10,82 mg/l en la zona fótica y 4,59 mg/l en la zona afótica. Sin embargo, estas concentraciones indican que hay disponibilidad de oxígeno en toda la columna de agua.
Figura 3 Variación con la profundidad de: (a) la temperatura y (b) la conductividad, a diferentes horas del día
Figura 4 Variación del oxígeno disuelto con respecto a la profundidad, a diferentes horas del día
pH y alcalinidad
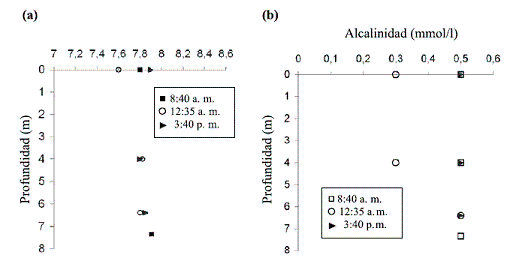
En la figura 5 se ilustra la variación del pH y la alcalinidad con respecto a la profundidad, a diferentes horas del día. El pH fue ligeramente básico en toda la columna de agua. Osciló entre 7,6 y 7,9. En general, esta variable no tuvo cambios importantes en el espacio y el tiempo.
Figura 5 Variación en (a) el pH y (b) la alcalinidad, con respecto a la profundidad, a diferentes horas del día
La alcalinidad encontrada mínima fue de 0,3 mmol/l durante el mediodía en la zona fótica (superficie y a 4,0 m en la columna de agua); y en la zona afótica es de 0,5 mmol/l, a una profundidad de 6,40 m. En las mediciones realizadas en la mañana y en la tarde, no se registró ninguna variación y el valor hallado fue 0,5 mmol/l.
Potencial redox
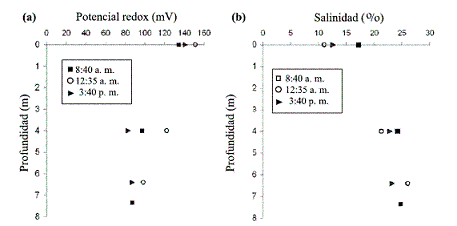
En la figura 6(a) se muestra la variación del potencial redox con la profundidad y a diferentes horas del día. En las muestras tomadas durante las 8:30 a. m. y 3:40 p. m. se observa que el potencial redox disminuye notoriamente con la profundidad. Durante el mediodía se presenta un valor máximo de 151 mV en la superficie y a las 8:30 a. m. se presenta un valor mínimo de 83 mV a una profundidad de 4,0 m. Según los valores puntuales medidos de potencial redox durante el muestreo, se infiere que el medio es oxidante; presenta una corrosividad potencial moderada en la región cercana a la superficie (Predox > 100 mV), y el resto de la columna de agua, que posee un potencial redox inferior a 100 mV, presenta una corrosividad potencial severa [15].
El potencial redox está relacionado con la conductividad y la salinidad. Para el sitio de muestreo se observó una relación entre la disminución del potencial redox y el aumento de la salinidad. Es importante resaltar la observación anterior, ya que el medio marino es muy corrosivo y la disolución metálica ocurre simultáneamente con la formación del biofouling. Por consiguiente, se observa que hay una activa interacción entre los procesos de corrosión y el establecimiento del biofilm en la interfase metal / superficie.
Salinidad
En la figura 6 (b) se muestra la variación de la salinidad con la profundidad, a diferentes horas del día. El porcentaje de salinidad en la superficie, al mediodía, es del 11%, mientras que en horas de la mañana fue de 17,2%. En el límite de la zona fótica, al mediodía, este porcentaje aumentó a 21,3% y en la zona afótica a 26, siendo este último el valor más alto con respecto a las otras mediciones de la mañana y de la tarde, debido a la influencia del agua dulce proveniente del canal del Dique. La densidad del agua dulce es inferior al agua de mar, lo que favorece la ubicación de aguas menos salobres en la superficie.
Figura 6 Variación en (a) el potencial redox y (b) la salinidad, con respecto a la profundidad, a diferentes horas del día
La salinidad afecta los fenómenos de ósmosis de los organismos. La mayor parte de las especies marinas han desarrollado estrategias adaptativas para mantenerse en equilibrio osmótico con el medio que los rodea; además, los cambios en la salinidad varían la densidad específica del agua influyendo sobre la flotabilidad de los organismos. En general, en el mar abierto, la salinidad oscila entre 34 y 36% [8]. En este caso, por la cercanía del canal del Dique se presenta disminución en la salinidad, lo cual genera una restricción en el tipo de ambiente marino y favorece el ambiente estuarino, ya que hay una mezcla muy marcada del agua dulce y el agua de mar, y no es representativa la variación de la salinidad comparada con los valores que esta presenta en mar abierto.
La concentración de cloruro de sodio afecta la solubilidad de la resina colofonia empleada para regular la velocidad de lixiviación del biocida en pinturas antiincrustantes, ya que se ha comprobado que al aumentar la salinidad disminuye la solubilidad [16]. Por consiguiente, se corre el riesgo de que la cantidad de biocida liberado por la pintura no alcance el nivel mínimo de 10 µg/cm2/día que son necesarios para proveer de protección, con la consiguiente colonización de los organismos sobre el sustrato a proteger.
Caracterización biológica
De acuerdo con los resultados de los muestreos realizados en las dos embarcaciones, tanto en condiciones estáticas (embarcación “Hope”) como dinámicas (embarcación “Mr. Nick”), existe una diferencia muy notoria en el tipo de fouling que colonizó las superficies de los barcos.
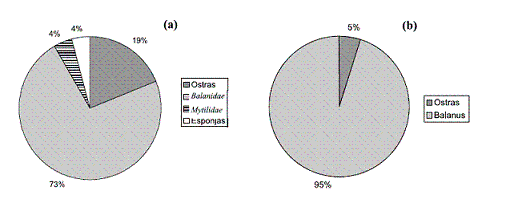
En la embarcación “Hope” se presenta un fouling que ha colonizado de manera excesiva el sustrato (1.030 individuos y 8 grupos en 500 cm2), deteriorando el material de la parte sumergida de la estructura (carena). Se hallaron los siguientes organismos: Balanidae (Balanus sp.), ostras (Crassostrea rizophora), Mytilidae (Mytilopsis sp.), esponjas, crustáceos (Panopeus sp., Petro¬listes sp., Pachigrapsus sp., Eurypanopeus sp.), camarones, poliquetos y oligoquetos.
La embarcación “Mr. Nick” presenta una colonización por especies incrustantes que han afectado el sustrato. El sistema se caracterizó por la presencia de pocas morfoespecies (34 individuos y 2 grupos en un área de 500 cm2): Balanus sp. y ostras (Crassostrea rizophora). En la figura 7 se muestra un detalle del casco de esta embarcación, colonizada por Balanus sp.
Figura 7 Detalle del biofouling en el casco de la embarcación “Mr. Nick”
En la figura 8 se muestran las cantidades relativas de las principales morfoespecies encontradas en los barco “Hope” (figura 8 (a)) y “Mr. Nick” (figura 8 (b)). Predomina en ambas embarcaciones el Balanus sp., el que exhibe una mayor resistencia a los biocidas que las otras especies halladas.
Figura 8 Cantidades relativas de especies predominantes (a) en el barco “Hope” y (b) en el barco “Mr. Nick”
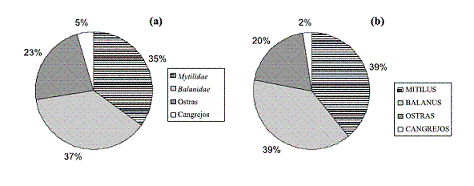
En la figura 9 se muestra la distribución porcentual obtenida de la caracterización visual y conteo de las diferentes comunidades adheridas a los paneles sumergidos durante 50 días en la zona de estudio, tanto desnudos (figura 9 (a)) como pintados (figura 9 (b)).
Figura 9 Frecuencia de comunidades incrustantes en paneles sumergidos durante 50 días: (a) acero naval desnudo y (b) acero naval pintado
En ambos casos, se observa un dominio claro del género Mytilopsis sp. y Balanus sp. En el macrofouling formado se observa un proceso de epibiosis, que es uno de los mecanismos frecuentes que adoptan los organismos de las comunidades incrustantes ante la falta de sustrato adecuado o ante el exceso de contingentes colonizadores. Debido a la gran contaminación de la zona de la bahía de Cartagena, la proliferación de organismos es muy abundante, lo cual conlleva a producir claros fenómenos de competencia ínter e intraespacial sobre el sustrato de fijación (figura 10).
Figura 10. Biofouling en el panel de acero naval sumergido durante 50 días en la zona de estudio
Conclusiones
Las variables fisicoquímicas que se modificaron en el sitio de muestreo fueron: transparencia del agua, salinidad y potencial redox. Estas variables inciden sobre la distribución vertical de las propiedades fisicoquímicas. La capa superior entre 0 y 3 m presentó mayor disponibilidad de luz, menor salinidad y un ambiente oxidativo. La capa de agua entre 3 y 7 m corresponde a la zona afótica; en ella se incrementa la salinidad, aunque continúa siendo un ambiente oxidativo.
La zona de fondo es, probablemente, un ambiente distinto cuando hay contacto con el sedimento; allí los procesos de reducción pueden ser relevantes.
Otras variables permanecieron aproximadamente constantes con la profundidad, como la temperatura, la conductividad, el pH, la alcalinidad, debido probablemente a la poca profundidad y al efecto del viento sobre la masa de agua, que genera mezclas verticales y horizontales de líquidos, gases y nutrientes.
Aunque presenta alguna variación con la profundidad, hay disponibilidad de oxígeno disuelto en toda la columna de agua, al no presentarse una estratificación térmica.
La cercanía del canal del Dique genera una restricción en el tipo de ambiente marino y favorece el ambiente estuarino, ya que hay una mezcla muy marcada del agua dulce y el agua de mar. La solubilidad de la resina colofonia empleada en pinturas antiincrustantes para regular la velocidad de disolución del biocida, disminuye con el aumento de la salinidad. Por esta causa, puede ocurrir que la cantidad de biocida liberado por la pintura no alcance el nivel mínimo necesario para proveer de protección, con la consiguiente colonización del sustrato por los organismos.
La morfoespecie predominante fue Balanus sp., que presenta una mayor resistencia a los biocidas que las demás especies halladas. Por este motivo, se debe tener en cuenta que la formulación de una pintura antiincrustante para inmersión en este tipo de ambiente debe orientarse al control de la fijación de ésta especie, puesto que al controlar los organismos más resistentes, se ejerce, por añadidura, un control efectivo sobre los demás.
Agradecimientos
Los autores expresan su agradecimiento a COLCIENCIAS, a la Universidad de Antioquia y a COTECMAR por la financiación del proyecto “Problemas de biocorrosión y alternativas de protección para embarcaciones en el mar Caribe” (Código 1115-06-12480, contrato 417-2002).
Referencias
1. R. Bastida, G. Brankevich. “Las comunidades incrustantes”. Ciencia Hoy. Vol. 1. 1989. pp. 74-75. [ Links ]
2. M. Pérez, M. Stupak. “El conocimiento del “biofouling”. Un aspecto importante para el desarrollo de pinturas antiincrustantes eficientes. Color & Textura. Vol. 64. 2000. pp. 8-11. [ Links ]
3. M. Callow, J. Callow. “Marine biofouling: a sticky problem”. Biologist (London). Vol. 49. 2002. pp.1-5. [ Links ]
4. C. A. Giudice, J. C. Benítez, V. Rascio. “Prevención del fouling en carena de embarcaciones con pinturas AF a base de resina colofonia y caucho clorado”. Revista Iberoamericana de Corrosión y Protección. Vol. XV. 1984. p. 16. [ Links ]
5. J. C. Benítez, C. A. Giudice, V. Rascio. “Binders of self polishing antifouling paints”. European Coatings Journal. Vol. 11. 1990. pp. 618-631. [ Links ]
6. C. A. Giúdice, B. del Amo, V. Rascio. “The use of calcium resinate in the formulation of soluble matrix antifouling paints based on cuprous oxide”. Progress in Organic Coatings. Vol. 16. 1988. pp. 165-176. [ Links ]
7. C. A. Giúdice, B. del Amo. “Influencia de la velocidad de disolución del ligante sobre el comportamiento de pinturas antiincrustantes tipo matriz soluble”. Anales CIDEPINT. 1993. pp. 1-12. [ Links ]
8. D. Meseguer, S. Kiil, K. Dam-Johansen.“Antifouling technology-past, present and future steps towards efficient and environmentally friendly antifouling coatings”. Progress in Organic Coatings. Vol. 50. 2004. pp. 75-104. [ Links ]
9. A. Socci. “What to consider when testing marine paints”. Journal of Protective Coatings and Linings. Vol 21. 2004. pp. 23-27. [ Links ]
10. R. Wetzel, G. Likens. Limnological Analysis. Third ed. New York. Springer Verlag. 2000. pp. 18-21. [ Links ]
11. R. Megalef. Limnología. Barcelona. Ed. Omega. 1983. pp. 272-274. [ Links ]
12. D. Jenkins. Química del agua. México. Ed. Limusa. 1995. pp. 15-16. [ Links ]
13. G. Linder. Muscheln und Schnecken der Weltmeer. München, Germany. BLV Verlagsgesellschaft mbH. 1999. pp. 176-303. [ Links ]
14. E. Otero. Corrosión y degradación de materiales. Madrid. Ed. Síntesis. 1997. pp. 204-210. [ Links ]
15. D. Jones. Principles and prevention of corrosion. New York. MacMillan Publishing. 1992. pp. 383-385. [ Links ]
16. D. Todd, B. H. Ketchum. Marine fouling and its prevention. Woods Hole, USA. Woods Hole Oceanographic Institution. 1952. pp. 306-308. [ Links ]
* Autor de correspondencia: teléfono: +97+4 210 66 15, fax +97+4 263 82 82, correo electrónico: fecheve@udea.edu.co