Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Ingeniería Universidad de Antioquia
Print version ISSN 0120-6230On-line version ISSN 2422-2844
Rev.fac.ing.univ. Antioquia no.52 Medellín Apr./June 2010
Monitoreo geoquímico de un sistema evaporítico natural: salar de Huasco (Chile)
Monitoring geochemistry of the evolution of natural system: salar de Huasco (Chile)
Ingrid Garcés Millas*1, Pedro López Julián2
1Departamento de Ingeniería Química. Universidad de Antofagasta (Chile). Casilla 170- Antofagasta, Chile.
2Área de Petrología y Geoquímica. Depto. Ciencias de la Tierra. Universidad de Zaragoza. 50.009- Zaragoza, España.
Resumen
Se realizó un proceso de evaporación a escala de laboratorio con salmueras del Salar de Huasco, con el objeto de estudiar la pauta de evolución geoquímica y contrastarlo con el medio natural. La secuencia de precipitación obtenida fue calcita, yeso, thenardita y halita, minerales cuya presencia se comprobó mediante difractometría de rayos X. Estos resultados se corresponden con la sucesión de los estados de equilibrio que alcanzan las salmueras a lo largo de su progresiva concentración por evaporación, de acuerdo con los cálculos geoquímicos realizados con el código PHRQPITZ.
La modelización geoquímica ha permitido comprobar que las situaciones de equilibrio se alcanzan en el dispositivo experimental en distintas etapas evolutivas a las observadas en el sistema natural. Este hecho se debe principalmente a dos factores, en primer lugar a la interacción de las soluciones diluidas de recarga del salar con la costra salina periférica rica en yeso, cuya disolución provoca alcanzar el equilibrio con esta fase mineralógica mucho antes en el sistema natural que en el laboratorio; y por otra, a la precipitación de mirabilita como consecuencia de las oscilaciones térmicas diarias, causantes de que el equilibrio con halita se alcance en el salar en una etapa evolutiva más avanzada que en el experimento, resultado del consumo de sodio, por precipitación de mirabilita.
Palabras clave: Salar de Huasco, evaporación, geoquímica, salmueras naturales, brines, PHRQPITZ, índices de saturación, mirabilita
Abstract
Evaporation process affecting brines in salar of Huasco (Chile) has been reproduced at laboratory scale with the main objective of studying its geochemical evolving path. Natural brines have been evaporated under isothermal conditions, precipitating progressively calcite, gypsum, thenardite, and halite. This mineral sequence confirms the evolution of equilibrium conditions calculated by means of PHRQPITZ geochemical code.
Geochemical modeling has allowed to determine that saline minerals reach saturation along the experiment performed at different evolutive moments that they do in natural conditions. This fact is due to two main causes, first to the interaction between dilute solutions entering salar with the external saline rim mainly composed of gypsum, whose solubilization causes that brines reach faster saturation respect to gypsum in the natural system compared to experiments in laboratory; and second, to precipitation of mirabilite as consequence of thermal oscillations to daily scale causing that halite equilibrium is reached for higher brine concentrations in salar that in laboratory, since mirabilite precipitation produces a significant depletion of sodium concentration in brines.
Keywords: Huasco salar's, evaporation, geochemistry, natural brines, PHRQPITZ, saturation, mirabilite
Introducción
El salar de Huasco se ubica en la zona de la Alta Cordillera andina, en la Primera Región (Figura 1) entre la cuenca del salar de Pintados en la pampa del Tamarugal y la cuenca del salar de Empexa en el Altiplano boliviano[1]. Se trata de un cuerpo evaporítico situado a una altitud aproximada de 3800 m.s.n.m, en la Precordillera Andina. La cuenca de drenaje del salar se extiende a lo largo de una superficie aproximada de 1500 Km2, elongada en sentido N-S. El salar se ubica en el sector meridional de dicha cuenca, cubriendo un área de 51 Km2 y con un eje mayor en dirección ONO-ESE, con una longitud aproximada de 10 Km [2].
El clima de la zona donde se ubica el Salar de Huasco ha sido definido como de tipo estepario de altura [3], caracterizado por una sequedad ambiental extrema, vientos fuertes y de frecuencia prácticamente diaria, además de grandes oscilaciones térmicas. Estas condiciones climáticas extremas condicionan que la vegetación existente sea escasa y esté constituida casi exclusivamente por matorrales xerófitos y cactáceas. El balance hídrico es claramente negativo, las precipitaciones promedio estimadas se sitúan en torno a 150 m//año [2] y los valores promedio calculados para la evaporación potencial alcanzan unos 2500 m//año [4]. Las precipitaciones no se distribuyen de forma equitativa a lo largo del año, y una parte importante de las mismas cae durante el verano austral [3], recargando el sistema evaporítico cuyas salmueras evolucionan por evaporación. De esta manera se forman acumulaciones superficiales de extensión variable y de poca profundidad (no superior a 20 cm). El balance hídrico del salar ha sido estimado por Grilli y Vidal [5] y la hidrogeología de la cuenca de drenaje ha sido estudiada por la Dirección General de Aguas y la agencia japonesa JICA. Los aspectos geológicos generales del salar de Huasco fueron presentados y publicados en un artículo previo [6], y junto a ellos se exponían los principales rasgos geoquímicos deducibles a partir del muestreo de salmueras y sedimentos salinos en la superficie del salar.
Figura 1 Mapa de la I región de Chile, en que se enfatiza la ubicación del Salar de Huasco
El cuerpo salino central del salar es de tipo masivo y su mineralogía está dominada por sales sódicas (principalmente sulfatos y cloruros, [7]), el área de agua libre es muy reducida en comparación con las dimensiones del salar, siendo de escasa profundidad. Los sedimentos salinos, al igual que otros sistemas andinos de este tipo, se generaron a partir de lagos profundos que ocuparon parcialmente las cuencas endorreicas donde actualmente sólo quedan salares y acumulaciones de agua de escasa entidad [8]. La mayor parte de estos lagos precursores (entre ellos el de Huasco) han sido datados como del Pleistoceno [8]. Los sondeos realizados indican que, bajo la zona superior de la costra salina, que ocupa aproximadamente el primer metro y medio desde la superficie actual, aparecen los materiales sedimentados en el paleolago de forma alterna arcillas, limos y capas de diatomitas [9].
La modelización geoquímica realizada en trabajos previos [6, 10], a partir de los análisis químicos de las soluciones muestreadas permitió observar que el proceso de evaporación que tiene lugar actualmente en la superficie del salar se ve afectado por la interacción entre las aguas superficiales que acceden al mismo y los minerales salinos previamente existentes, ya que en las condiciones climáticas actuales, el balance hídrico no permite que se llegue a formar una acumulación superficial de agua equiparable a la que dio lugar a la sedimentación salina que ocupa la zona más deprimida de la cuenca endorreica. Este hecho deriva directamente de la evolución paleoclimática que ha tenido lugar en tiempos recientes, tendiente en general hacia un incremento continuado de la aridez en buena parte del planeta, y que en zonas como el Norte de Chile, ha provocado que en sistemas salinos como el actual, la recarga hidráulica no llegue a generar una acumulación superficial de agua equiparable a la que dio lugar a la sedimentación salina que ocupa la zona más deprimida de la cuenca endorreica. Esta situación ha sido puesta de manifiesto en otros sistemas similares, como es el caso del Salar de Ascotán [11].
Por todo ello, se consideró oportuno realizar un estudio que permitiese evaluar los procesos geoquímicos que ocurren actualmente en el salar de Huasco como consecuencia de la concentración por evaporación de las soluciones que acceden a la superficie del sistema salino. El conocimiento de los procesos que operan en un sistema de este tipo puede aprovecharse para valorar una posible explotación de los recursos que alberga (fundamentalmente sodio y potasio), así como para optimizar un hipotético proceso de beneficio económico. Además, la realización de experimentos de evaporación en condiciones controladas de laboratorio permite tomar muestras del sistema salino en etapas evolutivas muy avanzadas, situación ésta que es complicada de realizar directamente en el sistema natural.
Metodología
Se recogieron 30 litros de salmuera a partir de agua superficial circulante sobre el salar, en un bidón de polietileno trasladándose de inmediato al laboratorio, donde se dispuso al abrigo de la luz y de los cambios térmicos. La experiencia se realizó en un baño termostático de inmersión (ver figura 2). Se escogió una temperatura de 40 oC para proporcionar al proceso de evaporación una velocidad adecuada, dado el volumen de solución a evaporar, a fin de evitar procesos de precipitación de mineral relacionados con las variaciones de temperatura, comprobándose su gran influencia en el sistema Na-SO4-H2O debido a la variabilidad de la constante de equilibrio de la mirabilita con la temperatura [12].
Figura 2 Esquema experimental utilizado en la evaporación de salmueras en laboratorio
Se diseñó igualmente una estrategia de muestreo del sistema experimental, que incluyó la toma de 20 ml de salmuera en varios momentos evolutivos. Paralelamente se determinaron pH, densidad, índice de refracción, viscosidad, alcalinidad total y composición química. La determinación analítica se efectuó por contenido en calcio, magnesio, sodio, potasio, cloruro, sulfato, bicarbonato, arsénico y boro. Los cationes se analizaron mediante espectrometría de absorción atómica con un equipo Perkin Elmer 2380. La determinación de sulfato fue llevada a cabo mediante precipitación con BaCl2, empleándose técnicas volumétricas para el análisis de cloruros (método de Mohr) y boratos (técnica ácido-base).
En el salar, en algunos puntos de muestreo de las salmueras, se procedió simultáneamente a la recolección de precipitados salinos, a los cuales se les realizó un análisis mineralógico mediante difractometría de rayos X, empleando para ello un equipo Siemens D-5000. Paralelamente, se midieron in situ, temperatura, pH, Eh, densidad e índice de refracción.
Con los datos obtenidos, a partir del análisis de las salmueras, se ha procedido a realizar los cálculos de modelización geoquímica. Dichos cálculos permiten, a través del empleo de programas informáticos basados en modelos geoquímicos, determinar los valores de fuerza iónica, actividad del agua, actividades iónicas e índices de saturación de las soluciones respecto de las fases salinas de interés en el sistema estudiado.
En el caso del estudio de salmueras resulta imprescindible utilizar modelos adecuados para soluciones de elevadas concentraciones. En este trabajo se ha utilizado el código de modelización geoquímica PHRQPITZ [13], el cual incorpora (y amplía la temperatura entre 0 y 60 oC para algunas fases minerales) la aproximación de Pitzer [14, 15], con la parametrización realizada por Harvie y colaboradores ([16, 17], para el sistema Na-KMg-Ca-H-Cl-SO4-HCO3-CO3-CO2-H2O.
El cálculo de los índices de saturación mineral se ha efectuado mediante la expresión siguiente:
En esta expresión, P.A.I. representa el producto de actividad iónica para una determinada fase mineralógica, y Keq su respectiva constante de equilibrio a la temperatura indicada. Si este índice muestra valores muy próximos a cero, la solución se encuentra en equilibrio termodinámico respecto de esa fase mineral; por otra parte, valores positivos o negativos del índice de saturación (en adelante I.S.) determinan una situación de sobresaturación o subsaturación, respectivamente, cuya magnitud es función directa del valor absoluto de dicha cantidad.
A partir de los datos termodinámicos propuestos por Greenberg y Moller [18], se han obtenido valores para la constante de equilibrio de la thernardita (Na2SO4), no incluida en la base de datos original del código y siendo de interés para este estudio. Del mismo modo se han obtenido los valores, a distintas temperaturas, de las constantes de equilibrio de otras fases minerales de interés como la glauberita (Na2Ca(SO4)2), que aparecían tabuladas en la base de datos original del código PHRQPITZ únicamente a 25 oC. La precisión alcanzada en el cálculo de los índices de saturación depende de la calidad tanto de los parámetros termodinámicos manejados (los incluidos en la base de datos del código y los procedentes de las necesarias ampliaciones, como la ya comentada de las constantes de equilibrio) como de los resultados analíticos obtenidos. El criterio aplicado para valorar la incertidumbre ha sido ±0,15 unidades de I.S., implicando que las situaciones de equilibrio no podrán determinarse con una precisión superior a la definida [19]. En el caso de los minerales carbonatados se ha considerado un rango de incertidumbre algo superior, de ±0,4 unidades de I.S. Este tratamiento diferente se debe a la existencia de importantes problemas metodológicos relacionados con la determinación del pH en soluciones altamente concentradas [20, 21], ya que el empleo de tampones convencionales para el calibrado del pH-metro condiciona que la medida de este parámetro en salmueras no se encuentre en la misma escala de coeficientes de actividad que el modelo acuoso empleado [13]. Este tipo de problemas relativos al comportamiento del sistema carbonatado en soluciones de concentraciones elevadas ha sido manifestado incluso en estudios de tipo experimental [22].
Resultados
Evolución composicional
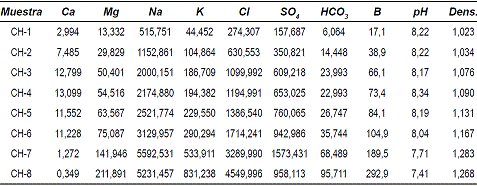
La tabla 1 presenta los resultados de los análisis químicos, pH y densidad durante el proceso de evaporación en el laboratorio. Todos estos datos se han representado gráficamente en función del parámetro escogido como indicador del grado de avance del proceso evaporativo (la concentración molal de Cl-, expresada en escala logarítmica), puesto que los cálculos se han llevado a cabo hasta alcanzar el equilibrio con la halita, momento en el cual dicho componente químico deja de presentar comportamiento conservativo en la solución.
Tabla 1 Composición química, pH y densidad de las salmueras evaporadas. La concentración elemental está expresada en milimoles por litro (mmoles/L), excepto en el caso del boro expresado en miligramos por litro (mg/L) y la densidad en gramos por mililitro (g/ml)
En la figura 3 se han representado los resultados de densidad y concentración (fuerza iónica) de la solución evaporada en función del parámetro escogido como indicador del proceso de evaporación. Se observa que la densidad aumenta gradualmente hasta un máximo cercano a 1,30 g/ml, aunque en la última muestra se comprueba un cambio en la tendencia, pasando a producirse en este punto un descenso apreciable en torno a 1,26 g/ml. En la misma, se muestra la evolución de la fuerza iónica (F.I.), parámetro calculado por el código de modelización empleado y que se aplica frecuentemente como expresión global de la concentración de una solución. La F.I. aumenta progresivamente hasta un valor máximo cerca de 10 molal, pero en la última muestra se observa nuevamente un descenso de éste, hasta situarse próximo a 9 molal. De la figura 3 se puede deducir por tanto, que el proceso evaporativo provoca un aumento progresivo tanto en la densidad de las soluciones como en su fuerza iónica, aunque en un punto determinado cuando las salmueras alcanzan una concentración elevada (próximo a 10 molal), tiene lugar un cambio de tendencia que provoca un descenso cuantitativamente apreciable en ambos parámetros.
Figura 3 Evolución de la densidad y concentración de la salmuera, en función del contenido en Cl
La figura 4, muestra la evolución de la concentración de los componentes de la solución evaporada. El gráfico de la izquierda (4A), presenta los valores discretos para cada solución y cada elemento analizado, y el de la derecha (4B) es la representación continua de la evolución elemental. En ambos se aprecian las pautas evolutivas correspondientes a los elementos químicos de interés, es así que podemos destacar el comportamiento conservativo deducible de la pauta lineal de K+, Mg2+ y B (además del Cl-, elemento empleado como variable de progreso del proceso de evaporación), lo que significa que estos elementos no se ven involucrados en proceso alguno de precipitación o disolución mineral a lo largo del intervalo muestreado. El resto de elementos analizados, Na+ y SO4-2 presentan una tendencia conservativa hasta la penúltima muestra, donde el aumento continuo en su concentración cambia de pendiente y tiene lugar un descenso apreciable en la última muestra recogida. Los dos elementos restantes, HCO3- y Ca+2, muestran un comportamiento irregular, mientras el primero ve aumentar su concentración (aunque con distintas pendientes) a lo largo de todo el proceso, el Ca+2 sufre un cambio de pendiente a partir del cual su concentración disminuye hasta alcanzar niveles muy bajos.
Figura 4 Evolución de la composición química de las salmueras a lo largo del proceso de evaporación, en función del contenido en Cl-
La representación de las determinaciones físicas y químicas realizadas sobre las soluciones muestreadas nos ha permitido apreciar que el proceso evaporativo provoca un aumento progresivo en la densidad y la fuerza iónica de las soluciones, aunque se alcanza un punto en la pauta evolutiva que da lugar a un cambio de tendencia, pasando a disminuir el valor de ambas variables (Figura 3). Este cambio de tendencia es simultáneo al que sufren Na+ y SO4-2, lo que parece indicar que tiene lugar un importante proceso de precipitación salina que afecta a estos dos iones cuando las soluciones alcanzan un grado de concentración muy elevado. En el caso de Ca+2 y HCO3-, presentan un comportamiento no conservativo, lo que se deduce que deben estar afectados por procesos de precipitación en alguna etapa del proceso evolutivo registrado.
La tabla 2 muestra los resultados del análisis mineralógico obtenido del experimento, la primera columna indica la muestra de salmuera que fue recogida de manera simultánea al sólido correspondiente, y los minerales presentes se han agrupado según su abundancia de un modo semicuantitativo a partir de los resultados de los difractogramas, considerando minerales mayoritarios aquellos presentes en la muestra en un porcentaje superior al 5%, y minoritarios a los que no alcanzan dicho porcentaje. Los minerales mayoritarios recogidos son calcita (muestra CH-2), yeso (muestras CH-3 y CH-5), thenardita (muestras CH-7 y CH-8) y halita (muestra CH-8). Por su parte, los minerales minoritarios no se espera que sean representativos del estadio evolutivo en el que se tomaron las respectivas muestras, ya que los sólidos fueron desecados previamente a su determinación difractométrica, y en este proceso la salmuera que los impregnaba debió dejar depositados sobre los minerales mayoritarios otros representativos de etapas más avanzadas (situación idéntica a la formación de eflorescencias en sistemas naturales).
Tabla 2 Composición mineralógica de los sedimentos salinos recogidos en el experimento (ver explicación en el texto)
Los minerales determinados en las muestras sólidas indican que, durante el proceso de precipitación que tiene lugar a partir de las salmueras evaporadas, la formación de carbonatos y sulfatos de calcio corresponden a etapas iniciales de menor concentración, mientras que, en las fases más avanzadas se produce la precipitación principalmente de sulfatos y cloruros.
Cálculos de saturación mineral
El estado de saturación de la salmuera respecto de los principales minerales salinos de interés se ha podido estudiar al representar los resultados de I.S. calculados por el código PHRQPITZ, frente a la variable indicativa del grado de evolución evaporativo del sistema. Las representaciones gráficas resultantes se reflejan en las figuras 5, 6 y 7.
En la figura 5 se observa la evolución de los principales minerales carbonatados y clorurados. La calcita se encuentra levemente sobresaturada desde etapas tempranas, pero manifiesta al final del proceso un descenso en su I. S. que, sin embargo, no llega a situarse en un estado de subsaturación. El estado de saturación del aragonito no se ha representado, ya que su producto de actividad iónica es igual al de la calcita y las constantes de equilibrio de los dos minerales difieren sólo en dos décimas de unidad, con lo cual la situación de saturación es prácticamente idéntica a la calcita y aragonito. El otro mineral carbonatado es la trona, el que se encuentra en todo momento en una clara situación de subsaturación. Las siguientes representaciones en la figura 5 corresponden a la evolución de los índices de saturación de los cloruros, halita, silvita y carnalita, que en su conjunto presentan una pauta ascendente con clara situación de subsaturación, llegando a alcanzar el equilibrio tan sólo la halita al final del proceso evaporativo. La última gráfica en esta figura, representa la evolución de la presión parcial del CO2 en solución, (pCO2) calculada, en que se observa cómo ésta en todo momento es superior al valor de 10-3,5 atm, aumentando en las etapas de mayor concentración, hasta un valor próximo de 10-1 atm.
Figura 5 Evolución de los índices de saturación mineral de calcita, trona, halita, silvita y carnalita, en función del contenido en Cl- y evolución de la presión parcial de CO2 en solución
Figura 6 Evolución de los índices de saturación mineral de yeso, anhidrita, mirabilita, thenardita, bloedita y bórax , en función de la concentración de Cl- en solución
Figura 7 Evolución de los índices de saturación mineral de singenita, polihalita, glaserita y epsomita, en función de la concentración de Cl- en solución
La figura 6 muestra los valores de I.S. para sulfatos y bórax. En el caso del gráfico del yeso, la evolución de los I.S. calculados van desde un estado de subsaturación inicial hasta alcanzar el campo del equilibrio, en la segunda muestra recogida, para volver finalmente a una situación de subsaturación en la solución. Por su parte, los sulfatos sódicos, mirabilita y thenardita, originan pautas evolutivas levemente diferentes en la etapa de mayor concentración, así, ambos minerales se aproximan progresivamente al equilibrio. Cuando la salmuera alcanza una concentración del Cl- de 0,54 molal (penúltima muestra), se observa que la thenardita alcanza y mantiene el estado de equilibrio, mientras que, la mirabilita ve disminuir el valor de su I.S., alejándose por tanto del campo del equilibrio. En éstos sistemas salinos es frecuente la presencia de bloedita, la cual presenta una evolución muy similar a la de la thenardita (aunque partiendo de una situación inicial de subsaturación más acusada), pero situándose siempre en el campo de la subsaturación y sufriendo una pauta descendente en las fases de mayor concentración de las salmueras. Finalmente, la representación del bórax, presenta un claro estado de subsaturación del sistema. Otros minerales sulfatados cuya presencia se suele detectar por difractometría de rayos X en muestras sólidas recogidas en sistemas naturales de este tipo son los representados en la figura 7 y son, singenita, polihalita, glaserita y epsomita. La pauta mostrada por los dos primeros minerales citados presenta una etapa inicial ascendente y una final descendente, diferenciándose entre sí únicamente en que la singenita llega a rozar en un momento determinado el estado de equilibrio. Por su parte, la evolución de la glaserita y de la epsomita es lineal en ambos casos, aunque la correspondiente a la glaserita presenta una pendiente mayor y llega a alcanzar el equilibrio tan solo en la última muestra recogida.
Discusión
La realización de experimentos de evaporación en condiciones controladas de laboratorio nos permite realizar un seguimiento detallado y progresivo de la evolución por evaporación de una salmuera. La ejecución del mismo tipo de estudios directamente sobre un sistema natural, como por ejemplo un salar, exige realizar muestreos periódicos o diseñar exhaustivas campañas de toma de muestras, pero aun así éstos resultados no suelen ser totalmente representativos de la evolución evaporativa de las soluciones, puesto que interfieren otros factores relevantes, tales como el tiempo, condiciones climáticas, etc., que suelen modificar las pautas obtenidas. Para ilustrar este comentario, se remite al lector a comparar los gráficos que se presentan en este trabajo con los previamente publicados por los mismos autores [6], en los que se representaban los datos procedentes exclusivamente de muestras recogidas en el sistema natural. La actuación de diferentes procesos ajenos a la evolución por evaporación de las salmueras, entre los que se encuentran la disolución de material salino preexistente y los reequilibrios provocados por las oscilaciones térmicas diarias, provoca una dispersión en los puntos representados que dificultan la estimación de las pautas evolutivas del sistema geoquímico.
Esta experiencia requirió un importante volumen de agua de recarga del salar, pero sin previo contacto con el cuerpo salino principal del mismo, lo que permitió evitar la disolución de material sólido ajeno a la evolución propia de la salmuera. De este modo, el experimento comenzó con una solución poco concentrada (con densidad de 1,02 g/ml y una fuerza iónica de 0,78 molal) y que aún no había alcanzado el equilibrio con yeso, primer mineral salino que suele alcanzar la saturación en sistemas naturales de este tipo. De hecho, un número significativo de las salmueras procedentes del salar con un grado de concentración similar e incluso inferior al de esta solución inicial, ya se encontraban en equilibrio con yeso (Figura 7 en López [6]), lo que viene a atestiguar la existencia del proceso de solubilización de material salino preexistente en las soluciones de recarga del salar.
El cálculo de los índices de saturación indica que las fases minerales que han alcanzado el equilibrio en algún momento de la evolución por evaporación son: yeso, anhidrita, thenardita, glauberita, halita, singenita y glaserita, además que las soluciones ya se encontraban en todo momento sobresaturadas en calcita (y/o aragonito). Los análisis mineralógicos efectuados sobre los depósitos salinos recogidos en distintos momentos del proceso experimental nos indican que la calcita, yeso, thenardita y halita, aparecen como constituyentes mayoritarios del material precipitado durante la evolución evaporativa de la salmuera, lo cual es compatible con los resultados obtenidos mediante el código PHRQPITZ, ya que son las fases sólidas cuya pauta es más fácilmente equiparable a un proceso efectivo de precipitación mineral. Del resto de fases que alcanzaron el equilibrio (al menos de forma aparente) a lo largo del experimento, no era esperable la presencia de anhidrita en los precipitados analizados, ya que la fase sulfatada cálcica estable para las condiciones normalmente reinantes en un sistema salino de este tipo es el yeso, como se ha podido corroborar a partir del análisis de las muestras del sistema natural (Tabla 2). Por otra parte, no se ha podido constatar la precipitación significativa de glauberita, singenita y glaserita en los depósitos recogidos; no obstante no se debe descartar su posible presencia real, aunque en cantidades mínimas, debido a las limitaciones de la técnica instrumental empleada (análisis difractométrico). Aun así, la precipitación efectiva en sistemas salinos de fases minerales de estequiometria compleja, como es el caso de glauberita, bloedita, singenita, polihalita y glaserita, se ve inhibida en procesos de precipitación salina bajo lámina de agua, quedando su presencia restringida a los procesos de formación de costras eflorescentes, veáse discusión en López [6].
Existe una identidad prácticamente total entre los minerales salinos precipitados en el experimento y los determinados sobre muestras recogidas directamente de la superficie del salar. En la Tabla 2 del trabajo previo de López [6] se puede comprobar cómo aquéllas muestras correspondientes claramente a precipitados salinos de la superficie del salar presentaban como componentes minerales mayoritarios: yeso, halita, thenardita y calcita, que aparecían acompañados por otros minerales salinos de estequiometría más compleja y en una proporción claramente inferior. Estos precipitados recogidos en el salar procedían siempre de las proximidades de las acumulaciones de salmuera superficial, lo que permitió identificarlos como productos de precipitación salina bajo lámina de agua.
Los resultados experimentales indican que la evaporación de la salmuera da lugar a la precipitación de los mismos minerales que fueron identificados en la superficie del salar. No obstante, la modelización geoquímica permite comprobar que la interacción entre el material salino del salar (con un cuerpo masivo central de sales sódicas con un espesor no inferior a 1,5 m, rodeado por una aureola principalmente yesífera) provoca que las condiciones de equilibrio se alcancen en etapas de menor concentración total de la salmuera que las observadas en el experimento. De este modo, las salmueras empleadas en el experimento se encuentran subsaturadas respecto del yeso hasta que se alcanza un valor de log(mCl) en solución de aproximadamente 2,7; mientras que en el salar se recogieron muestras de salmuera en equilibriocon yeso a partir de valores de log(mCl) de 1,5, es decir, de un orden de magnitud inferior.
La realización de un experimento en condiciones isotérmicas ha permitido estudiar la evolución de las salmueras sometidas a procesos de reequilibrio por variaciones de temperatura. Durante el experimento realizado a una temperatura constante de 40oC, las salmueras no alcanzaron el equilibrio con thenardita, sino cuando alcanzan un valor aproximado de log(mCl) de 3,4, mientras que la saturación en halita se consiguió para un valor de log(mCl) en torno a 3,6. Ambos estados de equilibrio de saturación se consiguen cuando las salmueras alcanzan valores de concentraciones altas, en este caso a fuerza iónica próxima a 9 molal. Por otra parte, estas soluciones no llegan a alcanzar el equilibrio en ningún momento con mirabilita a pesar de aproximarse al campo de saturación (Figura 6).
Contrariamente a lo observado respecto al yeso, mineral que logra el equilibrio en el sistema natural en concentraciones menores que las realizadas en el experimento, los dos minerales salinos sódicos mayoritariamente precipitados (thenardita y halita) llegan al estado de saturación con valores menores de log(mCl) en el dispositivo experimental que en el sistema natural. La explicación a esta situación se centra en el carácter isotérmico del experimento realizado, que ha impedido que tuviese lugar proceso alguno de precipitación-mineral, como consecuencia de una modificación importante en la temperatura del sistema. Este tipo de procesos es muy importante para el sistema Na-SO4-H2O a consecuencia de la elevada dependencia de la constante de equilibrio de la mirabilita respecto de la temperatura [12], y su influencia se hace más notoria cuanto mayor es la amplitud de las oscilaciones térmicas y también cuanto más elevada es la concentración de las soluciones.
La climatología de la zona del Salar de Huasco es muy extrema, siendo destacable las elevadas oscilaciones térmicas que tienen lugar a escala diaria en cualquier estación del año, hecho que condiciona que las soluciones del salar vean disminuir drásticamente su temperatura al caer la noche, circunstancia favorable para la precipitación de mirabilita (sulfato sódico hidratado) al alcanzar la temperatura que permita este proceso heterogéneo, independientemente del grado de concentración de las salmueras. Para ilustrar este efecto se realiza un sencillo cálculo geoquímico con las soluciones muestreadas en el experimento del laboratorio (Tabla 3), consistente en la disminución de la temperatura hasta obtener un valor de I.S. de la mirabilita próximo a cero.
Tabla 3 Valores de temperatura calculados por el código PHRQPITZ, a los cuales las salmueras recogidas alcanzarían el equilibrio con mirabilita. También se muestran los I.S. de la thenardita calculados empleando esos mismos valores de temperatura (en la muestra CH-1 no se ha podido efectuar el cálculo, ya que no se poseen datos a temperaturas inferiores a 0oC)
A partir de estos resultados, se puede comprobar que, a excepción de la muestra inicial (para la cual no teníamos los datos necesarios, al alcanzarse el equilibrio con mirabilita a temperaturas por debajo de 0oC), todas las salmueras muestreadas obtienen una temperatura de equilibrio para la mirabilita fácilmente alcanzable en el sistema natural del Salar de Huasco, situado a casi 4000 m de altitud y sometido a un clima cuya temperatura media anual estimada es de unos 4,5 oC [8]. Los resultados de estos cálculos indican además que, a las temperaturas calculadas para el equilibrio con mirabilita, la thenardita (el sulfato sódico anhidro) se encuentra todavía lejos de alcanzar la saturación, como se puede comprobar en la tercera columna de la Tabla 2, excepto en el caso de las dos últimas muestras en que ya se había alcanzado el equilibrio real con thenardita.
El proceso de precipitación de mirabilita en sistemas salinos sometidos a fuertes variaciones térmicas día-noche es bien conocido [12]. Este fenómeno tiene una importante influencia sobre el quimismo de las salmueras, ya que al precipitar la mirabilita por descenso de temperatura, tiene lugar una importante baja en sodio y sulfato presentes en la solución, lo que influye posteriormente a la hora de alcanzar el equilibrio con halita (cloruro de sodio). En la Figura 6 se comprueba que en el experimento de evaporación, libre del efecto del reequilibrio con mirabilita, se alcanza la saturación en halita para un valor de log(mCl) aproximado de 3,6; mientras que en las muestras recogidas en el salar el valor es 3,8 debido a la escala logarítmica empleada.
Conclusiones
En un estudio previo geoquímico de la evolución de estas salmueras superficiales se pudo constatar que, al menos a priori, las soluciones se veían expuestas a otros procesos que modificaban las pautas evolutivas esperables para un proceso simple de concentración por evaporación ([6, 10]). Con el objeto de estudiar las características de evolución de las salmueras producto de su evaporación, se realizó el experimento cuyos resultados presentamos aquí:
Se ha comprobado que las aguas de recarga del salar se evaporan para dar lugar a la precipitación progresiva de calcita, yeso, thenardita y halita, cuya presencia se pudo constatar mediante el análisis mineralógico de los precipitados obtenidos durante el experimento. Los resultados de la modelización geoquímica han permitido constatar que la precipitación de estos minerales se corresponde con las respectivas situaciones de equilibrio alcanzadas por las soluciones en el transcurso de su progresiva concentración por evaporación.
Se ha podido constatar que los minerales determinados en las muestras sólidas recogidas en el salar son prácticamente los mismos que se han identificado en el experimento de evaporación. No obstante, la modelización geoquímica ha permitido comprobar que el momento en el que se alcanza el equilibrio con las distintas fases minerales varía significativamente entre las condiciones controladas de laboratorio y las reinantes en el sistema natural. Así, los dos efectos más significativos evidenciados son:
a) la interacción entre las soluciones diluidas de recarga del salar con la costra salina periférica rica en yeso, cuya disolución provoca que se alcance el equilibrio con esta fase mineral primero en el sistema natural, que en el laboratorio;
b) la precipitación de mirabilita como consecuencia de las diarias oscilaciones térmicas, cuya constante de equilibrio varía ampliamente con la temperatura, provoca que el equilibrio con halita se alcance en el salar en una etapa evolutiva más avanzada que en el experimento, dado que la precipitación de mirabilita provoca la retirada de sodio de la solución.
Finalmente, se concluye que el Salar de Huasco es un sistema salino compuesto principalmente por sales sódicas, producto de la evaporación en una cuenca endorreica de las aguas de un lago preexistente. En la actualidad, las soluciones superficiales de recarga dan lugar a una acumulación que cubre únicamente una mínima parte del salar, viéndose sometidas a un proceso de concentración por evaporación a consecuencia de la elevada sequedad ambiental reinante.
Referencias
1. F. Risacher, H. Alonso, C. Salazar. Salar del Huasco. Geoquímica de aguas en cuencas cerradas: I, II y III Regiones. Convenio de Cooperación dga- ucn- ird-. S.I.T. No 51. Santiago de Chile. 1999. pp: I-95 [HCO] - I-110 [HCO]. [ Links ]
2. J. Karzulovic, F. García. Evaluación de los recursos hídricos de la provincia de Iquique. Ministerio de Obras Públicas (inédito). 1978. pp. 50. [ Links ]
3. H. Fuenzalida. Clima. Geografía Económica de Chile. Corp. Fomento de la Producción (CORFO). Vol. 1. 1965. pp. 188-325. [ Links ]
4. S. Montti, H. Henríquez. Interpretación hidrogeológica de la génesis de salares y lagunas del Altiplano Chileno. Actas del II Congreso Geológico Chileno. Arica (Chile). 1970. pp. 669-680. [ Links ]
5. A. Grilli, F. Vidal. Evaporación desde salares: metodología para evaluar los recursos hídricos renovables. Aplicación a las regiones I y II. Dirección General de Aguas, Departamento de Hidrología, Publicación Interna SDEH 86/4. 1986. pp. 19. [ Links ]
6. P. L. López, I. Garcés, L. P. Auqué, J. Gómez, M. J. Gimeno, M. P. Lapuente. Características geoquímicas y aspectos geológicos del Salar de Huasco (Chile). Boletín Geológico y Minero. Vol. 110. 1999. pp. 297- 316. [ Links ]
7. I. Garcés, J. Valderrama. Aspectos Químicos y Mineralógicos del Salar de Huasco. Depósito de sulfato de sodio. Actas del XVIII Congreso Interamericano de Ingeniería Química. Fundamentals in Chemical Engineering. Section 322. Puerto Rico. 1998. [ Links ]
8. G. E. Stoertz, G. E. Ericksen. Geology of salars in northern Chile. U.S. Geological Survey. Professional Paper No 811. 1974. pp. 65. [ Links ]
9. H. Vergara, A. Thomas. Hoja Collacagua, Región de Tarapacá. Carta Geológica de Chile. escala 1:250.000. Servicio Nacional de Geología y Minería (Chile). No 59. 1984. pp. 79. [ Links ]
10. I. Garcés. Geochemistry of Huasco Salar's, Chile. Origin of solutes and brines evolution. 8th World Salt'2000, Tomo II, R. Geertman (editor), Ed. Elsevier. Amsterdam. 2000. pp. 1159-1161. [ Links ]
11. C. Herrera, N. Guerra, M. Pereira, C. Guerrero. Características geológicas y geoquímicas del Salar de Ascotán. Actas del VIII Congreso Geológico Chileno, Antofagasta (Chile). Vol. 1. 1997. pp. 732-737. [ Links ]
12. L. Auqué, V. Vallès, H. Zouggari, P. López, G. Bourrié. Geoquímica de las lagunas saladas de Los Monegros (Zaragoza). I. Determinación experimental de los efectos del reequilibrio mirabilita-solución con la temperatura en un sistema natural. Estudios Geológicos. Vol. 51. 1995. pp. 243-257. [ Links ]
13. L. N. Plummer, D. L. Parkhurst, G. W. Fleming, S. A. Dunkle. Computer program incorporating Pitzer's equations for calculation of geochemical reactions in brines. Water-Resources Investigation Report. WRI 88-4153. 1988. pp. 310. [ Links ]
14. K. Pitzer. Thermodynamics of electrolytes. I. Theoretical basis and general equations. Journal of Physical Chemistry. Vol. 77. 1973. pp. 268-277. [ Links ]
15. K. Pitzer. Thermodynamic model for aqueous solutions of liquid-like density. Thermodynamic Modeling of Geochemical Materials: Minerals, Fluids and Melts. I.S.E. Carmichael, H.P. Eugster (Eds.). Reviews in Mineralogy. Vol. 17. 1987. pp. 97-142. [ Links ]
16. C. E. Harvie, J. H. Weare. The prediction of mineral solubilities in natural waters: The Na-K-Mg-Ca-Cl- SO4-H2O system from zero to high concentration at 25o C. Geochimica et Cosmochimica Acta. Vol. 44. 1980. pp. 981-997. [ Links ]
17. C. E. Harvie, N. Moller, J. H. Weare. The prediction of mineral solubilities in natural waters: The Na-KMg- Ca-H-Cl-SO4-OH-HCO3-CO3-CO2-H2O system to high ionic strengths at 25 oC. Geochimica et Cosmochimica Acta. Vol. 48. 1984. pp. 723-751. [ Links ]
18. J. P. Greenberg, N. Moller. The prediction of mineral solubilities in natural waters: A chemical equilibrium model for the Na-K-Ca-Cl-SO4-H2O system to high concentration from 0 to 250 oC. Geochimica et Cosmochimica Acta. Vol. 53. 1989. pp. 2503-2518. [ Links ]
19. E. A. Jenne, J. W. Ball, J. M. Burchard, D. V. Vivit, J. H. Barks. Geochemical modeling: apparent solubility controls on Ba, Zn, Cd, Pb and F in waters of the Missouri Tri-State mining area. Trace Substances in Environmental Health. D. D. Hemphill (editor). University of Missouri. Columbia (Montana). Vol. 14. 1980. pp. 353-361. [ Links ]
20. A.G. Dickson. pH scales and proton-transfer reactions in saline media such as sea water. Geochimica et Cosmochimica Acta. Vol. 48. 1984. pp. 2299-2308. [ Links ]
21. Y. Markus. Determination of pH in highly saline waters. Pure and Applied Chemistry. Vol. 61. 1989. pp. 1133-1138. [ Links ]
22. B. Lazar, A. Starinski, A. Katz, E. Sass, S. Ben-Yaakov. The carbonate system in hypersaline solutions: alkalinity and CaCO3 solubility of evaporated seawater. Limnology and Oceanography. Vol. 28. 1983. pp. 978-986. [ Links ]
(Recibido el 15 de enero de 2009. Aceptado el 23 de septiembre de 2009)
*Autor de correspondencia: teléfono: + 56 + 5 + 563 73 13, correo electrónico: igarces@uantof.cl (I. Garcés)