Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Ingeniería Universidad de Antioquia
Print version ISSN 0120-6230On-line version ISSN 2422-2844
Rev.fac.ing.univ. Antioquia no.55 Medellín Sept. 2010
Estudio cinético de la hidrogenación de trans-cinamaldehído sobre catalizadores de Ir/Nb2O5
Kinetic study of the hydrogenation of trans-cinnamaldehyde over Ir/Nb2O5 catalysts
Hugo Alfonso Rojas Sarmiento1* , José Jobanny Martínez Zambrano1, Patricio Alberto Reyes2
1Grupo de Catálisis (GC-UPTC) Universidad Pedagógica y Tecnológica de Colombia, Escuela de Química, Facultad de Ciencias. Av. Central del Norte, Tunja, Colombia.
2Facultad de Química, Universidad de Concepción, Chile. Concepción, Casilla 160-C, Concepción, Chile.
Resumen
Se estudió la hidrogenación de trans-cinamaldehído sobre catalizadores de Ir/Nb2O5 reducidos en atmósfera de hidrógeno a 473 K (LTR) y a 773 K (HTR). Los catalizadores se caracterizaron por adsorción de N2 a 77 K, quimisorción de H2 a 298 K, TPR y TPD-NH3. El estudio cinético de la hidrogenación de trans-cinamaldehído sobre catalizadores reducidos alta temperatura (HTR) se realizó en el rango de presiones de 0,48 a 0,98 MPa, a temperaturas de reacción entre 323 a 363 K, masa del catalizador de 0,1 a 0,3 g y concentraciones de trans-cinamaldehído de 0,025 a 0,1 M, usando como solvente n-heptano. Los resultados indican que la hidrogenación procede de manera selectiva hacía el alcohol insaturado, aunque la acidez del soporte conduce a la formación de subproductos. Un mecanismo dual Langmuir-Hinshelwood con adsorción molecular de hidrógeno no competitiva con las moléculas orgánicas en la que se asumió la reacción superficial como etapa limitante de la reacción se ajusta a los datos experimentales.
Palabras clave: Nb2O5, hidrogenación, trans-cinamaldehído, efecto SMSI, Langmuir-Hinshelwood
Abstract
The hydrogenation of trans-cinnamaldehyde was studied over Ir/Nb2O5 catalysts reduced at 473 K (LTR) and 773 K (HTR). The catalysts were characterized by N2 physisorption at 77 K, H2 chemisorption, TPR, and TPD- NH3. Kinetic study of trans-cinnamaldehyde over Ir/Nb2O5 reduced at HTR was carried out in n-heptane at hydrogen pressures in the range of 0.48 to 0.98 MPa, the reaction temperatures were 323-363 K, catalyst loadings 0.1 to 0.3 g and cinnamaldehyde concentrations 0.025 to 0.1 M. Trans-cinnamaldehyde can be selectively hydrogenated to cinnamyl alcohol although the support acidity leads to the formation of byproducts. A Langmuir-Hinshelwood model with molecular adsorption of hydrogen non competitive with organic molecules and considering the surface reaction as the rate-controlling step provided the best fit of the experimental data.
Keywords: Nb2O5, hydrogenation, trans-cinnamaldehyde, SMSI effect, Langmuir-Hinshelwood
Introducción
La hidrogenación catalítica selectiva de trans-cinnamaldehído (CALD) es un tema de interés en química fina por los valiosos productos que pueden generarse [1-8]. El alcohol cinamílico (COL) se emplea en la industria de fragancia y aromas y el hidroxicinamaldehído (HCALD) es un intermediario en la preparación de farmacéuticos usados en el tratamiento del VIH [2]. Se han ensayado diversos enfoques para aumentar la selectividad hacía uno de estos productos en la hidrogenación de CALD sobre catalizadores heterogéneos [1-8]. La selectividad hacía HCALD (SHCALD) y COL (SCOL) varía considerablemente con el método de preparación del catalizador, soporte, solvente y condiciones de reacción empleados [2-7]. El tamaño de partícula influye en la selectividad obtenida hacía el alcohol insaturado (SCOL) [3], lo cual se atribuye a un efecto estérico entre el grupo fenilo y la superficie metálica. En el caso de superficies planas se impide la adsorción preferencial del grupo C=C y se favorece la adsorción del grupo C=O, lo que no ocurre sobre partículas pequeñas, contrariamente a lo reportado por Arai et al [4] quienes mostraron una alta SCOL con partículas de Pt cercanas a 1 nm soportadas en alúmina y reducidas a 303 K. Los catalizadores de metales nobles soportados sobre óxidos parcialmente reducibles son especialmente útiles para obtener alcoholes insaturados, debido a la decoración superficial que sufren las partículas metálicas cuando son reducidos a alta temperatura (HTR: 773 K), efecto conocido como interacción fuerte metal soporte (SMSI) [8-10] que fundamentalmente consiste en la disminución de la relación H/Me, (donde Me: Metal), por migración de especies del soporte.
El Nb2O5 podría ser empleado como soporte con estos fines por ser ligeramente reducible, además de presentar otras propiedades como acidez y estabilidad térmica [10-11]. Se ha reportado que el orden de actividad en la hidrogenación de CO con catalizadores de Rh soportados sobre distintos óxidos es Nb2O5>ZrO2>Al2O3>SiO2>MgO. Esto se explica como consecuencia del efecto SMSI [9]. De igual manera, catalizadores de Rh/Nb2O5 reducidos a 773 K favorecen la formación de isopropanol en la hidrogenación de acetona, lo que se atribuye al efecto SMSI [10]. Resultados similares han sido observados en la hidrogenación selectiva de acroleína [3]. En el presente trabajo, se reporta un estudio de la cinética de hidrogenación de trans-cinamaldehído sobre catalizadores Ir/Nb2O5. A la fecha existe información cinética limitada sobre algunos sistemas, entre ellos Ir/C, Ir/TiO2 e Ir/TiO2/SiO2 [7-9,11-12].
Experimentación
Se prepararon catalizadores de Ir soportados sobre Nb2O5 (Merck 99% de 8,2 m2g-1) por impregnación del soporte con una solución acuosa de H2IrCl6 en cantidad adecuada para generar 1% en peso de iridio. Los sólidos se redujeron en H2 a 473 K (LT: baja temperatura de reducción) y 773 K (HT: alta temperatura de reducción). Los análisis de microscopia electrónica de transmisión (TEM) fueron obtenidas en un equipo JEOL modelo JEM-1200EXII, para determinar tamaño de partícula. La superficie específica (SBET) se determinó mediante adsorción de nitrógeno a 77 K en un equipo Micromeritics ASAP 2010. Los estudios de quimisorción de H2 se efectuaron a 298 K en el mismo equipo. La reducción con H2/Ar desde 423 K a 1173 K a 25 Kmin-1 permitió el análisis de reducción a temperatura programada de las muestras. Pruebas de acidez superficial fueron llevadas a cabo por TPD-NH3 previa prerreducción a 393 K.
Las reacciones se realizaron en fase líquida en un reactor por lotes, previa prerreducción del catalizador. Se analizaron las variables de reacción (solvente, presión, concentración, temperatura y masa de catalizador) para lo cual una variable fue modificada mientras las otras se mantenían constantes. El efecto de la presión de H2 se estudió en el rango de 0,34 MPa a 0,98 MPa, la concentración de trans-cinamaldehído en el rango de 0,025 a 0,1 M, la masa del catalizador de 0,1 a 0,3 g y la temperatura desde 333 K a 403 K. Los productos de reacción se analizaron en un cromatógrafo de gases - espectrómetro de masas (Varian 3800-Saturn 2000) con el uso de una columna HP-5 (30m x 0,25 mm de d.i.). Los tiempos de retención de reactivos y productos fueron cinamaldehído (CALD): 18,4 min; etilbenceno (EB): 6,3 min, metilestireno: (MST): 11.1 min; cinamilalcohol (COL): 19,3 min; hidrocinamaldehído (HCALD): 15,2 min; hidrocinamilalcohol (HCOL): 17,2 min.
Resultados y discusión
Los catalizadores empleados han sido previamente caracterizados y reportados en trabajos anteriores por nuestro grupo de investigación [13,14]. Como puede observarse de la tabla 1, para ambos catalizadores Ir/Nb2O5 HTR y LTR se evidenció una baja área superficial con un elevado tamaño de partícula metálica, lo que podría favorecer la formación del alcohol insaturado como ha sido reportado por Gallezot [3]. La disminución en la relación H/Ir en catalizadores reducidos a HTR se explica por la migración de especies parcialmente reducidas del soporte sobre el cristal metálico de Ir, ocasionando una disminución de la superficie metálica, las especies de Nb2Ox se generan por la transferencia de carga del metal hacía el soporte en el proceso de reducción del catalizador y ocasionan que el metal Ir0 (LT) quede ligeramente cargado como Irδ+ (HT), lo cual ha sido confirmado por el aumento de la energía de enlace (EE) del Ir 4f7/2 por XPS [14].
Tabla 1 Superficie específica, relación H/Ir, tamaño de cristal metálico y acidez superficial, medida por TPD de NH3, en catalizadores Ir/Nb2O5
La reducción a temperatura programada de las muestras calcinadas, revela que la reducción de especies de iridio tiene lugar a dos temperaturas, la primera cercana a 473 K y la segunda a 673 K, siendo completa a temperaturas inferiores de 773 K como puede ser demostrado por la integración de consumo de H2 de los perfiles TPR. El análisis TPD de amoniaco se usó para evaluar la acidez superficial de los catalizadores previamente reducidos a 393 K. El perfil muestra un pico ancho y de baja intensidad en el rango de temperatura de 473 a 673 K para ambos catalizadores.
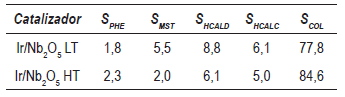
La figura 1 muestra el curso de la reacción en la hidrogenación de cinamaldehído (CALD) sobre los catalizadores de Ir/Nb2O5 reducidos a baja y alta temperatura. Al considerar que a temperaturas de reducción de 473 K hay una reducción incompleta de los óxidos de iridio (según los resultados de TPR) esto podría explicar la baja actividad de este catalizador. La tabla 2 compara la selectividad hacia los diferentes productos, bajo condiciones de isoconversión del 10% teniendo en cuenta que la selectividad es un parámetro que puede verse afectado por la extensión de la transformación. Puede observarse que la temperatura de reducción influye en la selectividad obtenida, así, la selectividad en los primeros minutos de reacción hacía alcohol cinamílico (SCOL) en catalizadores HT fue más alta, lo que puede atribuirse a una mayor fracción de cristales de Ir (Ir0-Irδ+) decorados por el soporte, que permite activar preferencialmente el grupo C=O y aumentar la selectividad hacía el alcohol insaturado [8-9,13-14]. Sin embargo, con el transcurso de la reacción la proporción de COL decrece por causa de la aparición de otros productos, principalmente de metil-estireno (MST), producto de la hidrogenólisis de COL sobre sitios ácidos presentes en la interfase metalsoporte. Este fenómeno es más marcado para catalizadores reducidos a alta temperatura, donde se produce una mayor proporción de COL (véase tabla 2). Aunque el MST aparece al comienzo de la reacción esto puede deberse a una menor saturación de la superficie de las moléculas que permiten que el alcohol cinamílico formado sea rápidamente transformado a este producto y a hidrocinamilalcohol (HCALC) el cual permanece constante en el transcurso de la reacción.
Aunque el elevado tamaño de partícula podría favorecer la formación de COL[3] y disminuir la influencia ácida del soporte, a medida que la reacción progresa debido a un posible efecto spillover se produce la hidrogenólisis de COL, que puede causar la pérdida del efecto SMSI e incrementar la acidez debido a la alta afinidad que posee la niobia con el agua. Además según se observa en la figura 1, en ambos catalizadores la formación de hidrocinamaldehído (HCALD) se incrementa con el tiempo de reacción, lo que sugiere que aunque se pierdan las propiedades del fenómeno SMSI la actividad hidrogenante del iridio se mantiene, y así el catalizador se comporta de manera bifuncional donde sitios hidrogenantes y sitios ácidos son activos. La formación de otros productos en especial de feniletano (PHE) se asocia con la decarbonilación de CALD en sitios ácidos del catalizador [1]. La reacción neta sobre catalizadores Ir/Nb2O5 en la hidrogenación de CALD se muestra en la figura 2.
Tabla 2 Selectividad hacia los productos de hidrogenación de cinamaldehído a 363 K y 0,62 MPa y 0,05 M de sustrato sobre catalizadores de Ir/Nb2O5 LTR y HTR a un nivel de isoconversión del 10%.
Figura 1 Hidrogenación de CALD sobre catalizadores de Ir/Nb2O5 a. LT y b. HT
Figura 2 Esquema de la hidrogenación de CALD sobre catalizadores de Ir/Nb2O5
Con el objeto de determinar la influencia de las variables de reacción en la conversión y selectividad se llevó a cabo el estudio cinético con el catalizador reducido a alta temperatura en términos de la concentración inicial, presión parcial de H2, carga del catalizador a diferentes temperaturas de reacción.
Efecto de transferencia de masa
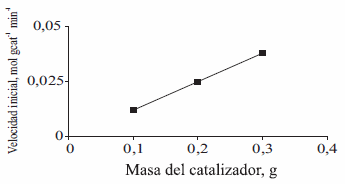
Para las reacciones de hidrogenación en fase líquida, procesos de transferencia de masa pueden influenciar las velocidades de reacción, y deben estar ausentes para garantizar que la reacción este gobernada por parámetros cinéticos y no de transferencia de masa. Las limitaciones de transporte de masa gas-líquido y líquido- sólido se verificaron con la tendencia lineal de una gráfica de conversión en función de la masa de catalizador, tal como se destaca en la figura 3. Las limitaciones de transporte de masa interna pueden superarse con la agitación y el tamaño de partícula, para lo cual se seleccionaron 1000 rpm y 0.15 mm, respectivamente, condiciones ya establecidas anteriormente [8].
Efecto de la concentración inicial de CALD
Se estudió el efecto de la concentración inicial de CALD en el rango de 0,025 a 0,1 M a distintas temperaturas de reacción (333 K a 403 K) y a una presión parcial de H2 de 0,62 MPa. La figura 4 muestra que la actividad inicial es proporcional a la concentración inicial en las distintas temperaturas de estudio. Se observó que un incremento en la concentración inicial de CALD a temperatura constante ocasiona una disminución en SCOL, favoreciendo la formación de los otros productos de reacción, principalmente MST y PHE (Véase la tabla 3).
Figura 3 Hidrogenación de CALD sobre catalizadores de Ir/Nb2O5; Efecto de la masa del catalizador
Figura 4 Hidrogenación de CALD sobre catalizadores de Ir/Nb2O5; Efecto de la concentración inicial
Tabla 3 Selectividad hacia los productos de hidrogenación a distintas concentraciones de trans-cinamaldehído a 363 K y 0,62 MPa sobre catalizadores de Ir/Nb2O5 HTR a un nivel de isoconversión del 10%
Efecto de la presión parcial de H2
Se estudió el efecto de la presión parcial de H2 en el rango de 0,34 a 0,89 MPa a distintas temperaturas de reacción (333 K a 403 K) y a una concentración inicial de 0,1 M de cinamaldehído. La figura 5, muestra que la velocidad inicial se mantiene constante con el incremento de la presión. La selectividad hacía los productos de reacción se mantiene con el incremento en la presión parcial de H2.
Figura 5 Hidrogenación de CALD sobre catalizadores de Ir/Nb2O5; Efecto de la presión parcial de H2
Efecto de la temperatura de reacción
La actividad y selectividad son de gran importancia para la reacción de hidrogenación, así el efecto de la temperatura de reacción fue estudiada en el rango de 323 a 403 K con diferentes condiciones de presión parcial de H2 y concentración inicial de CALD. La temperatura tiene un efecto marcado sobre la selectividad, así SCOL disminuye con la temperatura, mientras incrementa la SMST y SPHE, como puede observarse en la tabla 4.
Tabla 4Selectividad hacia los productos de hidrogenación a distintas temperaturas de reacción en la hidrogenación de trans-cinamaldehído a 0,62 MPa y 0,1 M, sobre catalizadores de Ir/Nb2O5 HTR a un nivel de isoconversión del 10%.
Modelos cinéticos
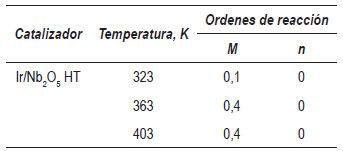
Se presentan dos modelos cinéticos, en el primer modelo la ley de acción de masas puede ser expresada como r=k(CALD)m(pH2)n donde m y n son los ordenes de reacción con respecto a la concentración inicial y con respecto a la presión de H2, respectivamente. Para el cálculo de los órdenes de reacción con respecto a la concentración inicial de CALD y a la presión parcial de H2, se aplicó el método de velocidades iníciales, con éste procedimiento, se podría suponer en los primeros tiempos de reacción no hay competencia de productos con CALD por los sitios activos del catalizador. La tabla 5 resume los órdenes obtenidos a las distintas temperaturas de estudio. Puede observarse que el orden global de la reacción a bajas temperaturas es cercano a cero, pero al aumentar la temperatura es cercano a 0,4, esto puede interpretarse como una saturación completa de moléculas de CALD e H2 sobre los sitios activos del catalizador en los primeros tiempos de reacción. Un orden cero con respecto a la presión parcial de H2 significa que sobre este catalizador la reacción es independiente de la presión de H2 y así debe presentar una elevada constante de adsorción de H2 [6]. Con el uso de esta expresión se determinó la energía de activación, la cual fue cercana a 13 kJmol-1 similar a la obtenida previamente [1,6].
Tabla 5Ordenes de reacción según el método de actividades iniciales
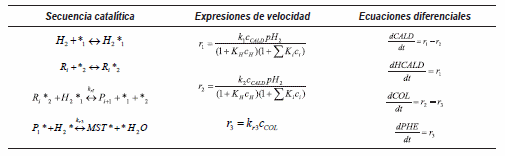
Un segundo modelo no competitivo tipo Langmuir-Hinshelwood (LH) en régimen cinético se propuso, asumiendo que no existen efectos de transferencia de masa como fue indicado por los resultados obtenidos al variar la masa del catalizador. Es posible considerar como se ha indicado T. Salmi et al., [15] que el H2 se adsorbe en forma molecular y debido a que las moléculas de H2 son muchos más pequeñas que las moléculas orgánicas pueden ser adsorbidas en los sitios activos sin ninguna competición. Se consideró para el modelo L-H que las etapas de adsorción de H2 y CALD están en cuasiequilibrio (QE) y la etapa de reacción superficial es la etapa limitante de la reacción. La secuencia catalítica se muestra en la tabla 6. Ri y Pi+1 representan las moléculas orgánicas y productos de la hidrogenación (COL, HCALD, HCALL), mientras *1 y *2 corresponden a los sitios activos para hidrógeno y moléculas orgánicas, respectivamente. P1 corresponde a COL que produce MST y H2O.
Tabla 6 Secuencia catalítica, expresiones de velocidad y ecuaciones diferenciales obtenidas para la hidrogenación de cinamaldehído sobre catalizadores de Ir/Nb2O5
Este modelo da las expresiones de velocidad que se presentan en la tabla 6. ki es la constante que reúne la constante de velocidad y las constantes de adsorción de H2 y CALD. La expresión 1+∑kici es equivalente a 1+KHcH+KCALDcCALD+KCOLcCOL+KHCALDcHCALD. Con el fin de minimizar las variables, las reacciones 4 y 5 de la figura 1 no fueron consideradas debido a la baja proporción obtenida de HCALL y PHE. La formación de MST fue considerada como una ecuación de primer orden (r3).
La velocidad de reacción de cada compuesto está definida según las ecuaciones diferenciales propuestas en la tabla 6. Las ecuaciones diferenciales fueron resueltas numéricamente usando un programa de regresión no linear con un método iterativo de Gauss-Newton. Los valores de las constantes de velocidad k1, k2, k3, KCALD, KHCAL, KCOL, KH fueron halladas con los ajustes de datos experimentales y calculados de la concentración versus tiempo. Debido al orden cero obtenido para la presión parcial de H2, fue asumido una KH mayor que las demás constantes de adsorción de las moléculas orgánicas [6].
Las constantes de velocidad y constantes de adsorción de reactivos y productos están dadas en la tabla 7. La suma residual de cuadrados (SRC) da información sobre la bondad del ajuste.
Tabla 7 Constantes de reacción y de adsorción del modelo propuesto a las distintas temperaturas de estudio
De los parámetros cinéticos obtenidos a diferentes temperaturas a partir del modelo propuesto se determinaron los parámetros energéticos, energía de activación para la etapa limitante de la reacción, como la entalpia y entropía de adsorción de CALD, HCALD y COL. Los valores se muestran en la tabla 8. Las entalpias de adsorción fueron negativas, lo mismo que las entropías de adsorción, lo que demuestra una consistencia termodinámica y satisface las reglas establecidas por Vannice [16].
Tabla 8 Parámetros termodinámicos obtenidos del modelo propuesto
Conclusiones
El catalizador Ir/Nb205 HT presenta una alta selectividad hacia el alcohol insaturado en los primeros tiempos de reacción debido a la presencia del efecto SMSI, pero a medida que la reacción progresa se produce la hidrogenólisis de COL, que puede causar la pérdida del efecto SMSI e incrementar la acidez debido a la alta afinidad que posee la niobia con el agua. Según los parámetros termodinámicos un modelo dual Langmuir-Hinshelwood con adsorción molecular del hidrógeno que considera la reacción superficial como etapa limitante de la reacción describe los resultados obtenidos.
Agradecimientos
Los autores agradecen las facilidades económicas otorgadas por DIN-UPTC-Colombia a través del proyecto DIN SGI-596.
Referencias
1. G. Neri, L. Bonaccorsi, L Meracndante, S. Galvagno. ''Kinetic Analysis of Cinnamaldehyde Hydrogenation over Alumina-Supported Ruthenium Catalysts''. Ind. Eng. Chem. Res, Vol. 36. 1997. pp. 3554-3562. [ Links ]
2. M. Lashdaf, A. O. I. Krause, M. Lindblad, M. Tiitta, T. Venalainen. ''Behaviour of palladium and ruthenium catalysts on alumina and silica prepared by gas and liquid phase deposition in cinnamaldehyde hydrogenation''. Appl.Catal. A. Vol. 241. 2003. pp. 65-75. [ Links ]
3. P. Gallezot, D. Richard. ''Selective hydrogenation of α,β-unsaturated aldehydes'' Catal. Rev. Sci. Eng. Vol. 40. 1998. pp. 81-126.
4. M. Arai, A. Obata, K. Usui, M. Shirai, Y. Nishiyama. ''Activity for liquid-phase hydrogenation of α,β-unsaturated aldehydes of supported platinum catalysts prepared through low-temperature reduction''. Appl. Catal. A. Vol. 146. 1996. pp. 381-389.
5. A. Silva, E. Jordao, M. J. Mendez, P. Fouilloux. ''Effect of metal-support interaction during selective hydrogenation of cinnamaldehyde to cinnamyl alcohol on platinum based bimetallic catalysts''. Appl. Catal. A. Vol. 148. 1997. pp. 253-264. [ Links ]
6. M. L. Toebes, T. A. Nijhuis, J. Hajek, J. H. Bitter, A. J. Dillen, D. Y. Murzin, K. P. Jong. ''Support effects in hydrogenation of cinnamaldehyde over carbon nanofiber-supported platinum catalysts: Kinetic modeling''. Chem. Eng. Sci. Vol. 60. 2005. pp 5682-5695. [ Links ]
7. J. P. Breen, R. Burch, J. Gomez-Lopez, H. Griffin, M. Hayes. ''Steric effects in the selective hydrogenation of cinnamaldehyde to cinnamyl alcohol using an Ir/C catalyst''. Appl. Catal. A. Vol. 268. 2004. pp. 267-274. [ Links ]
8. P. Reyes, H. Rojas, G. Pecchi, J. L. G. Fierro. ''Kinetic study of liquid-phase hydrogenation of citral over Ir/ TiO2 catalysts''. Appl. Catal. A. Vol 248. 2002. pp. 59-65. [ Links ]
9. H. Rojas, G. Borda, J. Martinez, J. S.Valencia, P. Reyes, Liquid phase hydrogenation of citral and intermediares over Ir/TiO2/SiO2 catalysts: Kinetic study''. J. Mol. Catal. A. Vol. 28(5. 2008. pp. 70-78. [ Links ]
10. T. Uchijima; ''SMSI Effect in some reducible oxides including niobia''. Catal. Today. Vol. 28. 1996. pp. 105-117. [ Links ]
11. K. Tanabe. ''Catalytic application of niobium compounds''. Catal. Today. Vol. 78. 2003. pp. 65-77. [ Links ]
12. T. Iizuka, Y. Tanaka, K. Tanabe. ''Hydrogenation of carbon monoxide and carbon dioxide over supported rhodium catalysts''. J. Mol. Catal: Chem. Vol. 17. 1982. pp. 381-389. [ Links ]
13. J. J. Martinez, H. Rojas, G. Borda, P. Reyes. ''Hydrogenation of α,β-unsaturated aldehydes over Ir catalysts supported on monolayers of Ti-Si and Nb- Si''. Catalysis of Organic Reactions. M. L. Prunier (editor). Ed.. CRC Press. Indianápolis (USA). 2008. pp. 117-125.
14. H. Rojas, G. Borda, J. Castañeda, J. L. G. Fierro, P. Reyes. ''Synthesis, characterization and catalytic behavior of the Ir/Nb2O5/SiO2 system in the citronellal hydrogenation''. J. Chil. Chem. Soc. Vol. 53. 2008. pp. 1464-1468. [ Links ]
15. T. Salmi, D. Y. Murzin, J. P. Mikkola, J. Warna, P. Maki-Arvela, E. Toukoniitty, S. Toppinen. ''Advanced Kinetic Concepts and Experimental Methods for Catalytic Three-Phase Processes''. Ind. Eng. Chem. Res. Vol. 43. 2004. 4540-4550. [ Links ]
16. M. A. Vannice, S. H. Hyun, B. Kalpakci, W. C. Liauh. ''Entropies of adsorption in heterogeneous catalytic reactions''. J. Catal. Vol. 56. 1979. pp. 358-362. [ Links ]
Recibido el 4 de Marzo de 2009. Aceptado el 6 de abril de 2010
Autor de correspondencia: telefax: + 57+ 8+ 742 21 75 ext. 1690, correo electrónico: hurojas@udec.cl (H. A. Rojas)
















 >
>