Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Ingeniería Universidad de Antioquia
Print version ISSN 0120-6230On-line version ISSN 2422-2844
Rev.fac.ing.univ. Antioquia no.55 Medellín Sept. 2010
Degradación y adsorción del colorante AZO RR239 en solución acuosa, por partículas de hierro ''zero-valente'' a nanoescala, inmovilizadas sobre aserrín
Degradation and adsorption of AZO RR239 dye in aqueous solution by nanoscale zerovalent iron particles immobilized on sawdust
Nedher Sánchez1* , Mario Vazquez1, Roberto Torresi2
1instituto de Química. Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, Calle 67 N.° 53-108. A.A.1226, Medellín, Colombia.
2Instituto de Química. Universidade de Sao Paulo, Av. Prof. Lineu Prestes, 748 Bloco 06 Sup.CP 26077 Sao Paulo (SP), Brasil.
Resumen
Se reportan resultados de adsorción del colorante RR239 (colorante reactivo azo) con aserrín pretratado con formaldehído, los experimentos se realizaron a dos valores de pH y considerando el efecto de nanopartículas de hierro de valencia cero. Los datos cinéticos de adsorción se ajustaron bien a un modelo de seudo segundo orden. Los experimentos realizados en el sistema por lotes sugieren que la eficiencia de la decoloración esta fuertemente influenciada por la presencia de partículas de ZVI y bajos pH. La cinética de adsorción por la mezcla de adsorbente (5 g de aserrín y 180 mg de ZVI) a pH 2,0 fue rápida, lográndose más del 90% de la decoloración en 3 minutos.
Palabras clave: Partículas de hierro valencia cero (ZVI), colorantes azo, adsorción, cinética de adsorción, seudo segundo orden
Abstract
Carra sawdust pretrated with formaldehyde was used to adsorb RR239 (reactive azo dye) at varying pH and zerovalent iron (ZVI) dosage. Modeling of kinetic results shows that sorption process is best described by the pseudo- second-order model. Batch experiments suggest that the decolorization efficiency was strongly enhanced with the presence of ZVI and low solution pH. The kinetics of dye sorption by mixed sorbent (5 g of sawdust and 180 mg of ZVI) at pH 2.0 was rapid, reaching more than 90% of the total discoloration in three minutes.
Keywords:Zerovalent iron particles (ZVI), azo dye, sorption, kinetics, pseudo-second order
Introducción
Los colorantes fabricados actualmente son muy variados y a menudo son sintetizados para resis-tir la degradación por exposición a la luz, agua, y otras condiciones ambientales extremas, esto hace el tratamiento de efluentes coloreados más difícil. En el contexto global de la industria de colorantes, los colorantes sintéticos tipo azo constituyen aproximadamente la mitad de la pro-ducción mundial (700.000 toneladas por año). Esto desde el punto de vista ambiental es importante, considerando que durante el proceso de teñido entre el 15-50% de estos quedan remanentes y son vertidos como agua residual [1,2].
Cuando los colorantes reactivos son vertidos a los cuerpos de agua producen aminas como consecuencia de la escisión del enlace azo, que causan muchos efectos en algunos órganos del ser humano tales como el cerebro, hígado, riñones, sistema nervioso central y sistema reproductor. Asimismo los colorantes sintéticos afectan la actividad fotosintética de algunas plantas acuíferas debido a la presencia de aromáticos, metales, cloruros etc. [3-5]. Es por eso que los tratamientos de decoloración de efluentes reciben cada vez más atención. Por lo anterior han surgido diferentes metodologías para paliar y atacar estos problemas de contaminación hídrica. Estas tecnologías comprenden tres métodos fundamentales: métodos biológicos, químicos y físicos [6]. En el tratamiento de este tipo de efluentes pocos casos son reportados como totalmente exitosos en el sentido de conseguir una completa decoloración y mineralización del contaminante usando un solo método [7], como consecuencia de esto, la fortaleza en el tratamiento de aguas residuales coloreadas está en la combinación de diferentes procesos para así obtener agua de la calidad deseada a un costo moderado [6]. Entre las técnicas físico-químicas, la adsorción, es el proceso más conocido de tratamiento, es un método interesante por su simple diseño, fácil operación y flexibilidad. Además, los procesos de adsorción pueden producir una alta calidad de los efluentes tratados, convirtiéndose en una alternativa interesante para el tratamiento de aguas contaminadas, sobre todo si se cuenta con adsorbentes de bajo costo [8].
Por otra parte, una herramienta importante para la degradación de contaminantes son las nano- partículas de hierro (denominadas ZVI, zero valent iron). Las partículas de ZVI son usadas comúnmente como un agente reductor metálico en aplicaciones medioambientales debido a su abundancia, baja toxicidad, bajo costo y efectividad como reductor [7, 9,10]. Estas partículas han sido ampliamente usadas para remediar varios contaminantes, tales como: [7, 9,11] compuestos alifáticos halogenados y orgánicos aromáticos (solventes y pesticidas); compuestos nitro aromáticos; metales tóxicos de alto estado de oxidación (incluyendo oxianiones) y colorantes textiles.
En este trabajo, se muestran resultados del uso del material adsorbente aserrín con el apoyo de una técnica de decoloración como las partículas de ZVI, lo cual podría incrementar la adsorción al mismo tiempo que una degradación parcial del colorante.
Experimentación
Síntesis de partículas de hierro de valencia cero (ZVI)
El procedimiento para la síntesis de partículas de ZVI (Fe0), se llevó a cabo empleando atmósfera de N2 (99,9%) y ultrasonido (10 W); los solventes fueron desaireados con N2 antes de su posterior uso siguiendo métodos reportados en la literatura [11-18]. Las nanopartículas de hierro se sintetizaron adicionando una solución de NaBH4 (1,6 mol L-1) a una solución de FeCl3.6H2O (1,0 mol L-1) (relación molar NaBH4: FeCl3.6H2O = 2,5: 1). Después de la adición de NaBH4 la solución se agitó por 15 minutos a temperatura ambiente. Posteriormente, la solución fue centrifugada a 7.330 rpm por 3 minutos. El metal sólido negro se lavó varias veces con agua destilada desaireada y por último con acetona desaireada, el procedimiento final fue secar las partículas de ZVI al vacío. El equipo de ultrasonido es tipo Vibra Cell con punta de titanio que opera a 20 kHz con potencia moderada de 1 a 22W.
Adsorbente
Para el estudio de adsorción del colorante rojo reactivo 239 se seleccionó una muestra de aserrín obtenidos de talleres de madera y carpinterías de Medellín (Colombia).
Pretratamiento del adsorbente
Con el fin de aumentar la capacidad adsorbente mediante reacciones de polimerización y reducción de liberación de sustancias solubles, el aserrín fue pretratado con solución de formaldehído al 1% en una relación de 1:5 (Aserrín: formaldehído) a 50 °C por 4 horas. Posteriormente, el aserrín se lavó con agua destilada para remover el formaldehído libre y por último se activó en un horno a 80°C por 24 h para su posterior almacenamiento [19-21].
Las imágenes de microscopía electrónica de barrido (MEB) se obtuvieron con un microscopio de emisión de campo (FEG -SEM -JEOL JSM-7401F). La figura 1a muestra micrografías obtenidas con el adsorbente con formaldehído. Comparando con las características que presenta el aserrín sin tratar (figura 1b) se observa la aparición de irregularidades en la superficie del adsorbente causadas por el pretratamiento y que podrían estar relacionadas con el comportamiento mostrado por el adsorbente.
Figura 1 Imagen MEB del aserrín carra. a) aserrín pretratado con formaldehído y b) aserrín sin pretratar
El adsorbato
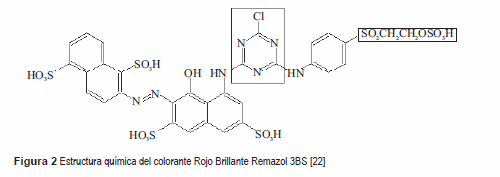
Se utilizó una muestra del colorante Rojo Brillante Remazol ó 3BS Clariant (Reactive Red 239 o RR239), las características del colorante se muestran en la tabla 1 y la figura 2 presenta la estructura de la molécula de colorante.
Proceso de decoloración
Para realizar el proceso de decoloración con nanopartículas se suspendieron 180 mg de las mismas en 5 mL de agua con la ayuda de ultrasonido. Posteriormente se mezcló con 5 g de aserrín y luego se secó el sistema resultante al vacío y se almacenó en desecador. Como referencia se analizó también el comportamiento del sistema en ausencia de nanopartículas.
Tabla 1 Características generales del colorante seleccionado
Para el estudio cinético el sistema aserrín-nanopartículas se puso en contacto con 60 mL de solución de colorante RR239 (70 mgL-1). Este estudio se realizó a dos valores diferentes de pH 5.2 y 2.0. El pH mayor corresponde al valor que tiene la solución del colorante mientras el pH más ácido fue seleccionado para analizar su efecto en el proceso de adsorción y decoloración
El valor de pH se ajustó adicionando la cantidad adecuada de una solución 0.1 molL-1de HCl El pH de las soluciones de colorante se midió con un pH-metro marca Thermo Orion Modelo 420. El sistema se agitó usando N2, los ensayos se realizaron a 25 °C. La solución se filtró con un filtro de tamaño de poro de 2 µm para analizar el remanente del colorante disuelto empleando un espectrofotómetro Agilent HP 8453 a λmax, 540 nm. Los experimentos se realizaron por duplicado.
Figura 2 Estructura química del colorante Rojo Brillante Remazol 3BS [22]
Resultados y discusión
Materiales y métodos
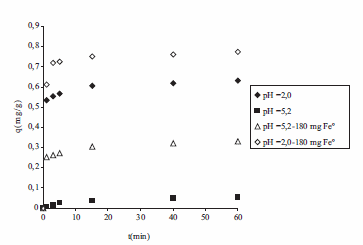
En la figura 3 se muestra el efecto del pH y la cantidad de partículas ZVI en la adsorción del RR239, se puede notar que hay un incremento de la adsorción con la disminución del pH y con el incremento de la cantidad de partículas de ZVI. La cantidad de colorante adsorbido, q, se obtuvo mediante la ecuación (1):
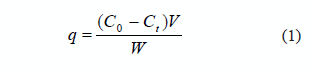
Donde C0 es la concentración (mg/L) inicial de RR239, Ct es la concentración (mg/L) a tiempo t, V es el volumen (L) de solución y W (g) es la cantidad de utilizada de adsorbente. En particular cuando Ct es la concentración en el equilibrio de colorante, q corresponde a la cantidad de colorante RR239 adsorbida en equilibrio (qe).
Figura 3 Efecto del pH y la cantidad de partículas ZVI en la adsorción del RR239
La adsorción del colorante RR239 por el aserrín se puede modelar por la ecuación de Lagergren de pseudo primer orden (Eq. 2) o por una ecuación de pseudo segundo orden (Eq.3) [23-24]:
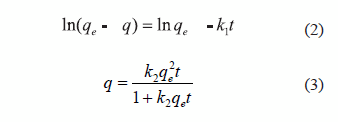
Donde k1 es la constante de velocidad de seudo-primer orden (min-1), qe es la cantidad de colorante adsorbido en el equilibrio (mg g-1) q es la cantidad de colorante adsorbida en cualquier tiempo (mg g-1), t es el tiempo de contacto (min), y k2 es la constante de velocidad de seudo segundo orden (g mg-1min-1). La velocidad de adsorción inicial h(mg g-1 min-1) viene dad por la ecuación (4):
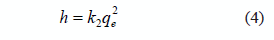
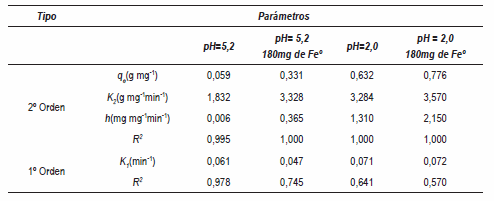
La ecuación de seudo segundo orden y de seudo primer orden pueden ser linealizadas tal como se muestra en la tabla 2. Utilizando los datos mostrados en la figura 3 se calcularon los diferentes parámetros, conjuntamente con el coeficiente de correlación para definir cuál es el modelo cinético que se adecua mejor al comportamiento observado. Para el modelo de seudo primer orden, el valor de la constante cinética k1 y de la cantidad de colorante adsorbido en el equilibrio qe se obtiene graficando el 1n(qe - q) versus t. Como puede observarse en la tabla 3 los coeficientes de correlación son bastantes menores que 1, por ello es inadecuado su uso para representar la adsorción del colorante sobre el aserrín carra. Cuando se utiliza el modelo de seudo segundo orden, los coeficientes de correlación son próximos a 1, por tanto, se utilizó este modelo para realizar el análisis comparativo del proceso de adsorción del colorante para los diferentes substratos utilizados.
Tabla 2 Ecuación de seudo primer orden y seudo segundo orden linealizadas y sus parámetros
En la tabla 3 se muestran los parámetros obtenidos utilizando el modelo de seudo segundo orden, donde se puede observar que la velocidad de adsorción inicial, la constante de velocidad y la cantidad adsorbida en el equilibrio aumentan con la cantidad de partículas de ZVI presentes y con la disminución del pH.
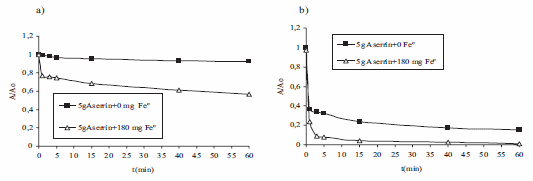
Para comparar los experimentos de forma cuantitativa se realizaron los gráficos usando la absorbancia normalizada que consiste en dividir la absorbancia en cualquier tiempo y la absorbancia en el tiempo inicial. En la tabla 4a se muestra la disminución de la absorbancia normalizada versus el tiempo a pH 5,2 en presencia y ausencia de nanopartículas. Claramente se observa el efecto de las partículas ZVI sobre el colorante bajo las condiciones especificadas ya que cuando solamente se utiliza el aserrín la variación de la absorbancia normalizada es muy pequeña; mientras que cuando están presentes partículas ZVI esta variación es mayor. La disminución de la absorbancia con la presencia de 180 mg de ZVI es atribuible a su poder adsorbente-reductor [2].
Tabla 3 Parámetros de los modelos de seudo segundo orden y seudo primer orden
Figura 4 Variación de la absorbancia normalizada versus el tiempo para diferentes cantidades de ZVI a) pH= 5,2, 5 g de aserrín pretratado con formaldehído al 1%, concentración de colorante = 70 mg/L, volumen de solución = 60 ml.b) pH= 2,0, 5 g de aserrín pretratado con formaldehído al 1%, concentración de colorante = 70 mg/L, volumen de solución = 60 ml
La figura 4b muestra el proceso de adsorción a pH = 2,0. Nuevamente se verifica el efecto sinérgico aserrín/nanopartículas pero en este caso la disminución de la absorbancia normalizada con el tiempo de contacto es mas pronunciada, lo anterior evidencia el efecto benéfico del pH para el proceso de adsorción degradación.
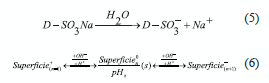
Se puede apreciar que a pH bajos se favorece la adsorción tanto en el aserrín como en las partículas de ZVI. La explicación es que a estos valores de pH existe una atracción electrostática entre ambas superficies y el colorante, como consecuencia del potencial de carga cero que poseen tanto las partículas ZVI (pHpzc ≈ 8) [2], como el aserrín(pHpzc=5.9-6.4) [25-26] que a pH lo suficientemente ácidos estarán cargadas, positivamente, modificación que favorece la interacción del colorante con el sistema combinado adsorbente - ZVI este tipo de comportamiento ha sido reportado por otros autores[27-32] donde se postulan las siguientes reacciones para el proceso [32] :
Conclusiones
La adsorción sobre aserrín o sobre aserrín con nanopartículas ZVI inmovilizadas muestra una alta sensibilidad al pH y la razón radica en las propiedades superficiales del adsorbente. En particular, del potencial de carga cero. Los resultados se ajustan bien por un modelo de seudo segundo orden, los parámetros cinéticos son sensibles al pH y a la presencia de partículas de ZVI.
También es posible potenciar la técnica de adsorción normal por una ''adsorción activa'' donde el contaminante pueda ser adsorbido y degradado simultáneamente, como cuando se inmovilizan nanopartículas reactivas en el adsorbente. En este sentido, teniendo en cuenta los resultados obtenidos en esta investigación es posible concluir que la técnica es bastante promisoria por lo que optimiza el tiempo de decoloración ostensiblemente dado que en solo 3 minutos decolora mas del 90 % de una solución de 70 mgL-1. Estos resultados deben ser complementados con estudios, actualmente en curso, que permitan cuantificar el nivel de degradación del colorante (reductiva y eventualmente oxidativa) al tiempo que su capacidad de adsorción, además de estudiar la optimización de otros parámetros que influyan en el proceso.
Agradecimientos
Los autores agradecen el aporte financiero realizado por Colciencias (Colombia) y CNPq (Brasil) al proyecto de cooperación bilateral (Proc. N° 490116/2007-8).
Referencias
1. H. Park, W. Choi. ''Visible light and Fe (IlI)-mediated degradation of Acid Orange 7 in the absence of H2O2''. Journal of Photochemistry and Photobiology A: Chemistry. Vol. 159. 2003. pp. 241-247. [ Links ]
2. J. Fan, Y. Guo, J. Wang, M. Fan. ''Rapid decolourization of azo dye methyl orange in aqueous solution by nanoscale zerovalent iron particles''. Journal of Hazardous Materials. Vol. 166. 2009. pp. 904-910. [ Links ]
3. S. J. Allen, B. Koumanova. ''Decolourisation of Water/ Wastewater Using Adsorption (Review)''. Journal of the University of Chemical Technology and Metallurgy. Vol. 40. 2005. pp. 175-192. [ Links ]
4. O. Hao, H. Kim, P. Chiang. ''Decolorization of Wastewater. Critical Reviews''. Environmental Science and Technology. Vol. 30. 2000. pp. 449-505. [ Links ]
5. C. Martínez, E. Brillas. ''Decontamination of wastewaters containing synthetic organic dyes by electrochemical methods: A general review''. Applied Catalysis B: Environmental. Vol. 87. 2009. pp. 105-145. [ Links ]
6. A. Adamu. Adsorptive Removal of Reactive Azo Dyes using Industrial Residue. M.Sc. Thesis. University of Addis Ababa. Ethiopia. Febrero de 2008. pp. 8-11. [ Links ]
7. K. Sohn , S. W. Kang , S. Ahn, M. Woo , S. Yang. ''Fe (0) Nanoparticles for Nitrate Reduction: Stability, Reactivity, and Transformation''. Environ. Sci. Technol. Vol. 46. 2006. pp. 5514-5519. [ Links ]
8. G. Crini. ''Non-conventional low-cost adsorbents for dye removal: A review''. Bioresource Technology. Vol. 97. 2006. pp. 1061-1085. [ Links ]
9. W. Epolito, H. Yang, L. Bottomley, S. Pavlostathis. ''Kinetics of zero-valent iron reductive transformation of the anthraquinone dye Reactive Blue''. Journal of Hazardous Materials. Vol. 160. 2008. pp. 594-600. [ Links ]
10. W. Zhang. ''Nanoscale iron particles for environmental remediation: An overview''. Journal of Nanoparticle Research. Vol. 5. 2003. pp. 323-332. [ Links ]
11. O. Celebi, C. Uzum, T. Shahwan, H. N. Erten. ''A radiotracer study of the adsorption behavior of aqueous Ba2+ ions on nanoparticles of zero-valent iron''. Journal of Hazardous Materials. Vol. 148. 2007. pp. 761-767. [ Links ]
12. B. Geng, Z. Jin , T. Li, X. Qi. ''Kinetics of hexavalent chromium removal from water by chitosan-Fe0 nanoparticles''. Chemosphere. Vol. 75. 2009. pp. 825-830. [ Links ]
13. H. Shu , M. Chang, H. Yu, W. Chen. ''Reduction of an azo dye Acid Black 24 solution using synthesized nanoscale zerovalent iron particles''. Journal of Colloid and Interface Science. Vol. 314. 2007. pp. 89-97. [ Links ]
14. Y. Lina, C. Weng, F. Chen. ''Effective removal ofAB24 dye by nano/micro-size zero-valent iron''. Separation and Purification Technology. Vol. 64. 2008. pp. 26-30. [ Links ]
15. H. Song, E. Carraway. ''Catalytic hydrodechlorination of chlorinated ethenes by nanoscale zero-valent iron''. Applied Catalysis B: Environmental. Vol. 78. 2008. pp. 53-60. [ Links ]
16. Y. Sun, X. Li , W. Zhang , H. Wang. ''A method for the preparation of stable dispersion of zero-valent iron nanoparticles''. Colloids and Surfaces A: Physicochem and Eng. Aspects. Vol. 308. 2007. pp. 60-66. [ Links ]
17. W. Wang, Z. Jin , T. Li, H. Zhang, S. Gao. ''Preparation of spherical iron nanoclusters in ethanol-water solution for nitrate removal''. Chemosphere. Vol. 65. 2006. pp. 1396-1404. [ Links ]
18. Y. Xu, D. Zhao. ''Reductive immobilization ofchromate in water and soil using stabilized iron nanoparticles''. Water research. Vol. 41. 2007. pp. 2101-2108. [ Links ]
19. V. K. Garg, M. Amita, R. Kumar, R. Gupta. ''Basic dye (methylene blue) removal from simulated wastewater by adsorption using Indian Rosewood sawdust: a timber industry waste''. Dyes and Pigments. Vol. 63. 2004. pp. 243-250. [ Links ]
20. V. K. Garg, R. Kumar, R. Gupta. ''Removal of malachite green dye from aqueous solution by adsorption using agro-industry waste: a case study of Prosopis cineraria''. Dyes and Pigments .Vol. 62. 2004. pp. 1-10. [ Links ]
21. V. K. Garg, R. Gupta, A.B. Yadav, R. Kumar. ''Dye removal from aqueous solution by adsorption on treated sawdust''. Bioresource Technology. Vol. 89. 2003. pp. 121-124. [ Links ]
22. D. Karadag, M. Turan, E. Akgul, S.Tok, A. Faki. ''Adsorption Equilibrium and Kinetics of Reactive Black 5 and Reactive Red 239 in Aqueous Solution onto Surfactant-Modified Zeolite''. Journal of Chemical and Engineering Data. Vol. 52. 2007. pp. 1615-1620 [ Links ]
23. I. Ghodbane, L. Nouri, O. Hamdaoui, M.Chiha. ''Kinetic and equilibrium study for the sorption of cadmium (II) ions from aqueous phase by eucalyptus bark''. Journal of Hazardous Materials. Vol. 152. 2008. pp. 148-158. [ Links ]
24. A. A. Ahmad, B. H. Hameed, N. Aziz. ''Adsorption of direct dye on palm ash:Kinetic and equilibrium modeling''. Journal of Hazardous Materials. Vol. 141. 2007. 70-76. [ Links ]
25. F. A. Batzias, D. K. Sidiras. ''Simulation of dye adsorption by beech sawdust as affected by pH''. Journal of Hazardous Materials. Vol. 141. 2007. pp. 668-679. [ Links ]
26. A. Shukla, Y. Zhang , P. Dubey, J. L. Margrave , S.S. Shukla. ''The role of sawdust in the removal of unwanted materials from water''. Journal of Hazardous Materials. Vol. 95. 2002. pp. 137-152. [ Links ]
27. C. K. Lee, K. S. Low; S. W. Chow. ''Chrome Sludge as an Adsorbent for Colour Removal''. Enviromental Technology. Vol. 17. 1996. pp. 1023-1028. [ Links ]
28. C. Namasivayam, D. Prabha, M. Kumutha. ''Removal of direct red and acid brilliant blue by adsorption on to banana pith''. Bioresour. Technol. Vol. 64. 1998. pp. 77-79. [ Links ]
29. P. B. Rai, S. S. Banerjee, R. V. Jayaram. ''Removal of Disperse Dyes from Aqueous Solution Using Sawdust and BDTDA-Sawdust''. Journal of Dispersion Science and Technology. Vol. 28. 2007. pp. 1066-1071. [ Links ]
30. A. S. Ozcan, A. Ozcan. ''Adsorption of acid dyes from aqueous solutions ontoacid-activated bentonita''. Journal of Colloid and Interface Science. Vol. 276. 2004. pp. 39-46 [ Links ]
31. P. Leechart, W. Nakbanpote, P. Thiravetyan. ''Application of 'waste' wood-shaving bottom ash for adsorption of azo reactive dye''. Journal of Environmental Management. Vol. 90. 2009. pp. 912-920. [ Links ]
32. O. Tunc, H. Tanaci, Z. Aksu. ''Potential use of cotton plant wastes for the removal of Remazol Black B reactive dye''. Journal of Hazardous Materials. Vol. 163. 2009. pp. 187-198. [ Links ]
(Recibido el 18 de noviembre de 2009. Aceptado el 7 de abril de 2010)
*Autor de correspondencia: teléfono: + 57 + 4 + 219 56 69, fax: + 57 + 4 + 233 01 20, correo electrónico: nedher2002@yahoo.com (N. Sánchez)