Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Facultad de Ingeniería Universidad de Antioquia
versão impressa ISSN 0120-6230versão On-line ISSN 2422-2844
Rev.fac.ing.univ. Antioquia n.55 Medellín set. 2010
Relación entre las formas solubles de hierro y manganeso y la presencia de bacterias oxidadoras de ambos elementos en el embalse Riogrande II- Don Matías (Antioquia, Colombia)
Relationship between soluble forms of iron and manganese and the presence of oxidizing bacteria of both elements in the dam Riogrande II-Don Matías (Antioquia, Colombia)
Yamilet Arcos Arango1* , Judith Betancur Urhan1, Gustavo Peñuela2, Néstor Jaime Aguirre1
1Grupo de Investigación en Gestión y Modelación Ambiental (GAIA). Facultad de Ingeniería. Universidad de Antioquia. Apartado Aéreo 1226. Medellín, Colombia.
2Grupo de Investigación en Diagnóstico y Control de la Contaminación (GDCON). Facultad de Ingeniería. Universidad de Antioquia. Apartado Aéreo 1226. Medellín, Colombia.
Resumen
Entre agosto de 2006 y marzo de 2008 se determinó la presencia de bacterias asociadas a la oxidación de hierro y manganeso en el límite de zona fótica (LZF) y en el fondo del hipolimnio (FH) en siete estaciones del Embalse Riogrande II en función de la disponibilidad de estos metales. Se realizaron mediciones in situ de temperatura del agua, oxígeno disuelto, pH, potencial redox y conductividad eléctrica. En el fondo del hipolimnio con niveles de oxígeno disuelto ≤ 4mgL-1 solo se encontró presencia de las bacterias oxidantes de hierro compatibles con Gallionella sp, Sphaerotilus sp, Beggiatoa sp y estructuras compatibles con bacterias prostecadas. El mayor número de estas bacterias se observó en el brazo de Río Grande (E4) en donde los niveles de hierro soluble fueron superiores a 1,4 mgL-1 . No se encontró presencia de bacterias dependientes de la oxidación del manganeso.
Palabras clave: hierro, manganeso, oxidación, Gallionella sp, Sphaerotilus sp, Beggiatoa sp, límite zona fótica, fondo del hipolimnio, Embalse Riogrande II
Abstract
From August 2006 to March 2008 presence of bacteria associated with the oxidation of iron and manganese was determined in the euphotic zone limit (LZF) and in the bottom of the hipolimnio (HF) in seven seasons of Riogrande II Dam reservoir depending on the availability of these metals. A water temperature, dissolved oxygen, pH, redox potential and electrical conductivity were measured in situ. At the bottom of hipolimnio with levels of dissolved oxygen ≤ 4 mgL-1 only were found iron oxidizing bacteria compatible with Gallionella sp, and Sphaerotilus sp, Beggiatoa sp . Final estimates for the bacterial population were conducted in culture media and the selective and specific recognition through morphological observations on wet mounts and colors. The largest number of these bacteria was found on the arm of Rio Grande (E4) in which levels of soluble iron were above 1.4 mgL-1. We found no presence of manganese-oxidizing bacteria.
Keywords: Iron, Manganese, oxidation, Gallionella sp, Sphaerotilus sp, Beggiatoa sp euphotic zone limit, bottom of hipolimnio, dam of the Riogrande II reservoir
Introducción
Los embalses son ecosistemas artificiales de agua superficial, en los cuales interactúan un importante número de especies incluyendo flora, fauna y microoiganismos, además de sustancias orgánicas e inorgánicas tanto en el agua como en el sedimento los cuales permiten conocer las condiciones y el metabolismo de los embalses [1,2]. Para tener un conocimiento integral de un embalse es necesario conocer la geología de la cuenca, actividades antrópicas, geomorfología del embalse, características físicas, químicas y biológicas. Estas últimas merecen un seguimiento continuo ya que son aspectos dinámicos, bien sea por efectos climáticos o por la actividad humana [2]
En Colombia existen 24 embalses con volúmenes superiores a los mil millones de metros cúbicos, la mayoría tienen por finalidad la generación de energía hidroeléctrica. Sus áreas varían entre 0,2 y 74 km2, su ubicación entre los 70 y 3000 metros sobre el nivel del mar y una capacidad de generación entre los 10 y 1000 MW. La mayoría están localizados sobre las cuencas de los ríos Magdalena y Cauca y la altiplanicie de Cundinamarca-Boyacá [3]. El Embalse Ríogrande II es considerado una de las principales fuentes para el abastecimiento a la planta de potabilización de Manantiales, la generación hidroeléctrica y saneamiento del río Me- dellín. Esta conformado por un relieve localmente montañoso, donde son comunes las zonas pantanosas y humedales, propios de un territorio con drenaje deficiente, a él llegan descargas de aguas residuales domésticas e industriales de algunas comunidades vecinas de San pedro, Santa Rosa de Osos, Entrerríos y algunas veredas localizadas en el sector las Animas [4].
Recientes estudios realizados en el embalse por los grupos de la Universidad de Antioquia GAIA (Grupo de Investigación en Gestión y Modelación Ambiental) y GDCON (Grupo de Investigación en Diagnóstico de la Contaminación) en el 2002, han demostrado la presencia de metales como aluminio, hierro, y manganeso. La presencia de estos metales está asociada tanto a la configuración geológica e hidrografía de la cuenca donde se encuentra el embalse como a la actividad agrícola y ganadera, especialmente cultivos de tierra fría y producción lechera en las cuencas que abastecen sus principales afluentes: Río Grande, Río Chico y Quebrada las Ánimas [4].
El hierro y manganeso son considerados micro- nutrientes importantes para el funcionamiento celular de plantas, animales y algunos microorganismos, además son elementos clave para ci- tocromos y proteínas implicadas en el transporte de electrones, los cuales estimulan y favorecen la proliferación de estos organismos [1,5,6]. El hierro ferroso, con estado de oxidación (2+) pre-domínate en el estrato reductor (hipolimnio) de la columna de agua, es oxidado a hierro férrico (3+) al ingresar en forma disuelta en la fase oxigenada (epilimnio) de la columna, dando lugar a la formación de hidróxido férrico de baja solubilidad que precipita a los sedimentos. La oxidación del manganeso soluble (Mn2+) tiene lugar en sedimentos, su oxidación química solo se produce a un pH > 8 y en presencia de oxígeno originando el ion mangánico tetravalente. Este ion tetravalente forma un dióxido (MnO2) insoluble en agua que no puede ser asimilado directamente por la plantas y microorganismos. [6,7].
Muchas de las reacciones de oxidorreducción ligadas al hierro y al manganeso son mediadas por microorganismos. Estos a excepción de determinados lactobacilos, necesitan hierro y manganeso, utilizado como cofactor por muchas enzimas metabólicas y proteínas reguladoras, debido a su capacidad de existir en dos estados de oxidación estables, soluble (Fe2+ y Mn2+) e insoluble (Fe3+ y Mn4+). La oxidación aeróbica del hierro y manganeso del estado soluble al estado insoluble es una reacción productora de energía para algunas bacterias. La cantidad de energía disponible de esta oxidación es muy pequeña y por esta razón, las bacterias del hierro (término usado para describir un grupo diverso de bacterias del hierro y manganeso) deben oxidar grandes cantidades de estos metales para desarrollarse. Cuando la oxidación de hierro y manganeso no esta asociada a la producción de energía, las paredes celulares de las bacterias cumplen una función importante dado que actúan como superficies catalíticas para la precipitación de estos metales. [5,7,8]. Las altas concentraciones de hierro, manganeso y la presencia de microorganismos asociados a estos metales, representan una problemática importante para los embalses, en la generación de energía o el correcto abastecimiento de agua potable, dado que causan incrustaciones bióticas y abióticas en los sistemas de enfriamiento y en las redes de distribución además de producir alteración en la calidad del agua de consumo [1,4,8,9,10,11].
Materiales y métodos
Área de estudio
El embalse de Río Grande II (6° 32,62¢ N, 75° 27,27¢ W) está ubicado en jurisdicción de los municipios de Don Matías, San Pedro, Belmira, Santa Rosa de Osos y Entrerríos al norte de la ciudad de Medellín (figura 1) [4]. Esta formado por el represamiento de las aguas de los ríos Grande y Chico mediante una presa ubicada a 1,7 km aguas abajo de la confluencia de estos ríos, construida entre 1986 y 1988 [4]
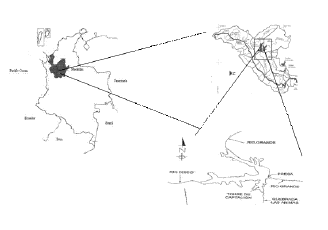
Figura 1 Ubicación del embalse Ríogrande II en el contexto nacional y regional (tomado y modificado de Montoya & Ramírez, 2007) [12]
Fase de campo
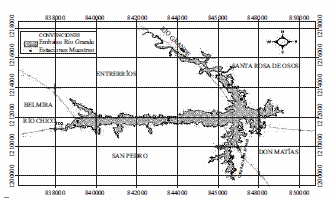
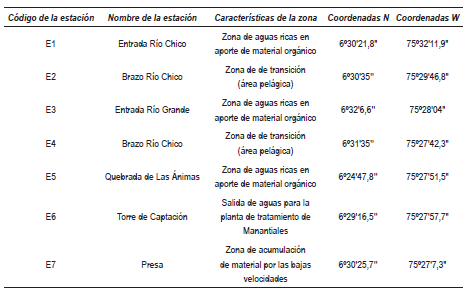
Se realizó una salida de reconocimiento de la zona que permitió la selección de siete estaciones de muestreo representativas del embalse (figura 2). La toma de muestras se efectuó en el límite zona fótica (LZF) y en el fondo del hipoliminio (FH), durante los meses agosto y noviembre de 2006; febrero, marzo, octubre de 2007 y marzo de 2008. En la tabla 1 se presenta una breve descripción de las estaciones de muestreo con su respectiva georreferenciación realizada con un Sistema de Posicionamiento Global (GPS 72).
Figura 2 Mapa embalse Ríogrande II, indicando las estaciones de muestreo (Fuente EPM)
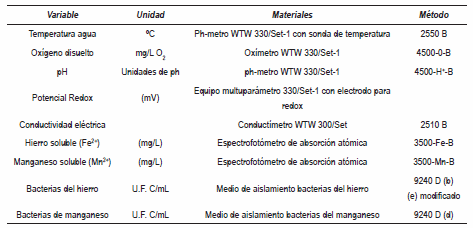
Se tomaron muestras puntuales incluyendo las dos profundidades seleccionadas con una botella tipo Ruttner de 1,5 litros de capacidad. Se determinaron in situ las variables temperatura del agua, oxígeno disuelto, pH, potencial redox y conductividad eléctrica. Las muestras para el análisis de hierro y manganeso soluble se colectaron en envases de 2 L de capacidad, después de la toma de las muestras se filtraron con filtro de membrana 0,45µm y luego se preservaron con ácido nítrico. Para los análisis microbiológicos, se tomaron muestras en recipientes de vidrio estériles de 250 mL de capacidad y fueron transportadas al laboratorio a temperatura ambiente. Las muestras para las determinaciones de metales se transportaron a 4°C. En la tabla 2 se presentan las variables físicas, químicas y microbiológicas, los materiales y métodos utilizados [15].
Tabla 1 Descripción de las zonas de muestreo del Embalse Ríogrande II
Procedimiento experimental
Para la determinación de hierro y manganeso soluble y las poblaciones bacterianas se utilizaron los siguientes equipos y reactivos: Espectrofotómetro de absorción atómica marca Termo electrom S. Series con una rendija de 0,2 nm, aire acetileno y se realizó las corrección de backgraund con lámpara deuterio. Microscopio Olympus CX 41 con Sistema óptico UIS (Universal, corregido al infinito), bombillo halógeno 6V30W 100-120V/220- 240V - 0,85/0,45A 50/60Hz, Ocular 10x, Objetivos de 4x, 10x, 40x y 100x, cuenta colonias marca Indulab 007, con lupa incorporada ecualizable de 7,5 optrias bifocal, escala milimétrica-simétrica y cabina de flujo laminar modelo miniflow, con prefiltro y filtro HEPA eficiencia de 99,99% diseñada con el objetivo de proteger totalmente el producto del riesgo de contaminación exterior. Se emplearon soluciones estándar de hierro y manganeso (Centripur Merk), Ácido Nítrico, Ácido sulfúrico grado traza, para la preparación de los medios de cultivos se utilizó (NH4)2SO4 Ca(NO3)2, K2HPO4 MgSO4.7H2O, KCl, CaCO3, MnCO3, Fe(NH4)2, (SO4)2, NaOH 10N, FeSO4.7H2O al 14,74% Citrato de sodio, agar-agar, extracto de carne, extracto de levadura (merk), Vitamina B12 y tiamina de uso comercial [10]
Tabla 2 Variables físicas, químicas y microbiológicas analizadas en este estudio
Análisis fisicoquímico
Para el análisis de hierro y manganeso soluble, se realizaron digestiones ácidas de las muestras hasta la disminución del volumen y el desprendimiento de vapores blancos, aforando hasta 50 mL. Se realizó la lectura de las muestras por duplicado en el espectrofotómetro de absorción atómica, a una longitud de onda de 248,3 nm para hierro y 279,5 nm para manganeso. Se realizó una curva de calibración usando estándares con una concentración entre 0,05 ppm y 10 ppm para Fe y 0,05 y 2 ppm para Mn, preparados a partir de una solución patrón de 1.000 ppm. Para garantizar la confiabilidad de los resultados el Laboratorio de Ingeniería Sanitaria y Ambiental realizó la validación de hierro y manganeso.
Análisis microbiológico
Para comprobar si los medios de cultivo preparados eran selectivos para las bacterias compatibles con la oxidación del hierro y manganeso, se utilizaron cepas de bacterias que no oxidaban estos metales, sin obtenerse crecimiento bacteriano. El reconocimiento de los grupos bacterianos asociados a la oxidación de hierro y manganeso se realizó mediante placas de colonización, coloraciones de Gram y montajes húmedos. Mientras que para la estimación del número de estas bacterias se utilizaron técnicas de aislamiento en medios de cultivos selectivos y específicos. (Medios de asilamiento sólidos y líquidos para bacterias del hierro y manganeso, medio líquido de sales basales modificado dado que no se adicionó H2SO4, para mantener el pH cercano a 6,0) referenciados en el Standard Methods 2005 los cuales fueron incubados durante de 60 días.
Análisis estadístico
Inicialmente se realizó un análisis exploratorio y descriptivo de los datos utilizando la mediana como medida de tendencia central, y como medidas de dispersión: desviación estándar, varianza y coeficiente de variación. También se determinaron los valores mínimos, máximos y rangos para cada estación.
Para determinar cuál factor, entre campañas de muestreo, estación, y profundidad, tuvo mayor contribución en la variabilidad de las variables fisicoquímicas y microbiológicas, se realizó un análisis de componentes de varianza. Para establecer si hubo o no diferencias significativas de las variables físicas, químicas y microbiológicas entre profundidades (LZF y FH) se efectuó la prueba de rangos de Kruskal-Wallis. Estas pruebas fueron analizadas con el programa estadístico Statgraphics plus 5,1. Para evaluar la asociación entre los grupos de variables se aplicó un análisis multivariado directo (Correlación canónica -CA-), la prueba fue ejecutada con el programa Statistica versión 7.
Resultados y discusión
El análisis de componentes de varianza mostró que el factor que contribuyó a la mayor variación de las variables fisicoquímicas y microbiológicas fue la profundidad. La prueba de rangos de Krus- kal-Wallis mostró diferencias significativas de las variables temperatura del agua, oxígeno disuelto, pH, hierro y manganeso soluble y poblaciones bacterianas entre las dos profundidades (valor p < 0,005). Sin embargo las variables que no presentaron diferencias significativas entre profundidades fueron el potencial redox (p=0,751) y la conductividad eléctrica (p= 0,499) El análisis de correlación canónica bajo el modelo de 3 raíces canónicas registró un R Canónico de 0,65 con un p=0,00753, indicando que la correlación entre el grupo de variables fisicoquímicas y las variables respuesta fueron estadísticamente significativo.
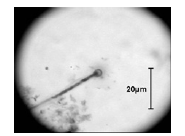
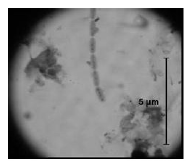
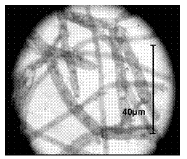
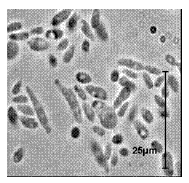
En los estudios microbiológicos realizados en esta investigación, en el fondo del hipolimnio del Embalse Ríogrande II, se determinó la presencia de algunas poblaciones bacterianas asociadas a la oxidación de hierro soluble como bacterias filamentosas compatibles con Gallionella sp (figura 3) Sphaerotillus sp (figura 4), Beggiatoa sp (figura 5) y estructuras compatibles con prostecas (figura 6). No se observó presencia de grupos bacterianos dependientes de la oxidación de manganeso.
Figura 3 Células apicales y filamentos compatibles con Gallionella sp (1000X)
Figura 4 Estructuras bacilares gram negativas con granulaciones compatibles con Sphaerotilus sp (1000X)
Figura 5 Filamentos septados compatibles con Beggiatoa sp (1000X).
Figura 6 Estructuras similares a prostecas (1000X)
El embalse Ríogrande II presentó valores de temperatura del agua estables (16,2°C y 19,8°C) en ambas profundidades durante los periodos muestreados, y no se observó influencia de la temperatura sobre la disponibilidad de hierro y manganeso soluble ni sobre la presencia de las poblaciones bacterianas compatibles con la oxidación del hierro, debido a que las temperaturas del embalse fueron muy homogéneas, tampoco hubo influencia de la temperatura sobre la pre-sencia de las poblaciones bacterianas compatibles con la oxidación del hierro; dado que estos grupos bacterianos presentan temperaturas óptimas de crecimiento entre 15-25 °C [5-6] y este fue el rango de temperatura aproximado que se observó en el embalse Ríogrande II.
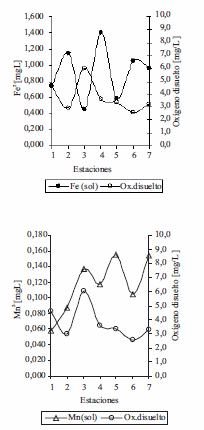
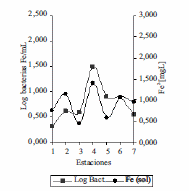
En el límite de la zona fótica del embalse Riogrande II, cuando el oxígeno disuelto estuvo por encima de 6 mgL-1, los niveles de hierro soluble fueron bajos (0 mgL-1 - 0,3 mgL-1) igualmente los de manganeso soluble (0 mgL-1 - 0,025 mgL-1 ). En el fondo del hipolimnio cuando el oxígeno disuelto fue ≤ 4 mgL-1 los niveles de hierro soluble se incrementaron hasta alcanzar valores entre (0,036 mgL-1 y 1,4 mgL-1 ) y manganeso soluble (0 mgL-1 - 0,160 mgL-1) (figura 7). Hallazgos similares se encontraron en la laguna Hinze en Australia, donde el hierro y manganeso soluble en el epilimnio fueron menores de 0,2 mgL-1 y 0,05 mgL-1 respectivamente, con niveles de oxígeno disuelto > 5 mgL-1. En el hipolimnio los metales hierro y manganeso en su forma soluble incrementaron las concentraciones cuando el oxígeno disuelto fue < 2 mgL-1 [13]. Estos resultados indican que la disponibilidad de estos dos metales hierro y manganeso disuelto en el embalse puede depender de los niveles de oxígeno disuelto [3,14]. Un incremento en las concentraciones de hierro disuelto por encima de 1,4 mgL-1 en brazo de Río Grande (E4) pareció estimular las poblaciones bacterianas asociada a la oxidación de este metal (figura 8).
Figura 7 Hierro soluble y manganeso soluble Vs Oxígeno disuelto en FH en las siete estaciones del Embalse Riogrande II
Figura 8 Log10bacterias Fe/mL Vs Hierro soluble en FH en las siete estaciones del Embalse Ríogrande II
En revisiones acerca de las bacterias del hierro (Gallionella y Leptothrix), se encontraron reportes de crecimiento de estas bacterias en aguas estáticas con niveles de hierro entre 1,6 y 12 mgL-1 [15]. La ausencia de las bacterias dependientes de la oxidación de manganeso se podría asociar a concentraciones de este metal (0 mgL-1 y 0,326 mgL-1) en las dos profundidades evaluadas. Resultados similares se encontraron en estudios realizados en suelos con diferentes concentraciones de manganeso y concluyeron que en suelos pobres en este metal, las bacterias oxidadoras de manganeso estuvieron ausentes [16].
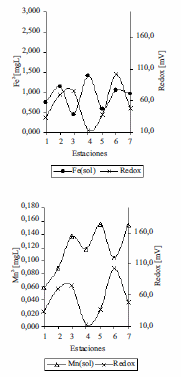
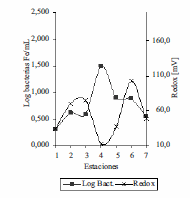
En el embalse Riogrande II, los valores de pH fueron muy homogéneos en las dos profundidades evaluadas, se presentaron valores entre 7 y 8. No se observó influencia de esta variable sobre la disponibilidad de hierro y manganeso soluble ni sobre la presencia de las poblaciones bacterianas asociadas a la oxidación de hierro ya que el pH óptimo para el crecimiento de estas bacterias esta entre 6,5 y 8 [5,6]. Se encontraron reportes que a pesar de la inestabilidad de Fe2+ a pH neutro, existen bacterias oxidadoras de este metal que prosperan en las interfases de las zonas anóxicas y óxicas, oxidando el Fe2+ que proviene de las zonas anaerobias antes de su oxidación espontánea [5, 6] En el embalse Ríogrande II tanto para el hierro soluble como para el manganeso soluble los resultados mostraron disminución del potencial redox con incremento en las concentraciones de hierro y manganeso soluble y viceversa, lo que concuerda con la presencia de las bacterias asociadas a la oxidación del hierro en aquellas estaciones donde se presentaron valores bajos de potencial redox (figuras 9 y 10).
La conductividad no influyó en la disponibilidad de hierro y manganeso soluble ni en la presencia de la población bacteriana asociada a la oxidación de hierro. No se encontraron reportes que evidencien la relación del hierro, manganeso soluble y las bacterias asociadas a la oxidación de hierro con la conductividad eléctrica.
Figura 9 Hierro soluble y manganeso soluble Vs Redox en FH en las siete estaciones del Embalse Ríogrande II
Figura 10 Log10bacterias Fe /mL soluble Vs Redox en FH en las siete estaciones del Embalse Ríogrande II
Conclusiones
Se encontró disponibilidad de hierro soluble en el embalse Ríogrande II con niveles entre 0,2 y 1,869 mgL-1. Los niveles de manganeso soluble encontrados en las siete estaciones del embalse Ríogrande II fUeron relativamente bajos (0,0 y 0,326 mgL-1).
La población más alta de bacterias asociadas a la oxidación del hierro se obtuvo en el brazo de Ríogrande (E4) cuando las concentraciones de hierro soluble fueron mayores de 1,4 mgL-1.
Las poblaciones bacterianas asociadas a la oxidación de hierro que se encontraron en Embalse Ríogrande II fueron bacterias filamentosas morfológicamente compatibles con Gallionella sp, Sphaerotilus sp y Beggiatoa sp, además, estructuras compatibles con bacterias prostecadas. No se obtuvo crecimiento de las bacterias del manganeso en el embalse, posiblemente debido a que los niveles de este metal estuvieron por debajo de 0,326 mgL-1
Las variables temperatura del agua, oxígeno disuelto, pH y conductividad eléctrica no mostra-ron influencia sobre la presencia y persistencia de las bacterias asociadas a la oxidación del hierro y las concentraciones de hierro y manganeso soluble tuvieron una correlación inversa con los niveles de oxígeno disuelto y potencial redox. La disponibilidad de los metales hierro y manganeso soluble no estuvo influenciada por las variables temperatura del agua, pH y conductividad eléctrica.
Proyecciones y sugerencias
Evaluar las concentraciones de hierro y manganeso soluble en las aguas del embalse durante los eventos de blooms algal, dado que dichos eventos están asociados a cambios en la dinámica del embalse en los niveles de oxígeno disuelto, pH y potencial redox lo que conllevaría probablemente a un aumento en las concentraciones de hierro y manganeso soluble y por ende un aumento en la presencia a las bacterias asociadas a estos metales.
Monitorear las concentraciones de hierro soluble en el embalse, ya que según los resultados obtenidos, si los valores de éste sobrepasan los 1,4 mgL-1 , se aumentan las poblaciones bacterianas asociadas a la oxidación de este metal y se presentarían problemas de corrosión en las redes de distribución y alteraciones organolépticas en el agua suministrada por la planta de potabilización de Manantiales.
Agradecimientos
Los autores agradecen el apoyo de: Laboratorio de Ingeniería Sanitaria y Ambiental, Grupo de investigación en Gestión y Modelación Ambiental -GAIA- de la Universidad de Antioquia Empresas publicas de Medellín -EPM-.
Referencias
1. G. Roldán, E. Ruiz. ''Development of Limnology in Colombia''. Limnology in Developing Counties. 2001. Vol. 3. pp. 69-119. [ Links ]
2. P. Peralta, J. León. Estudio de caracterización Limnológica de los embalses de la Provincia de Mendosa. Argentina. 2006. pp.5-8. [ Links ]
3. G. J. Roldán. Fundamentos de limnología neotropical. Ed. Universidad de Antioquia. Medellín. 1992. pp. 374-376. [ Links ]
4. N. J Aguirre, G. Peñuela. Proyecto análisis de Calidad del Agua de los Embalses y Quebradas que abastecen el Acueducto de EPM. Grupo en Gestión y Modelación Ambiental (GAIA), Grupo de diagnóstico y Control de la Contaminación (GDCON). Facultad de Ingeniería. Universidad de Antioquia. 2002. pp. 87-91. [ Links ]
5. M. T. Madigan, J. M. Martinko, P. Jack. Biología de los microorganismos. 10a ed. Editorial. Pearson Educación. Madrid. 2004. pp. 351-441. [ Links ]
6. R. Atlas, R. Bartha. Microbiology Ecology Fundamentals and Applications. 4a.ed. Ed. Addison Wesley Longman. Madrid. 2002. pp 441-446. [ Links ]
7. R. G. Wetzel, G. E Likens. Limnological Analysis. 3a ed. Ed. Springer Science. New York (USA). 2001. pp.289-304. [ Links ]
8. A. V. Pacini, A. M. Ingallinella, G. Sanguinetti ''Renoval of iron and manganese using biological roughing up flow filtration technology''. Water research. 2005. Vol 39. pp. 4463-4475. [ Links ]
9. C. N. Sawyer, P. L. McCarty, G. F. Parkin. Química para Ingeniería Ambiental. 4a ed. Ed. McGraw Hill. Bogotá. 2001. pp. 624-631. [ Links ]
10. APHA-AWWA-WPCF. Standard Methods for examination of water and wastewater. 21a ed. Centennial Edition.USA. 2005. pp. 4784-4792. [ Links ]
11. D. Fortin, X. Chatellier. ''Biogenic iron oxides''. S. G. Pandalai (editor) Recent Research Developments in Mineralogy. Ed. Research Signpost. 2003. Vol.3. pp. 47-63. [ Links ]
12. Y. Montoya, J. Ramírez. ''Flujos de mineralización en el embalse tropical Ríogrande II (Antioquia, Colombia)''. Revista limnética. 2007. Vol. 26. pp. 39-52. [ Links ]
13. M. Zaw, B Chiswell. ''Iron and manganese dynamics in lake water''. Water Research. Vol 33. 1999. pp. 1900-1910. [ Links ]
14. G. R Wetzel. Limnology. 2a ed. Ed. Saunders College Publishing. New York. 1983. pp.289-304. [ Links ]
15. U. Hasselbarth, D. Ludemann. ''Biological incrustation of wells due to mass development of iron andmanganese bacteria''. Water treatment and Examination. Vol. 21. 1972. pp.20-29. [ Links ]
16. J. Gottfreund, R. Schweisfurth ''Mikrobiologische Oxidation und Reduktion von Manganspecies''. Fresenius Z. (editor) Analytische Chemie. Vol. 316. 1983. pp 634-638. [ Links ]
(Recibido el 29 de mayo de 2009. Aceptado el 16 de abril de 2010)
1Autor de correspondencia: teléfono: + 57 +4 + 464 46 58, fax: + 57 +4 + 273 9310, correo electrónico: yaarcos@hotmail.com (Y. Arcos)