Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Facultad de Ingeniería Universidad de Antioquia
versão impressa ISSN 0120-6230versão On-line ISSN 2422-2844
Rev.fac.ing.univ. Antioquia n.55 Medellín set. 2010
Dinámica de la producción primaria fitoplanctónica en un lago tropical (ciénaga Escobillitas) a lo largo del pulso de inundación
Dynamics of the primary production of phytoplankton in tropical lake through the flood pulse
Yimmy Montoya, Néstor Aguirre*
Grupo de Investigación en Gestión y Modelación Ambiental GAIA, Facultad de Ingeniería, Universidad de Antioquia. Apartado 1226, Medellín, Colombia
Resumen
En comparación con los ecosistemas acuáticos de zonas templadas, los lagos de inundación tropicales son sistemas altamente complejos, numerosos pero poco conocidos. Esta investigación evaluó la variación de la producción primaria y la biomasa fitoplanctónica en una estación en la ciénaga Escobillitas del complejo cenagoso de Ayapel, ubicado al norte de Colombia. Se presentó variación de la producción primaria en relación con el pulso de inundación, ya que esta osciló entre 0 (aguas altas en ascenso 2007) y 191.6 mgC m-2 d-1 (aguas altas en descenso 2007) con un valor medio de 108.6 mgC m-2 d-1. Se encontró la mayor producción primaria bruta en aguas altas en descenso, condición acompañada por un mayor registro de biomasa algal, reducción en la eficiencia fotosintética, bajos valores de respiración y de las relaciones P/B y P/R. Entre ciclos hidrológicos consecutivos se presenta variación de los patrones de producción primaria, ya que para la fase de aguas altas en ascenso, en el 2006 se presentó una baja biomasa, con una alta PPB, acompañados de la mayor eficiencia fotosintética y altos valores de la respiración, En contraste, para el mismo periodo hidrológico del pulso de inundación pero en el año 2007, se presentó un aumento de la biomasa, reducción de la PPB, de la eficiencia fotosintética, de la relación P/B y de la respiración. El sistema acuático oscila entre euproductivo y oligoproductivo, lo cual es indicador de una alta dinámica trófica.
Palabras clave: Lago de llanura de inundación, fitoplancton, producción primaria, pulso de inundación, Ciénaga de Escobillitas, Ayapel
Abstract
Compared to aquatic ecosystems in temperate zones, tropical flood plain lake systems are highly complex, and poorly understood. This work evaluated the variation of primary production and phytoplankton biomass in one station in Escobillitas swamp in the complex of Ayapel system, located in northern Colombia. Primary production presented variation in relation to the flood pulse, as it ranged from 0 (high water ascent in 2007) and 191.6 mgC m-2 d-1 (high water on the decline in 2007) with an average value of 108.6 mgC m-2 d-1. We found the highest gross primary production in high water falling, a condition accompanied by increased algal biomass photosynthetic efficiency, reduction low rates in respiration and the P / B and P / R. ratios. Between consecutive hydrological cycles variations in the patterns of primary production the high water rising in 2006 had a low biomass, high PPB, with the highest photosynthetic efficiency, and low respiration rates; in contrast, for the same period of the hydrological flood pulse in 2007, an increase in biomass and reducing of PPB, photosynthetic efficiency, P / B ratio and respiration were observed. The water system changed between euproductive and oligoproductive, which indicates a high trophic dynamics.
Keywords: Flood plain lake, phytoplankton, primary production, flood pulse, Escobillitas swamp, Ayapel
Introducción
La producción primaria permite evaluar la capacidad de captación de energía de los organismos autotróficos. En los sistemas acuáticos a través de su evaluación se conoce la tasa de incorporación del carbono inorgánico durante la fotosíntesis por parte del fitoplancton [1]. La producción primaria en los cuerpos de agua depende de la que se origina en el (producción primaria autóctona) mas la que llega al sistema luego de ser sintetizada fuera de él (producción primaria alóctona) [2]. La distribución vertical de la productividad fitoplanctónica es determinada principalmente por la intensidad de la radiación luminosa, la disponibilidad de nutrientes, la transparencia y la mezcla [3].
En Colombia existen pocas publicaciones relacionadas con la producción primaria; entre ellas figuran algunos trabajos realizados en sistemas lénticos [2, 4-14]. Respecto a los lagos de llanura de inundación, llamados comúnmente en la parte norte de Suramérica como ciénagas, se encuen-tran publicados pocos trabajos [15-18], ya que se considera que Colombia posee 1.900 ciénagas con un área total de 478.418 ha, es considerado el más importante el complejo cenagoso del río Magdalena, con un área de 320,000 ha [19]. Según la literatura disponible, el sistema cenagoso colombiano más estudiado ha sido la Ciénaga Grande de Santa Marta [15], [18, 20-21]. En Colombia se encuentran en menor proporción publicaciones sobre la productividad primaria en los embalses [22], ya que estos últimos sistemas acuáticos han sido sometidos a diferentes investigaciones de consultoría ambiental, los cuales no terminan en publicaciones en revistas especializadas.
Un plano de inundación es un área que periódicamente es inundada por el sobreflujo lateral de ríos o lagos, o bien por precipitación directa sobre la cuenca de drenaje, lo que provoca como resultado un ambiente fisicoquímico cambiante, lo que a su vez provoca adaptaciones morfológicas, anatómicas, fisiológicas o ecológicas de la biota allí presente [23].
Por sus condiciones climatológicas, físicas y químicas se espera que la producción primaria en la ciénaga de Escobillitas presente valores bajos, no obstante, se evaluaron las siguientes preguntas de investigación: ¿se presenta patrones de variación de este proceso metabólico a nivel temporal y vertical?, ¿Cómo se comporta la PPB, la PPN y la respiración, la eficiencia fotosintética, la biomasa y las razones P/R y R/B con el pulso de inundación?, ¿Cómo es la relación entre la dinámica de las variables climáticas, físicas y químicas y la producción?
Materiales y métodos
Área de estudio
El sistema cenagoso de Ayapel se ubica en la jurisdicción del municipio de Ayapel, en el departamento de Córdoba, en la planicie atlántica del norte de Colombia (Fig. 1). Forma parte del macrosistema de humedales y zonas anegables de la depresión Momposina. La cuenca de la ciénaga tiene un área de 1.504 km2, situada entre 20 y 150 msnm. El territorio se ubica en la zona de bosque húmedo tropical, con temperaturas entre los 26 y 29 °C [24]. El sistema cenagoso de Ayapel se caracteriza por ser somero (Zmax = 10m) posee un área considerable (150 km2) con forma de una depresión cónica cóncava exhibiendo varios puntos de inflexión en forma en U, con un amplio desarrollo de la línea de costa (F = 4,48). Presenta un valor alto del fetch (15 km) y una baja profundidad relativa (Dr = 0,06%), factores que en conjunto favorecen una amplia pista de acción para el viento, una baja tendencia a la estabilidad térmica de la columna de agua y el predominio de la mezcla completa nocturna, por lo que se puede considerar el sistema como polimíctico cálido [25].
El régimen de precipitaciones fluctúa entre un periodo de lluvias (abril a noviembre) y otro de sequía (diciembre a marzo). Geográficamente, la zona se encuentra en la vertiente oriental del río San Jorge, y en la parte suroriental del complejo cenagoso de Ayapel se encuentra la ciénaga de Escobillitas. Este sistema, junto con las ciénagas de ese sector del complejo exhibe unas condiciones fisicoquímicas diferenciales, ya que en esta zona se presentan las mayores transparencias del agua, menores conductividades eléctricas, pH ligeramente ácido, baja concentración de clorofila a y una escasa cobertura de macrófitas.
Figura 1 Localización general de la zona de estudio
La ciénaga de Escobillas se encuentra dentro de la subcuenca denominada Escobillas, la cual posee un área de 139,84 km2 con una precipitación media de 2562,5 mm anuales, localizándose hacia la parte sur-oriente del sistema de Ayapel [26]. El sitio de investigación se localizó entre los 8° 17' 18.6'' N y 75° 5' 37.9'' W (Fig. 1). En esta estación se realizaron 5 muestreos entre los años 2006 y 2007, teniendo en cuenta los diferentes momentos de nivel del agua en la ciénaga: aguas altas en ascenso (1 de agosto), aguas altas fase estabilización (29 de septiembre), aguas altas descenso (12 de diciembre), aguas bajas (18 de marzo) y aguas altas en ascenso (30 agosto de 2007) (Fig 2).
Caracterización ambiental y fisicoquímica
Los valores de pluviosidad, radiación solar, temperatura del aire, velocidad y dirección del viento se obtuvieron mediante una estación meteorológica portátil Dawis Groundwater, con intervalos de cinco minutos durante los muestreos. La evaluación ambiental partió de la caracterización de las condiciones físicas y químicas del agua. La transparencia se midió con un disco de Secchi de 20 cm de diámetro, la temperatura del agua, el oxígeno disuelto y su porcentaje de saturación, la conductividad eléctrica, los sólidos disueltos totales (SDT), los sólidos suspendidos totales (SST) y el pH, empleándose medidores WTW; la profundidad total se evaluó con una plomada.
Figura 2 Variación de la radiación solar, la temperatura del aire y la precipitación (A) y del nivel del agua histórico y el registrado en campo (B)
Evaluación de la biomasa autotrófica y estimación de la producción primaria
Para el fitoplancton la biomasa se estimó mediante la determinación de la concentración de clorofila ''a'' extraída con etanol caliente al 96%, realizándose acidificación para la evaluación de la concentración de feopigmentos [1, 27]. La concentración de clorofila a fue multiplicada por 50, obteniéndose un estimativo grueso de la biomasa algal [28]. La producción primaria se cuantificó mediante el método de evolución de oxígeno en botella clara y oscura ''In Situ'', empleando botellas tipo Winkler y un Oxímetro digital WTW 320 con precisión de 0,01 ppm [29], con incubaciones de una hora a tres profundidades diferentes (100%, 50% y 1% de luz que efectivamente penetra (Io)) y con una réplica para cada profundidad, en dos estaciones de muestreo separadas entre sí 200 m. Para la conversión a mgC.m-3.h-1 se utilizó el factor 0,375 y un valor de PQ (cociente fotosintético) de 1,2. [30]. Los cálculos de la producción primaria/ área y de la capacidad fotosintética máxima se realizaron por integración gráfica y teniendo en cuenta la máxima PPB (mg O2.m-3h-1) / la concentración de clorofila a (mg Chl a. m-3) con la finalidad de comparar con otros ecosistemas [31]. La producción primaria anual se estimó por integración numérica de los datos, empleando la regla trapezoidal.
Análisis estadísticos
Los datos obtenidos han sido sometidos a análisis exploratorio mediante el uso de estadísticos de tendencia central (media aritmética, MA) y de dispersión (desviación estándar, S, y coeficiente de variación relativa de Pearson, C.V.). Para establecer la significancia de la variación temporal de la PPB, PPN y la respiración se efectuó un análisis de varianza. Para explicar la dependencia entre variables se efectúo un análisis de regresión y correlación lineal no paramétrico de Spearman, empleando los datos sin transformaciones.
El análisis de componentes principales (ACP) se empleo para detectar patrones de organización de las variables de producción, el tiempo y su relación con las variables climáticas y fisicoquímicas evaluadas, siendo usado el programa Statgraphics 5.0.
Resultados
En la figura 2 se observa la variación de la pluviosidad, la temperatura del aire y la radiación solar, información que corresponde al promedio de los datos diarios tomados de una estación climatológica cercana, se evidenció que los valores de pluviosidad fueron mayores en agosto; luego se presentó una tendencia a la disminución de esta variable, reportándose el mes de enero como el más seco. En aguas altas en ascenso se observó la menor concentración de oxígeno disuelto, valores de pH cercanos a la neutralidad, baja conductividad eléctrica, concentración alta de SDT y los valores más bajos de clorofila a activa y feopigmentos (tabla 1). La tabla 2 presenta los valores medios y de tendencia central de las características físicas y químicas evaluadas en la Ciénaga de Escobillitas, al igual que los datos de incubación de botellas claras y oscuras en dos sistemas separados.
Tabla 1 Principales variables fisicoquímicas y biológicas de la estación de muestreo
La ciénaga de Escobillitas es un sistema léntico somero, con aguas transparentes, cálidas, subsatura- das, pH ligeramente ácido, con baja concentración de clorofila ''a'' y de iones. Presenta valores relativamente altos de sólidos totales disueltos y de feopigmentos, los cuales son tres veces superiores a la concentración de clorofila a activa, los cuales son debidos a la acidificación de la muestra.
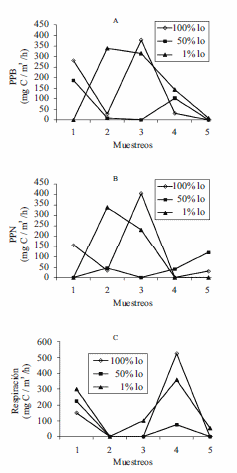
La variación temporal de la biomasa fitoplanctónica fue alta (148,5%), presenta un valor medio alto (890 mg CL. a.m-3), con un valor mínimo de 5 mg CL. a.m-3 correspondiente al muestreo de agosto/2006 (aguas altas en ascenso) y un valor máximo de 3200 mg CL. a.m-3 medido en diciembre/2006 (aguas altas en descenso). En este momento hidrológico se registró la mayor PPB con un valor de 191,6 mg C m-3 h, la cual presentó una tendencia a la disminución hacia los muestreos restantes (transición entre aguas bajas en descenso y aguas altas en ascenso), en este último periodo presentó su valor mínimo, el cual fue de 0 mg C m-3 h. (Fig 3). En este mismo muestreo se presentó el menor valor de respiración del ensamble fitoplanctónico con un valor de 0 mg C m-3 h y en marzo/2007 ocurrió el mayor valor de la respiración en las botellas incubadas (320 mg C m-3 h). En esta figura, también se observa que la ciénaga presentó alternancia entre periodos de autotrofía y heterotrofía, con un predominio de la respiración sobre la producción en los periodos 2, 3 y 5 (aguas altas).
Se evidencian diferencias entre los valores de PPB, PPN y respiración incluso para un mismo muestreo y entre profundidades (Fig. 4). Se presentaron coeficientes de variación temporal entre profundidades de incubación superiores al 100%. Al estudiar la columna de agua, la producción primaria bruta al 50% de Io y la respiración al 100% de Io presentaron diferencias significativas (F = 34,8, p = 0,001; F = 65,2, p = 0,003, respectivamente). Los menores valores de producción primaria bruta se presentaron en aguas altas en descenso en el 2007, los cuales estuvieron acompañados de un ambiente con transparencia alta, las mayores concentraciones de clorofila a activa y feopigmentos y valores de saturación de oxígeno del 56%.
Tabla 2 Medidas de tendencia central y de dispersión en las dos estaciones de muestreo
Figura 3 Variación de la biomasa, la producción primaria bruta y la respiración (C)
La variación de la eficiencia fotosintética durante el ciclo hidrológico estuvo marcada por un primer muestreo con valores altos (aguas en ascenso) y el resto de las incubaciones presentaron valores bajos y cercanos a cero, con un coeficiente de variación de 207 % con un valor medio de 1,4 (Fig. 5A). La respiración fue mayor en varios muestreos que la producción primaria, como consecuencia, la relación producción/respiración presentó oscilaciones continuas, predominando la respiración sobre la producción (Fig. 5B). La relación producción/ biomasa presentó una tendencia similar a la eficiencia fotosintética (Fig. 5C).
Figura 4 Variación promedio de la producción primaria bruta (A), la producción primaria neta (B) y la respiración (C) en tres profundidades de incubación
Las variables evaluadas presentaron relación significativa en su mayoría con los parámetros de nivel del agua, transparencia Secchi y temperatura del agua (tabla 4).
El análisis de componentes principales recogió el 78,2% de la variabilidad total de los datos en los primeros ejes (Fig. 6). El primer componente (50%) fue asociado positivamente con el nivel hidrométrico, transparencia, pluviosidad, clorofila y la respiración y negativamente con los sólidos disueltos totales y la producción primaria bruta y neta (tabla 4). El segundo componente (28,2%) estuvo asociado a la mineralización del agua (sólidos y respiración), los pigmentos y el pulso de inundación (profundidad, transparencia y pluviosidad).
Figura 5 Variación promedio de la eficiencia fotosintética (A), la relación PPB/respiración (B) y la relación PPB/biomasa (C)
Tabla 3 Matriz de correlaciones entre las variables evaluadas
Tabla 4 Correlaciones de las variables con los componentes principales 1 y 2
Figura 6 Análisis de componentes principales (ACP) relacionando factores limnológicos y la producción primaria
Valores de biomasa y altitud sobre el nivel para algunas ciénagas colombianas se tomaron de [18] (Tabla 5).
Tabla 5 Comparación de sistemas cenagosos de la parte norte de Colombia.
El valor de la producción primaria encontrado fue relativamente alto comparado con otras ciénagas y lagunas colombianas (Tabla 6).
Tabla 6 Valores de producción primaria en algunos lagos de llanura de inundación y lagunas colombianas y en lagos de tierras bajas brasileros
Discusión
Dado que toda la producción primaria de un ecosistema acuático depende de los organismos fotosintetizadores, es fundamental que se considere la medida de esta producción como un punto de partida inicial para una evaluación sobre el potencial sustentable del mismo [34]. El cociente producción / respiración fluctuó a través del pulso de inundación, lo que sugiere que en el epilimnio de la ciénaga Escobillitas la producción bacteriana mediante la utilización del carbono inorgánico disuelto debe ser importante en el funcionamiento del ecosistema, por lo que se gasta bastante de la biomasa producida al comienzo de las perturbaciones (PPB/R<1) y en las fases de estabilización, el aumento de la biomasa y de la dominancia aumentan la relación producción / respiración.
Otra característica para resaltar fue el bajo valor medio de la concentración de clorofila a, aunque se presentó un incremento considerable en el último muestreo correspondiente a aguas altas en ascenso, si se tiene en cuenta que en la literatura [35] se registra que durante el flujo los nutrientes previamente mineralizados en la fase seca son disueltos, los cuales presentan altas tasas de producción primaria y de descomposición.
La concentración del oxígeno disuelto fue siempre menor que el valor de saturación. El valor de la relación P/B (eficiencia o productividad) alcanza un valor máximo de 5 para el fitoplancton [36]. El valor medio de 158 sobrepasa el valor superior de esta relación, lo cual indicaría una alta eficiencia fotosintética debida a los bajos valores de biomasa o problemas en su evaluación. Investigaciones en un lago eutrófico colombiano reportan una relación P/B media de 2,92, con un valor máximo de 10 señalando que no necesariamente valores altos de clorofila implican producción alta [4].
La eficiencia fotosintética presentó valores altos en el primer muestreo, los cuales se asociaron al valor alto de la relación P/B. Una eficiencia fotosintética alta significa un flujo de electrones mayor y por tanto una mejor utilización de la luz y posiblemente de los nutrientes por parte de las plantas [4]. El resto de los muestreos, se presentaron valores bajos de la eficiencia fotosintética y de la razón P/B los cuales responden posiblemente a daños en el aparato fotosintético, ya que la alta tasa fotosintética puede provocar supersaturación de oxígeno y déficit de gas carbónico. Esto puede incrementar la fotorespiración, lo que genera una reducción de la producción. Este efecto es más común en los lagos eutróficos [3]. Este sistema presenta oscilación del nutriente limitante, aunque la mayor parte del tiempo predomina la limitación por nitrógeno.
La biomasa (clorofila-a) no se encuentra relacionada directamente con la producción primaria, ya que los eventos de estratificación y mezcla determinan su concentración, evidenciándose relación con la transparencia y la conductividad eléctrica. El concepto de pulso de inundación implica que la producción biológica se lleva a cabo a través de una gran variedad de procesos durante el ciclo del pulso [35]. En el caso de la ciénaga de Paticos, otro lago de llanura de inundación cercano, las variables más relacionadas con la variación nictemeral fueron la pluviosidad, la velocidad y dirección del viento, la temperatura del aire y del agua, el pH y la concentración de oxígeno disuelto [37].
En los lagos de regiones tropicales, se observa alta variación de los valores de la producción primaria fitoplanctónica durante el año [30], incluso a nivel diario se presenta fluctuación marcada [1]. Los resultados obtenidos del análisis de varianza para la producción primaria bruta y neta no concuerdan con lo planteado (F = 8,67, p = 0,07, F = 4,4, p = 0,35, respectivamente), ya que la ciénaga estudiada corresponde a un lago raso tipo I [3] con estratificaciones térmicas de corta duración, por lo que el nivel del agua juega un papel importante en la dinámica de la producción primaria. Se observó relación entre la producción y el nivel del agua, lo cual se ha documentado [38].
La variación temporal de la producción fitoplanc- tónica está controlada por la radiación subacuática y por la disponibilidad de nutrientes [3]. No obstante, sólo la respiración presentó diferencias estadísticas a nivel temporal (F = 12,4, p = 0,0146), aunque mostró relación con la temperatura del agua. Aunque se considera que en los lagos tropicales, la temperatura del agua por estar siempre encima de los valores limitantes del crecimiento, no tiene efectos tan significativos sobre la variación temporal del fitoplancton como en los lagos templados. La alta temperatura de los lagos tropicales tiene influencia significativa sobre la magnitud de la producción líquida, o sea, sobre la tasa de respiración del fitoplancton tropical y es esencialmente superior al fitoplancton de los lagos templados [3]. Otro aspecto a considerar es la actividad microbiológica, correspondiente en el efecto de la respiración de hongos, bacterias y protozoos durante los experimentos de incubación.
La respiración presentó diferencias en el ciclo hidrológico y entre niveles de agua de la ciénaga, las cuales se asocian al grado de mineralización de la materia orgánica en la columna de agua y al grado de atenuación lumínica. Al parecer, la disminución de la concentración de clorofila implicó un aumento en la PPB. Esto podría deberse a un aumento del metabolismo asociados a la mayor disponibilidad de nutrientes. Dado que toda la producción orgánica de un ecosistema acuático depende de los organismos fotosintetizadores, es fundamental que se considere la medida de esta producción como un punto de partida para la evaluación de la soste- nibilidad ambiental del mismo [26].
Es importante resaltar que, el alto desbalance en la relación P/R en el primer muestreo indica una asimetría entre la fotosíntesis y la respiración, lo que implica un gasto metabólico alto lo que incidió en los bajos valores de clorofila a y de la producción neta encontrados en la ciénaga. Esto indica un gasto metabólico y de biomasa, por lo que se puede considerar al sistema como exportador de materia, lo cual se acentúa por los bajos tiempos de residencia de la ciénaga (menos de un mes). Igualmente puede mencionarse que el sistema alterna su metabolismo entre los tipos autotrófico y heterotrófico, con un predominio de los pigmentos degradados sobre los activos (lo cual puede estar relacionado con la manipulación de las muestras), lo cual pudo deberse a la fluctuación del nivel asociado a cambios en la concentración del material orgánico disuelto; lo cual implica disminución en la transparencia y en la PPB.
Es posible que durante la fase de ascenso, se inunde el ecosistema terrestre lo que se relaciona con los valores más altos de sólidos disueltos y una mayor descomposición de materia orgánica del ecosistema adyacente que determinan valores altos de respiración. Puede considerarse que la producción fitoplanctónica es alta, pero la carga orgánica de la ciénaga (posiblemente de material alóctono) es mucho mayor, por lo cual hay una elevada respiración. Las tasas máximas de producción primaria acuática ocurren a velocidades intermedias de la corriente, donde los beneficios del flujo implican crecimiento pero no ejercen suficientes fuerza como para ser considerados como generadores de estrés ambiental [31], ya que en el plancton el control de las especies presentes y sus abundancias se ejerce principalmente por el medio físico, debido a la estructura móvil de la masa de agua [34].
Los valores medios de clorofila y de altitud sobre el nivel del mar de este lago de llanura de inundación están muy cercanos al promedio para esta clase de ecosistemas colombianos. Sin embargo, los valores de PPB son relativamente altos ya que el sistema en promedio presenta el 59,5% de su profundidad máxima iluminada. El clima lumínico del cuerpo de agua fluctuó con el pulso de inundación, al igual que otras variables. No obstante, a través del pulso de inundación se presentan varios escenarios y tener una zona fótica amplia en promedio favorece la PPB. En términos generales, se encontró la mayor producción primaria bruta en aguas altas en descenso, condición acompañada por un mayor registro de biomasa algal, reducción en la eficiencia fotosintética y bajos valores de respiración y de las relaciones P/B y P/R. En relación con las variables fisicoquímicas, se presentaron los menores valores de transparencia y temperatura del agua y los mayores valores de pH, conductividad eléctrica y SDT.
La zona media de la columna de agua tuvo siempre valores de producción primaria y respiración menores a los registrados en superficie y en el fondo (perfil heterogrado de productividad y respiración). Este hecho puede deberse a que en la superficie se presentan condiciones óptimas de luz y en la parte inferior, la acumulación de nutrientes sumados a la penetración de la luz [39].
Entre ciclos hidrológicos se presentan cambios de los patrones de producción primaria, ya que para la fase de aguas altas en ascenso en el año 2006 se presentó una alta PPB, la mayor eficiencia fotosintética, altos valores de la respiración, los cuales son muy próximos a los valores de PPB, acompañados de una baja biomasa, baja relación P/R y con el valor más alto de la relación P/B. En contraste, para el mismo periodo hidrológico del pulso de inundación en el año 2007, se presentó un aumento de la biomasa, reducción de la PPB, de la eficiencia fotosintética, de la relación P/B y de la respiración; esta última exhibió valores negativos en casi todas las profundidades de incubación. Adicionalmente, se halló el doble de la concentración de oxígeno disuelto y los mayores valores de biomasa fitoplanctónica y de feopigmentos. En la literatura se plantea que los ambientes de aguas tropicales responden a cambios ambientales en corto plazo, ya que las fuerzas climáticas y meteorológicas, tales como los episodios anómalos de intensa precipitación, sequías y vientos fuertes, pueden afectar rápidamente los procesos bioquímicos [40].
[3] ha propuesto una tipología de clasificación de los lagos tropicales según su producción primaria anual ya que es erróneo utilizar la clasificación trófica de los lagos templados en las bajas latitudes. Con base en este criterio, los lagos tropicales pueden identificarse como: lagos euproductivos >500 g C m-2 año-1, lagos mesoproductivos, 200 - 500 g C m-2 año-1 y lagos oligoproductivos <200 g C m-2 año-1. Teniendo en cuenta esta propuesta, la ciénaga de Escobillitas puede clasificarse como euproductiva, ya que presentó valores medios de PPB del orden de 3056,8 g C m-2 año-1, los cuales oscilaron entre 148,9 y 7944,4 g C m-2 año-1, es decir, se presentan oscilaciones entre euproductivo y oligoproductivo, lo cual es indicador de una alta dinámica trófica, por lo que se puede considerar la ciénaga como distrófica, implicando la necesidad de un acople entre las necesidades alimenticias de los peces y las condiciones tróficas del sistema.
Conclusiones
Se presentó alta dinámica de la producción primaria en la ciénaga Escobillitas, la cual fluctuó en relación con la extinción de la luz en la columna de agua, con el periodo del ciclo hidrológico evaluado y entre las réplicas. La variabilidad alta de la información recolectada incidió en que no se presentó relación de la PPB y la PPN con las variables ambientales y fisicoquímicas investigadas. Tan solo la respiración evidenció relación con la temperatura del agua, la cual presentó una oscilación inferior a los 2°C durante la investigación con un valor medio de 30,5°C, por lo que se podría deducir que pequeñas fluctuaciones de la temperatura generan respuestas diferenciales en la respiración de los microorganismos. Pueden ser también factores de orden mayor que inciden sobre la respiración, por ejemplo la acumulación de materia orgánica durante el descenso de las aguas.
Entre las variables fisicoquímicas evaluadas, el nivel de la columna de agua fue el responsable de la mayoría de cambios que se presenta en las condiciones del medio acuoso, lo que muestra la importancia del pulso de inundación sobre las características de los ecosistemas acuáticos. Se ratifica la necesidad de realizar muestreos durante diferentes momentos del pulso hidrológico para hacer una mejor caracterización de los ecosistemas cenagosos y poder hacer así una mejor aproximación a su dinámica trófica; la cual puede cambiar incluso para una misma etapa del pulso entre ciclos hidrológicos sucesivos.
Agradecimientos
Al grupo de Investigación en Gestión y Modelación Ambiental GAIA de la Universidad de Antioquia y al Programa de Investigación de la gestión integral del agua en Colombia - Grecia por el apoyo económico y logístico y a los evaluadores anónimos del manuscrito.
Referencias
1. G. E. Roldán, J. J. Ramírez. Fundamentos de limnología neotropical. 2a ed. Ed. Universidad de Antioquia. Medellín. 2008. pp. 268. [ Links ]
2. J. J. Ramírez, H. Alcaráz. ''Dinámica de la producción primaria fitoplanctónica en un sistema eutrófico tropical: Laguna del Parque Norte, Medellín, Colombia''. Caldasia. Vol 24. 2002. pp. 411-423. [ Links ]
3. F. Esteves. Fundamentos de limnología. 2a ed. Ed. Interciencia. Sao Paulo. 1998. pp. 409. [ Links ]
4. G. Pinilla. Ecología del fitoplancton en un lago amazónico de aguas claras (Lago Boa, Caquetá Medio República de Colombia). Tesis de doctorado. Universidad Jorge Tadeo Lozano. Bogotá. 2005. pp. 1-256. [ Links ]
5. G. Pinilla. ''Evaluación de la eficiencia fotosintética del fitoplancton en un lago amazónico (Lago Boa) y en un lago andino (Lago Guatavita)''. Acta Amazónica. Vol 36. 2006. pp 221-228. [ Links ]
6. C. T. Castillo. ''Productividad y biomasa fitoperifítica en los lagos de Yahuarcaca y Tarapoto (Amazonas- Colombia)''. Revista Ambiental Universidad de Pamplona. Vol 1. 2000. pp 59-68. [ Links ]
7. A. M. Zapata. Variaciones diarias y mensuales de la producción primaria en un lago andino (Lago de Guatavita-Cundinamarca). Tesis de maestría. Pontificia Universidad Javeriana. Bogotá. 2001. pp. 33-34. [ Links ]
8. S. R. Duque. Tipificación limnológica de algunos lagos de la Amazonía colombiana a través de la composición, biomasa y productividad del fitoplancton. Tesis de maestría. Universidad Nacional de Colombia. Bogotá. 1997. pp. 1-36. [ Links ]
9. P. Jiménez. Variaciones diarias de la producción primaria fitoplanctónica y a concentración de la clorofila en un lago tropical (Guatavita, Colombia). Tesis Maestría. Pontificia Universidad Javeriana. Bogotá. 2005. pp. 1-125. [ Links ]
10. S. Lozada. Variaciones espacio-temporales de la estructura fitoplanctónica, la biomasa de clorofila y la productividad primaria en el estuario del río Dagua (Bahía de Buenaventura). Tesis Maestría.Universidad del Valle. Cali. 2004. pp. 1-134. [ Links ]
11. P. Duarte. Productividad primaria y biomasa del fitoplancton en una laguna tropical de alta montaña (Laguna de Guatavita). Tesis Ecóloga. Pontificia Universidad Javeriana. Bogotá. 2004. pp. 25-28. [ Links ]
12. R. Orjuela. Relaciones entre diversidad y producción primaria fitoplanctónica en el lago de Guatavita. Tesis Biólogo. Pontificia Universidad Javeriana. Bogotá. 2004. pp. 46-55. [ Links ]
13. Z. Marín. Estudio de la composición, biomasa fitoplanctónica y productividad primaria en el lago Tarapoto durante dos periodos hidrológicos. Tesis Bióloga. Universidad Nacional de Colombia. Bogotá. 2000. pp. 1-83. [ Links ]
14. M. Gavilán. Biomasa y productividad primaria de la comunidad fitoplanctónica en el lago Boa, Caquetá Medio-Colombia. Tesis Bióloga Marina. Universidad Jorge Tadeo Lozano. Bogotá. 2003. pp. 1-164. [ Links ]
15. K. Gocke, C. Hernández, H. Giesenhagen, H. G. Hoppe. ''Seasonal variations of bacterial abundance and biomass and their relation to phytoplankton in the hypertrophic tropical lagoon Ciénaga Grande de Santa Marta, Colombia''. Journal of plankton research. Vol 26. 2004. pp 1429-1439. [ Links ]
16. E. Pava, J. Carrasquilla, W. López. ''Caracterización de la comunidad fitoplanctónica de un plano de inundación del río Sogamoso en la cuenca media del río Magdalena (Ciénaga de San Silvestre, Colombia)''. Revista Intrópica. Vol 3. 2006. pp 43-57. [ Links ]
17. A. Ramírez, G. Viña. Limnología Colombiana. Ed. Panamericana. Bogotá. 1998. pp. 1-293. [ Links ]
18. C. Hernández, K. Gocke. ''Productividad primaria en la Ciénaga Grande de Santa Marta, Colombia''. An. Inst. Invest. Mar PuntaBetín. Vol 19. 1990. pp 101-119. [ Links ]
19. P. Arias. ''Las ciénagas en Colombia''. Revista Divulgación Pesquera Inderena. Vol 22. 1985. pp 39-70. [ Links ]
20. R. Sánchez, S. Zea. ''Metabolismo de nitrógeno y fósforo inorgánico disueltos en la columna de agua en una laguna costera tropical (Caribe Colombiano)''. Caribbean Journal of Science. Vol 36. 2000. pp 127-140. [ Links ]
21. C. Granados, C. Rodríguez, J. C. Mancera, H. J. López. Producción primaria fitoplanctónica, respiración, balance metabólico y relación con variables fisicoquímicas durante la época lluviosa de 2007 en la Ciénaga Grande de Santa Marta, Caribe colombiano. Resúmenes VIII Seminario Colombiano de Limnología. Santiago de Cali. 2008. pp. 102. [ Links ]
22. G. Naundorf. ''Caracterización de la comunidad fitoplanctónica y determinación de la productividad primaria en el embalse ''La Salvajina'' y su área de influencia''. Revista Asociación Colombiana de Ciencias Biológicas. Vol 7. 1990. pp. 154-163. [ Links ]
23. W. J. Junk, P. B. Bayley, R. E. Sparks. ''The flood pulse concept in river floodplain systems''. D. P. Dodge (editor). Can. Sper. Publ. Fish. Aquat. Sci. Vol 106. 1989. pp 110-127. [ Links ]
24. Instituto Geográfico Agustin Codazzi (IGAC). Estudio general de los suelos de los municipios de ayapel, Buenavista, Planeta Rica y Pueblo Rico (Departamento de Córdoba). Bogotá. 1986. pp.282. [ Links ]
25. Y. Montoya, N. Aguirre, C. Benjumea, A. Wills. Morfometría de un sistema cenagoso tropical. Resúmenes I Congreso Nacional de Ciénagas y Lagunas de Colombia. Medellín. 2008. pp.150. [ Links ]
26. N. Aguirre, J. Palacio, M. T. Flórez, A. Wills, O. Caicedo, L. F. Jiménez, N. Villegas, H.Vargas, C. Palacio, M. Toro, J. Vélez. Análisis de la relación río- ciénaga y su efecto sobre la producción pesquera en el sistema cenagoso de Ayapel, Colombia. Informe de Investigación. Universidad de Antioquia-Universidad Nacional de Colombia. 2005. pp 419. [ Links ]
27. D. P. Sartory, J. U. Grobbelaar. ''Extraction of chlorophyll from freshwater phytoplankton for spectrophotometric analysis''. Hydrobiologia. Vol 114. 1984. pp 177-187. [ Links ]
28. C. S. Reynolds. Vegetation processes in the pelagic: a modelfor ecosystem theory. Ed. Ecology Institute ECI. Oldendorf (Germany). 1997. pp. 1-371. [ Links ]
29. T. Gaarder, H. H. Gran. Investigations of the production of plankton in the Oslo Fjord. Rapports et Proces-Verbaux des Réunions. Conseil Permanent International pour l'Exploration de la Mer. Vol. 42. 1927. pp. 1-48. [ Links ]
30. R. G. Wetzel, G. E. Likens. Limnological Analysis. Ed. Springer-Verlag. New York. 1991. pp. 207-235. [ Links ]
31. J. J. Ramírez. ''Medición de la productividad primaria en ecosistemas acuáticos lenticos por el método de la botella clara y oscura''. Revista Ainsa. Vol 2. 1991. pp. 21-40. [ Links ]
32. S. Asprilla, J. J. Ramírez, G. Roldán. ''Caracterización limnológica preliminar de la ciénaga de Jotaudó (Chocó, Colombia)''. Actualidades Biológicas. Vol 20. 1998. pp 87-107. [ Links ]
33. R. Tatis, L. Gutiérrez. Phytoplankton primary production in a tropical shallow pulsing system: Malambo complex (Atlántico, Colombia). VII Seminario Colombiano de Limnología. Tolima. 2006. pp. 64-65. [ Links ]
34. J. Tundisi, T.M. Tundisi. ''Produjao orgánica em ecosistemas acuáticos''. Ciencia e Cultura Sao Paulo. Vol 8. 1976. pp 861-887. [ Links ]
35. P. B. Bayley. ''Understanding large river-floodplain ecosystems''. BioScience. Vol 45. 1995. pp 153-158. [ Links ]
36. R. Margalef. Limnología. Ed. Omega. S A. Barcelona. 1983. pp. 253-269. [ Links ]
37. Y. Montoya, N. Aguirre. ''Cambios nictemerales de variables físicas y químicas en la ciénaga de Paticos, complejo cenagoso de Ayapel, Colombia ''. Revista de Biología Tropical. Vol. 57. 2009. pp. 635-646. [ Links ]
38. H. Rai, H. Hill. Primary production in the Amazonian Aquatic Ecosystem. The Amazon. Limnology. Vol 16. 1984. pp. 312-335. [ Links ]
39. L. T. Cassandra, Li. Zhang, J. Mitsch. ''Aquatic metabolism as an indicator of the ecological effects of hydrologic pulsing in flow-through wetlands''. Ecological Indicators. Vol 8. 2008. pp 795-806. [ Links ]
40. M. F. L. Souza, E. C. G. Couto. ''Short-term changes and longitudinal distribution of carbon metabolism in the Piauí River Estuary (Sergipe, Brasil)''. Revista Brasileira de Biologia. Vol 59. 1999. pp.195-202. [ Links ]
(Recibido el 17 de abril de 2009. Aceptado el 19 de febrero de 2010)
1Autor de correspondencia: teléfono: + 57 + 4 + 219 65 63, fax: + 57 +4 + 219 65 64, correo electrónico: naguirre@udea.edu.co. (N.Aguirre)