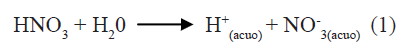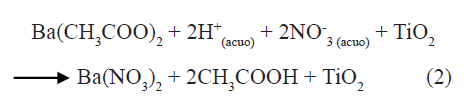Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Facultad de Ingeniería Universidad de Antioquia
versão impressa ISSN 0120-6230versão On-line ISSN 2422-2844
Rev.fac.ing.univ. Antioquia n.56 Medellín out./dez. 2010
Síntesis de BaTiO3 cúbico por rutas químicas
BaTiO3 cubic synthesis by chemical ways
Claudia Patricia. Fernández Perdomo*, Edison Rivera Figueroa, Jorge Enrique Rodríguez Páez
Grupo de Ciencia y Tecnología de Materiales Cerámicos (CYTEMAC), Dpto. de Física, Universidad del Cauca, Calle 5 No 4-70. Popayán, Colombia
Resumen
En este trabajo se sintetizaron polvos cerámicos de titanato de bario (BaTiO3) mediante dos métodos químicos: coprecipitación y precursor polimérico (Pechini). Estos métodos, altamente reproducibles y confiables, permitieron obtener partículas de BaTiO3 nanométricas (<200 nm) con alta pureza química, a una temperatura de 650°C; además, se logró estabilizar la fase cúbica del BaTiO3 a temperatura ambiente. Se realizó una breve discusión sobre los mecanismos de formación de las partículas y una adecuada descripción de los procesos de síntesis. Los polvos obtenidos se caracterizaron empleando espectroscopía infrarroja (FTIR), difracción de rayos X (DRX), análisis térmico (ATD/TG) y microscopía electrónica de trasmisión (MET).
Palabras clave: Precursor polimérico, coprecipitación, BaTiO3, fase cúbica.
Abstract
In this work were synthesized ceramic powders of barium titanate (BaTiO3 by two chemical methods: coprecipitation and polymeric precursor (Pechini). These methods, are highly reproducible and reliable, allowed to obtain nanosized BaTiO3 particles (<200 nm) with high chemical purity, at a temperature of 650 °C, moreover, allowed to stabilize the cubic phase of BaTiO3 at room temperature. We conducted a brief discussion on the mechanisms of particle formation and an adequate description of the synthesis processes. The powders were characterized using infrared spectroscopy (FTIR), X-ray diffraction (XRD), thermal analysis (DTA / TG) and transmission electron microscopy (TEM).
Keywords: Polymeric precursor, coprecipitation, BaTiO3, cubic phase.
Introducción
El titanato de bario (BaTiO3) es uno de los materiales ferroeléctricos más ampliamente estudiado debido a que su estructura es simple, comparándola con la de otros ferroeléctricos conocidos lo que ha permitido entender mejor el fenómeno. Además, presenta gran cantidad de aplicaciones debido a su buena estabilidad química y mecánica; su obtención es relativamente fácil cuando se utilizan los métodos convencionales de síntesis [1].
El titanato de bario presenta cuatro fases cristalinas: la cúbica (grupo puntual Pm3m) que es estable a temperaturas mayores a 120°C, la fase tetragonal (grupo puntual P4mm) estable entre 120°C y 5°C, la ortorrómbica (grupo puntual C2mm) estable entre 5°C y -90°C y la romboedral (grupo puntual R3m) que ocurre por debajo de -90°C. La fase de interés para este trabajo es la cúbica que es centrosimétrica y no piezoeléctrica, con una estructura tipo perovskita [1, 2].
Debido a su alta constante dieléctrica, bajas corriente de fuga de corriente y pérdidas dieléctricas, el BaTiO3 (BT) se emplea en el conformado de condensadores cerámicos multicapa (MLCC), memorias no volátiles de bajo voltaje de conmutación, sensores de infrarrojo, dispositivos electro-ópticos, sensores de humedad y termistores con coeficiente positivo de temperatura (PTCR) [1, 3, 4]. En los últimos años, se ha venido trabajando en reducir el tamaño de los MLCC para obtener capacitancias altas en pequeños volúmenes. El espesor del dieléctrico tiene que ser pequeño mientras que el numero de capas activas, dentro del dispositivo, debe ser alta [4]; esto ha generado un creciente interés de reducir la temperatura de síntesis del BT para utilizar como electrodos metales no nobles, que son más baratos [3-5].
La transición de fase tetragonal-cúbica (ferroeléctrico-paraeléctrico), que presenta el BaTiO3, ocurre a la temperatura de Curie (~120°C) y es acompañada por un incremento abrupto en el valor de la constante dieléctrica, esto debido a la gran polarización espontánea que presenta el BaTiO3 en su fase tetragonal [6]. El cambio de la temperatura de Curie hacia mayores o menores valores, que los 120 °C del BaTiO3 puro, permite ampliar el rango de temperaturas en el cual se puede utilizar la funcionalidad de este material. Para obtener el BaTiO3, por el método convencional, se promueve la reacción en estado sólido del BaCO3 y del TiO2. El BaCO3 es un compuesto muy estable y su descomposición térmica, en presencia de TiO2, comienza a temperaturas del orden de 700°C. De igual forma, el hecho de que la reacción para obtener el BaTiO3 se produzca por difusión del Ba+2 en el material, esto requiere de altas temperaturas, por encima de 1000°C con tiempos de reacción largos, lo que propicia la aparición de segundas fases cristalinas [1,3 -5]. Debido a las propiedades especiales del BaTiO3, y su amplio rango de aplicaciones, actualmente se ha incrementado el interés por la obtención de nanopartículas de BaTiO3 con el fin de aprovechar tecnológicamente más este material [7]. Para ello se han utilizado diversos métodos químicos: sol-gel [8], co-precipitación e hidrolisis de alkoxidos [9,10], síntesis hidrotermal [11,12] y mecanoquímica [9], entre otros. Por otro lado, el método de precursor polimérico (Pechini) es una técnica de relativo bajo costo que ha permitido obtener diversos compuestos con partículas de tamaño pequeño, uniforme y homogéneo, con alta pureza química, entre ellos polvos de BaTiO3 [13]. En este trabajo se sintetizaron polvos cerámicos de BaTiO3, con estructura cúbica, utilizando los métodos de coprecipitación y precursor polimérico (Pechini). Estos métodos permitieron obtener partículas nanométricas con una alta pureza química. El pequeño tamaño de partícula del BaTiO3 favoreció la estabilización de la fase cúbica a temperatura ambiente. Además, el haber sintetizado el titanato de bario fase cúbica a baja temperatura, 650°C, debe reducir la temperatura de sinterización del compuesto ya que la reactividad del mismo debe ser alta. Los métodos de síntesis utilizados en este trabajo permiten garantizar la reproducibilidad de las propiedades físico-químicas del producto final, el BaTiO3 cúbico.
Experimentación
Síntesis de BaTiO3 por coprecipitación
Para obtener el BaTiO3, utilizando el método de coprecipitación, se mezcló una solución de ácido nítrico 0,5 N (HNO3 Fisher 69,7%), en 200 mL de agua destilada, y se le adicionó acetato de bario Ba((CH3COO)2 - Aldrich 99%), para obtener una solución 0,06M, y TiO2 fase anatasa (Aldrich); se prepararon composiciones con estequiometria ajustada a la relación BaO/TiO2 =1.
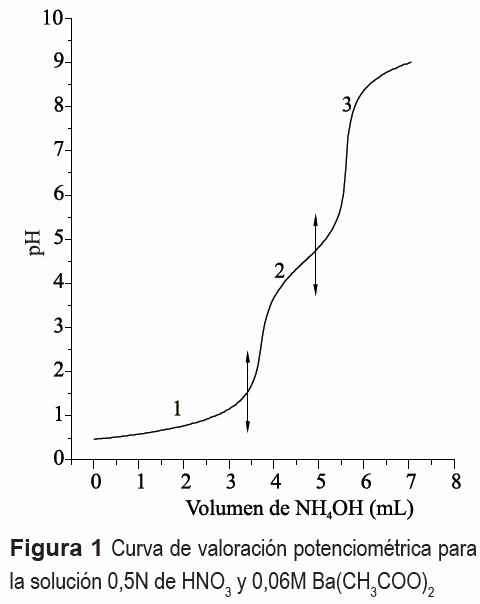
Para garantizar homogeneidad en el sistema, se colocó en continua agitación, a 200 r.p.m. y temperatura ambiente, el agua acidulada junto con el TiO2 (fase anatasa) y se adicionó a la suspensión el Ba (CH3COO)2. Posteriormente, se adicionó el hidróxido de amonio (NH4OH- J.T. Baker 29,6%) a una velocidad de 0,05 mL cada 20 segundos; el sistema se llevó hasta el pH de interés (pH 9), valor que se determinó previamente con base en la curva de valoración potenciométrica del sistema (gráfica que indica la variación del pH con el volumen adicionado de precipitante). Tanto el monitoreo como el registro del pH, de cada una de las soluciones al adicionarles el precipitante, fueron realizados utilizando el Titrino Metrohn SM 702 con electrodo de vidrio.
Para eliminar gran parte del solvente de la suspensión se usó el rota-evaporador Buchi R-124. Luego, el polvo húmedo obtenido se mantuvo a 60°C en una plancha, durante 24 horas hasta obtener peso constante del sólido. El sólido resultante fue macerado, en un mortero de ágata, obteniéndose así un polvo de color blanco con textura fina, bastante higroscópico.
Síntesis de BaTiO3 utilizando el método de precursor polimérico (pechini)
Inicialmente se calentó etilenglicol (Mallinckrodt 99,5%) a 70°C y se adicionó ácido cítrico (Mallinckrodt 99%) en una proporción 4:1, respectivamente, manteniendo constante la temperatura de la mezcla a 70°C; agitando continuamente, se agregó el acetato de bario.
Por separado, se diluyó el precursor de titanio, tetrabutóxido de titanio (TBT- Acros 99,9%) en 50 mL de etanol (Merck, 99,9%), solución base para obtener la muestra denominada P10. Paralelamente, a una solución similar a la anterior se le adicionó un acomplejante, acetilacetonato - AcacH (J. T. Baker 99%) en una proporción 1:1 con el TBT, para evitar la formación de precipitado en el sistema debido a la alta velocidad de hidrólisis del alcóxido (esta fue la solución base que se utilizo para obtener la muestra denominada P11). Las soluciones se dejaron en agitación por 10 min y cuando la mezcla, precursor de bario-etilenglicol y acido cítrico, se tornó totalmente transparente, se llevó el sistema a temperatura ambiente y se le adicionó lentamente la solución del precursor de titanio, sin (P10) y con acomplejante (P11), manteniendo la agitación por 30 min. A continuación, se les adicionó el hidróxido de amonio notándose que a pH 3,95, para el sistema sin acomplejante, se presentaron reacciones de hidrólisis generándose un precipitado en el seno de la solución; los sistemas se llevaron hasta pH 8 adicionándoles NH4OH a una velocidad de 0,05 mL/s. Luego, las suspensiones se calentaron a 70°C y después de 10 min el sistema sin acomplejante se tornó transparente. Una vez se garantizó la inexistencia de precipitado en los sistemas, estos se calentaron, en continua agitación, hasta alcanzar una temperatura de 140°C para favorecer las reacciones de poli-esterificación. Estas reacciones llevaron a la conformación de una resina de color negro, resina que se calcinó a 200°C, durante 24 h, obteniéndose un sólido negro que se maceró empleando un mortero de ágata.
Caracterización de los polvos cerámicos
Los polvos cerámicos obtenidos, tanto por coprecipitación como por el método Pechini, se caracterizaron utilizando análisis térmico diferencial y térmico gravitacional (ATD\ TG) para conocer los principales eventos fisicoquímicos que ocurren al someter los polvos a tratamientos térmicos; para ello se utilizó el equipo DTA-50 shimadzu con una atmósfera de aire seco, a un flujo de 71 L/min, y a una velocidad de calentamiento de 10°C/min. Para determinar los grupos funcionales presentes en los polvos cerámicos sintetizados se utilizó Espectroscopia Infrarroja (FTIR); el equipo utilizado para obtener los espectros IR fue el espectrofotómetro Nicolet Modelo IR200. Para conocer las fases cristalinas presentes en los polvos cerámicos de interés, con y sin tratamiento térmico, se empleó difracción de rayos X (DRX); el equipo empleado para tal fin fue el difractómetro marca Philips PW1710, utilizando la radiación Kα del Cu (λ=1,54Å), en un rango de barrido en 2θ entre 10° y 70° y a una velocidad de 0,04°s-1.
Por último, se utilizó el Microscopio Electrónico de Transmisión (MET), Jeol JEM-1200 EX, para determinar la morfología y el tamaño de partícula de los polvos cerámicos sintetizados.
Resultados y discusión
Valoración potenciométrica
La curva de valoración potenciométrica de la figura 1 se obtuvo para una disolución 0,5N de HNO3 y 0,06M de Ba(CH3COO)2, al adicionarle el precipitante (NH4OH). En ella se presentan 3 regiones bien definidas si se considera la variación de la pendiente de la curva. Como se observa, la región 1 presenta poca variación del sistema lo que indica un alto consumo de OH-suministrado por el NH4OH. Por otro lado, las regiones 2 y 3 muestran un cambio más significativo en los valores del pH. La curva de valoración potenciométrica no solo sirve para identificar las etapas del proceso sino que, además, se utiliza como medio de control del método de síntesis. En la solución, al adicionar el HNO3, ocurre la siguiente reacción:
Al agregar el acetato de bario a la suspensión de titanio se puede favorecer la formación de nitrato de barrio y acido acético tal como se indica en la siguiente reacción:
reacciones que ocurren, principalmente, por el intercambio de los ligandos CH3COO- y NO3-.
En la región 1, figura 1, la variación del pH no es muy notoria y debe corresponder, principalmente, a la neutralización del ácido por la base débil adicionada, produciéndose nitrato de amonio a través de la reacción (3):
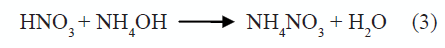
Entre pH 1,5 y 4,5, los posibles compuestos presentes en el sistema, como resultado de las reacciones de neutralización e intercambio de ligandos podrían ser: Ba(NO3)(OH)-, Ba- CH3COO-OH, NH4CH3COO asi como Ba(NO3)2, CH3COOH y NH4NO3. Finalmente, entre pH 4,5 y 9, se deben formar compuestos que son estables a estas condiciones del sistema.
Por otro lado, dado que el catión Ba es grande y tiene una carga de 2+, las reacciones de hidrólisis y condensación de este ión no serían relevantes en la disolución y solo se formarían pares iónicos [14].
Análisis térmico
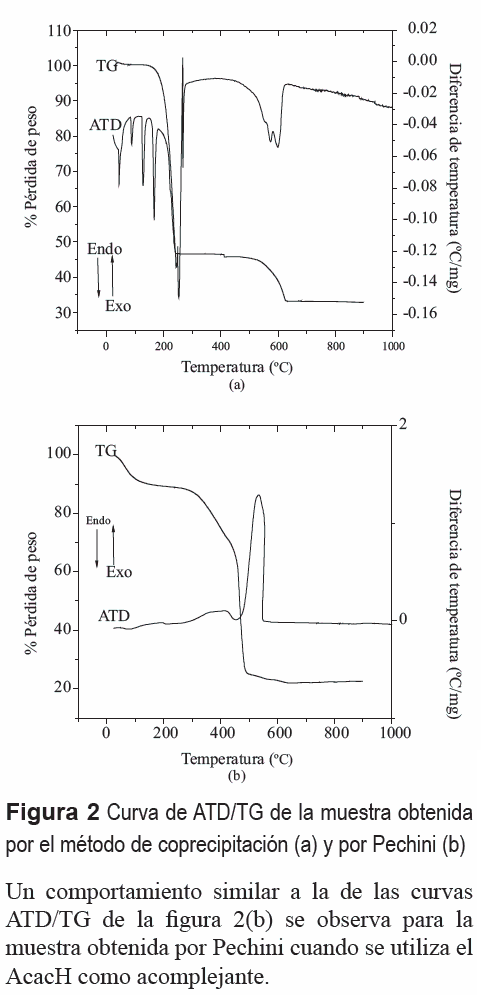
La figura 2 presenta las curvas de ATD/TG correspondientes a muestras sintetizadas por los métodos de coprecipitación a pH 9, figura 2(a), y Pechini, figura 2(b). Las curvas ATD/TG de la figura 2(a) indican que al realizar el tratamiento térmico se presentan picos endotérmicos entre 50 y 200°C, curva de ATD figura 2(a), deben corresponder a la pérdida de agua, tanto adsorbida como de cristalización, así como a la volatilización del amonio presente en la muestra (pico a 200°C). Los picos endotérmicos, entre 200 y 280°C, deben corresponder al proceso de fundido del NH4NO3 y su posteriormente volatilización, tal como lo indica la gran pérdida de peso que presenta la curva TG de la muestra alrededor de esta temperatura. Los dos picos endotérmicos alrededor de 600°C, curva ATD de la figura 2(a), deben corresponder a la descomposición del Ba(NO3)2 y a la reacción del Ba2+ con el Ti4+ para producir el titanato de bario; es de esperar, por tanto, que por encima de los 600°C se forme el BaTiO3. La volatilización del nitrato se evidencia por la pérdida de peso que experimenta la muestra en este rango de temperatura (curva TG de la figura 2(a)).
Las curvas de ATD/TG para la muestra obtenida por el método Pechini se indican en la figura 2(b). La curva TG muestra que, hasta ~100°C, se presenta una pérdida de masa que se puede asociar al desprendimiento de agua. Una gran pérdida de masa ocurre entre 250 y 500°C, curva TG de la figura 2(b), que se puede asociar, principalmente, a la oxidación de la fase orgánica presente en ella, con el desprendimiento de CO2; inicialmente, entre 250 y ~ 400°C, se debería formar el oxicarbonato de Ba y Ti tal como lo indica la literatura [15], y finalmente se produciría la combustión completa de la fase orgánica. El pico exotérmico entre 450 y 550°C (curva ATD de la figura 2(b)) estaría asociado a la oxidación de la fase orgánica presente en la muestra y a la cristalización del titanato de bario tal como lo indican los resultados de DRX que se mencionan más adelante; es de esperar que por encima de los ~600°C la muestra presente al titanato de bario como principal fase cristalina.
Un comportamiento similar a la de las curvas ATD/TG de la figura 2(b) se observa para la muestra obtenida por Pechini cuando se utiliza el AcacH como acomplejante.
Efecto de la temperatura sobre la fase sólida obtenida por coprecipitación
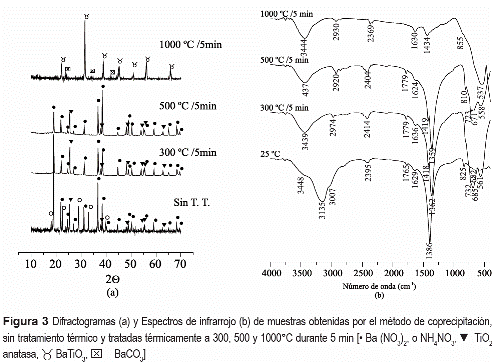
En la figura 3(a) se muestran los difractogramas de rayos x correspondientes a la muestra sólida del sistema bario-titanio obtenida por coprecipitación, a pH 9, y a muestras que fueron tratadas térmicamente a diferentes temperaturas. Estos difractogramas indican que las principales fases cristalinas presentes en las muestras son: Ba(NO3)2 (PDF 76-1376), NH4NO3 (PDF 83-0524), TiO2 anatasa (PDF 84-1286), tanto para la muestra sin tratamiento térmico como para las tratadas a 300 y 500°C por 5 min; el nitrato de bario y el TiO2, fase anatasa, no aparecen a altas temperaturas. Este resultado reitera lo que indicó el análisis térmico de estas muestras, figura 2(a), donde la volatilización del nitrato ocurrió entre los 500 y 600°C, acompañada de la descomposición del nitrato de amonio. La muestra tratada a 1000 °C, por 5 min, presenta como fase cristalina mayoritaria el BaTiO3 (PDF 75-0212), con presencia de BaCO3 tipo Witherite (PDF 71-2394) en pequeña proporción.
La figura 3(b) muestra los espectros IR de sólidos del sistema bario-titanio obtenidos por coprecipitación a pH 9, y que fueron sometidos a diferentes tratamientos térmicos. Se nota que entre 300 y 500°C la banda a 1386 cm-1 se divide en dos, ubicadas a 1362 y 1418 cm-1 las cuales corresponden a los dos modos de tensión de un complejo de carbonato unidentado [16]. La principal característica de estos espectros es la banda intensa entre 558 y 685 cm-1 que se pueden asociar a las vibraciones de tensión del octaedro [TiO6] [17]. Por otro lado, en el espectro de la muestra tratada a 1000 °C se observa una banda intensa centrada en 537 cm-1 que es característica del BaTiO3 [17].
Efecto de la temperatura y la presencia del acomplejante en el método pechini
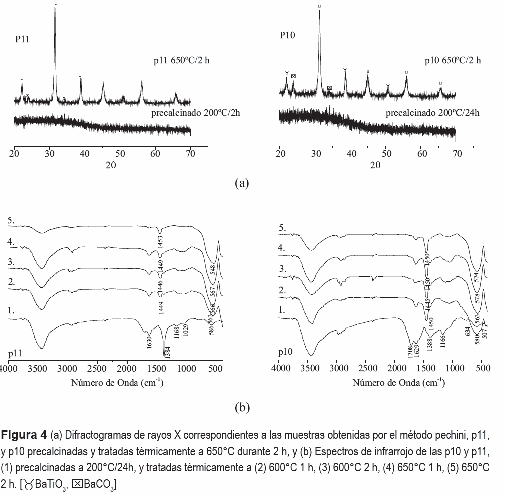
Para identificar las fases cristalinas presentes en las muestras obtenidas por el método Pechini, con y sin acomplejante, se utilizó la técnica de difracción de rayos X (DRX). Considerando las curvas de ATD/TG de la muestra obtenida por el método de pechini, figura 2(b), la oxidación completa de la fase orgánica se finaliza a los 600°C, temperatura a la cual se debe tener titanato de bario cristalizado en la muestra. Por tanto, como era de esperar, los difractogramas de la figura 4(a) muestran que los sólidos pre- calcinados son totalmente amorfos, mientras que la muestra tratada a 650°C, durante 2 h, está completamente cristalizada y el BaTiO3, fase cúbica, es la principal fase cristalina, con algunas impurezas de BaCO3.
Para evaluar la evolución de los grupos funcionales en las muestras, y establecer el tratamiento térmico más adecuado para obtener el titanato de bario utilizando el método Pechini, se tomó la temperatura de 600°C como base ya que, de acuerdo al ATD/TG figura 2(b), es a esta temperatura que se oxida completamente la fase orgánica. Para realizar este estudio se evaluaron diferentes tiempos de tratamiento térmico a 650 °C, para la muestra con acomplejante (P11), tal como lo indican los espectros de infrarrojo de la figura 4(b). La banda más importante de estos espectros IR es la ubicada alrededor de 560-550 cm-1 que es característica del BaTiO3. La banda centrada en 1450 cm-1 corresponde a un complejo de carbonato [16].
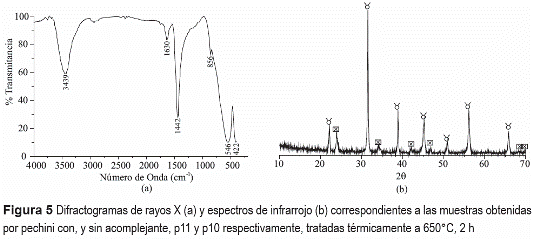
Los difractogramas de rayos X de las muestras tratadas a 650°C, durante 2 horas, se ilustran en la figura 5(a). La principal fase cristalina presente, en ambas muestras, es el BaTiO3 fase cúbica (PDF 75-0212) y existe, además, BaCO3 tipo Witherite (PDF 71-2394). El difractograma de la muestra sin acomplejante (P10) presenta una mayor cantidad de carbonato de bario si se compara con la muestra con acomplejante (P11). Este resultado reitera la tendencia que tiene el bario a formar compuestos con el carbonato [9, 10, 13]. En los espectros de IR correspondientes a estas muestras, figura 5(b), se aprecian las bandas a 1454 cm-1 asociadas al grupo carbonato [16]. El espectro infrarrojo de la muestra P10, figura 5(b), indica una mayor presencia de carbonato que la muestra P11, condición reiterada por los difractogramas de rayos X de la figura 5(a). Las bandas más intensas a bajo número de onda, 548 y 574 cm-1, son características del BaTiO3 [17].
Disminución del carbonato
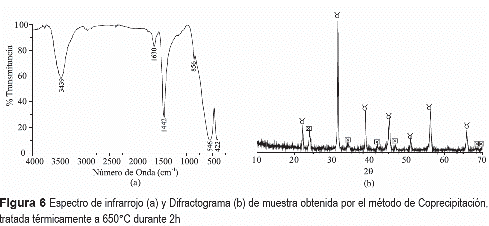
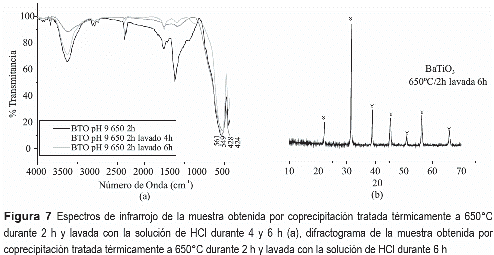
Teniendo en cuenta los resultados de ATD/ TG de la muestra obtenida por el método de coprecipitación, figura 2(b), se decidió tratar una muestra a 650°C por 2 h para conocer qué fases cristalinas estarían presentes en ella, ya que se ha propuesto que por encima de 600°C debería existir titanato de bario. En su espectro de IR, figura 6(a), se aprecian las bandas a 1442 y 856 cm-1, asociadas al grupo carbonato [16], y la más intensa a 546 cm-1 que corresponde al BaTiO3 [17]. La principal fase cristalina presente en la muestra tratada térmicamente a 650°C por 2 h es el BaTiO3 (PDF 75-0212), figura 6(b), pero también existe BaCO3 en fase Witherite (PDF 71-2394). El BaCO3 presente en esta muestra fue fácilmente removido lavando el sólido con ácido clorhídrico, en una solución 6M durante 6 h, dejándolo envejecer en suspensión durante 4 o 6 horas y filtrando a continuación el sistema; el sólido se redispersó en agua y se dejó allí durante 12 horas, se filtró y se secó a 40°C durante 12 h para eliminar totalmente el solvente. La figura 7(a) muestra cómo evolucionan los grupos funcionales de la muestra obtenida por coprecipitación, tratada térmicamente a 650°C durante 2h, al ser lavada durante 4 y 6 h. La figura 7(b) muestra el difractograma del sólido lavado con una solución de HCl, durante 6 h, e indica que la única fase cristalina presente en la muestra era el BaTiO3 totalmente libre de impurezas.
Morfología y tamaño de partícula de los polvos cerámicos obtenidos
En la figura 8 se muestran las fotografías obtenidas con MET del polvo cerámico sintetizado por los métodos de coprecipitación y Pechini. Como se puede observar, para temperaturas menores a 500 °C, la muestra obtenida por coprecipitación, figuras 8(a) y 8(b), presenta partículas con forma esferoidal y tamaño nanométrico (<200 nm); por encima de los 500 °C las partículas nanométricas presentan una morfología tipo tablón y gran cantidad de agregados duros, figura 8(c), lo que indica que ocurre un proceso de sinterización entre ellas.
Los polvos obtenidos por el método Pechini, y que fueron tratados a 650°C durante 2 h, presentaron un tamaño de partícula menor a la de los polvos sintetizados por coprecipitación, figuras 8(d) y 8(b), evidenciándose, además, una adecuada dispersión.
Conclusiones
Con base en los resultados obtenidos en este trabajo, se puede concluir lo siguiente:
Las rutas químicas utilizadas, coprecipitación y pechini, permitieron obtener como única fase cristalina BaTiO3 cúbico a bajas temperaturas, 650°C para ambos casos; adicionando una etapa de tratamiento químico de la muestra con una solución diluida de HCl.
Los procesos son reproducibles y garantizan la obtención de las características predeterminadas del BaTiO3.
Las partículas de BaTiO3 cúbico sintetizado, utilizando los métodos químicos indicados en el presente trabajo, presentan un tamaño de partícula nanométrico (< 200 nm) y son altamente reactivos. El polvo cerámico de BaTiO3 sintetizado por el método pechini presenta una mayor dispersión de sus partículas.
Agradecimientos
Este trabajo fue financiado por el proyecto Fundación Banco de la República numero 2348. Agradecimiento especial a la VRI de la Universidad del Cauca por la administración de los recursos del proyecto.
Referencias
1. J. Shirane. Ferroelectric crystals. Ed. Dover Publications Inc. New York. 1993. pp. 108-215. [ Links ]
2. M. H. Frey, D. A. Payne. "Grain-size effect on structure and phase transformations for barium titanate". The American Physical Society, physical review. Vol. 54.1996. pp. 3158-3168. [ Links ]
3. A. J. Moulson, J. M. Herbert, Electroceramics: materials, properties and applications. 2nd ed. Ed. John Wiley & Sons Ltda. West Sussex-England. 2003. pp. 1-167.
4. L. M. Levinson. Electronic ceramics: properties, devices and applications. Ed. Marcel Dekker Inc. New York. 1988. pp. 191-274. [ Links ]
5. R. C. Buchanan. Ceramic materials for electronics. 3ra. ed. Ed. Marcel Dekker Inc. New York. 2004. pp. 141-206. [ Links ]
6. K. Ch. Kao. Dielectric phenomena in solids. Ed. Elsevier Academic Press. San Diego. 2004. pp. 41-112. [ Links ]
7. G. Cao. Nanostructures & Nanomaterials: synthesis, properties and applications. Ed. Imperial College Press. London. 2004. pp. 126-357. [ Links ]
8. G. Pfaff. "Sol-gel synthesis of barium titanate powders of various compositions". J. Mater. Chem. Vol. 2. 1992. pp. 591-594. [ Links ]
9. K. S. Mazdiyasni. "Fine Particle Perovskite Procesing". Am. Ceramic. Soc. Bull. Vol. 63. 1984. pp. 591-94. [ Links ]
10. W. S. Clabauhg, E. M. Swiggard, R. Gilchrist. "Preparation of Barium Titanyl Oxalate Tetrahidrate for Conversion to Barium Titanate High Purity". J. Res. Natl. Bur. Stand. Vol. 56. 1956. pp. 289-291. [ Links ]
11. H. Xu, L. Gao, J. Guo. "Preparation and characterizations of tetragonal barium titanate powders by hydrothermal method". J. Euro. Ceram. Soc. Vol. 22. 2002. pp.1163-1170. [ Links ]
12. S. S. Flaschen. "An aqueous synthesis of barium titanate". J. Am. Chem. Soc. Vol. 77. 1955. pp. 6194. [ Links ]
13. V. Vinothini, P. Singh, M. Balasubramanian. "Synthesis of barium titanate nanopowder using polymeric precursor method". Ceram Int. Vol. 32. 2006. pp. 99-103. [ Links ]
14. J. Jolivet. Metal oxide chemistry and synthesis. Ed. Jhon. Wiley & Sons, New York. 2000. pp.12. [ Links ]
15. J. F. Fernández, P. Duran, C. Moure. "Reaction Kinetics in the BaTiO3 Synthesis: influence of the TiO crystalline structure and morphology". Ceramics today-tomorrow's. Ed. Elsevier Science Publishers. 1991. pp. 1973-1982. [ Links ]
16. K. Nakamoto. Infrared and Raman spectra of inorganic and coordination compounds. part B. 5ta .ed. Ed. Wiley-interscience. New Jersey. 1997. pp. 300. [ Links ]
17. P. Pradeep, H. R. Subas. "Low-temperature synthesis and processing of electronic materials in the BaO-TiO2 system". Review. J. Mater. Sci. Vol. 25. 1990. pp. 1169-1183. [ Links ]
(Recibido el 4 de Marzo de 2009. Aceptado el 3 de septiembre de 2010)
*Autor de correspondencia: teléfono: + 57 + 4 + 219 66 14, fax: + 57 + 4 + 219 65 65, correo electrónico: fmondra@udea.edu.co (F. Mondragón)