Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Facultad de Ingeniería Universidad de Antioquia
versão impressa ISSN 0120-6230versão On-line ISSN 2422-2844
Rev.fac.ing.univ. Antioquia n.56 Medellín out./dez. 2010
Estimación del balance de Nitrógeno en un humedal construido subsuperficial plantado con Heliconia psittacorum para el tratamiento de aguas residuales domésticas
Nitrogen balance estimation in a subsurface flow constructed wetland planted with Heliconia psittacorum for domestic wastewater treatment
Harry Gutiérrez Mosquera1* , Miguel Ricardo Peña Varón2, Alexander Aponte Reyes2
1Facultad de Ciencias de la Tierra y del Ambiente - Tecnológico de Antioquia, Calle 78B N.° 72A - 220 Medellín - Colombia
2Instituto Cinara - Universidad del Valle, Calle 13 N.° 100-00, Cali, Colombia
Resumen
La influencia de la vegetación (Heliconia psittacorum) y el principal mecanismo de eliminación de nitrógeno en un humedal construido de flujo subsuperficial (HFSS) fueron estudiados por la aplicación de un balance de N. Para ésto se construyeron seis unidades de HFSS a escala de laboratorio (microcosmos) que incluyeron lechos de grava plantados con Heliconia sp. y sin plantar (controles), sometidos a una carga de 5,68 g N m-2 d-1 y un tiempo nominal de retención de 1,0 día. Los resultados indicaron una mayor eficiencia de eliminación de la carga de N en los microcosmos plantados (29,6%) comparado con los sin plantar (24,3%). El balance de masas indicó que el principal mecanismo de eliminación de N fue la nitrificación/desnitrificación al eliminar el 66,7 y 69,7% del N eliminado en los microcosmos plantados y sin plantar, respectivamente. La acumulación en el medio de soporte eliminó el 21,4 y 22,0% del N, respectivamente. Mientras que una pequeña asimilación del N por la Heliconia sp. fue establecida (0,6%). Pese a la baja asimilación directa de N por parte de la planta, fue evidente que éstas contribuyeron indirectamente a la eliminación de N en los microcosmos plantados vía la translocación de oxígeno atmosférico y el ensamblaje de una comunidad microbiana más diversa en la rizósfera.
Palabras clave: Precursor polimérico, coprecipitación, BaTiO3, fase cúbica.
Abstract
The influence of vegetation (Heliconia psittacorum) and the main nitrogen elimination mechanism were studied via the mass balance method in a subsurface flow constructed wetland (HFSS). Six HFSS lab-scale units (microcosms) were built and filled out vertically with gravel and coarse sand. Three of the lab-scale units were planted with Heliconia sp., and the remaining three were left unplanted and run as control units. All of the experimental units were operated with an organic surface load of 5.68 g N m-2 d-1, and a theoretical hydraulic retention time (HRT) of 1.0 day. Results showed a higher N load removal efficiency in the planted units (29.6%) compared to the unplanted ones (24.3%). The nitrogen balance showed that coupled nitrification/denitrification was the main N removal mechanism, since its contribution to the overall removal was 66.7 and 69.7% in planted and unplanted units, respectively. Meanwhile, N accumulation in the support media removed 21.4 and 22.0 % in planted and unplanted units, respectively. N assimilation via physiological activity of Heliconia sp. was responsible for only 0.6 % of the total removal. Despite this low removal rate, it was evident that plants contributed indirectly to N removal in the planted units via atmospheric oxygen translocation and the assemblage of a more diverse microbial community in the rizospheric habitat.
Keywords: Constructed wetland, denitrification; Heliconia psittacorum, nitrogen balance, nitrogen removal, plant uptake.
Introducción
La descarga de aguas residuales sin previo tratamiento produce en los cuerpos de aguas receptores un incremento de nutrientes como el nitrógeno y el fósforo, y a la vez, problemas ambientales como la eutroficación, disminución de oxígeno en el agua y toxicidad para los peces, entre otros [1]. Una tecnología para el tratamiento de aguas residuales lo constituyen los sistemas de humedales construidos de flujo subsuperficial (HFSS), los cuales simulan procesos de conversión de materia orgánica y nutrientes que ocurren en los sistemas de humedales naturales, en los que microorganismos adheridos al medio de soporte y plantas actúan como agentes activos en el tratamiento [2]. Estos sistemas se han convertido en una solución de gran proyección para el tratamiento de aguas residuales.
Razón de lo anterior es que un amplio número de investigaciones [3-6] reportan la aplicación de HFSS para el tratamiento de aguas residuales, siendo uno de los aspectos más importantes la eliminación de nutrientes como el N. Como resultado de la aplicación de estos sistemas, las plantas más utilizadas han sido el Cáñamo (Phragmites sp.), el Papiro (Scirpus sp.) y la Tifa (Typha sp.), las cuales son de amplia distribución biogeográfica o cosmopolita. Recientes investigaciones [7, 8], evidencian una tendencia en la utilización de plantas ornamentales como la Calla lily (Zantedeschia aethiopica), Canna (Canna generalis), Heliconia (Heliconia psittacorum) en los sistemas de HFSS, las cuales, además de los beneficios ambientales asociados al tratamiento de las aguas residuales, generan eficiencias sostenidas de eliminación de nutrientes al cosechar su biomasa aérea [9], incrementan el valor estético y brindan beneficios económicos adicionales al cosecharse y comercializarse su infloración.
Las investigaciones realizadas sobre humedales construidos (CWs) han acumulado información sobre la evaluación cuantitativa de la eficiencia de eliminación de N bajo diferentes condiciones experimentales, sin embargo pocos estudios [10-12], han identificado la importancia de los mecanismos de eliminación de N (desnitrificación, asimilación por la planta, acumulación en el medio de soporte) bajo las mismas condiciones experimentales, y en condiciones tropicales utilizando especies ornamentales.
En el trópico las plantas crecen rápidamente durante todo el año y la degradación de los contaminantes se acelera [8]. Teniendo en cuenta que la Heliconiapsittacorum es una planta nativa del trópico americano, la asimilación directa de N por parte de ésta podría ser significativa y/o su presencia podría estimular una mayor nitrificación/desnitrificación y acumulación de N, que finalmente se traduce en una mayor eliminación de N en los sistemas de HFSS plantados con estas especies vegetales.
Para contribuir a un mayor conocimiento de estos sistemas, el propósito de este artículo es presentar los resultados de una investigación en la que se realizó un balance de nitrógeno y se evaluó la influencia de la Heliconia sp. en la eliminación del nitrógeno en un humedal construido subsuperficial de flujo horizontal.
Experimentación
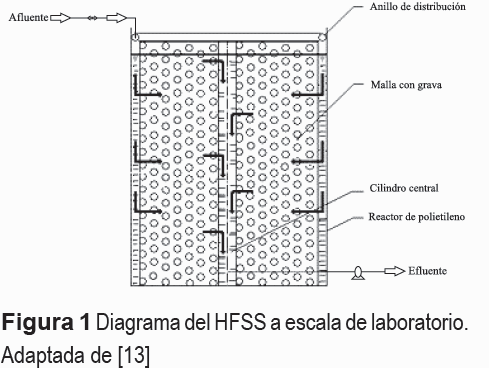
El experimento fue desarrollado en seis (6) HFSS a escala de laboratorio (microcosmos), conforme la metodología propuesta por [13], los cuales fueron ubicados en una casa malla de la Universidad del Valle, Colombia (3° 22' N, 76° 31' O). Cada uno de los microcosmos (figura 1) consistió en un cilindro de polietileno de alta densidad de 0,36 m de diámetro y una altura de 0,45 m dentro del cual se ubicó una malla de 0,32 m de diámetro y 0,40 m de alto. En el centro de la malla se ubicó un tubo de succión en PVC de 38 mm de diámetro y 0,42 m de alto, con varias perforaciones para garantizar un flujo radial horizontal. La malla fue llenada completamente con un medio de soporte inerte, carbonilla (2-5 mm de diámetro) y grava (30 Kg), esta última con un diámetro efectivo de 25-40 mm. Las alturas de las capas de carbonilla y de grava fueron de 0,08 y 0,4 m., respectivamente.
En la parte inferior del tubo de succión se ubicó un dispositivo de succión (venoclises) que permitió evacuar de manera controlada el agua residual tratada. Para garantizar el suministro del agua residual con flujo constante y controlado a los microcosmos, se utilizó un tanque de almacenamiento de agua residual sintética que estuvo integrado a un sistema por goteo a gravedad, el cual, a su vez estuvo conectado a un anillo de distribución (manguera de 9,5 mm) con perforaciones en ángulos de 90° que permitió garantizar una distribución uniforme del agua residual cruda en el biorreactor.
El experimento siguió un diseño completamente al azar, se plantaron cuatro individuos (Heliconia psittacorum) en tres de los seis microcosmos. Los individuos fueron seleccionados de acuerdo con sus características fenotípicas (e.g. número de hojas, altura de la planta, grosor del tallo) de la zona de entrada de un HFSS ubicado en Ginebra, Valle del Cauca (3° 43' N, 76° 15' O). Un grupo adicional de cuatro Heliconias sp. fue seleccionado para estimar el contenido de Nitrógeno y peso seco de las plantas inicialmente trasplantadas, el cual fue de 20,5 g N Kg-1 y 30,2 g, respectivamente. Los tres microcosmos restantes sirvieron de controles (sin plantar) para evaluar la influencia de la Heliconia sp. en la eliminación de Nitrógeno.
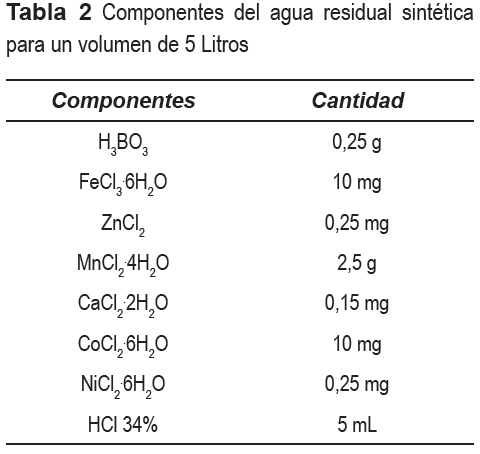
Para un mejor control del experimento, los microcosmos fueron alimentados con una solución de nutrientes (agua residual sintética) tabla 1 y 2, la cual estuvo compuesta por una solución madre que se preparó según una relación (72:20:4) de ácido Acético, Propiónico y Butanóico, respectivamente, más una fuente de amonio (NH4Cl), generando una concentración de N y DQO similar a la del efluente de la laguna anaerobia para el tratamiento de aguas residuales domésticas ubicada en Ginebra, Valle del Cauca (3° 43' N, 76° 15' O).
Para evitar las caídas bruscas de pH a la solución de nutrientes se adicionó NaHCO3 en una relación DQO:NaHCO3 de 1:0,5. Las concentraciones promedio de la DQO y NH3 resultantes de la solución de nutrientes fueron de 122 y 42 mg l-1, respectivamente.
Los microcosmos fueron llenados con 13 L de la solución de nutrientes más inoculo biológico (microorganismos) del efluente de la laguna anaerobia de Ginebra, en una proporción de 1,4 L por cada 5 L de solución de nutrientes. Para facilitar el crecimiento de biofilm en el medio de soporte, los microcosmos fueron operados durante 15 días como reactores batch, renovando la solución de nutrientes cada tres días. Posteriormente, se previó un tiempo de aclimatación de 30 días para que los microcosmos alcanzaran las condiciones de estado estacionario, operando con flujo semi-continuo durante seis (6) horas al día con una carga hidráulica (Q) de 0,05 m3 d-1, que equivale a un tiempo teórico de retención hidráulico (TRH) de 1,0 día. Los microcosmos fueron operados desde abril de 2008 hasta diciembre de 2008.
Análisis fisicoquímico del agua residual
Muestras compuestas de agua residual fueron recolectadas y analizadas semanalmente para los parámetros fisicoquímicos DQO, NTK, NH3, NO3- pH, de acuerdo con la metodología descrita por [14]. La eficiencia de eliminación de los parámetros fisicoquímicos fue calculada de acuerdo con la expresión descrita por [1].
Análisis de N en tejido vegetal y en el medio de soporte
Al finalizar el periodo experimental los microcosmos fueron desmantelados y se separó la grava de los rizomas de la Heliconia sp. La biomasa de la Heliconia sp. se dividió en biomasa aérea (tallos y hojas) y subterránea (rizomas y raíces). Las muestras de biomasa fueron secadas a 72 °C durante 48 horas hasta alcanzar un peso constante. Las muestras fueron trituradas, homogenizada, y una sub-muestra fue seleccionada para determinar el contenido de N mediante la técnica de micro-Kjeldhal [14].
A profundidades de 0-0,15 m y 0,15 m-0,4 m. se extrajeron aproximadamente 500 g de grava en cada uno de los estratos de los microcosmos. Las muestras fueron trituradas y homogenizadas, y se tomó una sub-muestra para determinar el contenido de N por digestión de acuerdo con el método de micro-Kjeldhal. Esta masa de grava fue utilizada para garantizar una mayor representatividad de los resultados obtenidos. Las concentraciones de N en la planta y en el lecho de soporte fueron determinadas en el Laboratorio de Servicios Analíticos del Centro Internacional de Agricultura Tropical (CIAT), ubicado en Palmira -Colombia.
Tasa de potencial de desnitrificación
La tasa de desnitrificación fue determinada utilizando el método de inhibición con acetileno (C2H2) propuesto por [15], el cual se fundamenta en el principio de que el C2H2 bloquea la reducción enzimática de N2O a N2, así que el N2O acumulado puede ser medido en lugar del N2. Muestras de 25 g de grava fueron tomadas a las profundidades antes mencionadas, y adicionadas en frascos de incubación de 600 mL. A cada frasco se le agregó 50 mL de agua residual sintética cruda, la cual fue suficiente para garantizar una completa saturación de la grava. Después de ésta adición, los frascos fueron sellados con tapones de gomas, y la micro-atmósfera de aire de cada frasco fue bombeada con N2 durante 2 minutos para crear condiciones anaerobias. El 30% del volumen de la micro-atmósfera de cada frasco fue reemplazado por C2H2 utilizando una jeringa de 30 ml. Posteriormente, los frascos fueron incubados por 12 horas en la oscuridad, a una temperatura de 25 °C. Muestras de 5 ml de aire fueron tomadas de la micro-atmósfera a intervalos de 2 horas, y adicionadas en viales de 10 ml.
Las mediciones de las concentraciones (µl l-1) de oxido nitroso (N2O) en la micro-atmósfera de aire fueron realizadas en el Laboratorio de Isotopos Estables del CIAT, Colombia, utilizando un Cromatógrafo de gases (Shimadzu GC- 14A) equipado con un detector de captura de electrones (ECD) y una columna Porapak Q. Las temperaturas del inyector, el horno y el detector fueron 80, 70 y 320 °C, respectivamente. La tasa de desnitrificación fue calculada de la zona más pendiente de la curva (entre 2 y 6 horas), en la cual la producción de N2O fue lineal en el tiempo. Ésto indicó que dos (2) horas fueron suficientes para permitir una completa difusión del acetileno (C2H2) en la grava. Finalmente, el flujo total (Flux, g N m-2 h-1) de N2-N fue calculado de acuerdo con la ecuación (1).
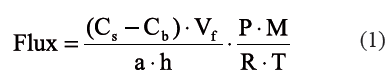
Donde, Cs y Cb son las concentraciones iniciales y finales de N2O determinadas por GC (µl l-1); Vf es el volumen de la microatmosfera de aire al interior de los frascos de incubación (l); a es el área superficial del núcleo de grava (m2); h representa el número de horas entre muestreos; P es la presión en los frascos de incubación, equivalente a 1 atm; M es el peso molecular del N2O (44,01 g/mol); R es la constante de los gases ideales (0,082 atm-l mol-1K-1); T es la temperatura en el frasco de incubación (K).
Balance de nitrógeno
El modelo utilizado para expresar el balance de N en los microcosmos se describe con la ecuación 2.
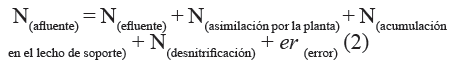
Análisis estadístico de resultados
Un análisis de varianza ANOVA se aplicó para comparar las diferencias entre los promedios de los parámetros fisicoquímicos en los microcosmos plantados y sin plantar, previa verificación de los supuestos de normalidad con la prueba de Kolmogorov-Smirnov. Todos los datos fueron tasas de desnitrificación y acumulación de N en el medio de soporte de los tratamientos plantados utilizado para todos los casos fue de 0,05.
Resultados
Asimilación de nitrógeno por la Heliconia psittacorum
La mayor concentración de N en la biomasa aérea fue encontrada en las hojas (26,5 g N Kg-1 DW), mientras que la concentración en el tallo fue de 12,04 g N Kg-1 DW. La concentración de N en la biomasa subterránea fue de 24,2 g N Kg-1 DW. La mayor producción de biomasa se presentó en el tejido aéreo de la Heliconia sp. (tabla 3), que equivale al 54% de la biomasa producida por la planta.
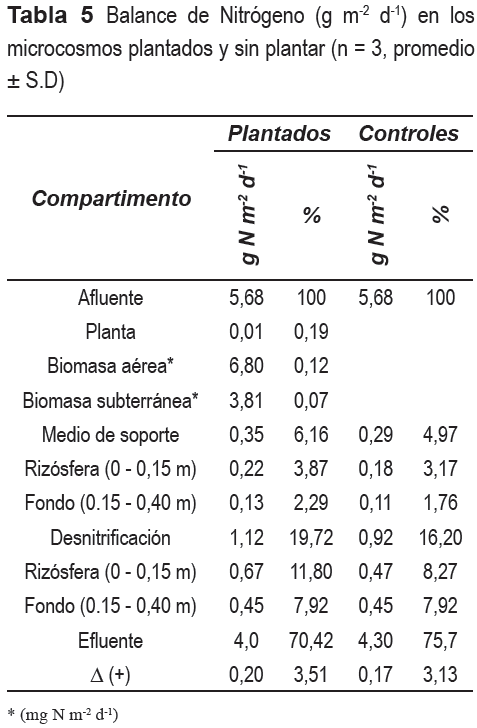
Por multiplicación de las concentraciones de N en la planta y las tasas de crecimiento de la biomasa seca, iniciales y finales, se estimó que 6,8 mg N m-2 d-1 fue eliminado por la biomasa aérea de la Heliconia sp., el cual equivale al 64% del N asimilado por la planta. De acuerdo con la tabla 5, la Heliconia sp. asimiló el 0,2% de carga de N (5.68 g N m-2 d-1) afluente.
Parámetros fisicoquímicos en el agua
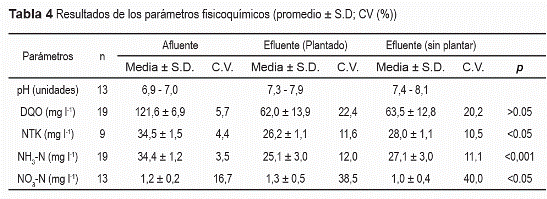
El pH en el afluente fue neutro, del mismo modo se encontró que los valores de pH registrados en las unidades plantadas fueron menores a lo largo de todo el periodo experimental, comparados con los valores de pH registrados en las unidades controles (tabla 4). Los microcosmos plantados y sin plantar eliminaron el 53,6% (10,5 g m-2 d-1) y 52,4% (10,2 g m-2 d-1) de la carga afluente de DQO (19,5 g m-2 d-1), respectivamente. Sin embargo, las diferencias en la eliminación de la DQO no fueron significativas (P > 0,05). Las concentraciones promedio del NTK, NH3-N, NO3-N, DQO afluentes y efluentes de los microcosmos plantados y sin plantar son mostradas en la tabla 4. Una significativa (P < 0,05) reducción de las concentraciones de NH3 fue establecida en los microcosmos plantados, respecto a los microcosmos sin plantar. Las cargas de NH3-N afluentes y efluentes en los microcosmos plantados y sin plantar fueron de de 5,5; 3,7 y 4,0 g m-2 d-1, respectivamente. Lo cual indica que las eficiencias de eliminación de NH3-N en los microcosmos plantados y sin plantar fueron del 33,6 y 27,6%, respectivamente. La carga de nitratos afluente fue de 0,18 g m-2 d-1 de NO3-N. Una significativa (P < 0.05) mayor carga efluente de NO3- fue establecida en los microcosmos plantados (0,19 g m-2 d-1) comparado con los microcosmos sin plantar (0,15 g m-2 d-1), lo cual se traduce en una eficiencia negativa (-3,4%) de eliminación de NO3- en los microcosmos plantados, y una eficiencia positiva (16,8%) de eliminación en los microcosmos sin plantar (tabla 4). Las concentraciones de NTK y NH3 en el afluente fueron iguales (tabla 4) debido a la única fuente N (NH4Cl) utilizada en el afluente. Los microcosmos plantados y sin plantar presentaron eficiencias de eliminación de NTK muy similares a las eficiencias de NH3 obtenidas (P < 0.05). Bajas eficiencias de eliminación de la carga de 5,7 g N m-2 d-1 afluente fueron establecidas en los microcosmos plantados y controles, en los efluentes de éstos se registraron cargas de 4,0 y 4,3 g N m-2 d-1, que equivalen a eficiencias de eliminación del 29,6 y 24,3%, respectivamente.
Eliminación de N en el medio de soporte
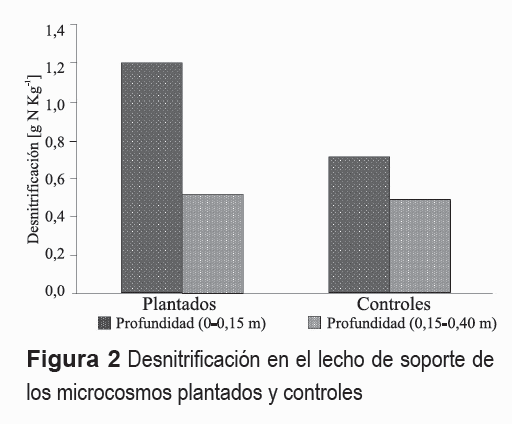
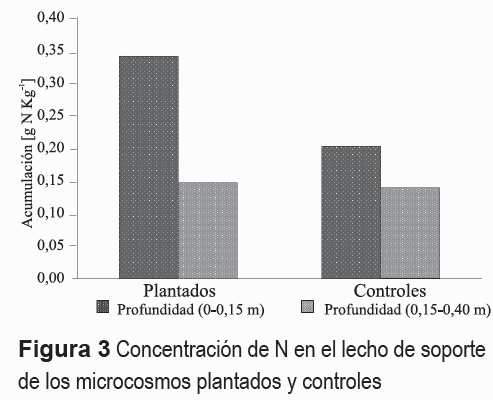
Las tasas y porcentajes de eliminación de N por desnitrificación y acumulación de N en el lecho de soporte se presentan en la tabla 5. La cual indica una mayor tasa de desnitrificación en los microcosmos plantados respecto a los controles. Sin embargo, ésta no fue significativa (P = 0,35). Del mismo modo, se encontró una mayor ocurrencia de la desnitrificación en los estratos superiores (0-0,15 m) de los microcosmos plantados y controles, respecto a los estratos inferiores (0,15-0,40 m) (figura 2), la cual no fue significativa (P = 0,20). Resultados similares fueron establecidos para la acumulación de N en el medio de soporte (figura 3).
Balance de nitrógeno
De acuerdo con la tabla 5. El principal mecanismo de eliminación de N fue la desnitrificación, la cual transformó el 66,7% y 69,7% del N eliminado en los microcosmosplantadosycontroles, respectivamente. En segundo lugar estuvo la acumulación de N en el lecho de soporte, la cual eliminó el 20,8 y 21,0% del N retenido en los microcosmos plantados y controles, respectivamente. Mientras que un aporte marginal en la eliminación de N fue realizada por la planta, al eliminar solo el 0,6% del N retenido en los microcosmos plantados.
Discusión
Un incremento de la concentración inicial de N (20,5 g N/Kg DW) en el tejido de la Heliconia psittacorum fue registrada al final del experimento (21,9 g N/Kg DW). Estas concentraciones de N en la planta estuvieron acordes comparadas con el valor de 29 g N/Kg DW reportado por [16]. Los resultados también indicaron que el 64% del N asimilado fue acumulado en la biomasa aérea de la Heliconia sp. Esta capacidad de acumulación de N es deseable en las plantas utilizadas en CWs, la cual, acompañada de actividades periódicas de podas pueden generar eficiencias sostenidas de eliminación de N, y a su vez, beneficios económicos al comercializarse la biomasa aérea de la planta, especialmente en las especies ornamentales [7].
Sin embargo, la tasa de asimilación de 0,01 g N m-2 d-1 obtenida en este estudio fue similar a la reportada por [17]. Sin embargo, fue baja comparada con los estudios de [2,8,18], lo anterior fue asociado a la baja tasa de crecimiento de la biomasa de la Heliconia sp. (tabla 3), la cual, también resultó baja comparada con los resultados reportados en otros estudios. Tasas de asimilación de 0,15 g N m-2 d-1 y tasas de crecimiento de 11,0 g DW m-2 d-1 obtenidas en un CW de flujo vertical operado bajo condiciones tropicales y plantado con Typha sp. fueron reportadas por [19]. En adición, [8] estudiando la Canna generalis y la Heliconia psittacorum en HFSS piloto operado bajo condiciones tropicales reportaron tasas de crecimiento en la biomasa aérea de 8,50 y 1,51 g DW m-2 d-1 y tasas de asimilación de 0,23 y 0,03 g N m-2 d-1, respectivamente.
De acuerdo con [20], no es recomendable comparar los resultados del crecimiento de las plantas obtenidos bajo condiciones diferentes de nutrientes en distintos estudios. En este estudio, los resultados de las tasas de crecimiento y asimilación de N se explican por las condiciones experimentales, sustrato, relación N/P, las especie de plantas, la limitada radiación solar incidente en la casa malla y las condiciones de hacinamiento de las plantas en los sistemas de microcosmos.
Los valores de Eh, menores a -130 mV (Datos no publicados) indicaron la prevalencia de condiciones anóxicas en el lecho de los microcosmos. Sin embargo, pese a que no se encontró diferencias significativas (P = 0.081) en los valores de Eh, los mayores valores de Eh (-149 mV) en los microcosmos plantados, respecto al valor de Eh (-158 mV) en los controles, evidenciaron la influencia de la actividad fotosintética de la Heliconia sp., y la posterior translocación de Oxígeno por medio del aerenchyma a su sistema de raíz, lo que proporciona ambientes óxicos o microaerofílicos en la rizósfera y sus alrededores. En adición, estos ambientes permiten el desarrollo de procesos de biodegradación aerobios cuyos subproductos son el acido carbónico (H2CO3) y la producción de iones H+, este último durante la nitrificación, los cuales ayudan a explicar los menores valores de pH registrados en el efluente de los microcosmos plantados.
En esta investigación las eficiencias promedios de eliminación de la DQO fueron del 53,6 y 52,4% en los microcosmos plantados y controles, respectivamente, las cuales estuvieron por debajo de los resultados reportados en otras investigaciones [21, 22]. Estas diferencias pueden estar asociadas a los TRH bajo los cuales operan los CWs. De este modo, [8] reportan eficiencias de eliminación de la DQO del 41-80% en sistemas de HFSS operados bajo diferentes TRHs (12 horas y 4 días). En adición, [7] reportan eficiencias entre el 18 y 20% en sistemas de HFSS plantados con especies ornamentales (Zantedeschia aethiopica) y sin plantar, respectivamente, ambos expuestos a un TRH de 1,0 día. Las eficiencias de eliminación de la DQO obtenidas en esta investigación fueron altas comparadas con las reportadas por [7]. Ésto pudo estar asociado a una mayor biodegradabilidad del agua residual sintética utilizada en nuestro estudio.
Aunque la eliminación de la DQO fue mayor en los microcosmos plantados que en los sin plantar, la falta de significancia estadística en la eliminación de la DQO indicó que el principal mecanismo de eliminación de la DQO fue la actividad de los microorganismos adheridos al medio de soporte, sugiriendo además, que la presencia de la Heliconia sp. no jugó un papel determinante en la eliminación de la DQO, y solo se limitó a proveer un área superficial adicional para el crecimiento microbiano adherido, [23, 24] también reportan poca diferencia en la eliminación de la DQO y la DBO entre CWs plantados y sin plantar. En contraste, [25] establecen una eliminación significativa de la DQO y la DBO en CWs plantados (Typha latifolia) comparado con los CWs sin plantar. Estas diferencias sugieren que las plantas pueden jugar un papel significativo en la eliminación de la DQO y DBO, pero también que el efecto de la planta es usualmente pequeño y depende de la especie de planta sembradas [8].
La eliminación de N bajo las condiciones de este estudio fue relativamente baja, obteniéndose eficiencias de eliminación entre el 24,3 y 29,6%. Lo anterior, es probable que haya ocurrido porque los nutrientes como el N requieren mayores TRHs para su eliminación [25], la baja eliminación de N por asimilación de la planta y la baja capacidad de adsorción del amonio en el lecho de soporte [10]. Las diferencias en las eficiencias de eliminación de N entre los microcosmos plantados y sin plantar pueden ser debidas a que en la rizósfera aerobia de la planta la nitrificación ocurre más eficientemente, ya que el N-amoniacal es oxidado a nitratos, el cual también puede ser asimilado por la planta, o difundido en la capa reductora para ser convertido a N2O y N2 vía desnitrificación heterótrofa. El desarrollo de este proceso ha permitido que los humedales plantados superen a los humedales sin plantar en la eliminación de N [24].
De acuerdo con el balance de N el principal mecanismo de eliminación de N fue la desnitrificación, la cual ocurrió a tasas de 1,1 y 0,9 g N m-2 d-1 en los microcosmos plantados y controles, respectivamente. Lo anterior, también ha sido establecido por [26]. Los valores de desnitrificación encontrados en este estudio estuvieron acordes con los resultados reportados por [27], quienes obtuvieron una tasa de desnitrificación de 1,0 g N m-2 d-1 en HFSS plantados con Phragmites australis, en contraste, de los resultados reportados por [6, 11]. Teniendo en cuenta que la fuente y disponibilidad de carbono son factores que influencian la desnitrificación, la relativa mayor tasa de desnitrificación comparada con los estudios anteriores puede ser debida a la utilización del acidó acético como fuente de carbono, con el cual, de acuerdo con [28, 29] se obtienen mayores velocidades de desnitrificación.
En los microcosmos plantados se registró una mayor eliminación de la DQO, la cual se traduce en una mayor disponibilidad de carbono para la desnitrificación. Utilizando los coeficientes de 0,31 y 0,36 de [30], se estimó que la cantidad de C disponible para desnitrificación fue de 2,5 y 2,3 g C m-2 d-1, los cuales fueron mayores a los valores de 1,2 y 1,0 g C m-2 d-1 necesarios para la desnitrificación en los microcosmos plantados y sin plantar, respectivamente. Ésto indica que la DQO también fue eliminada por otro tipo de metabolismo microbiano.
Las mayores tasas de desnitrificación ocurridas en los microcosmos plantados pudieron verse favorecidas por unas mejores condiciones de Eh y una mayor disponibilidad de NO3- provocadas por la translocación de Oxígeno a la rizósfera por parte de la Heliconia sp. Esta afirmación puede ser confirmada con la figura 2, en la que se observa una mayor tasa de desnitrificación (0,67 g N m-2 d-1) en el estrato de lecho de grava comprendido entre los 0 y 0,15 m. (próxima a la rizósfera) donde además se encuentra la mayor cantidad y diversidad microbiana [31]. En adición, fue observada una disminución de la desnitrificación (0,45 g N m-2 d-1) en el estrato del fondo (0,15-0,40) de los microcosmos plantados. En contraste, para estas mismas profundidades los microcosmos sin plantar presentaron tasas de desnitrificación de 0,47 y 0,45 g N m-2 d-1, respectivamente, las cuales no mostraron la tendencia antes dicha. En términos generales, lo anteriores coincidió con lo observado por [10, 32].
El balance de N mostró errores residuales (er) del 3,5% y 3,1% para los microcosmos plantados y controles, respectivamente, los cuales estuvieron por debajo de los errores del 8 y 9% reportados por [10, 33], respectivamente. Estos errores pueden ser atribuidos a los análisis en el laboratorio, es decir, se encuentra dentro del margen de error de los experimentos y la manera en que se tomaron las muestras, pues los métodos como el de inhibición con acetileno utilizado en esta investigación solo muestran la desnitrificación potencial y no real. Así mismo, estos errores también pueden ser atribuidos a la no determinación de la masa de N desnitrificada y acumulada en la capa de carbonilla de los microcosmos plantados y sin plantar.
Otros procesos como la volatilización del NH3 y producción de N2O pueden también influenciar el balance de N en los sistemas de HFSS. La volatilización del amoniaco (NH3) ocurre a un pH > 8,0 y una temperatura del agua mayor de 25 °C [26]. En este estudio, el pH y la T en los efluentes de los microcosmos plantados y controles se mantuvieron alrededor de 8,0 y 23 °C, respectivamente. Por lo anterior, se asumió que la contribución de la volatilización eventual del NH3 en las pérdidas de N en los microcosmos fue despreciable.
De acuerdo con [6], las emisiones de N2O solo son significativas cuando el pH del agua es ácido. En adición, [2] solo detectó emisiones de N2O cuando los valores de pH estuvieron cercanos a cinco. En éste estudio se registró un pH ligeramente alcalino tanto en las microcosmos plantados (7,3-7,9) como en los controles (7,4-8,1), lo cual indica que las pérdidas de N2O pudieron ser muy bajas.
Conclusion
En este estudio se encontró que la Heliconia psittacorum promueve la eliminación de N en los microcosmos, probablemente por la translocación de oxígeno a la rizósfera, la cual estimula la nitrificación/desnitrificación. Los resultados indicaron que la nitrificación/desnitrificación y la acumulación de N en el medio de soporte fueron los principales mecanismos de eliminación de N en los microcosmos plantados y sin plantar. La desnitrificación eliminó el 19,7 y 16,2% de la carga de N afluente en los microcosmos plantados y sin plantar, mientras que la acumulación en el medio de soporte eliminó el 6,2 y 5,0 % del N afluente, respectivamente. Pese a que la presencia de la Heliconia sp. promovió la eliminación de N en los microcosmos, a la vez que generó ganancia estética por la bella inflorescencia que ellas tienen, la cual a su vez, puede generar beneficios económicos al comercializarse, su bajo aporte (0,2%) en la eliminación directa de la carga de N indican que esta especie no funciona también como otras especies cosmopolitas comúnmente utilizada en este tipo de sistemas.
Agradecimientos
A la Universidad del Valle por su apoyo financiero mediante la Convocatoria Interna 2006, así como al Cinara y el Grupo de Investigación en Saneamiento Ambiental (GISAM) por su apoyo logístico.
Referencias
1. Water Environment Federation. "Natural Systems for Wastewater Treatment". Alexandria. Virginia. MOP FD-(16). 1998. pp. 127-145. [ Links ]
2. C. H. Sim, M. K. Yusoff, B. Shutes, S. C. Ho, M. Mansor. "Nutrient removal in a pilot and full scale constructed wetland, Putrajaya city, Malaysia". Environmental Management. Vol. 88. 2008. pp. 307-317. [ Links ]
3. G. A. Moshiri. Constructed Wetlands for Water Quality Improvement. Lewis Publishers. Boca Raton. Florida. 1993. pp. 132. [ Links ]
4. L. Yang, H. T. Chang, M. T. Lo Huang. "Nutrient removal in gravel - and soil - based wetland microcosms with and without vegetation". Ecological Engineering. Vol. 18. 2001. pp. 91-105. [ Links ]
5. A. Wiebner, U. Kappelmeyer, P. Kuschk, M. Kastner. "Influence of redox condition dynamic on the removal efficiency of a laboratory-scale constructed wetland". Water Research. Vol. 39. 2005. pp. 248-256. [ Links ]
6. S. Teiter, U. Mander. "Emission of N2O, N2, CH4, and CO2 from constructed wetlands for wastewater treatment and from riparian buffer zones". Ecological Engineering. Vol. 25. 2005. pp. 528-541. [ Links ]
7. M. A. Belmont, C. D. Metcalfe. "Feasibility of using ornamental plants (Zantedeschia aethiopica) in subsurface flow treatment wetlands to remove nitrogen, chemical oxygen demand and nonylphenol ethoxylate surfactants a laboratory-scale study". Ecological Engineering. Vol. 21. 2003. pp. 233-247. [ Links ]
8. D. Konnerup, T. Koottatep, H. Brix. "Treatment of domestic wastewater in tropical, subsurface flow constructed wetlands planted with Canna and Heliconia". Ecological Engineering. Vol. 35. 2009. pp. 248-257. [ Links ]
9. P. F. Breen. "A mass balance method for assessing the potential of artificial wetlands for wastewater treatment". Water Research. Vol. 24. 1990. pp. 689-697. [ Links ]
10. A. F. M. Meuleman, R. Logtestijn, G. B. J. Rijs, J. T. A. Verhoeven. "Water and mass budgets of a vertical-flow constructed wetland used for wastewater treatment". Ecological Engineering. 20. 2003. pp. 31-44. [ Links ]
11. A. K. C. Chung, Y. Wu, N. F. Y. Tam, M. H. Wong. "Nitrogen and phosphate mass balance in a sub-surface flow constructed wetland for treating municipal wastewater". Ecological Engineering. Vol. 32. 2008. pp. 81-89. [ Links ]
12. S. Zhou, M. Hosomi. "Nitrogen transformations and balance in a constructed wetland for nutrient-polluted river water treatment using forage rice in Japan". Ecological Engineering. Vol. 32. 2008. pp. 147-155. [ Links ]
13. U. Kappelmeyer, A. Wiebner, P. Kuschk, M. Kastner. "Operation of a Universal Test Unit for Planted Soil Filters - Planted Fixed Bed Reactor". Engineering in Life Sciences. Vol. 2. 2002. pp. 311-315. [ Links ]
14. APHA, AWWA, WPCF. Standard Methods for the Examination of Water and Wastewater. 17th. ed. Ed. Ediciones Díaz de Santos S.A. Madrid. España. 2005. pp. 189-263 [ Links ]
15. T. Yoshinari, R. Hynes, R. Knowles. "Acetylene inhibition of nitrous oxide reduction and measurement of denitrification and nitrogen fixation in soil". Soil Biology and Biochemistry. Vol. 9. 1977. pp. 177-183. [ Links ]
16. Z. Zhang, Z. Rengel, K. Meney. "Interactive effects of nitrogen and phosphorus loadings on nutrient removal from simulated wastewater using Schoenoplectus validus in wetland microcosms". Chemosphere. Vol. 72. 2008. pp. 1823-1828. [ Links ]
17. N. Gottschall, C. Boutin, A. Crolla, C. Kinsley, P. Champagne. "The role of plants in the removal of nutrient at a constructed wetland treating agricultural (dairy) wastewater, Ontario, Canada". Ecological Engineering. Vol. 29. 2007. pp. 154-163. [ Links ]
18. R. H. Kadlec, C. C. Tanner, V. M. Hally, M. M. Gibbs. "Nitrogen spiraling in subsurface-flow constructed wetlands: Implications for treatment response". Ecological Engineering. Vol. 25. 2005. pp. 365-381. [ Links ]
19. M. Greenway. "Suitability of macrophytes for nutrient removal from surface flow constructed wetlands receiving secondary treated sewage effluent in Queensland, Australia". Water Science Technology. Vol. 48. 2003. pp. 121-128. [ Links ]
20. L. Vojtiskova, E. Munzarova, O. Votrubova, A. Rihova, B. Juricova. "Growth and biomass allocation of sweet flag (Acorus calamus L.) under different nutrient conditions". Hydrobiology. Vol. 518. 2004. pp. 9-22. [ Links ]
21. J. Vymazal. "The use constructed wetlands with horizontal sub-surface flow for various types of wastewater". Ecological Engineering. Vol. 35. 2009. pp. 1-17. [ Links ]
22. F. Ye, Y. Li. "Enhancement of nitrogen removal in towery hybrid constructed wetland to treat domestic wastewater for small rural communities". Ecological Engineering. Vol. 35. 2009. pp. 1043-1050. [ Links ]
23. J. Coleman, K. Hench, K. Garbutt, A. Sexstone, G. Bissonnette, J. Skousen. "Treatment of domestic wastewater by three plant species in constructed wetlands". Water Air Soil Pollut. Vol. 128. 2001. pp. 283-295. [ Links ]
24. P. E. Lim, T. F. Wong, D. V. Lim. "Oxygen demand, nitrogen and copper removal by free-water-surface and subsurface-flow constructed wetlands under tropical conditions". Environment International. Vol. 26. 2001. pp. 425-431. [ Links ]
25. C. S. Akratos, V.A.Tsihrintzis. "Effect of temperature, HRT, vegetation and porous media on removal efficiency of pilot-scale horizontal subsurface flow constructed wetlands". Ecological Engineering. Vol. 29. 2007. pp. 173-191. [ Links ]
26. J. Vymazal. "Removal of nutrients in various types of constructed wetlands". Science of the Total Environment. Vol. 380. 2007. pp. 48-65. [ Links ]
27. T. Picek, H. CizKova, J. Dusek. "Greenhouse gas emissions from a constructed wetland-Plants as important sources of carbon". Ecological Engineering. Vol. 31. 2007. pp. 98-106. [ Links ]
28. J. C. Akunna, C. Bizeau, R. Moletta. "Nitrate and nitrite reductions with anaerobic sludge using various carbon sources: glucose, glycerol, acetic acid, lactic acid and methanol". Water Research. Vol. 27. 1993. pp. 1303-1312. [ Links ]
29. H. Constantin, M. Fick, "Influence of C-sources on the denitrification rate of high-nitrate concentrated industrial wastewater". Water Research. Vol. 31. 1997. pp. 583-589. [ Links ]
30. P. Pitter. Hydrochemistry. VSCHT, Praha, Czech Republic (inczech). 1999. pp. 45-75. [ Links ]
31. U. Stottmeister, A. Wiebner, P. Kuschk, U. Kappelmeyer, M. Kastner, O. Bederski, R. Muller, H. Moormann. "Effects of plants and microorganisms in constructed wetlands for wastewater treatment". Biotechnology Advances. Vol. 22. 2003. pp. 93-117. [ Links ]
32. Ch. Munch, P, Kuschk, I. Ruske. "Root stimulated nitrogen removal - only effect or important for the water treatment?". Water Science and Technology. Vol. 51. 2005. pp. 185-192. [ Links ]
33. V. Sawaittayothin, C. Polprasert. "Nitrogen mass balance and microbial analysis of constructed wetlands treating municipal landfill leachate". Bioresource Technology. 98. 2007. pp. 565-570. [ Links ]
(Recibido el 14 de Enero de 2009. Aceptado el 20 de Mayo de 2010)
*Autor de correspondencia: teléfono: + 57 + 4 + 454 70 00, fax: + 57 + 4+ 454 70 50, correo electrónico: harrypol1@hotmail.com. (H. Gutiérrez)