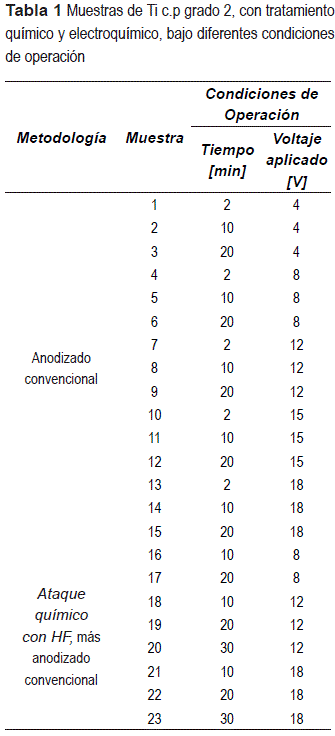Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Ingeniería Universidad de Antioquia
Print version ISSN 0120-6230
Rev.fac.ing.univ. Antioquia no.69 Medellín Oct./Dec. 2013
ARTÍCULO ORIGINAL
Procesamiento, caracterización y ensayos biológicos de titanio modificado electroquímicamente para implantes dentales
Processing, characterization and biological testing of electrochemically modified titanium for dental implants
Sandra Liliana Arias Suarez1, Mónica Echeverry Rendón2, Sara María Robledo Restrepo2, Jorge Alberto Arismendi Echavarría3, Diana Marcela Escobar Sierra4, Claudia Patricia Ossa Orozco4, Juan José Pavón Palacio1*
1Grupo de Biomateriales Avanzados y Medicina Regenerativa, Facultad de Ingeniería, Universidad de Antioquia. Calle 67 No. 53-108 Bl. 19 of. 417. A.A. 1226. Medellín, Colombia.
2Programa de Estudio y Control de Enfermedades Tropicales, PECET, Sede de Investigación Universitaria - SIU, Universidad de Antioquia. Calle 62 #52-59 Lab. 632 . A.A. 1226. Medellín, Colombia.
3Grupo POPCAD, Facultad de Odontología, Universidad de Antioquia. A.A. 1226. Medellín, Colombia.
4Grupo de Investigación en Biomateriales y Biomecánica, Facultad de Ingeniería, Universidad de Antioquia. Calle 67 No. 53-108 Bl. 19 of. 417. A.A. 1226. Medellín, Colombia.
*Autor de correspondencia: teléfono + 57 + 4 + 219 85 91, fax: 57 + 4 + 219 65 11, correo electrónico: jjpavon@udea.edu.co (J. Pavón)
(Recibido el 14 de Septiembre de 2012. Aceptado el 11 de Octubre de 2013)
Resumen
Las aplicaciones biomédicas del titanio y sus aleaciones son posibles debido a que éste material posee características deseables para el reemplazo de huesos, incluyendo buenas propiedades mecánicas, excelente resistencia a la corrosión y alta biocompatibilidad. Sin embargo, una de sus principales limitaciones radica en el encapsulamiento del material por un delgado tejido fibroso, el cual puede estar relacionado con el aflojamiento del implante. Como una alternativa para dar solución a esta limitación, en el presente trabajo se realizaron modificaciones químicas y electroquímicas a la superficie del titanio para evaluar su influencia en la oseointegración de los implantes, para lo cual se realizaron ensayos in vitro del material en contacto con osteoblastos. Los resultados de caracterización por microscopía electrónica de barrido (SEM), de medición de parámetros de rugosidad y de morfología de los osteoblastos, indicaron que existe una relación entre la rugosidad superficial y la adhesión de las células óseas. Las superficies con los mayores parámetros verticales de rugosidad, para las condiciones evaluadas, permitieron una mejor adhesión celular. Estos resultados sugieren que la combinación de técnicas químicas y electroquímicas puede permitir el control de la rugosidad de los implantes dentales de titanio y, por tanto, la optimización de su oseointegración.
Palabras clave: Titanio, implante dental, biomaterial, superficies, oseointegración, modificaciones químicas y electroquímicas
Abstract
Biomedical applications of titanium and its alloys are possible due to their suitable characteristics for bone replacement, including good mechanical properties, excellent corrosion resistance and high biocompatibility. However, one of their main limitations is the fibrous tissue capsule that is formed around the material, which can be related with implants loosening. As an alternative to solve this problem, in this work were carried out some chemical and electrochemical modifications of titanium surface, in order to evaluate their influence on implants osteointegration through in vitro testing in contact with osteoblasts. Results of scanning electron microscopy (SEM), roughness parameters measured and osteoblasts morphology indicate that there is a relationship between surface roughness and bone cells adhesion. Surfaces with highest vertical roughness parameters, within evaluated conditions, allowed better cells adhesion. These results suggest that a combination of chemical and electrochemical techniques can help to control surface roughness of titanium dental implants and, by this way, it can also allow to optimize osteointegration.
Keywords: Titanium, dental implant, biomaterial, surfaces, osteointegration, chemical and electrochemical modifications
Introduccción
La aleación Ti6Al4V intersticial extra-baja (ELI, ASTM F136) y el titanio comercialmente puro (Ti c.p., ASTM F67) son los biomateriales metálicos más ampliamente utilizados en la actualidad [1]. El hecho que la aleación Ti6Al4V y el Ti c.p. cumplan de manera eficiente con las condiciones básicas para la utilización de un biomaterial en el reemplazo de hueso es la razón para su amplia aceptación a nivel clínico. A pesar que las estadísticas de fallo en los implantes de Ti c.p. y Ti6Al4V no se relacionan siempre con la presencia de la cápsula de tejido fibroso, el hecho que la mayoría de estos fallos se originan en la intercara (interface) tejido-implante [2], permite pensar que, especialmente la fibrosis, puede tener un papel importante en dichos fallos. Una de las alternativas para disminuir el riesgo de aflojamiento de los implantes es cambiar la naturaleza físico-química del titanio a partir de diferentes técnicas como: i. Aplicando recubrimientos bioactivos sobre la superficie, los cuales permiten que se establezca un enlace químico directo entre el material y el hueso [3]. También se puede convertir la superficie originalmente bioinerte del titanio a una bioactiva, a través de un proceso de conversión química, conocido como recubrimiento biomimético [4]; ii. Las características topográficas de la superficie se pueden modificar y controlar por métodos mecánicos, químicos y electroquímicos. Con respecto a la topografía, existe un consenso en que ciertos parámetros de rugosidad obtenidos por arenado al impactar superficies con un chorro de arena, sandblasting, resulta en unos valores de rugosidda superficial de: altura media de picos, Ra = 4-5 μm, espacio medio entre picos, Pc = 65-80 cm; estos valores promueven la adhesión de los osteoblastos, mejorando la osteointegración y, por tanto, disminuyendo el riesgo de aflojamiento de los implantes [5].
Entre los métodos químicos y electroquímicos que han sido propuestos para lograr una mayor tasa de oseointegración, a través de la modificación de las características topográficas del titanio, se encuentran el ataque con ácido y el anodizado. El primero, a través de ácidos fuertes tales como ácido clorhídrico (HCl), ácido sulfúrico (H2SO4), ácido nítrico (HNO3) y ácido fluorhídrico (HF) o mezclas duales de éstos, puede generar superficies microrugosas de titanio con tamaños de poro de 0,5 a 2 μm o superiores. Estas rugosidades han mostrado que favorecen los procesos de osteoconductividad, mediante la absorción de fibrina, un mejor anclaje de los osteoblastos cultivados sobre dichos substratos y una mayor actividad biosintética [6].
Por otro lado, el anodizado u oxidación anódica es un proceso electroquímico utilizado para producir distintos tipos de películas protectoras sobre la superficie del titanio, que le brindan además, una mayor resistencia a la corrosión y características topográficas especiales, como mayor rugosidad [7]. Algunos estudios in vitro con osteoblastos, han mostrado que las superficies anodizadas exhiben una mayor tasa de anclaje y diferenciación celular, si se les compara con aquellas que han sido sólo maquinadas [8]. En este sentido, los resultados obtenidos por Das y col. [9] son de particular interés. Estos autores investigaron las interacciones in vitro célula/material, empleando para ello una línea celular precursora de osteoblastos, OPC1, y substratos de titanio anodizados con tres tipos de electrolitos (H3PO4, HF, H2SO4). Sus resultados mostraron que los substratos que obtuvieron mayor rugosidad (H3PO4, HF), exhibieron una mejor adhesión celular (célula-célula y célula- material).
En este trabajo se han evaluado técnicas químicas y electroquímicas para la obtención de los parámetros de rugosidad adecuados para mejorar la oseointegración. Las condiciones óptimas del ataque químico con ácido fluorhídrico (HF) fueron posteriormente combinadas con diferentes condiciones de anodizado convencional, con el propósito de analizar el efecto de dicha combinación en los parámetros de rugosidad. Una vez caracterizadas las superficies, se realizaron ensayos biológicos de citotoxicidad y comportamiento de los osteoblastos en contacto con las diferentes superficies obtenidas.
Materiales y métodos
Procesamiento de las muestras
El material base empleado para la fabricación de las muestras planas y rectangulares (2cmx3cm) fue Ti c.p. grado 2 (ASTM F67). Estas fueron preparadas metalográficamente y desengrasadas por ultrasonido. Posteriormente, las muestras se dividieron en dos lotes (tabla 1), que se sometieron a una de dos metodologías de modificación superficial. El primer lote fue sometido a un ataque químico convencional, en una solución de ácido nítrico (1M HNO3) y ácido fluorhídrico (0.4M HF), como reportado por Pavón y Col. [10]. El segundo lote se sometió a un ataque químico más severo, en una solución de ácido fluorhídrico al 2% vol., durante 2 horas a una temperatura de 50°C. Una vez concluyó el ataque químico de las muestras, ambos lotes se sometieron a un anodizado convencional con una fuente de corriente directa Inelpro® (40 A, 100V DC), utilizando como electrolito 50 g/l de ácido crómico en un rango de voltajes entre 2 y 20V DC, y empleando como cátodo una lámina de acero inoxidable AISI 304, según protocolo desarrollado por Pavón y Col. [10]. Después del procesamiento y antes de los ensayos biológicos, todas las muestras fueron lavadas con agua y esterilizadas en autoclave con vapor de agua (esterilizador Cisa 4210, Italia), a una presión de 2300 mbar y una temperatura de 121°C.
Caracterización morfológica de las superficies
Las muestras de Ti cp modificadas superficialmente fueron inicialmente inspeccionadas de manera visual y a través de un microscopio óptico (Olympus BX51, Japón). La morfología superficial fue analizada mediante un microscopio electrónico de barrido (JSM- 6490LV, Jeol, Japón). Para la medición de los parámetros fundamentales de rugosidad, se utilizó un rugosímetro bidimensional de contacto con punta palpadora de diamante (Surftest SV 3000, Mitutoyo, Japón). Este análisis se realizó haciendo tres lecturas de rugosidad para cada muestra, a lo largo de trayectorias diferentes y paralelas entre sí. Los parámetros que describen la rugosidad superficial, fueron cuantificados mediante el software Surfpack - SV/PRO/SJ (Mitutoyo, Japón), a partir de las mediciones del perfil de rugosidad de las muestras seleccionadas. De todos los parámetros medidos, se eligieron dos, uno de ellos de tipo vertical o altura (Ra) y el otro parámetro de tipo horizontal o de espaciamiento (Sm). El cálculo de estos parámetros se hizo con base a lo reportado por Wield [11].
Ensayos biológicos in vitro
Para los ensayos de citotoxicidad y morfología celular, se empleó la línea celular osteoblástica SAOS-2 (ATCC, EEUU). Las células fueron cultivadas en botellas de cultivo y puestas a crecer 72 h antes del ensayo, en incubadora a 37°C y 5% de CO2. El medio de cultivo fue preparado con 10% de suero fetal bovino (SFB) y 90% de medio McCoy (Sigma-Aldrich).
Las pruebas de citotoxicidad, al igual que la morfología celular, se basaron en el protocolo descrito por Denizot y col. [12] y adaptado por Echeverry y col. [13]. Las muestras se dispusieron en un plato de cultivo de 48 pozos. Dos pozos sin muestras, conteniendo medio de cultivo con células, fueron empleados como control positivo de la citotoxicidad. Se tomó una botella de cultivo conteniendo una densidad adecuada de células osteoblásticas, se le adicionó tripsina por 10 min a 37°C, y luego el contenido de la botella se llevó a la centrífuga a 1.300 rpm durante 10 min, recuperándose el precipitado después de la centrifugación. Cada muestra se sembró en una suspensión celular de 500.000 células/ml, que se incubaron a 37°C por 72 h. La viabilidad celular se determinó mediante el método MTT. Se empleó como solución de parada 10 % de dodecil sulfato de sodio (Fisher) y 50% de isopropanol. La producción de formazán fue leída en un lector de microplatos (Benchmark, Biorad) a 570 nm. Los resultados se expresaron como el porcentaje de células muertas en el ensayo.
Para el análisis de la morfología celular, la suspensión celular a sembrar en cada muestra se obtuvo siguiendo un protocolo semejante al ensayo de citotoxicidad, pero esta vez se cultivaron 10.000 células/cm2, por muestra. Las muestras sembradas se llevaron a la incubadora a 37°C por 72 h. Cumplido este tiempo, los osteoblastos se fijaron sobre el material usando glutaraldehido al 2 %, y dejándolo actuar durante 12 h a una temperatura de 4°C. Se prepararon concentraciones de etanol en Buffer Phosphate Saline, BPS, del 30%, 50%, 70%, 80%, 90% y 100%, para la deshidratación celular. Finalmente, se llevaron al secado a punto crítico, se metalizaron con oro y fueron observadas por medio de un microscopio electrónico de barrido (Jeol JSM-6490LV).
Resultados y discusión
Caracterización morfológica de las superficies
El aspecto macroscópico de las probetas de Ti c.p. grado 2 anodizadas, con ambos ataques químicos, convencional y con HF, muestra que el color superficial desarrollado por las muestras de titanio anodizado está relacionado con el voltaje aplicado. En lo que respecta a las muestras sometidas al ataque convencional y posterior anodizado, muestran una tendencia a colores oscuros (azul o violeta) a medida que se aumenta el voltaje. En cuanto a la influencia del tiempo de anodizado, éste no parece tener una relación directa con el color de la superficie, para ninguna de las muestras procesadas. Diversos autores han indicado que la diferencia de potencial aplicado entre el ánodo y cátodo, durante el proceso de oxidación anòdica, determina el espesor de la película formada sobre la superficie del titanio, lográndose mayores espesores para voltajes de anodizado más altos [14]. Pérez del Pino y Col. [15], indicaron que la principal causa de la formación del color sobre la superficie del titanio anodizado, es el fenómeno de interferencia de la luz que tiene lugar al interior de la capa anódica, dependiendo del espesor de la misma.
La topografía de las muestras con ataque químico convencional y posterior anodizado, exhiben superficies suaves, carentes de poros a nivel micromètrico (figura 1). Esto indica que un ataque químico previo con 1M HNO3 y 0.4M HF, no es suficiente para producir una rugosidad que favorezca la oseointegración, incluso sometiendo las muestras a tiempos y voltajes de anodizado crecientes.
Las muestras de Ti c.p. atacadas con HF y posteriormente anodizadas, presentan superficies claramente más irregulares y rugosas (figura 2). En éstas se puede observar que un aumento en el voltaj e empleado para el tratamiento parece tener un efecto suavizante en la topografía de la superficie; es decir, los picos se tornan más redondeados para las muestras con mayor voltaje de anodizado (18V DC).
El HF ataca preferentemente los bordes de grano del metal, dando lugar al perfil de rugosidad que se aprecia en la figura 2. Los picos de rugosidad son más reactivos durante el proceso electroquímico de oxidación anódica y, como consecuencia, en estas zonas se experimenta un redondeo y, por lo tanto, una disminución de la rugosidad.
Con respecto a la cuantificación de la rugosidad, en la figura 3 se presentan los valores medios de los parámetros de rugosidad calculados, para cada una de las muestras con tratamiento químico y electroquímico. Los valores de Ra para las muestras con un tratamiento químico convencional, son menores a 0,2 μm. El máximo valor registrado para el Ra, lo presenta la muestra con parámetros de tratamiento de 18 V y 2 min, con un valor de Ra=0,182 μm. Es evidente que estos valores del parámetro vertical están muy alejados del rango de referencia óptimo para la adhesión celular (Ra= 4-5 μm). Nótese que no hay una relación evidente entre las condiciones de anodizado y los valores de R medidos; esto indica que la capa anódica no altera de manera apreciable las condiciones micrométricas superficiales iniciales del titanio, ya que la rugosidad que se forma con el proceso de anodizado convencional es a escala nanométrica.
Respecto al parámetro de espaciamiento (Sm), éste es mayor para las muestras con parámetros de 12V-2min y 18V-2 min (figura 3). Se nota como el rango de valores Sm obtenidos (80-500/cm) no corresponde al rango deseado para una óptima oseointegración (Pc = 65-80 /cm, recíproco de Sm). Tampoco es posible establecer una relación entre este parámetro y las condiciones de anodizado por lo que, nuevamente, se demuestra que el proceso electroquímico tampoco altera apreciablemente los valores iníciales de Sm. Aunque este tipo de muestras exhiben valores de rugosidad muy pequeños con escaso interés para la oseointegración, el anodizado de las mismas mejora su resistencia a la corrosión, mediante la formación de películas anódicas más resistentes al ataque de agentes oxidantes. Prueba de ello, es el color que se aprecia sobre la superficie de las muestras, el cual está relacionado con el espesor de la capa formada sobre la superficie del titanio.
Con relación a las muestras tratadas químicamente con HF, en la figura 3 se aprecia que los valores de Ra fueron superiores a 0,7 μm, con un máximo de 2,070 μm para unos parámetros de tratamiento de 12V-10 min. Aunque estos valores de Ra siguen siendo pequeños con respecto a la referencia óptima (4-5 micras), es claro que el ataque previo con HF ha permitido acercarse a dicho rango. Por otro lado, si se consideran rangos de Ra óptimos recomendados por otros autores como Boyan and Swartchz [16], quienes sugieren un rango entre 2 y 10 micras, los mayores valores obtenidos con HF son aún más adecuados para mejorar la oseointegración. Estos valores de Ra son inferiores a los reportados por Pavón J. y col. [10], quienes obtuvieron valores de Ra de hasta 6 μm para probetas de Ti6Al4V atacadas químicamente con HF y posterior anodizado, bajo condiciones de operación semejantes a las descritas en el presente trabajo. Esto es debido a que la estructura metalográfica del Ti c.p., que consiste básicamente de granos equiaxiales de fase α, le confiere una mayor resistencia a la corrosión en comparación a otro tipo de estructuras. El parámetro de espaciamiento, Sm, sigue una tendencia semejante a la observada para las muestras con ataque químico convencional; el proceso de anodizado no parece tener un efecto claro sobre este parámetro. Sin embargo, el rango de valores es diferente, siendo más estrecho (90-200/cm) que en el caso del ataque químico convencional. Lo anterior parece indicar que el ataque previo con HF tiene una influencia más importante en el parámetro vertical de la rugosidad (Ra), que en el parámetro horizontal, Sm.
Los resultados de la evaluación cuantitativa de la rugosidad pueden considerarse consistentes con la evaluación cualitativa a través de micrografías de SEM. En dichas imágenes, al igual que en las mediciones de rugosidad, se pone de manifiesto la poca influencia que tiene el anodizado en los parámetros micrométricos de la misma y, al mismo tiempo, se demuestra como el ataque químico previo con HF es determinante en la topografía superficial, especialmente en lo que se refiere al parámetro vertical, Ra.
Ensayos biológicos in vitro
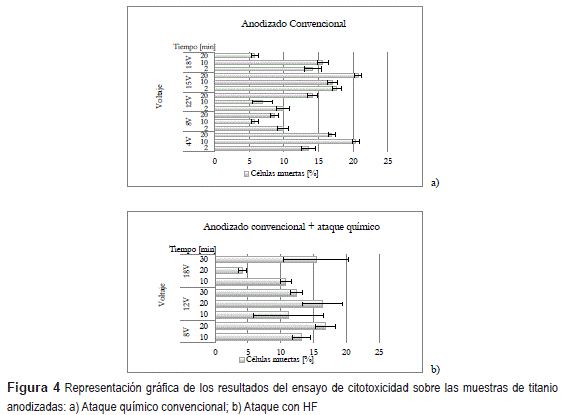
El porcentaje de citotoxicidad de las distintas muestras de estudio, fue calculado de acuerdo con la ecuación 1[12]:
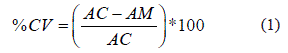
Donde % CVes el porcentaje de células vivas, AC es la absorbancia de control y AM es la absorbancia de la muestra.
Los resultados fueron expresados como el porcentaje de células muertas en el ensayo, como se indica en la figura 4. Estos resultados manifiestan que el porcentaje de supervivencia celular para la mayoría de los casos es superior al 75%, por lo que se considera que las muestras de estudio no son potencialmente tóxicas. Al comparar los dos gráficos de la figura 4, se aprecia una ligera tendencia de las muestras con ataque químico convencional, a presentar una mayor citotoxicidad; es decir, mayor porcentaje de células muertas. Esta tendencia puede estar asociada a la considerable menor rugosidad de dichas muestras, lo cual implica una menor adhesión celular y, por tanto, mayor dificultad para recuperarlas y contarlas, debido a su precipitación al fondo de los pozos de cultivo. En el caso de las muestras atacadas con HF, por el contrario, al tener una superficie considerablemente más rugosa, la adhesión celular es mayor y, en consecuencia, se facilitará la recuperación y conteo de células vivas a través de la cuantificación de los diferentes valores de absorbancia.
En lo que respecta a la morfología adoptada por las células en contacto con las diferentes superficies de titanio, en la figura 5, se observan osteoblastos sobre las superficies anodizadas después del ataque químico convencional. En estas se aprecia que las células poseen morfologías aplanadas, con escasos filipodios (prolongaciones citoplasmáticas de pequeño diámetro) y poca actividad dorsal. Aunque estas muestras son claramente biocompatibles, de acuerdo con el ensayo de citotoxicidad, sus características topográficas son insuficientes para una buena adhesión de los osteoblastos sobre la superficie de las mismas. Esto es consecuencia directa de la baja rugosidad que presentan dichas superficies, cuyos parámetros se encuentran muy alejados de los valores aceptados como óptimos para la adhesión osteoblástica y posterior oseointegración. En otras palabras, la poca adhesión celular observada en la figura 5 es una primera validación de la importancia de la rugosidad en el comportamiento celular.
En la figura 6 se aprecian las morfologías celulares de osteoblastos cultivados sobre substratos tratados químicamente con HF. En el substrato con parámetros de tratamiento de 12V-30 min, se distingue una morfología plana, similar a las adoptadas por los osteoblastos sobre substratos con tratamiento convencional; en íntimo contacto con el material y con poca actividad dorsal. Por otro lado, para la muestra con parámetros de 18V-20 min, es posible observar morfologías más compactas, algunas de ellas con pocos filipodios y una actividad dorsal limitada, en íntimo contacto con el substrato; otras presentan algunas extensiones citoplasmáticas (filipodios y lamelipodios), en contacto con células vecinas. Se aprecia un mejor anclaje de las células al substrato, en muestras con tratamientos de 12V-10min y 18V-10min, tal que la morfología exhibida por las células sembradas en estas muestras, se caracteriza por una visible actividad dorsal, con el desarrollo de filipodios y extensiones citoplasmáticas anchas (lamelipodios), que se adaptan a la topografía de la superficie.
Teniendo en cuenta todas las observaciones anteriores, no se puede establecer una relación clara entre la respuesta celular y las condiciones de anodizado, lo cual es consistente con el efecto micrométrico despreciable que tiene este proceso en los parámetros iniciales de rugosidad de la superficie. Sin embargo, es evidente que el tratamiento químico del Ti c.p. utilizando ácido fluorhídrico, mejora las características morfológicas de las células adheridas, como consecuencia de la optimización de los parámetros topográficos de la superficie. En este orden de ideas, con el ataque producido se lograron rugosidades significativamente mayores a las obtenidas por los tratamientos químicos convencionales, con valores de Ra superiores a 0,7 μm. Aquellas muestras que registraron los valores más altos de Ra (12V-10min, 18V-10min, 18V-20 min); correspondientes a 2,070 μm, 1,692 μm y 1,448 μm; mejoraron el aspecto morfológico de los osteoblastos cultivados sobre estos sustratos, evidenciándose una estructura compacta extendida y una elevada actividad dorsal, siendo esta última un indicador del desarrollo fenotípico del osteoblasto. Es destacable la morfología osteoblástica que se aprecia en la figura 6b: en ella la célula presenta mejor adhesión que en el resto de imágenes, coincidiendo con cierta curvatura en la superficie subyacente. Este resultado puede sugerir que, además de la reconocida importancia de los parámetros verticales y horizontales de rugosidad superficial, la curvatura puede ejercer un papel importante en el proceso de optimización de la adhesión celular. Este último tópico está siendo estudiado actualmente por los autores utilizando la porosidad generada mediante técnicas pulvimetalúrgicas, tal que los primeros resultados serán publicados en un futuro cercano.
La relación observada en este trabajo, entre el parámetro Ra y la adhesión osteoblástica permite hacer dos lecturas: por un lado, los parámetros de rugosidad obtenidos se encuentran por debajo del rango ampliamente aceptado y sugerido por autores como Aparicio y Col. [6], quienes han reportado respuesta osteoblástica óptima para valores de Ra entre 4-5 μm; esto podría indicar que la topografía obtenida con la técnica aquí implementada no requiere parámetros de rugosidad tan altos. Por otro lado, si se consideran recomendaciones como las de Boyan y Swarchz [16] (Ra entre 2-10 μm), se puede considerar que los valores obtenidos en este trabajo se aproximan razonablemente a dicho rango óptimo.
Conclusiones
La evaluación morfológica y biológica de las superficies de Ti c.p. modificadas mediante la técnica de anodizado, ha permitido destacar los siguientes aspectos de relevancia:
La topografía general micrométrica de la superficie de Ti c.p. y la cuantificación de los parámetros de rugosidad asociados dependen básicamente del ataque químico previo. El tratamiento posterior de anodizado parece tener un ligero efecto de redondeo de pico y valles del perfil de rugosidad, al aumentar el voltaje de proceso, si tener un efecto apreciable en los parámetros micrométricos de rugosidad. Esto último se debe al carácter nanométrico de la rugosidad asociada estrictamente a la capa anódica del titanio.
La cuantificación de los parámetros de las diferentes superficies modificadas demuestra que el ataque previo con HF presenta una fuerte influencia en el parámetro vertical de rugosidad (Ra), mientras dicha influencia es menor en el parámetro horizontal (Sm). Para las superficies con ataque convencional, ambos parámetros están alejados de los parámetros óptimos de referencia para una buena oseointegración. Por el contrario, el ataque previo con HF genera parámetros de rugosidad más próximos a los deseados, especialmente en el caso del Ra, de gran importancia para la oseointegración.
Las modificaciones superficiales implementadas sobre el Ti c.p. en este trabajo, no han alterado las características citocompatibles originales del material de partida, de acuerdo a los resultados de citotoxicidad. Algunos valores aparentemente bajos de citocompatibilidad están asociados a la misma técnica de análisis y a la baja rugosidad de las muestras con ataque químico convencional (suave).
Las morfologías presentadas por los osteoblastos sobre las diferentes superficies obtenidas fueron totalmente consistentes con los parámetros de rugosidad previamente determinados. Las células sobre las muestras menos rugosas, con ataque químico convencional, no muestran buena adhesión celular ya que sus características topográficas son insuficientes para ello, como consecuencia directa de su baja rugosidad.
La morfología celular observada sobre las superficies atacadas previamente con HF indica una mejor adhesión osteoblástica, con una visible actividad dorsal, y con el desarrollo de filipodios y extensiones citoplasmáticas anchas, que se adaptan a la topografía de la superficie. Como en el caso del parámetro vertical de rugosidad, Ra, es el ataque químico con HF el que establece una influencia clara en la respuesta morfológica de los osteoblastos, mientras que la sensibilidad al anodizado posterior no parece ser evidente. Sin embargo, en vista que el anodizado puede generar detalles estructurales a escala nanométrica, su influencia en la respuesta celular requiere estudios futuros aislando el efecto del tratamiento electroquímico.
Agradecimientos
Los autores expresan su agradecimiento al Ing. Darling Peréa por su asistencia en el análisis por SEM. Igualmente, al Dr. Alejandro Toro y su Grupo de Tribología y Superficies de la Universidad Nacional de Colombia Sede Medellín, por su colaboración en las mediciones de rugosidad. Finalmente, los autores agradecen a Colciencias y al CODI de la Universidad de Antioquia, por la financiación a través de los proyectos C0L08-1-01-111545221209 y CODI- UdeA-MC08-1-10, respectivamente.
Referencias
1. J. Park. Biomaterials: principles and applications. Bronzino J, Park J. D. (Editor). 1st ed. Ed.CRC Press. Boca Raton, Fl, Estados Unidos. 2003. pp. 1-20. [ Links ]
2. L. Hench. ''Bioceramics: from concept to clinic''. J Am Ceram Soc. Vol. 74. 1991. pp. 1487-1510. [ Links ]
3. S Cook, K. Thomas, R. Hadd, M. Harcho, J. Kay. ''Hydroxylapatite-coated titanium for orthopaedic implant applications''. Clin Orthop Relat R. Vol. 232. 1988. pp. 225-231. [ Links ]
4. H. Kim, F. Miyaji, T. Kokubo, T. Nakamura. ''Preparation of bioactive Ti and its alloys via simple chemical surface treatment''. J Biomed Mater Res. Vol. 32. 1996. pp. 409-417. [ Links ]
5. C. Aparicio, F. Gil, J. Planell, E. Engel. ''Human- osteoblast proliferation and differentiation on grit-blasted and bioactive titanium for dental applications''. J Mater Sci Mater Med. Vol. 13. 2003. pp. 1105-1111. [ Links ]
6. J. Park, J. Davies. ''Red blood cell and platelet interactions with titanium implant surfaces''. Clin Oral Implants Res. Vol. 11. 2000. pp. 530-539. [ Links ]
7. L. Guéhennec, A. Soueidan, P. Layrolle, Y. Amouriq. ''Surface treatments of titanium dental implants for rapid osseointegration: Review''. Dental materials. Vol. 23. 2007. pp. 844-854. [ Links ]
8. L. Xie, G. Yin, D. Yan, X. Liao, Z. Huang, Y. Yao, Y. Kang, Y. Liu. ''Structure, morphology and fibroblasts adhesion of surface-porous titanium via anodic oxidation''. J Mater Sci: Mater Med. Vol. 21. 2010. pp. 259-266. [ Links ]
9. K. Das, S. Bose,A. Bandyopadhyay. ''Surface modifications and cell-materials interactions with anodized Ti''. Acta Biomaterialia. Vol. 3. 2007. pp. 573-585. [ Links ]
10. J. Pavón, P. Velásquez, S. Velásquez. Modificación superficial del titanio para mejorar su oseointegración. VI Encuentro Nacional de Materiales Módulo Metales. Universidad de Antioquia. Medellín, Colombia. Octubre, 2010. [ Links ]
11. M. Wield. Experimental Determination and quantitative evaluation of the surface composition and topography of medical implant surfaces and their influence on osteoblastic cell-surface interactions. PhD Thesis. Swiss Federal Institute of Technology (ETH). Zurich, Switzerland. 1999. pp. 132-158. [ Links ]
12. F. Denizot, R. Lang. ''Rapid colorimetric assay for cell growth and survival: Modifications to the tetrazolium dye procedure giving improved sensitivity and reliability''. J Immunol Methods. Vol. 89. 1986. pp. 271-277. [ Links ]
13. M. Echeverry. Evaluación de la oseointegración mediante ensayos biológicos de Ti c.p y Ti6Al4V Anodizados. Tesis de Maestría. Universidad de Antioquia. Medellín, Colombia. 2012. pp. 32-60. [ Links ]
14. A. Karambakhsh, A. Afshar, S. Ghahramani, P. Malekinejad. ''Pure commercial Titanium color anodizing and corrosion resistance''. J Mater Eng Perform. Vol. 20. 2011. pp.1690-1696. [ Links ]
15. A. Pérez, P. Serra, J. Morenza. ''Coloring of titanium by pulsed laser processing in air''. Thin Solid Films. Vol. 415. 2002. pp. 201-205. [ Links ]
16. B. Boyan, Z. Schwartz. ''Modulation of osteogenesis via implant surface design''. Davies J., Vacanti J. P. Bone Engineering. 1st ed. Ed. Squared Inc. Toronto, Canada. 1999. pp. 72-89. [ Links ]