Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Ingeniería Universidad de Antioquia
Print version ISSN 0120-6230
Rev.fac.ing.univ. Antioquia no.69 Medellín Oct./Dec. 2013
ARTÍCULO ORIGINAL
Influencia del tiempo de hidrólisis en la obtención de película híbrida con adición de iones cerio para la protección de aceros galvanizados
Hydrolysis time influence in obtaining hybrid film with addition of cerium ions for protecting galvanized steels
Sandra R. Kunst*, Gustavo A. Ludwig, José F. Matos, Célia F. Malfatti
Escuela de Ingeniería, Universidade Federal do Rio Grande do Sul, Av. Bento Gon^alves 9500, sector 4, predio 75. Porto Alegre, Brasil.
*Autor de correspondencia: teléfono: + 55 + 51 + 33089539, fax: + 55 + 51 + 33089468, correo electrónico: sandra_kunst@ig.com.br. (S. Kunst)
(Recibido el 24 de mayo de 2012. Aceptado el 11 de octubre de 2013)
Resumen
Las películas hibridas actúan como una barrera entre el substrato y el medio, reduciendo la velocidad de entrada del agua, electrolito, oxígeno y la penetración deiones agresivos hasta el metal, disminuyendo la velocidad de corrosión del substrato. Los principales factores que influyen en la resistencia a la corrosión de las películas híbridas son: el tiempo de curado, la concentración del baño, el pH de la solución de hidrólisis y el tiempo de hidrólisis. En este trabajo, se realizaron las pruebas con cuatro diferentes tiempos de hidrólisis (1, 3, 24 y 48 horas), el acero galvanizado fue revestido con una película híbrida obtenida a partir de un sol constituido por los precursores alcohoxidos 3-(trimetoxisililpropil) metacrilato (TMSPMA) y Tetraetoxisilano (TEOS) con adición de nitrato de cerio [0,01 M]. La caracterización de las películas fue realizada por MEB, perfilometria, ángulo de contacto, polarización y espectroscopia de impedancia electroquímica. Los resultados muestran que el tiempo de hidrólisis interfiere en la obtención de la película híbrida y consecuentemente en las propiedades protectoras de la película.
Palabras clave: Película híbrida, tiempo de hidrólisis, impedancia electroquímica
Abstract
The hybrid films act as a barrier layer between the substrate and the environment. This kind of coating reduces the electrolyte permeability, decreasing the corrosion rate of the substrate. However, many variables influenced the corrosion resistance of hybrid coating. The main factors that influence the thickness of the films are: temperature, curing time, the concentration alcooxide precursors on the bath, the pH of the hydrolysis and the hydrolysis time. In this study, the galvanized steel was coated with and hybrid film obtained from precursors consisting of a sol alcooxide 3-(trimetoxisililpropil) methacrylate (TMSPMA) and tetraethoxysilane (TEOS) with cerium nitrate addition [0,01 M]. The hydrolysis time was varied in four levels of (1, 3, 24 and 48 hours). The characterization of the films was performed by SEM, profilometry, contact angle determination, polarization and electrochemical impedance spectroscopy measurements. Results showed that the hydrolysis time presented influence on the hybrid film properties and consequently on the protection.
Palabras clave: Hybrid film, hydrolysis time, electrochemical impedance
Introducción
El zinc posee una tasa de corrosión inferior a la del acero, por poseer un potencial de reducción más electronegativo [1], por lo que, se utiliza como revestimiento protector, por la protección catódica que ofrece al acero en las discontinuidades del revestimiento y la baja tasa de corrosión, que permite la protección por periodos prolongados [2].
El cromado presenta un excelente desempeño frente a los procesos corrosivos para una serie de materiales metálicos; este proceso está cuestionado por el uso del cromo hexavalente que es altamente toxico y cancerígeno [3,4].
Una alternativa ambientalmente correcta al proceso de cromado es el revestimiento con capas híbridas orgánico-inorgánico [5], estos compuestos despiertan gran interés, porque otorgan una buena protección contra la corrosión a diferentes metales, por poseer una óptima adhesión al substrato metálico y a la capa posterior de pintura, lo que permite ser utilizado como pre- tratamiento al proceso de pintado industrial [6,7].
La adición de inhibidores de corrosión o de otros compuestos a las películas de silano puede modificar las propiedades de capa de protectora, aumentando el grosor y densidad [8], mejorando consecuentemente el desempeño anticorrosivo. La literatura reporta la modificación de películas de silano con sales de tierras raras los cuales suministran buenas propiedades anticorrosivas cuando son utilizados como capas aislantes en aleaciones de aluminio y acero galvanizado [9]. Entre los elementos de tierras raras, los más utilizados son los compuestos a base de cerio. Cuando el cerio es insertado en la matriz de silano, aumenta el grosor y la hidrofobicidad de la película y otorga propiedades de cicatrización de los defectos formados por el ataque de especies agresivas.
Cuando un silano es dopado con iones de cerio (baño de silano realizado con adición de ciertas cantidades de cerio), luego del proceso de curado, este queda incorporado en la película. En el caso que ocurran fallas en la película debido a la acción del electrolito, el metal queda expuesto a la solución agresiva, generando una actividad anódica y catódica. La actividad catódica provoca un aumento local del pH por la formación de iones hidroxilos. Los iones de cerio poseen cierta movilidad dentro de la película de silano y se desplazan hasta el lugar de la actividad catódica reaccionando con los iones hidroxilos [10], ocurriendo la formación de óxidos/hidróxidos de Ce+3 y Ce+4, los cuales precipitan exactamente sobre las áreas catódicas, sellando los defectos de la película. La literatura reporta que los iones de Ce, pueden estar involucrados en la formación de una capa hidratada o hidroxilado rico en cerio [11].
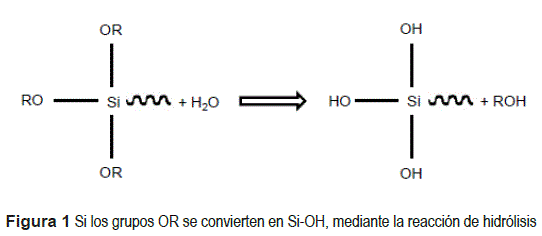
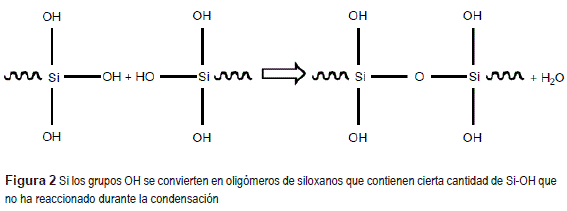
Para formar una película de silano se requiere que las moléculas de silano sufran una reacción de hidrólisis en una solución a base alcohol, esta reacción tiene por objetivo la formación de grupos silanol es (SiOH) [12]. Si existe una cantidad suficiente de grupo de silanos en la solución y se sumerge un substrato metálico, ocurre una interacción entre la superficie del substrato (rico en grupos hidroxilos) y los silanol es, estableciéndose enlaces de hidrógeno entre los hidroxilos metálicos (MeOH) y los grupos OH de los silanol es. Los silanol es distantes al substrato metálico forman enlaces de hidrógeno entre sí. El substrato metálico recubierto con silano, es curado térmicamente, donde el tiempo y la temperatura está en función de la naturaleza y concentración del silano, ocurriendo reacciones de condensación que liberan moléculas de agua y los enlaces de hidrogeno se convierten en enlaces siloxanos (Si-O-Si) y metal siloxanos (Si-O-Me) [13]. La formación de la capa de silanos depende del tiempo de hidrólisis (silanos a base de agua, desde 15 minutos hasta 1 hora y silanos a base de alcohol, desde 18 horas hasta 48 horas)y el tipo de solución de silano [14].
Si el tiempo de hidrólisis es insuficiente no se forman los grupos necesarios de SiOH para reaccionar con los hidroxilos presentes en el substrato, por la falta de enlaces covalentes entre los grupos silanol es e hidroxilos presentes en el substrato [15]. Según investigadores, normalmente la hidrólisis es suficiente, pero no completa, cuando la solución se torna clara; cualquier turbidez que se forme indica la presencia de productos de condensación y la solución debe ser descartada [16].
El objetivo del presente trabajo es revestir el acero galvanizado con una película hibrida obtenida a partir de un sol constituido por los precursores alcóxidos 3-(trimetoxisililpropil) metacrilato (TMSPMA) y Tetraetoxisilano (TEOS) con adición de nitrato de cerio [0,01 M], variando en cuatro niveles el tiempo de hidrólisis (1, 3, 24 y 48 horas).
Experimentación
Los substratos de acero galvanizado se lavan con etanol y se secan con aire caliente (60 °C), luego son desengrasados con detergente neutro, (pH=7) a 70°C por inmersión durante 10 minutos, después se lavan con agua desionizada y secados, para finalmente ser lavados con etanol y secados con aire caliente (60 °C).
Las reacciones de hidrólisis de la película híbrida se preparan con los precursores de silanos (TMSPMA) 3-(trimetoxisililpropil) metacrilato (C10H20SiO5) y (TEOS) tetraetoxisilano (C8H200SiO4) con adición de nitrato de cerio [0,01 M]; como solvente se utilizó agua y alcohol. Se utilizó cuatro tiempos de hidrólisis (1, 3, 24 y 48 horas). El proceso de dip-coating se utiliza en la aplicación de la solución la solución híbrida hidrolizada, con un tiempo de permanencia de 10 min y velocidad de retirada de 10 cm.min-1[17], después los substratos se curan en un horno a 60±2°C, por 20 minutos.
El proceso de sililación puede ser descrito mediante un modelo de reacción como se muestra las figuras 1 y 2.
Si el grupo OH en el siloxano forma enlaces de hidrógeno con los grupos hidroxilos en la superficie de la lámina de acero, luego, los grupos Si-OH forman enlaces covalentes con la lámina de acero mediante la condensación durante el proceso de calentamiento [18].
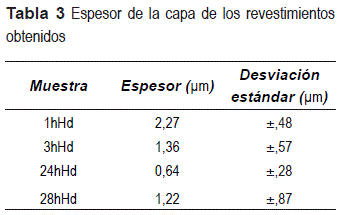
La tabla 1 presenta la descripción de las muestras utilizadas.
La morfología de los revestimientos se evaluó mediante MEB (Microscopía Electrónica de Barrido). La marca del microscopio es JEOL 6060, que posee un sistema computacional para la obtención de imágenes. Las muestras fueron observadas desde una vista de planta para identificar la morfología superficial y también en corte transversal, para observar el espesor de las películas obtenidas. La microrugosida de las superficies se evaluó en un perfilómetro (PRO500 3D), que registralos movimientos de una sonda sobre la superficie del material y generan señales eléctricas que son representados gráficamente. La técnica de perfilometria se emplea para cuantificar la topografía de un material.
Esta prueba se realiza mediante el método de la gota sésil, en un equipo desarrollado por el Laboratorio de Investigaciones en Corrosión (LAPEC) de la Universidade Federal do Rio Grande do Sul. El ángulo de contacto se determinó por medio de un programa de análisis de imágenes [19]. Para medir la impedancia electroquímica se utilizó un potenciostato (OmnimetraMod. PG- 05) acoplado a un analizador de respuesta en frecuencia (Solartron 1255). Las medidas fueron realizadas aplicándo una señal senosoidal de 10 mV y barrido de 100 kHz a 10 mHz. El electrolito utilizado fue una solución de NaCl [0,05 M].
La monitorización del potencial de circuito abierto se realizó en un potenciostato PAR 273 acoplado a un computador para la recopilación de datos. Las curvas de polarización se llevaron a cabo con velocidades de barrido de 1 mV.s-1, con un intervalo de potencial de 200 mV, por debajo del potencial de circuito abierto. Para los análisis electroquímicos se emplearon una celda de tres electrodos, el electrodo de referencia es el calomelano saturado y contraelectrodo de platino.
Resultados y discusión
Las figuras 3 y 4 presenta las micrografías obtenidas por MEB, para los sistemas estudiados: 1hHd, 3hHd, 24hHd y 48hHd, el aspecto morfológico de los revestimientos obtenidos para 1hHdy 3hHd muestra la presencia de discontinuidades en los revestimientos, siendo más acentuado para el sistema 1hHd.
Según las investigaciones, cuando una solución de silano es diluida en alcohol tiene un tiempo corto de hidrólisis y no existe la formación de una red, lo que implica la ausencia de la capa barrera de la película, ocasionando la formación de discontinuidades [3].
El revestimiento 48hHd presenta fisuras, esto es debido [20] a la formación de una estructura porosa y frágil, característicos de los materiales cerámicos luego de la hidrólisis y reticulación de TEOS. La adición de TEOS contribuye en la formación de una película irregular en un tiempo de hidrólisis muy prolongado.
La película y el sistema 24hHd presentan una superficie homogénea, sin fisuras, y con pocas discontinuidades, en comparación a los sistemas 1hHd y 3hHd.
Los resultados muestran que el sistema 24hHd tiene el mejor aspecto morfológico y que 24 horas es el tiempo adecuado para generar un número suficiente de grupos SiOH, que puedan reaccionar con los hidroxilos presentes en el substrato.
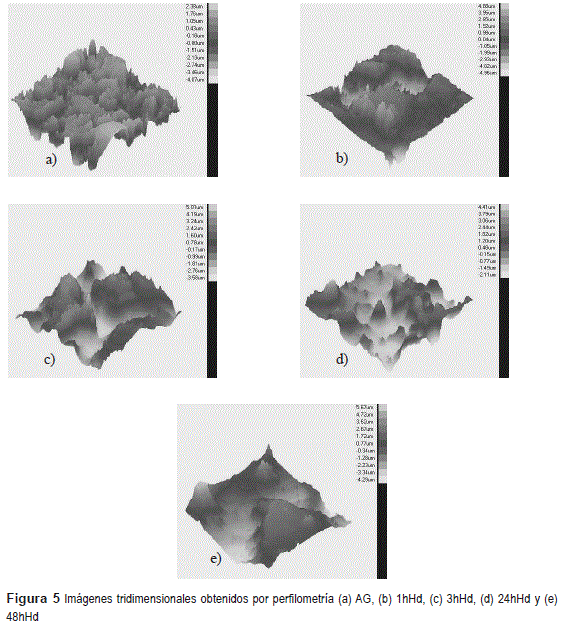
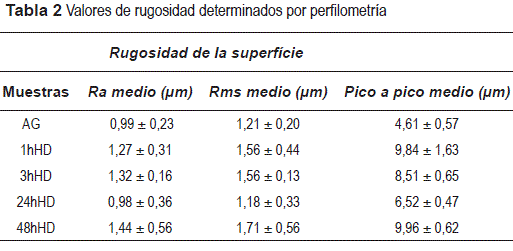
Se observa que el revestimiento 24hHd presenta el menor valor de rugosidad, en comparación con los otros sistemas estudiados, indicando que ese revestimiento presenta una película más homogénea. La película 48hHd, presenta mayores valores de rugosidad (figura 5, tabla 2), eso está asociado al hecho de presentar mayores fisuras (figuras 1 y 2). Según los resultados de algunos investigadores [21] el valor del tiempo de hidrólisis debe ser ajustado para un determinado valor, para obtener la máxima velocidad de hidrólisis de las moléculas de silano y la mínima velocidad de condensación de las moléculas de silano ya hidrolisadas (silanol) en solución, mientras que, a mayor tiempo de hidrólisis (48 horas) hubo una máxima velocidad de hidrólisis y condensación de las moléculas, existiendo la formación de una película con fisuras e irregular.
La figura 5 presenta las imágenes tridimensionales, obtenidos por perfilometría para todos los sistemas estudiados y también del acero galvanizado sin revestimiento. Los valores de rugosidad con las respectivas desviaciones estándar se presentan en la tabla 2.
El espesor de la capa de la sección transversal de las películas, determinado por análisis de imágenes (figura 6) y obtenido por MEB, se presenta en la tabla 3.Analizando los datos (figura 6 y tabla 3) se observa que el mayor espesor de la capa se obtiene para1 hora de hidrólisis y es casi constante con el aumento del tiempo de hidrólisis de 3, 24 y 48 horas.
Sin embargo, esos resultados son contradictorios a los reportados en la literatura [13], porque a mayor tiempo de hidrólisis, mayor debe ser el número de grupos SiOH, para reaccionar con los hidroxilos presentes en el substrato formando más grupos siloxanos con densidades de 2,2 g.cm-3, que origina un mayor espesor de la capa y un aumento en la viscosidad, que podría afectar el tiempo de vida útil de la solución.
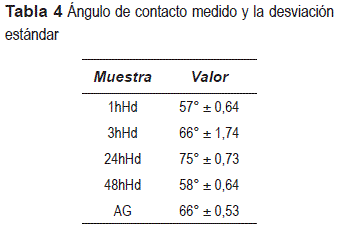
A partir de la tabla 4, es posible observar los valores de los ángulos de contacto obtenidos mediante el método de la gota sésil, para los sistemas estudiados y del acero galvanizado sin revestimiento.
Se observa que el sistema 24hHd presenta un mayor ángulo de contacto y, consecuentemente, una menor humectabilidad, por presentar una película compacta con pequeñas discontinuidades. Analizando las imágenes de MEB (figuras 3 y 4) y perfilometría (figura 5), se concluye que el tiempo de 24 horas de hidrólisis es adecuado para generar la cantidad suficiente de grupos SiOH que reaccionen con los hidroxilos presentes en el substrato, formando los grupos siloxanos (Si-O-Si) [20] estables que actúan como una barrera hidrofóbica.
A tiempos menores de hidrólisis (1 y 3 horas) las películas presentan los menores valores de ángulo de contacto. Una vez que la película de silano no forma el número de moléculas necesarias de silanol, debido al poco tiempo de hidrólisis para que pueda existir una eficiente reticulación durante el proceso de condensación, la película presenta un carácter hidrofílico, indicando que no hubo la formación de grupos siloxanos (Si-O-Si) estables, de este modo, el agua y los iones podrán alcanzar la superficie metálica [15].
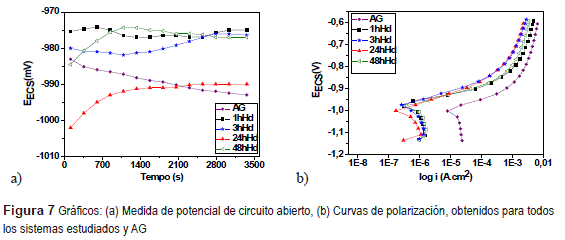
Los valores del potencial de circuito abierto (figura 7-a), para todos los sistemas estudiados son próximos al valor del potencial de circuito abierto del acero galvanizado, un indicativo que todas las películas obtenidas presentan discontinuidades y fisuras en la superficie (figuras 3 y 4).
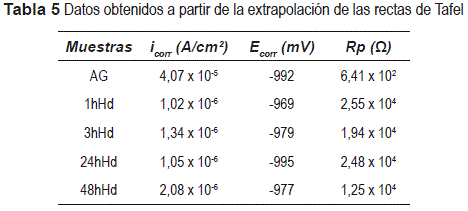
El ensayo de polarización (figura 7-b y tabla 5) muestra que los pre-tratamientos con las películas hibridas promueve el aumento de la resistencia de polarización (Rp) y disminuye la densidad de corriente (icorr) en comparación al acero galvanizado no revestido, que evidencia la acción protectora del revestimiento. De las curvas de polarización, no es posible observar una diferencia significativa, respecto al desempeño en corrosión, en función de los cuatro tiempos de hidrólisis empleado.
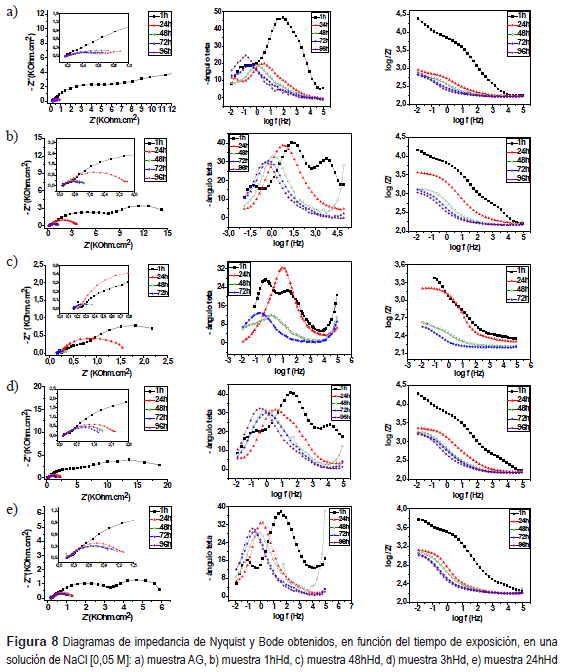
La (figura 8 presenta los gráficos de impedancia para los sistemas estudiados y AG, en función del tiempo de inmersión (1, 24, 48 y 96 horas, respectivamente) en electrolito de NaCl [0,05 M].
Estos diagramas se obtienen secuencialmente para una misma muestra, los cuales son el resultado de la respuesta del electrolito en función del tiempo de inmersión, en la solución de ensayo.
Para el acero galvanizado sin revestimiento AG (figura 8-a) se observa un fenómeno en alta frecuencia asociado al efecto de la permeabilidad del electrolito a través de productos de corrosión del zinc. Para el AG, 1hHD y 48hHD, se observa un fenómeno en baja frecuencia en todos los tiempos de inmersión (1, 24, 48, 72 y 96 horas).
Para 1hHd (figura 8-b) y 48hHd (figura 8-c) se observa, en la primera hora de inmersión un fenómeno en media frecuencia, asociado al efecto de la permeabilidad del electrolito mediante la película, que indica un revestimiento deficiente por presentar fisuras y discontinuidades.
Para los sistemas 3hHd (figura 8-d) y 24hHd (figura 8-e) se observa, solo en la primera hora de inmersión, un fenómeno en alta frecuencia asociado al efecto barrera de la película; después de 24 horas de inmersión surge un fenómeno en media frecuencia asociado al efecto de la permeabilidad del electrolito a través de la película. El comportamiento que presenta estos sistemas, luego de 24 horas de inmersión, se mantiene hasta el final del ensayo (96 horas). Así mismo, 24hHd presenta la mayor resistencia a la corrosión por poseer un mayor ángulo de contacto (tabla 4) y una película más homogénea, a pesar de tener discontinuidades (figuras 3 y 4).
Esto confirma el relato de algunos investigadores [22], que las películas de silano reducen la tasa de corrosión con la cual el agua o los iones alcanzan el metal protegiendo el substrato sobre el cual están depositados, actuando como una barrera hidrofóbica, pero eso evidentemente depende de la naturaleza del silano empelado, ajustes del tiempo de hidrólisis y pH del Sol.
Conclusiones
Los resultados muestran que el tiempo de hidrólisis interfiere en la formación de las películas híbridas estudiadas y consecuentemente, en las propiedades protectoras (efecto barrera contra la corrosión) del revestimiento sobre el acero galvanizado.
Todas las películas obtenidas presentan un significativo aumento de la resistencia de polarización y disminución de la densidad de corriente de corrosión, en comparación al acero galvanizado sin revestimiento.
Los sistemas 3hHd y 24hHd, presentaron mejores desempeños (efecto barrera) contra la corrosión.
Agradecimientos
Este trabajo, fue realizados con el apoyo de la CAPES, CNPq y la FAPERGS.
Referencias
1. Standard definitions of terms relating to electroplating, Book of ASTM Standards, B374. 4th ed. American Society for Testing and Materials. 2003. pp. 9. [ Links ]
2. M. Schlesinger, M. Pauovic. ''Modern Electroplanting''. The Electrochemical Society. 4th ed. Ed. Inc. John Willey & Sons. New York, USA. 2000. pp. 833. [ Links ]
3. D. Graeve, J. Vereecken, A. Franquet, T. Schaftinghen, H. Terryn. ''Silane coating ofmetal substrates: Complementary use of electrochemical, optical and thermal analysis for the evaluation of film properties''. Progress in Organic Coatings. Vol. 59. 2007. pp. 224-229. [ Links ]
4. A. Franquet, H. Terryn, J. Vereecken. ''Composition and thickness of non-functional organosilane films coated on aluminum studied by means of infra-red spectroscopic ellipsometry''. Thin Solid Films. Vol. 441. 2003. pp. 76-84. [ Links ]
5. A. Franquet, J. Laet, T. Schram, H. Terryn, V. Subramaniam, W.van Ooij, J. Vereecken. ''Determination of the thickness of thin silane films on aluminum surfaces by means of spectroscopic ellipsometry''. Thin Solid Films. Vol. 384. 2001. pp. 37-45. [ Links ]
6. Seth, W. Van Ooij, P. Puomi, Z. Yin, A. Ashirgade, S. Bafna, C. Shivane. ''Novel, one-step, chromate-free coatings containing anticorrosion pigments for metals- An overview and mechanistic study''. Progress in Organic Coatings. Vol. 58. 2007. pp. 136-145. [ Links ]
7. M. Zheludkevich, R. Serra, M. Montemor, I. Miranda, M. Ferreira. ''Corrosion protective properties of nanostructured sol-gel hybrid coating to AA2024-T3.'' Surface & Coatings Technology. Vol. 200. 2006. pp. 3084-3094. [ Links ]
8. F. Deflorian, S. Rossi, L. Fedrizzi. ''Silane pre- treatments on copper and aluminium''. Electrochimica Acta. Vol. 51. 2006. pp. 6097-6103. [ Links ]
9. D. Zhu,W. Ooij. ''Corrosionprotectionofmetalsbywater- based silane mixtures of bis-[trimethoxysilylpropyl] amine and vinyltriacetoxysilane''. Progress in Organic Coatings. Vol. 49. 2004. pp. 42-52. [ Links ]
10. W. Ooij, D. Zhu. ''Electrochemical impedance spectroscopy of bis- triethoxysilypropyl]tretasulfide on Al 2024-T3 substrates''. Corrosion. Vol. 57. 2001. pp. 413-427. [ Links ]
11. W. Ooij. ''Corrosion protection properties of organofunctionalsilanes - an overview''. Tsinghua Science and Technology. Vol. 10. 2005. pp. 639-664. [ Links ]
12. M. Montemor, M. Ferreira. ''Electrochemical study of modified bis-[triethoxysilylpropyl] tetrasulfidesilane films applied on the AZ31 Mg alloy''. ElectrochimicaActa. Vol. 52. 2007. pp. 7486-7495. [ Links ]
13. L. Palomino. Caracterizaçao microestrutural e eletroquímica de revestimentos ambientalmente amigáveis aplicados sobre a liga de Al 2024-T3. Tesis de doctorado. Dpto. Eng. Química. USP. Sâo Paulo, Brasil. 2007. pp. 5-15. [ Links ]
14. W. Ooij, D. Zhu, V Palanivel, J. Lamar, M. Stacy. Potential of silanes for chromate replacement in metal finishing industries. Department of Materials Science Engineering, University of Cincinnati. Ohio, 2002. Available on: http://www.eng.uc.edu/~wvanooij/SILANE/pot_chromate_rpl.pdf. Accessed: March 2012. [ Links ]
15. D. Zhu. Corrosion protection of metals by silane surface treatment. PhD. Thesis. Doctor of Philosophy. Department of Materials and Engineering, University of Cincinnati. Ohio, USA. 2005. pp. 290 [ Links ]
16. T. Child, W. Ooij. ''Application of silane technology to prevent corrosion of metals improves paint adhesion''. Coatings World. 1999. pp. 42-53. [ Links ]
17. S. Kunst, J. Matos, E. Leal, C. Malfatti. ''Tratamiento superficial del acero galvanizado con películas híbridas constituidos por TMSPMA y TEOS''. Información Tecnológica. Vol. 22. 2011. pp. 67-76. [ Links ]
18. F. Xia, S. Xu. ''Effect of surface pre-treatment on the hydrophilicity and adhesive properties of multilayered laminate used for lithium battery packaging''. Applied Surface Science. Vol. 268. 2013. pp. 337-342. [ Links ]
19. Y. Xiu, D. Hess, C. Wong. UV-Resistant and Superhydrophobic Self-Cleaning Surfaces using Sol-gel Process. A. Cairú, K. Mittal. (editors). 1st ed. Ed. Hoboken. CRC Press. New Jersey, USA. 2009. pp.495. [ Links ]
20. X. Zhang, Y. Wu, S. He, D. Yang. ''Structural characterization of sol-gel composites using TEOS/ MEMO as precursors''. Surface and Coatings Technology. Vol. 201. 2007. pp. 6051-6058. [ Links ]
21. W. Ooij. ''Improved service life of coated metals by engineering the Polymer-Metal interface''. Service Life Prediction of Organic Coatings - A Systems Approach. D. Bauer, J. Martin. (editors). 1 st ed. Ed. ACS Symposium Series. Oxford University. Oxford, England. 1999. pp. 354-377. [ Links ]
22. W. Ooij, D. Zhu, V. Palanivel, J. Lamar, M. Stacy. Potencial of silanes for chromate replacement in metal finishing industries. Department of Materials Science Engineering, Universityof Cincinnati. Ohio, US. 2002. Available on: http://www.eng.uc.edu/wvanooij/SILANE/pot_chromate_rpl.pdf. Accessed: August 2011. [ Links ]