Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina
Print version ISSN 0120-8705
CES Med. vol.23 no.2 Medellín July/Dec. 2009
ARTÍCULOS DE REVISIÓN
Aproximación diagnóstica al paciente con molestia torácica de origen coronario en el servicio de urgencias
Diagnostic approach to patients with chest discomfort of coronary origin in the emergency department
CAMILO DUQUE H.1, FRANCISCO LUIS OCHOA J2
1 Especialista en medicina de urgencias. . Profesor CES. Hospital del Sur, Itaguí.
2MD- Magíster en epidemiología. Profesor CES, Grupo Observatorio de la salud pública
RESUMEN
La enfermedad coronaria es hoy en día la causa número uno de mortalidad en el mundo. Para los médicos es supremamente importante saber cómo enfrentarse a esta enfermedad de la mejor forma posible. El problema radica en que es mucha la información que se encuentra sobre el tema, pero esta no siempre es clara y frecuentemente es difícil de aplicar. Con esta revisión se pretende aclarar las herramientas adaptadas a la realidad de Colombia, con el fin de que el clínico sea capaz de abordar los pacientes comprendiendo el por qué de las acciones que toma. Se discutirán cuatro puntos críticos donde se cometen la mayoría de los errores: valoración de la probabilidad, estratificación del riesgo, interpretación del electrocardiograma y correcta utilización de los biomarcadores.
PALABRAS CLAVES
Dolor torácico, Molestia torácica, Enfermedad coronaria, Riesgo, Biomarcadores, Diagnóstico
ABSTRACT
Coronary artery disease is today the number one cause of mortality worldwide. For doctors it is of the utmost importance to know the best possible way to approach these patients. The problem is that there is a lot of information on the subject and it is not always clear or easily applicable. This review intends to go over and explain the tools needed - adapted to the Colombian reality, in order for the clinician to be able and engage these patients knowing "the why" of the actions taken. The four topics where most of the mistakes are made will be reviewed, these are: evaluation of the probability, risk stratification, electrocardiogram interpretation and correct use of biomarkers.
KEY WORDS
Chest pain, Chest discomfort, Coronary artery disease, Risk, Biomarkers, Diagnosis
¿Por qué hablar del evento coronario agudo (ECA)?
Es la causa número uno de mortalidad en el mundo, en Colombia y en Antioquia (1-2). Es una causa muy importante de error médico y de la cual se deriva gran morbilidad; en EEUU hay pérdidas monetarias secundarias a litigio de hasta el 30 %. El ECA representa del 5 al 8 % de las consultas a los servicios de urgencias y, entre otras razones, porque todos nos hemos enfrentado a un paciente con dolor en el pecho y no sabemos qué hacer (3,4).
A continuación se presentarán los cuatro puntos críticos donde se toman las decisiones mas importantes y donde se cometen la mayoría de los errores: valoración de la probabilidad, estratificación del riesgo, interpretación del electrocardiograma (ECG) y, correcta utilización de los biomarcadores. Con estos cuatro puntos, el médico debe ser capaz de definir si el paciente tiene una enfermedad coronaria o no y de clasificar el tipo de evento coronario para así poder iniciar el tratamiento.
1. VALORACIÓN DE LA PROBABILIDAD
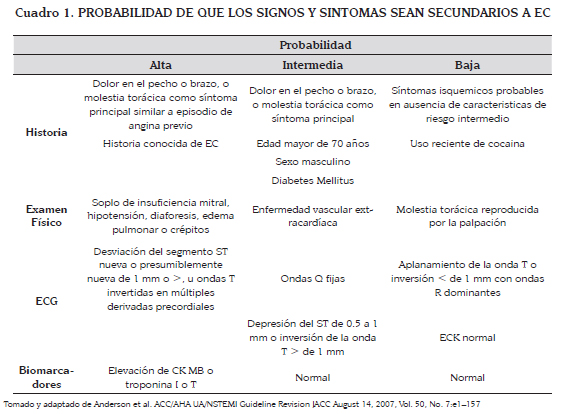
La mortalidad por enfermedad coronaria (EC) no diagnosticada es del 25 %, el doble de la que recibe manejo hospitalario. Sólo en el 15 a 25 % de los pacientes que consultan con una molestia torácica, esta es de origen coronario (3-5). La probabilidad nos habla de la posibilidad que tiene el paciente de tener realmente una EC, en contraparte de un dolor torácico no coronario (Ver cuadro 1).
A menos de que el paciente esté en colapso circulatorio o falla respiratoria, se debe hacer un interrogatorio dirigido, que debe estar encaminado a realizar un diagnóstico diferencial, buscar factores de riesgo para enfermedad ateroesclerótica y caracterizar la calidad del dolor y los síntomas asociados (5), descartando primero las causas potencialmente mortales: disección aórtica, trombo- embolismo pulmonar (TEP), pericarditis, neumotórax, neumonía y síndrome de Boerhaave (4). Y luego, se centra la atención en las que son mas frecuentes: enfermedad acido-péptica, molestias osteomusculares y trastornos de ansiedad.
La angina inestable (AI) tiene tres presentaciones: en reposo, de reciente comienzo y progresiva (mas intensa, duradera o frecuente).
Fisiopatológicamente la AI y el infarto agudo de miocardio no ST (IAMNST) son diferentes del infarto agudo de miocardio ST (IAMST). En la AI/ IAMNST hay un disbalance entre el aporte y la demanda de oxígeno, pero aun hay flujo. Por el contrario, en el IAMST hay ateroesclerosis con trombo oclusivo (nO hay flujo distal) originado por ruptura o erosión de la placa vulnerable (5).
Con el tiempo el término dolor torácico ha cambiado por molestia torácica ya que se ha visto que el término "dolor" restringe el concepto (manifestación de isquemia) y deja por fuera muchos pacientes. Es peor aun cuando se habla del conocido "dolor típico"ya que las características de esta "presentación clásica" fueron tomadas de los pacientes con angina crónica estable, las cuales son: dolor profundo que alcanza una intensidad máxima en minutos, pobremente localizado en el pecho con molestia en el brazo y/o cuello/mandíbula, reproducible con el ejercicio o estrés, que mejora luego del reposo o cinco minutos después de la administración de nitroglicerina -NTG- (3).
El otro problema que se puede presentar al hablar de dolor torácico "típico" es que se piense que esta es la manifestación mas común: la EC se manifiesta muy frecuentemente en otra localización (epigastrio) o con otras características (dolor punzante, urente, fluctuante) o incluso sin dolor. Puede presentarse asociada o no con arritmias, síncope o muerte súbita; con irradiación al brazo derecho. Incluso en ocasiones los síntomas asociados son mas llamativos o son la única manifestación. Estos se conocen como equivalentes anginosos, puesto que se pueden presentar en reposo o con el ejercicio/estrés y mejoran con el reposo o la administración de NTG. En estos pacientes lo que se aprecia no es el dolor sino la disnea por congestión pulmonar, nauseas, vómito y diaforesis -como reflejo vagal- o manifestaciones de bajo gasto (alteración del estado de conciencia, astenia), etc. Cuando estos signos y síntomas son la manifestación de EC y se están presentando en reposo la posibilidad de errar en el diagnóstico es mas alta.
Estas manifestaciones de EC son mucho mas frecuentes en algunos grupos poblacionales con el riesgo de ser dados de alta con un diagnóstico errado y sus consecuencias - muerte o IAM no fatal-. Estos grupos son: hombres menores de 45 años, mujeres, ancianos, alcohólicos, diabéticos, consultadores crónicos, psiquiátricos, pacientes demandantes, pacientes con antecedentes de enfermedad acido péptica, entre otros. Un grupo que merece especial atención es el de los pacientes con compromiso renal (que generalmente están sub-representados en los grandes estudios), por su mayor riesgo de sangrado y mayor incidencia de falla cardíaca y arritmias.
Los factores de riesgo cardiovascular (hipertensión arterial, tabaquismo, obesidad, sedentarismo, diabetes mellitus -DM-, dislipidemia, microalbuminuria o tasa de filtración glomerular <60 ml/min, edad mayor de 55 en hombres y 65 en mujeres, antecedentes familiares positivos -con las edades anotadas-), ayudan a saber si el paciente tiene mayor predisposición para tener enfermedad ateroesclerótica coronaria a largo plazo (6,7), pero sirven muy poco para predecir que la molestia aguda que el paciente presenta hoy en el servicio de urgencias es por EC. de los anteriores solo tener una edad avanzada, diabetes mellitus (DM) y los antecedentes familiares para EC prematura, son predictivos de tener una EC (8). Con ello no se pretende demeritar los factores de riesgo, sino llamar la atención sobre el hecho de que si el paciente no los tiene, no se puede descartar que no se tenga una EC (9).
La DM tipo II y la I de larga data (mayores de 30 años), deben verse como equivalentes de EC. Equivalente quiere decir que en pacientes sin EC, a 10 años el riesgo de presentar un infarto o morir por IAM es mayor al 20 %, igual que en pacientes con EC. En ellos, los eventos cardiovasculares constituyen la primera causa de mortalidad (10). Al igual que los pacientes con antecedente de EC, la decisión del manejo posterior se basa en la estratificación del riesgo que se verá mas adelante (11). Las otras entidades que son consideradas equivalentes de EC son: enfermedad arterial periférica, enfermedad carotidea, aneurisma de aorta abdominal y pacientes de alto riesgo por tabla de predicción de Framingham (11).
Otro grupo poblacional importante es el de los pacientes con lupus. Esta enfermedad se debe considerar como un factor de riesgo para EC equivalente a la DM, pues se ha visto que estos pacientes presentan ateroesclerosis acelerada con un riesgo relativo de EC 7,5 veces superior a la población general y de presentar el primer IAM 20 años mas joven (12-13).
Con respecto a la historia clínica, los cinco puntos mas importantes en orden decreciente son: naturaleza y calidad del dolor, la historia de EC conocida, sexo masculino, edad y, finalmente, los factores de riesgo tradicionales de EC. Específicamente con el sexo femenino, no caer en el error de descalificar por este hecho la probabilidad de tener EC (14).
Erróneamente se ha creído que porque un paciente recibió angioplastia/stent hace poco tiempo no puede estar cursando en el momento con un evento coronario, pero no se puede olvidar que este paciente está dentro del grupo de probabilidad alta y el hecho de tener un stent no desaparece la enfermedad. Estos pacientes se pueden infartar por tres mecanismos: trombosis del stent, hiperplasia intimal y progresión de la ateroesclerosis en otro lugar diferente (5).
El examen físico de los pacientes con EC por lo general tiene pocos hallazgos, pero estos se deben buscar con especial atención haciendo énfasis en: evidencia de arritmias, falla cardíaca aguda (congestión pulmonar), soplos o compromiso cardiovascular (signos de choque o bajo gasto cardíaco). Estos hallazgos no son raros y son extremadamente importantes ya que el pronóstico está directamente relacionado con su corrección (15).
Con respecto al consumo de cocaína, esto debe ser visto como una entidad aparte en la cual hay que tener otras consideraciones diferentes para esclarecer su riesgo. Se mencionan algunos de estos aspectos: entre los pacientes consumidores, el 40 % consultan al servicio de urgencias por molestia torácica y si bien, sólo del 0,7 % al 6 % de ellos tienen biomarcadores elevados, el 25 % de los IAM en la población menor de 45 años es atribuible a la cocaína (16). Se conoce también que estos pacientes tienen aumento en la demanda de oxígeno, vasoconstricción coronaria, estado protrombótico y ateroesclerosis acelerada (16,17).
Para terminar con la evaluación de la probabilidad, todos hemos visto el médico quien, inmediatamente ingresa el paciente, palpa la unión costocondral y si es dolorosa lo diagnóstica como un síndrome de Tietze, pero no se debe olvidar que hasta un 7 % de los pacientes con EC pueden tener dolor en la unión costocontral (14).
2. ESTRATIFICACIÓN DEL RIESGO
Cuando se habla de estratificar el riesgo, se divide los EC en dos: IAMST y AI/IAMNST, pero se debe entender que el riesgo no es un sistema binario (blanco o negro), sino un "continuum" (grises) (11). La importancia de la estratificación es que permite seleccionar la terapia y/o intervención que mas servirá al paciente (sopesando el riesgo- beneficio), ayuda a calcular su pronóstico y a definir el lugar donde va a permanecer (14,18).
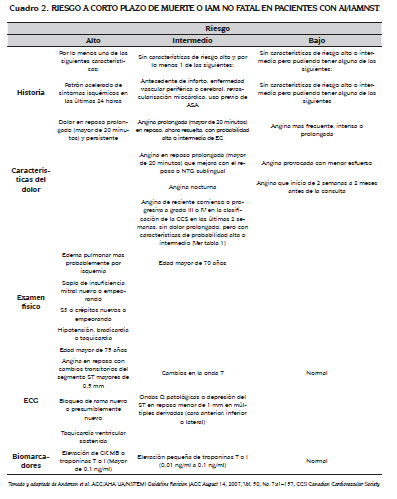
En AI/IAMNST, se habla del riesgo que tiene un paciente a corto plazo (14 a 30 días) de morir, tener un infarto no fatal o isquemia recurrente, también conocidos como MACE (Mayor Adverse Cardiac Event) (19). Cuando se analizan los subgrupos se ha visto que los rangos de morbilidad y mortalidad son muy altos, por lo que surgen herramientas aplicables a la población general, cuyo objetivo es tratar de estimar el riesgo que tiene el paciente con AI de presentar un evento adverso mayor (20-23). Si bien es cierto que el momento de mayor riesgo es en el que hay síntomas, en los pacientes con AI/IAMNST el riesgo de muerte a los 6 meses es igual al del IAMST y a los 12 meses la mortalidad, riesgo de IAM o recurrencia de la angina es superior al 10 %. Este riesgo a plazo intermedio está determinado, principalmente, por las comorbilidades (edad y reserva funcional, DM, falla renal y disfunción ventricular izquierda) (23). Lo importante es recordar que el riesgo cambia mucho y por esta razón la terapia se debe individualizar.
Existen múltiples tablas de predicción del riesgo, siendo las mas conocidas, la del Dr. Braunwald, la TIMI, la GRACE y la PURSUIT (5,20,23). De estas, las mas utilizadas en nuestro medio son la del Dr. Braunwald y TIMI (ver cuadros 2 y 3). Estas se han preferido ya que han sido validadas, son extrapolables a nuestra población, son efectivas y lo mas importante es que son fáciles de recordar y aplicar (18,22,24). También tienen la ventaja de que se utilizan al lado de la cama, es decir con información fácilmente obtenible. Cumpliendo con los estándares, el resultado de los biomarcadores debe estar en menos de 60 minutos, y en los pacientes de alto riesgo este es un lujo que no nos podemos dar y es uno de los motivos por el cual surgen estas tablas de predicción (19).
El puntaje de TIMI está determinado por la suma de las variables presentes al ingreso, 1 punto se le asigna a cada variable y son 7 variables en total: edad igual o mayor a 65 años, por lo menos tres factores de riesgo cardiovasculares, antecedente de estenosis coronaria documentada igual o mayor del 50 %, desviación del ST en el ECG, dos episodios de angina en las últimas 24 horas, uso de ASA en los últimos siete días, biomarcadores elevados
Cuando se creó la tabla TIMI fueron excluidos del estudio los pacientes que estaban pendientes de coronariografía, lo cual pudo haber creado un sesgo, y tampoco se incluyeron variables de falla cardíaca o hemodinámicas, las cuales
también pueden hablar del alto riesgo. Así que vale la pena recordar estos puntos de exclusión para incluirlos en la evaluación del riesgo (22). Igualmente esta tabla se ha empleado omitiendo un punto cuando se desconoce si hay estenosis del 50 % y ha conservado su eficacia. Si el paciente ha tenido un infarto en el pasado pero no se sabe el grado de estenosis, se le asigna un punto a este parámetro.
La tabla de riesgo GRACE, si bien no es tan empleada, tiene conceptualmente una ventaja y es que la población utilizada para su creación es mas cercana a la realidad. El otro punto importante es que incluye variables que hacen que sea mejor predictor de eventos adversos a un año (23). Su desventaja radica en que se requiere de sistemas digitales para su cálculo (computador, PDA) ya que el resultado es producto de muchas variables.
No importa la tabla que se utilice, lo importante es que se tenga familiaridad con ella, se conozcan sus ventajas y desventajas, y se conozca la población en la que se creó, para así hacer una extrapolación mas responsable. Entre las variables que se incluyen, algunas se comparten (edad, cambios electrocardiográficos, biomarcadores y signos de falla cardíaca) y otras no, por lo que pueden ser complementarias (19,23).
El subgrupo de pacientes que mas se beneficia de estas tablas es el de alto riesgo, biomarcadores elevados o cambios electrocardiográficos, ya que es en ellos en quienes hay real beneficio de revascularización durante la hospitalización (23). La conducta con los pacientes de bajo riesgo está de igual forma muy claramente definida: estudio ambulatorio idealmente en menos de 72 horas. El problema radica en los pacientes de riesgo intermedio (30 a 40 %) (19). Es esta la población que probablemente se beneficie mas de los biomarcadores, las medidas dinámicas (información obtenida en el tiempo) y nuevos factores de riesgo (entre los que se incluyen las pruebas de inducción de isquemia en forma temprana (menos de 72 horas). En estos pacientes la decisión no es fácil y por esto incluso hay evidencia que avala la coronariografía. Para los pacientes de riesgo bajo e intermedio es que se crearon las unidades de dolor torácico (14).
Para terminar con la evaluación del riesgo hablemos un poco del choque cardiogénico, principal causa de mortalidad hospitalaria por IAM (25). Tiene una incidencia del 2,5 al 8,6 %. Una vez instaurado su mortalidad es del 47 al 73 % (26,27). En esta condición se convierte en crítica la necesidad de prevenir su aparición. Lo bueno es que la oportunidad para hacerlo es alta ya que solo de 10 a 15 % de los pacientes se presenta en franco estado de choque y la mayoría lo desarrolla en promedio 4 a 6 horas luego del inicio del IAMST o a las 76 a 94 horas en el IAMNST.
La identificación temprana de predictores permitirá ajustar la terapia y así ganar tiempo mientras seleccionamos y procuramos darle al paciente la mejor terapia de reperfusión. Los principales predictores son: edad mayor de 70 años, DM, presión arterial sistólica (PAS) menor de 120, frecuencia cardíaca mayor de 110 o menor de 60, clase de Killip al ingreso mayor de 1, IAM de cara anterior extenso en el ECG, antecedente de infarto, antecedente de falla cardíaca y bloqueo de rama izquierda (28). Es fundamental reconocer el estado de hipoperfusión, el cual frecuentemente se puede presentar con PAS mayor de 90 o un "pulmón silencioso". Cuando el clínico no reconoce que la taquicardia es secundaria a la hipoperfusión y no identifica los predictores de choque corre el riesgo de iniciar la terapia errada (29). Hay que recordar que, si bien es cierto que la principal causa de choque cardiogénico es la falla ventricular izquierda, hay otras complicaciones y eventos que pueden dar origen a esta condición, por lo que aclarar la etiología es una de las indicaciones mas importantes de la ecocardiografía transtorácica (25,26,30). Mientras mas temprano se inicie la terapia de reperfusión, sin importar cuál sea la forma, menor será el riesgo de desarrollar choque posteriormente (27).
Se observa entonces que la estratificación del riesgo puede ser compleja y no es perfecta; que es facilitada por las tablas de predicción, las cuales son complementarias y que incluso están incorporando nuevas variables. Es por esto que hoy en día se está hablando y la tendencia es a utilizar modelos de riesgo dinámicos, que lo que hacen es reunir información sobre cómo le está yendo al paciente a medida que evoluciona su enfermedad. Toman la información del "día siguiente": complicaciones médicas (falla cardíaca, arritmias), laboratorio (rangos y tendencia de biomarcadores), función renal, cambios en el ECG, etc. y con esto se toma una decisión (18,19,23).
3. INTERPRETACIÓN DEL ELECTROCARDIOGRAMA
El ECG está en el centro del algoritmo diagnóstico/ terapéutico y es una herramienta fundamental que habla de pronóstico, detección de reperfusión y aparición de complicaciones eléctricas, entre otras. Es gracias a este que podemos individualizar la terapia (31).
Siempre se nos ha dicho que la sensibilidad del ECG para EC es del 50 %, así que cuando uno ve esta cifra se pregunta ¿De verdad es tan malo? Trataremos entonces de entender un poco mas este 50 %. Si el paciente tiene fiebre, tos con expectoración purulenta, disnea y una placa de Rayos X con infiltrados de tipo alveolar; y se toma un ECG, ¿mostrará cambios de enfermedad coronaria? Si por el contrario el paciente es diabético, tiene antecedente de infarto hace dos años y ahora tiene una molestia torácica descrita como dolor precordial opresivo irradiado al cuello, asociado a diaforesis, con una duración de dos horas y se le toma un ECG, ¿mostrará algo? Pues bien, suena absurdo, pero este es uno de los principios fundamentales que no debemos olvidar: la probabilidad pretest. Dicho de otra forma, la sensibilidad del ECG está determinada por la probabilidad clínica que tiene el paciente de tener una EC (3,32).
Aquí entra a jugar el concepto de electrocardiograma seriado, pues se olvida que el ECG es el registro gráfico de un proceso dinámico, es decir, es solo la foto de un instante. Pero cuando se toman ECG en forma seriada (para lo cual no hay reglas de tiempo), la sensibilidad aumenta 15 a 20 % (11,35). Se sabe también que de los pacientes que consultan con clínica sugestiva de enfermedad coronaria, del 6 al 8 % elevan biomarcadores, es decir tienen un IAMNST con electrocardiogramas normales (34). Se aprecia entonces que hay una brecha muy grande, del 50 % al 8 %, la cual está representada por los ECGs descritos como "inespecíficos". Sabiendo que del 5,7 al 11 % de los pacientes que reciben trombolisis no tienen un IAMST, y el 12 % de los que la reciben no lo debieron haber hecho, pues su diagnóstico era otro (46,47), debemos preguntarnos ¿qué está pasando? Hay muchas respuestas pero quizá la mas importante es que probablemente no somos tan buenos en la interpretación del ECG (33).
Cuando se realiza el interrogatorio al paciente, este debe ser dirigido y si la clínica es sugestiva de EC, hay que recordar que el miocardio está sufriendo y es crítico solucionar el problema tan pronto sea posible; es por esto que el ECG se debe tomar a mas tardar a los 10 minutos del ingreso (idealmente cinco). Tenemos dos opciones: hallazgos de oclusión total o parcial. Si el ECG es normal o inespecífico, realizaremos ECG seriados (incluso cada 15 minutos) con el fin de identificar los cambios lo mas temprano posible. Un momento frecuentemente olvidado para la toma del ECG es luego de haber realizado las intervenciones iníciales o cuando el dolor ha mejorado. Este ECG, aproximadamente 15 a 20 minutos después, lo tomamos con el objetivo de buscar cambios dinámicos, los cuales, de estar presentes, hablan de alto riesgo.
El primer cambio de oclusión total que se debe buscar activamente es la onda T hiperaguda, que se presenta por lo general en los primeros 30 minutos y para que sea significativa debe ser ≥ 2/3 de la onda R en altura (37). Si este hallazgo está presente se debe seguir al paciente muy estrechamente con ECG seriados para detectar la elevación del segmento ST lo mas temprano posible y poder iniciar la terapia de reperfusión (35).
El otro hallazgo de oclusión total es la elevación del segmento ST. La inadecuada interpretación de este signo es uno de los puntos críticos de error. La elevación del segmento ST es un hallazgo tan frecuente en la población que ya no se considera una variante de lo normal. Se ha encontrado presente entre el 30 % y 93 % de los hombres y el 20 % de las mujeres (37). Hay muchas condiciones, incluyendo las normales, en las que se puede encontrar, por lo que este hallazgo se considera no específico de EC. Entre ellas están: patrón de repolarización precoz, hipertrofia ventricular izquierda, bloqueo de rama izquierda, pericarditis, hipercalemia, síndrome de Brugada, cardioversión, angina de Prinzmetal, embolismo pulmonar y las normales, por mencionar algunas (38).
Ahora bien: ¿cómo saber que la elevación del ST que tiene el paciente es de EC? Lo primero y mas importante es tener el contexto clínico adecuado. Además de esto, conocer las enfermedades simuladoras y enmascaradoras con sus características electrocardiográficas respectivas, tomar ECG seriados y/o previos para comparar, comprender los cambios electrocardiográficos y usar en forma selectiva la ecocardiografía (35,38). Comprender los cambios electrocardiográficos es importante, pues aumenta la especificidad. Ya se habló de uno: la onda T hiperaguda. Se tienen también la morfología del ST elevado recto o convexo, los cambios en espejo y los cambios correspondientes a topografías arteriales claras (cambios en la cara inferior, por compromiso de la arteria coronaria derecha o circunfleja; cara anterior, por compromiso de la coronaria descendente anterior; o cara lateral, por compromiso de la arteria circunfleja).
Se deben recordar ciertos principios básicos que pueden dificultar el diagnóstico, pues hay topografías que son relativamente ocultas, por ejemplo: la cara posterior, la cara lateral o el ventrículo derecho (39,40). Por lo que si el contexto clínico es sugestivo de EC y el ECG no es claro, debemos considerar tomar derivadas derechas o posteriores. Otro de los principios básicos, es que el grado de elevación del ST depende de varios factores, entre los que se encuentran la distancia entre el electrodo y el corazón, aspecto importante, por ejemplo, en los pacientes obesos o con EPOC. Lo anterior se debe tener en cuenta al momento de considerar una elevación del ST como significativa (2 mm en V2 - V3 ó 1 mm en las otras derivadas o en mujeres) (33,41). Notarán que no se ha mencionado el punto J: hay quienes lo utilizan, pero tiene sus detractores, ya que no siempre es fácil de reconocer y por ende se utiliza mas en investigación que en la clínica.
Luego se tienen los cambios de oclusión parcial. De estos, los de alto riesgo son el infradesnivel del ST y los cambios dinámicos. El infradesnivel para ser considerado significativo debe ser de 0,5 mm en V2 - V3 ó de 1 mm en las otras derivadas (41). Antes de ser considerado un ST infradesnivelado hay que descartar que estos cambios no sean el espejo de un IAMST, sobre todo cuando es en V1, V2 o incluso hasta V3 en los infartos de cara posterior; o en AVL cuando es de la cara inferior (40). Una vez descartado esto, se debe mirar la morfología. Es mas específico de EC cuando el ST es infradesnivelado recto o con pendiente descendente, y no cuando la pendiente es ascendente. Estos cambios igualmente corresponden a topografías arteriales y mientras mas derivadas estén comprometidas peor el pronóstico.
Nunca se debe olvidar mirar la derivada aVR. Un concepto básico de electrofisiología señala que el vector va dirigido a la zona de mayor isquemia. Cuando se tienen cambios de infradesnivel extensos o difusos, se tiene que considerar la posibilidad de isquemia muy extensa en el ventrículo izquierdo y dado que la mayor masa miocárdica está en la base del corazón, el vector se invierte y es por esto que podemos encontrar elevación del ST en aVR. Este hallazgo se ha correlacionado con enfermedad de tronco o tres vasos y una mortalidad que alcanza casi el 20 % (42,43).
Finalmente se tienen los cambios de la onda T. La tabla de predicción de riesgo del Dr. Braunwald y acogida por las Guías de la AHA, plantea que los cambios de la onda T son de riesgo intermedio. El problema está en que son muchos los cambios que puede tener la onda T y no todos son tan inocuos (52). La onda T invertida simétrica que indica isquemia es aquella en la que su profundidad es de 1 mm, es decir no es un cambio muy marcado. Lo crítico es que la onda T también se invierte en la reperfusión o en la pseudonormalización (14).
Cuando se habla de reperfusión, se está diciendo que el paciente se ha infartado ya, por lo tanto, en caso de tener dolor, su riesgo sería alto. Esta condición se diferencia porque el paciente tiene historia clínica sugestiva, hay alteraciones del QRS y la onda T puede ser mas profunda. La otra condición en que se puede presentar la reperfusión es en el Síndrome de Wellens. En ella hay estenosis crítica del tronco o de la arteria coronaria descendente anterior, esta se ha ocluido, y gracias al sistema lítico endógeno ha recanalizado. Como ha reperfundido, al momento de consultar, el paciente ya no tiene dolor o clínica sugestiva y los biomarcadores pueden ser normales. En esta entidad la posibilidad de infarto en las siguientes tres semanas es del 75 % aun con tratamiento médico si no se realiza una intervención de revascularización miocárdica invasiva. Por lo anterior esta también es una entidad de alto riesgo. El Síndrome de Wellens tiene dos patrones electrocardiográficos: el tipo A con una onda T bifásica de V2 a V4 (fácil de pasar por alto), y el tipo B con ondas T invertidas muy profundas (si bien ondas T invertidas por encima de 2 mm, deben preocupar), con un QTc que está alrededor de 450 mseg (45). En la tercera condición, la pseudonormalización, el paciente ingresa con clínica sugestiva de EC y el ECG muestra una onda T normal, le tomamos un ECG 20 minutos después (cuando ha mejorado el dolor y/o con las intervenciones que hemos hecho), y vemos que ya la onda T esta invertida. Esto nos habla de cambios dinámicos y por ende es de alto riesgo.
4. CORRECTA UTILIZACIÓN DE LOS BIOMARCADORES
Los biomarcadores son otra de las herramientas diagnósticas y pronósticas con que se cuenta (11). Con la necrosis o injuria miocárdica hay compromiso de la integridad de las membranas celulares y liberación de proteínas estructurales y macromoléculas a la circulación (46). Estos biomarcadores indican necrosis o injuria miocárdica pero no descartan la enfermedad ateroesclerótica - angina (47). Con el tiempo los biomarcadores han cambiado, aumentando cada vez mas la sensibilidad y especificidad (48). Se tiene desde hace algún tiempo a las troponinas T e I, proteínas que pueden ser medidas "fácilmente", con la gran ventaja de ser 30 % mas sensibles y mucho mas específicas que la CK-MB (14,47). Las troponinas son hoy en día, sin duda alguna, el marcador por excelencia de necrosis miocárdica (46,47,49).
Para el diagnóstico de IAM se requiere un contexto clínico adecuado y biomarcadores elevados, mas cualquiera de los siguientes: síntomas de isquemia, cambios nuevos del segmento ST u onda T, bloqueo nuevo de rama izquierda del haz de His, nuevas ondas Q patológicas o evidencia imagenológica de pérdida de miocardio viable o alteraciones del movimiento de la pared. Como se aprecia el contexto clínico y los biomarcadores son los criterios indispensables para el diagnóstico de IAM en ausencia de anatomía patológica que lo confirme (50). La sensibilidad de los biomarcadores también depende de la probabilidad pretest, por lo que considerar estos exámenes como una prueba tamiz o solicitarlos "por protocolo", es un error que lo que hace es que orientemos nuestro esfuerzo frecuentemente en la dirección equivocada y que mal gastemos recursos (46).
Las isoenzimas de Creatin Kinasa (CK) son dímeros de cadenas B o M. Existen tres combinaciones: BB, MM o MB. Estas enzimas se encuentran en el citosol y su función es facilitarle a la mitocondria la entrada o salida de fosfatos de alta energía. El porcentaje de la fracción MB que está en el corazón es mayor que en los otros tejidos; sin embargo, el músculo esquelético puede llegar a tener hasta el 10 % de la proteína de la cadena B, con el agravante de que los músculos tienen mas CK por gramo de tejido que el corazón. La CK-MB se encuentra también, aunque en menor medida, en intestino, diafragma, útero y próstata, por lo que no es específica y se puede elevar en condiciones que afecten estos órganos, y valga la aclaración, no con inyecciones intramusculares (48). Dicho de otra forma son específicas cuando no hay lesión en estos órganos. Cuando hay lesión musculo-esquelética asociada, la especificidad se ha intentado mejorar con la relación CK-MB/CK total, el problema es que la sensibilidad disminuye cuando el problema es agudo, y si el problema es crónico se reduce también la especificidad (47,48,51). Por lo anterior no se recomienda.
De forma similar, esperar que la CK total se eleve por lo menos dos veces el valor normal para poder considerar la elevación de la CK-MB como positiva es también un error (52,53). La enzima CK-MB comienza a elevarse a las tres o cuatro horas y persiste así por 48-72 horas. Es por su duración que es el biomarcador disponible de elección para el diagnóstico de re-infarto entre las 48 horas y las dos semanas. La sensibilidad de esta prueba cuando se toma solo una vez (al momento de la presentación al servicio de urgencias) alcanza a ser tan baja como del 47 %, pero cuando se toman en forma seriada, es decir, seis a nueve horas después, su sensibilidad es superior al 90 % (24). Debido a que su especificidad no es tan alta, la recomendación es tener dos valores por encima del percentil 99 de la población (tres desviaciones estándar) (60), y mejor aun, una tendencia al aumento. Cuando no disponemos de las troponinas, la medición de la CK-MB por análisis de masa -y no por medición de actividad (menos sensible y tiene falsos positivos al detectar macrokinasas) (48)- es la alternativa aceptada como recomendación clase I con nivel de evidencia A (46).
Las troponinas son un complejo de proteínas (I, C y T) que regulan la interacción actina - miosina modulada por el calcio. La isoforma cardiaca C también la tiene el músculo liso por lo que no es específica y no se utiliza. La troponina cardiaca I es específica del corazón. Las isoformas de troponinas cardiacas T son varias pero los anticuerpos que se utilizan hoy en día son específicos para la del corazón (47,54). No se debe confundir esta especificidad con el mecanismo de lesión, pues igualmente se puede elevar en diferente medida en: TEP, disección aórtica, pericarditis aguda, falla cardíaca aguda o severa, miocarditis, sepsis y/o choque, entre otros (54,55).
Entre las causas de diagnóstico diferencial no se incluyó la cardioversión, pues se conoce que ante la presencia de arritmias malignas y cardioversión, las enzimas positivas son mas de isquemia subyacente y no de lesión por corriente eléctrica (54). Con los pacientes que están en diálisis hay que recordar que la causa mas común de muerte es la cardiovascular, así es que si el paciente se presenta con clínica sugestiva, la interpretación de biomarcadores no debe cambiar. Anteriormente se prefería en este grupo poblacional la troponina I, pero con las pruebas actuales se sabe que la T es igualmente específica. Una prueba positiva en estos pacientes se debe interpretar como de lesión miocárdica y si no se tiene un valor basal la tendencia aclarará si se trata de un evento agudo o no. En los pacientes con insuficiencia renal y sin diálisis, la interpretación es igual ya que el problema no es de eliminación urinaria (47,49,54).
Con las troponinas actuales la elevación puede comenzar a las tres a cuatro horas, pero puede tardarse hasta nueve a 12. Por esto es que es crítico tomar el examen seis a nueve horas después del inicio de los síntomas y así obtener mayor sensibilidad (49). Continúan su ascenso por cuatro a siete días, la troponina I, y 10 a 14 días, la troponina T. Esta mayor ventana ha permitido la detección de un mayor número de pacientes (49). Similar a como ocurre con la CK-MB, la liberación inicial/aguda corresponde a pequeñas cantidades libres que hay en el citosol (3 a 6 %). En teoría, esta es la troponina que corresponde a injuria ya que es reversible pues no se ha dañado el aparato contráctil, incluso con una duración en sangre mucho menor. Hasta la fecha este es un hecho teórico y toda elevación debe considerarse de necrosis (47,49). La liberación posterior de troponinas depende de la degradación de miofilamentos. Esta cinética característica de liberación es la explicación por la cual estos dos biomarcadores no permiten hacer el diagnóstico de infarto en las primeras tres horas y que su máxima sensibilidad sea alrededor de las seis horas. A diferencia de la CK- MB con las troponinas basta con tener un solo resultado por encima del percentil 99 para ser diagnóstico de necrosis miocárdica.
Debido a que en el mercado existen múltiples pruebas con anticuerpos diferentes, reconociendo epítopes diferentes, con estabilidades, coeficientes de variabilidad y calibración diferente, se recomienda que si el valor está muy cercano al límite de referencia, se solicite un segundo valor y se mire la tendencia (49). El conocimiento de la cinética nos da otro concepto fundamental y es este uno de los puntos críticos donde mas errores se comete: no se puede esperar el resultado de los biomarcadores para la toma de la decisión en los pacientes de mas alto riesgo (46), mas aun cuando se trata de un IAMST, en donde el resultado final está estrechamente relacionado con la intervención terapéutica temprana (46,47).
La segunda función de los biomarcadores de lesión miocárdica, es el pronóstico, es decir, estratifica el riesgo siendo un factor independiente y aditivo (11,49). En los pacientes con IAMNST se ha visto que mientras mas alto el valor mas extensa y compleja es la lesión, mas frecuentemente hay asociación con trombo y mas severamente está comprometido el flujo. Esto se ha traducido a mayor probabilidad de malos resultados en la angioplastia. La repercusión clínica de esto es que mientras mas alto el valor de los biomarcadores mayor es la mortalidad o riesgo de IAM a corto (30 días) y largo plazo (un año) (11). Comparado con los pacientes con biomarcadores normales la mortalidad o un nuevo IAM es aproximadamente cuatro veces superior (46). Por ende, estos pacientes son los que mas se benefician de la terapia de anticoagulación, doble antiagregación y una estrategia de revascularización miocárdica invasiva temprana (11,14) versus selectiva (56,57). Es decir, los biomarcadores ayudan en la toma de la decisión terapéutica (11,46,47).
Llevando esta información a la práctica, y una vez se haya definido que el paciente tiene un EC, pues ya es obvio por la probabilidad clínica, se le toma un ECG para ver qué tipo de EC tiene ¿IAMST o AI/IAMNST?
IAMST. No esperar los biomarcadores para tomar la decisión: Reperfusión. La definición patológica de necrosis miocárdica es la de coagulación y necrosis en banda de contracción. Se sabe que a los 20 minutos hay muerte celular, pero cuando han pasado dos a cuatro horas en promedio, la mayoría de las células miocárdicas que estaban en riesgo mueren. Si se correlaciona con la fibrinólisis se comprende porqué el mayor impacto en la sobrevida se logra cuando la reperfusión se da en las primeras tres horas. En números absolutos, por cada hora que se retrase el inicio de la fibrinólisis, se están dejando de salvar 1,6 vidas por cada 1 000. En conclusión la fibrinólisis salva muchas vidas y mientras mas rápido, mucho mejor (58,59).
Angina inestable:
Riesgo alto: Como se vio hay múltiples factores con los que se puede definir el riesgo: historia o evolución, características del dolor, examen físico, ECG, co-morbilidades, edad y biomarcadores. Es decir que los biomarcadores son solo uno de los múltiples factores de alto riesgo y no se necesitan los biomarcadores para saber qué se tiene que hacer con el paciente mientras llegan (47).
Riesgo intermedio o bajo: En este grupo de pacientes ya no hay dolor y no hay factores de alto riesgo. Este es el paciente en el que la estratificación del riesgo requiere un poco mas de información con el fin de que no se nos pasen por alto, pues su riesgo aun puede ser considerable. Aquí es donde mayor impacto tienen los biomarcadores, pues un hallazgo positivo lo hace inmediatamente de alto riesgo (IAMNST). Un hallazgo negativo tranquiliza y permite un estudio mas conservador (47).
IAMNST. Conducta: anticoagulación, doble antiagregación y estrategia de revascularización miocárdica, probablemente invasiva temprana. En este grupo hay un porcentaje de pacientes (2-15 %) que se benefician de terapia invasiva inmediata: estos son: angina severa persistente, cambios dinámicos o marcados del ECG, arritmias malignas o inestabilidad hemodinámica (11).
Conocer muy bien esta información es fundamental por las condiciones del país, es decir: se sabe que el resultado de los biomarcadores para que cumpla con los estándares debe estar en 60 minutos (11,19), lo cual no siempre es posible. Conocemos también que se tiene que trabajar con el percentil 99 de nuestra población, la cual nosotros no siempre conocemos y lo que se tiene es el rango de referencia del laboratorio. ¿Qué hacer? Sencillamente nos guiamos por el valor superior de este, pues ya sabemos que mas importante que el valor es su tendencia. Sabemos que las troponinas no son cubiertas por la mayoría de las EPS/EPS-S y por ende tienen que ser pagadas por el paciente y su familia. Se podría decir que es un examen tan bueno, que su costo es "relativamente bajo" para el impacto que tiene; pero eso es porque los médicos desconocen que este "relativamente bajo" puede representar para la mayoría de la población colombiana una cuantía muy importante. Lo otro que desconocemos los médicos es que así como existe un comité técnico científico (CTC) para los medicamentos, también lo hay para las pruebas diagnósticas.
Hemos terminado esta revisión donde se analizaron los cuatro puntos críticos donde se comenten la mayoría de los errores. Esperamos que ahora la compresión de las herramientas con que se cuenta para la aproximación diagnóstica sea mucho mayor y lo mas importante, los beneficiados muchos mas.
REFERENCIAS
1. Dirección Seccional de Salud de Antioquia. Mortalidad por algunas causas de Antioquia 2008 por municipios, casos y tasas. (Sitio en Internet). Hallado en URL: http:// www.dssa.gov.co/, acceso en julio 6 de 2009 [ Links ]
2. Así vamos en salud. 10 primeras causas de muerte 1980 - 1985 - 1990 - 2000 - 2005. (Sitio en Internet). Seguimiento al sector salud en Colombia,. Hallado en URL:http://www.asivamosensalud.org/. Acceso en julio 6 de 2009 [ Links ]
3. Boie ET. Initial Evaluation of Chest Pain. Emerg Med Clin North Am. 2005 Nov;23(4):937-57. Review. [ Links ]
4. Ringstrom E, Freedman J. Approach to Undifferentiated Chest Pain in the Emergency Department: A Review of Recent Medical Literature and Published Practice Guidelines. Mt Sinai J Med. 2006 Mar;73(2):499- 505. Review [ Links ]
5. Braunwald's Heart Disease: A Textbook of Cardiovascular Medicine, 8th ed. [ Links ]
6. National Heart, Blood, Lung and Blood Institute. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC 7). (Sitio en Internet) URL: http://www.nhlbi.nih.gov/guidelines/%20hypertension/. Acceso en nov 25 de 2009 [ Links ]
7. National Heart, Lung and Blood Institute and Boston University, History of the Framingham Heart Study.. Framingham Heart Study. Hallado en URL: http://www.framinghamheartstudy.org/, acceso en julio 21 de 2009 [ Links ]
8. Goldberg R. Cardiovascular disease in patients who have diabetes. Cardiol Clin. 2003 Aug;21(3):399-413, vii. [ Links ]
9. Antman EM, Cohen M, Bernink PJ, McCabe CH, Horacek T, Papuchis G, Mautner B, Corbalan R, Radley D, Braunwald E. The TIMI risk score for unstable angina/non-ST elevation MI: A method for prognostication and therapeutic decision making. JAMA. 2000 Aug 16;284(7):835-42.. [ Links ]
10. National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation. 2002 Dec 17;106(25):3143-421 [ Links ]
11. Task Force for Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of European Society of Cardiology, Bassand JP, Hamm CW, Ardissino D, Boersma E, Budaj A, Fernández-Avilés F, Fox KA, Hasdai D, Ohman EM, Wallentin L, Wijns W. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. Eur Heart J. 2007 Jul;28(13):1598-660. Epub 2007 Jun 14. [ Links ]
12. Lash AA, Lusk B. Systemic lupus erythematosus in the intensive care unit. Crit Care Nurse. 2004 Apr;24(2):56-60, 62-5. [ Links ]
13. Hahn BH. Systemic Lupus Erythematosus and Accelerated Atherosclerosis. N Engl J Med. 2003 Dec 18;349(25):2379-80. [ Links ]
14. American Heart Asocciation. Guidelines for the Management of Patients With Unstable Angina/Non-ST-Elevation Myocardial Infarction. JACC Vol. 50, No. 7, 2007, August 14: e1-157 [ Links ]
15. Hollenberg SM. Recognition and treatment of cardiogenic shock. Semin Respir Crit Care Med. 2004 Dec;25(6):661-71. [ Links ]
16. McCord J, Jneid H, Hollander JE, de Lemos JA, Cercek B, Hsue P, Gibler WB, Ohman EM, Drew B, Philippides G, Newby LK; American Heart Association Acute Cardiac Care Committee of the Council on Clinical Cardiology. Management of cocaine-associated chest pain and myocardial infarction: a scientific statement from the American Heart Association Acute Cardiac Care Committee of the Council on Clinical Cardiology. Circulation. 2008 Apr 8;117(14):1897-907. Epub 2008 Mar 17. [ Links ]
17. Hollander JE, Henry TD. Evaluation and management of the patient who has cocaine- associated chest pain. Cardiol Clin. 2006 Feb;24(1):103-14. [ Links ]
18. Morrow DA, Antman EM, Snapinn SM, Mc- Cabe CH, Theroux P, Braunwald E. An integrated clinical approach to predicting the benefit of tirofiban in non-ST elevation acute coronary syndromes. Application of the TIMI Risk Score for UA/NSTEMI in PRISMPLUS. Eur Heart J. 2002 Feb;23(3):223-9. [ Links ]
19. Vesely MR, Kelemen MD. Cardiac risk assessment: matching intensity of therapy to risk. Cardiol Clin. 2006 Feb;24(1):67-78. [ Links ]
20. GRACE Risk Score Calculator - Web Version (Sitio en Internet). GRACE, Global Registry of Acute Coronary Events, Hallado en URL: http://www.outcomes-umassmed.org, acceso en julio 21 de 2009 [ Links ]
21. Christopher P. Cannon, MD, Acute Coronary Syndromes: Risk Stratification and Initial Management, Cardiol Clin 23 (2005) 401-409 [ Links ]
22. Ohman EM, Granger CB, Harrington RA, Lee KL. Risk stratification and therapeutic decision making in acute coronary syndromes. JAMA. 2000 Aug 16;284(7):876-8 [ Links ]
23. de Araújo Gonçalves P, Ferreira J, Aguiar C, Seabra-Gomes R. TIMI, PURSUIT, and GRACE risk scores: sustained prognostic value and interaction with revascularization in NSTE-ACS. Eur Heart J. 2005 May;26(9):865-72. Epub 2005 Mar 11. [ Links ]
24. Pope JH, Selker HP. Acute coronary syndromes in the emergency department: diagnostic characteristics, tests, and challenges. Cardiol Clin. 2005 Nov;23(4):423-51, v-vi. [ Links ]
25. Gurm HS, Bates ER. Cardiogenic shock complicating myocardial infarction. Crit Care Clin. 2007 Oct;23(4):759-77, vi. [ Links ]
26. Topalian S, Ginsberg F, Parrillo JE. Cardiogenic shock. Crit Care Med. 2008 Jan;36(1 Suppl):S66-74. [ Links ]
27. Hochman JS, Sleeper LA, Webb JG, Sanborn TA, White HD, Talley JD, Buller CE, Jacobs AK, Slater JN, Col J, McKinlay SM, LeJemtel TH. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med. 1999 Aug 26;341(9):625-34. [ Links ]
28. Hollenberg SM. Recognition and treatment of cardiogenic shock. Semin Respir Crit Care Med. 2004 Dec;25(6):661-71. [ Links ]
29. Canadian Cardiovascular Society; American Academy of Family Physicians; American College of Cardiology; American Heart Association, Antman EM, Hand M, Armstrong PW, Bates ER, Green LA, Halasyamani LK, Hochman JS, Krumholz HM, Lamas GA, Mullany CJ, Pearle DL, Sloan MA, Smith SC Jr, Anbe DT, Kushner FG, Ornato JP, Pearle DL, Sloan MA, Jacobs AK, Adams CD, Anderson JL, Buller CE, Creager MA, Ettinger SM, Halperin JL, Hunt SA, Lytle BW, Nishimura R, Page RL, Riegel B, Tarkington LG, Yancy CW. 2007 focused update of the ACC/ AHA 2004 guidelines for the management of patients with ST-elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2008 Jan 15;51(2):210-47. [ Links ]
30. Menon V, Hochman JS. Management of cardiogenic shock complicating acute myocardial infarction. Heart. 2002 Nov;88(5):531-7. [ Links ]
31. Wagner G, Lim T, Gettes L, Gorgels A, Josephson M, Wellens H, Anderson S, Childers R, Clemmensen P, Kligfield P, Macfarlane P, Pahlm O, Selvester R. Consideration of pitfalls in and omissions from the current ECG standards for diagnosis of myocardial ischemia/infarction in patients who have acute coronary syndromes. Cardiol Clin. 2006 Aug;24(3):331-42, vii. [ Links ]
32. Restrepo JH, Maya Mejía JM. Epidemiología Básica y Principios de la Investigación. En: Fundamentos de Salud Pública, Tomo III, Primera Edición, CIB, 1995 [ Links ]
33. Atar S, Barbagelata A, Birnbaum Y. Electrocardiographic diagnosis of ST-elevation myocardial infarction. Cardiol Clin. 2006 Aug;24(3):343-65, vii. [ Links ]
34. Smith SW, Whitwam W. Acute Coronary Syndromes. Emerg Med Clin North Am. 2006 Feb;24(1):53-89, vi. [ Links ]
35. Cannon CP, Bahit MC, Haugland JM, Henry TD, Schweiger MJ, McKendall GR, Shah PK, Murphy S, Gibson CM, McCabe CH, Antman EM, Braunwald E. Underutilization of Evidence-Based Medications in Acute ST Elevation Myocardial Infarction: Results of the Thrombolysis in Myocardial Infarction (TIMI) 9 Registry. Crit Pathw Cardiol. 2002 Mar;1(1):44-52. [ Links ]
36. W ang K, Asinger RW, Marriott HJ. ST-segment elevation in conditions other than acute myocardial infarction. N Engl J Med. 2003 Nov 27;349(22):2128-35.. [ Links ]
37. Morris ,Edhouse J,Brady W, Camm J.ABC of clinical electrocardiography, BMJ Books, 2003 [ Links ]
38. Rautaharju PM, Surawicz B, Gettes LS, Bailey JJ, Childers R, Deal BJ, Gorgels A, Hancock EW, Josephson M, Kligfield P, Kors JA, Macfarlane P, Mason JW, Mirvis DM, Okin P, Pahlm O, van Herpen G, Wagner GS, Wellens H; American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; American College of Cardiology Foundation; Heart Rhythm Society. AHA/ACCF/HRS recommendations for the standardization and interpretation of the electrocardiogram: part IV: the ST segment, T and U waves, and the QT interval: a scientific statement from the American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; the American College of Cardiology Foundation; and the Heart Rhythm Society. Endorsed by the International Society for Computerized Electrocardiology. J Am Coll Cardiol. 2009 Mar 17;53(11):982-91. [ Links ]
39. Zimetbaum PJ, Josephson ME. Use of the electrocardiogram in acute myocardial infarction. N Engl J Med 2003;348:933-4 N Engl J Med. 2003 Mar 6;348(10):933-40. 0 [ Links ]
40. Hein JJ. Wellens L, Anton PM, Gorgels M, Doevendans PA. The ECG in acute myocardial infarction and unstable angina, dagnosis and risk stratification. Kluwer Academic Publishers, 2003 [ Links ]
41. Wagner GS, Macfarlane P, Wellens H, Josephson M, Gorgels A, Mirvis DM, Pahlm O, Surawicz B, Kligfield P, Childers R, Gettes LS, Bailey JJ, Deal BJ, Gorgels A, Hancock EW, Kors JA, Mason JW, Okin P, Rautaharju PM, van Herpen G; American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; American College of Cardiology Foundation; Heart Rhythm Society. AHA/ ACCF/HRS recommendations for the standardization and interpretation of the electrocardiogram: part VI: acute ischemia/infarction: a scientific statement from the American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; the American College of Cardiology Foundation; and the Heart Rhythm Society. Endorsed by the for Computerized Electrocardiology. International Society. J Am Coll Cardiol. 2009 Mar 17;53(11):1003-11. [ Links ]
42. Williamson K, Mattu A, Plautz CU, Binder A, Brady WJ. Electrocardiographic applicat Am J Emerg Med. 2006 Nov;24(7):864-74. American Journal of Emergency Medicine (2006) 24, 864-874 [ Links ]
43. Barrabés JA, Figueras J, Moure C, Cortadellas J, Soler-Soler J. Prognostic value of lead aVR in patients with a first non-ST-segment elevation acute myocardial infarction. Circulation. 2003 Aug 19;108(7):814-9. Epub 2003 Jul 28. [ Links ]
44. Atar S, Barbagelata A, Birnbaum Y. Electrocardiographic markers of reperfusion in ST-elevation myocardial infarction. Cardiol Clin. 2006 Aug;24(3):367-76, viii. [ Links ]
45. Tandy TK, Bottomy DP, Lewis JG: Wellens' syndrome. Ann Emerg Med March 1999;33:347-351 [ Links ]
46. Morrow DA, Cannon CP, Jesse RL, Newby LK, Ravkilde J, Storrow AB, Wu AH, Christenson RH; National Academy of Clinical Biochemistry. National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines: Clinical characteristics and utilization of biochemical markers in acute coronary syndromes. Circulation. 2007 Apr 3;115(13):e356-75. Epub 2007 Mar 23. [ Links ]
47. Jaffe AS. Use of biomarkers in the emergency department and chest pain unit. Cardiol Clin. 2005 Nov;23(4):453-65, vi. [ Links ]
48. Adams JE 3rd, Abendschein DR, Jaffe AS. Biochemical markers of myocardial injury. Is MB creatine kinase the choice for the 1990s? Circulation. 1993 Aug;88(2):750-63. [ Links ]
49. Jaffe AS, Ravkilde J, Roberts R, Naslund U, Apple FS, Galvani M, Katus H. It's time for a change to a troponin standard. Circulation. 2000 Sep 12;102(11):1216-20. [ Links ]
50. Thygesen K, Alpert JS, White HD; Joint ESC/ ACCF/AHA/WHF Task Force for the Redefinition of Myocardial Infarction. Universal definition of the myocardial infarction. Kardiol Pol. 2008 Jan;66(1):47-62. [ Links ]
51. Adams JE 3rd, Bodor GS, Dávila-Román VG, Delmez JA, Apple FS, Ladenson JH, Jaffe AS. Cardiac troponin I. A marker with high specificity for cardiac injury. Circulation. 1993 Jul;88(1):101-6 [ Links ]
52. Lloyd-Jones DM, Camargo CA Jr, Giugliano RP, Walsh CR, O'Donnell CJ. Characteristics and prognosis of patients with suspected acute myocardial infarction and elevated MB relative index but normal total creatine kinase. Am J Cardiol. 1999 Nov 1;84(9):957-62 [ Links ]
53. Galla JM, Mahaffey KW, Sapp SK, Alexander JH, Roe MT, Ohman EM, Granger CB, Armstrong PW, Harrington RA, White HD, Simoons ML, Newby LK, Califf RM, Topol EJ. Elevated creatine kinase-MB with normal creatine kinase predicts worse outcomes in patients with acute coronary syndromes: results from 4 large clinical trials. Am Heart J. 2006 Jan;151(1):16-24. [ Links ]
54. Tsai SH, Chu SJ, Hsu CW, Cheng SM, Yang SP. Use and interpretation of cardiac troponins in the ED. Am J Emerg Med. 2008 Mar;26(3):331-41 [ Links ]
55. Roongsritong C, Warraich I, Bradley C. Common causes of troponin elevations in the absence of acute myocardial infarction: incidence and clinical significance. Chest. 2004 May;125(5):1877-84. [ Links ]
56. Hoenig MR, Doust JA, Aroney CN, Scott IA. Early invasive versus conservative strategies for unstable angina & non-STelevation myocardial infarction in the stent era. Cochrane Database Syst Rev. 2006 Jul 19;3:CD004815. [ Links ]
57. de Winter RJ, Windhausen F, Cornel JH, Dunselman PH, Janus CL, Bendermacher PE, Michels HR, Sanders GT, Tijssen JG, Verheugt FW; Invasive versus Conservative Treatment in Unstable Coronary Syndromes (ICTUS) Investigators. Early invasive versus selectively invasive management for acute coronary syndromes. N Engl J Med. 2005 Sep 15;353(11):1095-104. [ Links ]
58. Kushner FG, Hand M, Smith SC Jr, King SB 3rd, Anderson JL, Antman EM, Bailey SR, Bates ER, Blankenship JC, Casey DE Jr, Green LA, Hochman JS, Jacobs AK, Krumholz HM, Morrison DA, Ornato JP, Pearle DL, Peterson ED, Sloan MA, Whitlow PL, Williams DO. 2009 Focused Updates: ACC/AHA Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction (Updating the 2004 Guideline and 2007 Focused Update) and ACC/AHA/ SCAI Guidelines on Percutaneous Coronary Intervention (Updating the 2005 Guideline and 2007 Focused Update) A Report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines.J Am Coll Cardiol. 2009 Dec 1;54(23):2205-2241. [ Links ]
59. Al-Mubarak N, Rogers WJ, Lambrew CT, Bowlby LJ, French WJ. Consultation before thrombolytic therapy in acute myocardial infarction. Second National Registry of Myocardial Infarction (NRMI 2) Investigators. Am J Cardiol. 1999 Jan 1;83(1):89-93, A8. [ Links ]
Recibido en: mayo de 2009. Revisado en: junio de 2009. Aceptado en: noviembre 13 de 2009
Forma de citar: Duque C, Ochoa FL. Aproximación al paciente con molestia torácica de origen coronario. Rev CES Med 2009; 23(2):21-38