Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
CES Medicina
versión impresa ISSN 0120-8705
CES Med. v.24 n.1 Medellín ene./jun. 2010
REVISIÓN DE TEMA
Manejo actual del trauma encéfalo craneano severo en niños
Current management of severe traumatic brain injury in children
MAURICIO FERNÁNDEZ-LAVERDE1, JULIO NICOLÁS TORRES-OSPINA2
1 Pediatra Intensivista, Jefe UCIP CORBIC, Coordinador Pediatría Clínica SOMA, Coordinador Programa cuidado intensivo pediátrico CES. Coordinador Grupo Investigación Pediatría CES
2 Pediatra Intensivista. Hospital General de Medellín y Hospital Pablo Tobón Uribe
RESUMEN
El trauma encéfalo craneano se define como todo trauma craneano causado por fuerzas externas que resultan en alteraciones anatómicas o funcionales del encéfalo y sus envolturas. Es responsable del 9 al 35 % de las muertes accidentales en la niñez. La mortalidad está en relación con la edad de presentación y con factores al momento del trauma, como otros traumas y la presencia de hipotensión e hipoxia. El manejo se inicia desde el servicio de urgencias con una agresiva resucitación que evite precisamente la hipoxia y la hipotensión. Ya en la unidad de cuidados intensivos pediátricos el manejo de la hipertensión endocraneana es fundamental. Dentro de los objetivos de manejo está el de mantener una presión endocraneana menor a 20 mmHg y en los lactantes menor a 15 mmHg, y además mantener una adecuada presión de perfusión. En este artículo se revisan las principales terapias disponibles para conseguir estos objetivos.
PALABRAS CLAVES
Traumatismo encefálico, Cerebro, Hipertensión Intracraneal, Niños, Unidades de cuidado intensivo pediátrico
ABSTRACT
Traumatic brain injury is defined as any head injury caused by external forces that result in anatomical or functional abnormalities of the brain and its envelopes. It accounts for 9 to 35% of accidental deaths in childhood. Mortality is related to age and certain factors at the time of trauma, like other traumas and the presence of hypotension and hypoxia. Its management starts in the emergency department with an aggressive resuscitation to avoid hypoxia and hypotension. Once in the pediatric intensive care unit management of intracranial hypertension is essential. Within the management objectives is to keep intracranial pressure below 20 mmHg and in infants less than 15 mmHg and to maintain an adequate perfusion pressure. This article reviews the main therapies available now to achieve these objectives.
KEY WORDS
Traumatic brain injury, Cerebrum, Intracranial Hypertension, Children, Intensive Care Units, Pediatric
DEFINICIÓN
El trauma encéfalo craneano (TEC) puede ser definido como todo trauma craneano causado por una fuerza externa que tiene como resultado una alteración a nivel anatómico y/o funcional (motora, sensorial y/o cognitiva) del encéfalo y sus envolturas, en forma precoz o tardía, permanente o transitoria (1).
Epidemiología
El TEC severo es responsable del 9 al 35 % de las muertes en la niñez (2). Los mecanismos de trauma son diversos y dependen, entre otras cosas, de la edad. Por ejemplo, por debajo de los cuatro años los traumas de cráneo se deben a caídas, accidentes en vehículos y a maltrato infantil; en los niños mayores son más frecuentes los accidentes de tránsito, violencia y durante prácticas deportivas (2). El síndrome de niño sacudido es responsable de daño cerebral traumático en menores de dos años hasta en 7-10 % de los casos (2). El TEC es dos veces más frecuente en niños que en niñas, como lo demuestran tanto estadísticas internacionales como locales (3). El TEC en muchas ocasiones se presenta como componente de un politrauma presentando mayor mortalidad en esta situación que como un TEC aislado (2). Cada año hay aproximadamente 60 000 muertes por TEC y cerca de 90 000 personas quedan con problemas neurológicos permanentes (4).
En Antioquia, las lesiones por causa externa producen 31 % de las muertes en niños de uno a cuatro años (4), y en el área metropolitana de Medellín son el principal motivo de atención por urgencias para todas las edades y el tercero en niños de uno a cuatro años. El TEC en Medellín es la principal causa de muerte en personas de uno a 15 años (4).
El TEC se traduce en una considerable carga financiera. Los costos asociados no sólo están relacionados directamente con los gastos médicos, tales como servicio de urgencias, de imágenes y la rehabilitación, sino también como consecuencia del costo indirecto de la pérdida de salarios a las familias (5). Los gastos de asistencia sanitaria se estiman para TEC en $ 60 mil millones por año en Estados Unidos (5).
Clasificación
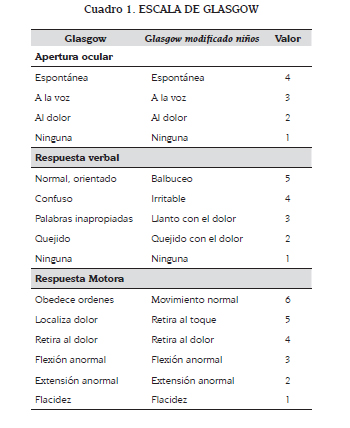
El trauma de cráneo se ha clasificado usando la escala de coma de Glasgow (ECG) que da unos valores a la respuesta verbal, respuesta motora y apertura ocular. De los tres componentes, el motor es el más confiable para predecir los resultados. Estos valores van de mínimo tres hasta 15. Según esta escala, el trauma leve corresponde a un valor entre 13 y 15, el moderado a un valor entre nueve y 12, y el severo cuando luego de una adecuada reanimación el niño tiene un valor en la escala igual o menor a ocho (6). Hay que tener en cuenta que a pesar de tener un valor en la ECG entre 13 y 15, si hay alguna alteración en la tomografía de cráneo, el trauma se clasificará como moderado.
La ECG relativa a la respuesta verbal se modifica para niños menores de cuatro años de edad. Una manera rápida de evaluar el coma es el AVPU, una medida en que la conciencia se califica como: A: alerta; V: respuesta al estímulo verbal; P: respuesta al estímulo doloroso; U: no respuesta. La respuesta al dolor es equivalente a un puntaje de 8 en la ECG, y debe ser considerada la intubación traqueal. La ECG (cuadro 1) es el más importante predictor de la supervivencia en comparación a otras variables clínicas. En niños una puntuación menor de cinco es un predictor importante de muerte (5,7).
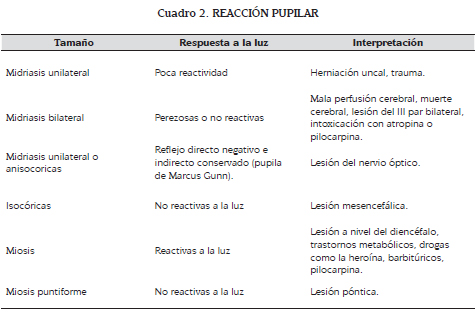
La valoración neurológica primaria incluye la evaluación de la ECG, el tamaño y la reacción pupilar (cuadro 2).
Se complementa la valoración, evaluando la presencia y severidad de focalización. Con estos elementos se establece la sospecha de una lesión en expansión (6). Cualquier anormalidad detectada debería desembocar en una rápida consulta con un neurocirujano y si hay signos de herniación (pupilas dilatadas fijas), se debe iniciar tratamiento inmediatamente (6).
Manejo del TEC severo
Resucitación inicial: la resucitación inicial en un niño con trauma de cráneo es vital. Las intervenciones iniciales deben ir dirigidas a bajar o evitar el aumento de la presión endocraneana y maximizar la perfusión cerebral, asegurando una adecuada entrega de oxígeno al tejido cerebral (6). Estos objetivos se consiguen con una vía aérea permeable y asegurada, una buena ventilación y una adecuada función circulatoria (6). La hipotensión, definida como una presión sistólica menor que el percentil cinco para la edad, se ha relacionado con un 61 % de mortalidad en niños con TEC severo y a un 85 % de mortalidad cuando adicionalmente hay hipoxia (4,6). Entre el 12 y el 30 % de los niños con TEC severo llegan al servicio de urgencias con hipotensión (2,4). La razón de estos episodios no está clara, pero siempre se debe descartar sangrado y daño medular (6). Lo importante es saber que independiente de la etiología, la hipotensión se debe tratar agresivamente.
El primer signo de disminución de la perfusión en el niño lesionado es la taquicardia. Otros signos de hipo perfusión son: disminución de pulsos periféricos, disminución de la temperatura de la piel, y un llenado capilar mayor de dos segundos. Debe resaltarse el hecho de que la disminución de la presión arterial es una de los últimos signos de hipo perfusión y choque. Por lo tanto, un niño con TEC severo que se presente con signos de hipo perfusión, aún sin hipotensión, debe ser resucitado agresivamente con líquidos.
El 60 % de los pacientes con TEC han sufrido múltiples lesiones que pueden ser responsables de la hipotensión (2). El reflejo de Cushing es una entidad clínica grave que puede ocurrir durante la reanimación en el servicio de urgencias del paciente con TEC severo. Este fenómeno incluye tres signos clínicos: hipertensión progresiva severa, bradicardia y respiración irregular. La tríada completa de los signos clínicos se presentan sólo en un tercio de los casos y el aumento de la presión endocraneana pone en riesgo la vida (6).
La transfusión de glóbulos rojos está indicada durante la resucitación para tener una hemoglobina al menos de 10 mg/dl (8). Los líquidos usados como primera opción en la reanimación son los cristaloides. En las primeras 48 horas se deben evitar las soluciones dextrosadas (7). Todos los niños deben recibir al ingreso oxígeno suplementario al 100 % (5). La hipoxemia se ha definido como una saturación de oxígeno inferior a 90 % o la presencia de apnea, cianosis y niveles de presión arterial de oxígeno menor a 60-65 mmHg (6,8).
Monitoreo de la presión intracraneana (PIC): La PIC es determinada por la interacción entre tres componentes: parénquima cerebral, LCR y volumen sanguíneo. En 1823 Monro y en 1824 Kelly propusieron: a) El cerebro está encerrado en un espacio relativamente rígido y no expandible, b) El parénquima cerebral no es compresible, y c) El volumen de sangre dentro del cráneo se mantiene casi constante y la salida de sangre venosa es necesaria para la entrada de sangre arterial. La doctrina de Monro-Kelly no tuvo en cuenta inicialmente el LCR (6). Hoy se conoce que el LCR es un importante mecanismo compensatorio que permite cambios recíprocos en el volumen de los otros componentes intracraneanos (6).
Durante las horas iníciales que siguen al TEC, hay una disminución en el LCR intracerebral porque este se desplaza al espacio subaracnoideo y se incrementa su reabsorción (6). La PIC puede ser evaluada con el uso de un monitor diseñado para la medición de dicha presión. Hay evidencia que sugiere una asociación entre hipertensión intracraneana y un pobre resultado neurológico. El valor de la PIC relacionado con mal pronóstico es el superior a 20 mmHg (8). La PIC normal es menor a 10 mmHg en adultos, entre tres y seis en escolares y menor de seis en lactantes (3). Las Guías de manejo médico de trauma cerebral severo en niños, publicadas en 2003, indican que una PIC de 20 mmHg puede ser incluso demasiado alta en los niños más pequeños (9).
El valor fundamental de conocer la PIC es permitir el cálculo de la presión perfusión cerebral (PPC), la cual está determinada por la diferencia entre la presión arterial media (PAM) y la presión intracraneana. Este valor es importante ya que es un indicador del flujo sanguíneo y la oxigenación cerebral. En casos de hipertensión endocraneana, la PIC supera la presión venosa y la perfusión cerebral dependerá de la diferencia entre la PAM y la PIC (5). En general, el flujo sanguíneo cerebral está disminuido en las primeras 24 horas que siguen al TEC y al mismo tiempo hay una disminución al 50 % de la tasa metabólica cerebral (5). En la actualidad, no en todas las unidades de cuidados intensivos del país se mide la PIC en niños con TEC severo.
Los dispositivos actuales, son de fácil instalación y con pocos riesgos, por lo que el monitoreo de la PIC debe ría ser más generalizado entre nosotros. En tal sentido, es importante tener en cuenta que algunos hallazgos en la tomografía simple de cráneo pueden sugerir hipertensión endocraneana e indicar su monitoreo, ellos son: desviación de la línea media y cierre de las cisternas basales, aunque no debe olvidarse que con tomografía normal también puede existir hipertensión endocraneana (6). En general las indicaciones de medir la PIC son: Glasgow menor a ocho, posiciones anormales, tomografía de cráneo simple anormal y presencia de hipotensión (9).
Tratamiento de la hipertensión intracraneana (HTE): cerca de la mitad de los traumas craneanos severos pueden tener la PIC normal o solo un poco elevada (6). Para el resto, que tienen HTE, se han propuesto dos opciones: una se centra en mantener la presión de perfusión cerebral adecuada. La otra se basa en reducir la presión capilar del cerebro reduciendo el edema cerebral bajando la presión arterial y controlando la presión coloidosmótica (concepto de Lund). Según estudios observacionales, la presión intracraneana cuando pasa de 20 mmHg debe ser tratada (10). Para lactantes y escolares el manejo de hipertensión debe iniciarse en 15 mmHg (6).
Los valores de PPC van de 40 mmHg a 65 mmHg, los cuales se han asociado con resultados favorables. Algunos autores definen 40 mmHg como umbral de PPC para la supervivencia (6). Se sugieren unos valores mínimos objetivos de PPC, de acuerdo a tres rangos de edad: de 2 a 6 años, 53 mmHg; de siete a10 años, 63 mmHg; y de 11 a16 años, 65 mmHg.
Terapia hiperosmolar en el tratamiento de la HTE. El manitol a dosis de 0,25 gr/Kg intravenosos, cada seis horas es efectivo en bajar la PIC. El manitol reduce el edema cerebral mediante la creación de un gradiente osmótico que promueve la transferencia de fluidos de los tejidos al espacio vascular. Los efectos osmóticos del manitol se producen en los primeros minutos, con un pico máximo de acción a los 60 minutos después de la administración. La disminución de la PIC luego de un bolo de manitol puede durar de seis a ocho horas (9,10). El mecanismo de acción inicial del manitol sobre la PIC es disminuir la viscosidad sanguínea y disminuir el diámetro de los vasos sanguíneos, actuando así rápidamente sobre la PIC.
La solución salina hipertónica al 3 % en bolos de 3 a 4 ml/kg, o en infusión contínua de 0,1 a 1ml/kg/h es efectiva en controlar la PIC elevada, al disminuir la respuesta inflamatoria postraumática, provocando una expansión del volumen plasmático y una reducción del vasoespasmo, además de ser una estrategia atractiva por los costos y pocos efectos colaterales (hipernatremia, hipokalemia, hipercloremia, insuficiencia renal, mielinolisis póntica central) (6). Los niños con TEC severo y manejo con solución salina al 3 % pueden tener valores de sodio en suero hasta 180 mEq/L. En estos casos no se debe usar agua libre. El retiro de esta infusión se debe hacer lentamente, reduciendo la velocidad de infusión en 50 % cada hora o cada dos horas y vigilando la posibilidad de hipertensión endocraneana de rebote (10). Otras soluciones hipertónicas se han usado, en concentraciones tan bajas como 1,8 % hasta el 23 %, pero en la actualidad la más recomendada, como mencionamos antes, es la solución al 3%, aunque en ambientes prehospitalarios en paciente con politrauma y TEC se ha propuesto la solución al 7,5 %, pero también en la unidad de cuidados intensivos en casos de HTE refractaria (11).
Hiperventilación en el tratamiento de HTE: el objetivo es reducir la PCO2 a valores de 30 a 35 mmHg. La hipocapnia induce vasoconstricción cerebral llevando a una disminución del flujo sanguíneo cerebral, con lo que podría reducirse la PIC. El efecto de la hiperventilación se evidencia dentro de los primeros 30 segundos: ésta disminuye la PIC en un 25 % en la mayoría de los pacientes. Si el paciente no responde a esta intervención aguda, el pronóstico de vida se ensombrece. La hiperventilación debe considerarse como una intervención de salvamiento a corto plazo, y debe ser utilizada sólo cuando un paciente que ha sufrido un TEC severo presenta deterioro del estado neurológico (disminución del puntaje de la ECG por lo menos dos puntos, en comparación con un puntaje previo), y signos inminentes de herniación (6). Para poder hacer más segura la hiperventilación, se puede usar la saturación venosa tomada del bulbo yugular.
Sedación, analgesia y relajación neuromuscular en el tratamiento de la HTE: para la sedación de los pacientes con TEC se puede usar midazolam en infusión y para la analgesia, medicaciones como el fentanil o morfina en infusión. Otros como la ketamina no se deben usar por su riesgo de incrementar la PIC (7). El propofol es un agente hipnótico y analgésico que se podría utilizar en los escolares con TEC severo. Una dosis de propofol produce disminución en el PCI, la actividad EEG y el flujo sanguíneo cerebral (6), además parece disminuir la rata metabólica cerebral y tiene propiedades antioxidantes (12,13), y cuando se utiliza con cautela el efecto negativo sobre la presión arterial se minimiza (6).
El etomidato es otra opción para la sedación y ha demostrado disminuir la presión intracraneana (12), pero hay que tener en cuenta que se han descrito casos de insuficiencia suprarrenal en niños con sepsis en los que se utilizó este medicamento y más si sabemos que en el TEC también puede haber alteraciones del eje hipófisis- adrenal con déficit de cortisol (6). Los relajantes neuromusculares están indicados para niños con HTE que ya tengan buena sedación y analgesia. Algunos efectos adversos de la relajación neuromuscular incluyen: enmascaramiento de la actividad convulsiva e incremento del riesgo de infección nosocomial (6).
Uso de barbitúricos en el tratamiento de la HTE: Los barbitúricos disminuyen la tasa metabólica cerebral y el volumen sanguíneo cerebral y parece que tienen efectos neuroprotectores (13). Sus principales efectos adversos son la depresión miocárdica que lleva a hipotensión, la anergia que predispone a infecciones nosocomiales y la hiponatremia (12,13).
Hipotermia: La hipotermia leve a moderada se ha propuesto como una estrategia para el manejo HTE con resultados muy diversos. La hipotermia moderada, 32-34 °C, debe ser considerada una terapia secundaria cuando no se ha controlado HTE. Sin embargo, Hutchinson y colaboradores en un estudio multicéntrico, donde compararon dos grupos de niños con TEC severo, uno con hipotermia, temperatura media 33,1 °C, y otro grupo con normotermia, temperatura media de 37 °C, no encontraron beneficio en la hipotermia, y por el contrario la asociaron con mayores eventos adversos y mayor mortalidad, así: 21 % en el grupo de hipotermia contra 12 % en el grupo de normotermia (14,15).
En el flujograma de la figura 1 se muestra un resumen de las principales terapias.
Otras terapias en el manejo del TEC severo
Anticonvulsivantes: las convulsiones postraumáticas complican el 10 % de los TEC en niños y cerca del 70 % de los menores de un año con TEC severo pueden presentar un episodio convulsivo (16). La mayoría de las convulsiones son inmediatas y no predicen la aparición de epilepsia posterior. La aparición tardía (después de siete días del TEC) se asocia más con daño intracerebral y epilepsia posterior (16). Las convulsiones pueden empeorar la lesión cerebral secundaria al causar hipoxia, hipercarbia, y liberación de neurotransmisores excitatorios (16) y aumentan la PIC. Por tal razón se recomienda el uso profiláctico de fenitoina en niños con TEC severo por una semana para disminuir la aparición de convulsiones (16,17).
Esteroides: El estudio CRASH (18) aleatorio controlado que incluía 10 000 pacientes adultos demostró que el riesgo relativo de muerte fue significativamente mayor en el grupo de esteroides vs. el grupo placebo (1,15; intervalo de confianza 95 % 1,07-1,24) (6). Algunos estudios bien diseñados no han demostrado ningún beneficio en niños con TEC (7).
Microdialisis: la microdialisis intracerebral con análisis bioquímico puede ser usada para evaluar signos de daño celular y hacer también una evaluación del metabolismo cerebral regional (15).
Ventilación mecánica (VM): en los niños con TEC severo está indicada la intubación orotraqueal cuando hay incapacidad de mantener permeable la vía aérea y además hay un manejo inadecuado de las secreciones. En esta situación se hace necesario conectar a soporte ventilatorio. La ventilación mecánica además ayuda a mantener una oxigenación adecuada y a controlar la reactividad vascular cerebral a través del manejo de CO2 (19).
El TEC tiene alteraciones bioquímicas y neuronales importantes que repercuten sobre la fisiología pulmonar, como por ejemplo aumento en la expresión de moléculas de adhesión en infiltración de neutrófilos al tejido pulmonar (19). La inflamación sobre el pulmón desencadenada por el TEC, además de predisponer a estos pacientes a un síndrome de dificultad respiratoria aguda (SDRA), también se propone como teoría sobre el aumento de la permeabilidad capilar que lleva a estos niños al edema pulmonar neurogénico que se puede ver en los pacientes con TEC. En cuanto a esta última entidad, se ha planteado que el TEC desencadena un aumento de la presión capilar pulmonar (teoría hidrostática) que llevaría a su aparición (19). Las metas en VM del niño con TEC son la protección de la vía aérea, la optimización de la oxigenación y la regulación del CO2, todo bajo una estrategia de ventilación protectora (18,19). En los niños con TEC no está indicada la estrategia de hipercapnia permisiva (19,20). La traqueostomía como una manera de acortar la VM en niños con TEC, no esta claramente definida y el momento y las indicaciones siguen en debate (19,20). En general, los pacientes con secuelas neurológicas del TEC con más de siete a 10 días de ventilación podrían ser candidatos a traqueostomía.
Concepto de Lund: este concepto para el manejo del trauma de cráneo severo fue desarrollado en la universidad de Lund en Suiza y fue dada a conocer entre 1992 y 1994. Este concepto está basado sobre principios fisiológicos de conservación del volumen cerebral y la perfusión cerebral. La reducción del volumen cerebral se conseguiría a través de una reducción en la presión arterial y un aumento en la presión oncótica (con albúmina). En general, el concepto recomienda control de filtración transcapilar con clonidina y metoprolol para disminuir la presión arterial, bajas dosis de pentotal y el uso de ergotamina para disminuir el volumen de las venas y el mantenimiento de la presión coloidosmótica con infusión de albúmina (21)
Monitoreo del paciente con TEC severo
Aspectos técnicos. Los dispositivos para el monitoreo de la PIC de dividen en acoplados a columna de líquido (catéter intraventricular), los no acoplados (tornillo subaracnoideo, monitor epidural) y los sistemas intraparenquimatosos que usan fibra óptica (22,23). Los dispositivos deben ser lo más precisos posibles y cumplir con algunas características: rango de presión de 0 a 100 mmHg, error máximo de 10 % y deben ser seguros (22). Los más comúnmente utilizados son los intraparenquimatosos que usan fibra óptica tipo camino. El inconveniente que tienen es que se descalibra y no se pueden recalibrar y cada día pueden ir alterando la medición hasta en 0,5 mmHg y no se deben utilizar más de cinco días. Las posibilidades de complicaciones como sangrado son inferiores al 1 %, pero para su colocación se recomienda que el paciente tenga más de 100 000 plaquetas y pruebas de coagulación normales. Se coloca en el hemisferio más afectado y en caso de compromiso difuso se prefiere el lado ipsilateral al dominante (evitar el hemisferio dominante). Otro monitor utilizado es el catéter intraventricular. Tiene como ventajas: se pueden recalibrar y permite el drenaje de LCR.
Su colocación es más difícil y necesita de personal entrenado -neurocirujano- y los ventrículos laterales deben estar abiertos. Tiene mayor riesgo de infección y ventriculitis (6).
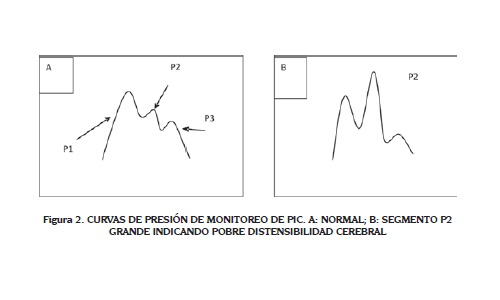
Todos estos dispositivos, intraventriculares o intraparenquimatosos, pueden mostrar unas curvas normales. Estas curvas u oscilaciones corresponden a variaciones que llegan de la presión arterial sistémica. Estas curvas normales tienen tres segmentos: P1 que corresponde a la presión arterial sistémica, P2 corresponde a la distensibilidad cerebral y P3 que corresponde a la presión diastólica (23). Pero también aparecen unas curvas patológicas llamadas las curvas de Lundberg. Son de tres tipos: A, B y C. La curva A es una corresponde a elevaciones de la PIC mayores a 50 mmHg y aparecen usualmente entre cada 5 a 20 minutos. Las ondas B pueden ser elevaciones súbitas de la PIC y aparecen cada minuto o cada dos minutos y se relacionan con cambios en la PCO2. Son muy significativas de una pobre distensibilidad cerebral. Ambas son signos de alto riesgo de herniación. Las ondas C son elevaciones superiores a 20 mmHg pero menores a 50. Carecen de menor significado clínico (24). Estas curvas se muestran en la figura 2.
En la última década, una amplia gama de nuevos dispositivos o sistemas de control han sido desarrollados, por lo que ciertas modificaciones en los dispositivos para medición de PIC hacen que hoy dichos dispositivos tengan la capacidad de medición de la presión parcial de oxígeno cerebral del espacio intersticial (PB02) (25). Stiefel y sus colegas demostraron que la PbO2 disminuyó en los períodos de mayor PCI o en periodos de disminución de la PPC (25). Datos preliminares sugieren que la PbO2> 30 mmHg se asocia con mejores resultados. En resumen, la utilización en niños de la PbO2 está surgiendo como una nueva y interesante herramienta para determinar la idoneidad de la reanimación permitiendo evaluar la oxigenación cerebral (26).
Monitoreo de la oxigenación tisular cerebral: Se monitoriza la presión tisular de oxígeno (PO2). Se define como episodio isquémico la caída de la PO2 por debajo de 10 mmHg por mas de 15 minutos y se relaciona con pobres resultados (27). También se ha encontrado que a mejor presión de perfusión cerebral la PO2 es mejor, mientras que con la hiperventilación la PO2 puede caer en forma importante (27). El cerebro representa el 2 % del peso corporal, pero recibe el 15 % del gasto cardiaco y consume el 20 % del aporte de oxígeno al organismo (6). En condiciones normales la saturación de oxígeno venoso yugular está entre 55 y 70 % y la diferencia arteriovenosa de contenido de oxígeno es entre 4 y 8 ml/dl (27).
Una manera de monitorizar la oxigenación tisular cerebral es a través de la saturación venosa yugular (SVJO2). La SVJO2 se consigue en forma contínua o intermitente a través de un catéter colocado en la vena yugular interna en forma ascendente hasta el bulbo de la yugular. La técnica: 2-3 centímetros por encima de la clavícula homolateral se ubica el triángulo que forman los dos haces del esternocleidomastoideo y la clavícula, y medio centímetro por fuera del pulso carotideo se punciona en forma ascendente y con técnica de Seldinger avanzar el catéter hasta que se encuentre resistencia. En este mismo momento debe retirarse medio centímetro el catéter y fijar allí. Si es posible debe colocarse un catéter de fibra óptica que permita saturación continua. Si no es posible deben tomarse muestras periódicas para gases venosos. La toma debe ser lenta para evitar traer muestra de sangre extracraneana. Se debe tomar una radiografía simple de cuello lateral para verificar que el catéter esté bien colocado. La yugular por la cual se pasa el catéter se puede elegir así: se ocluyen ambas venas yugulares, una primero y la del otro lado después, y se mira la PIC. El catéter se pasara por la yugular que al ocluirla elevó mas la PIC.
Una SVJO2 menor a 50 % demuestra una severa disminución en el flujo sanguíneo cerebral y se asocia con mal pronóstico, una diferencia menor a cuatro quiere decir que el aporte es mayor que la demanda, como en el caso de hiperemia, y si la diferencia es superior a ocho es porque la extracción es alta y refleja isquemia (27). En caso de hiperemia con PIC alta es necesario disminuir la PCO2. En caso de isquemia se debe evitar hiperventilar, mejorar la presión de perfusión y disminuir el consumo de oxígeno.
Doppler trascraneano: es otra herramienta para el monitoreo del paciente con HTE. Se usa para medir la velocidad del flujo por las grandes arterias cerebrales. La más usada es la arteria cerebral media. La disminución de la velocidad de flujo por ella se asocia con hipertensión intracraneana (20). Los aumentos en la velocidad del flujo indican hiperemia o vasoespasmo (20).
Se utiliza un transductor colocado en la ventana ósea de la región temporal, permitiendo la sonorización de la arterias cerebral media anterior y posterior, arterias basales y polígono de Willis. Un aumento en la velocidad de flujo de ambas arterias indica hiperemia y el aumento en la velocidad de flujo en la arteria cerebral media mayor de 50 cm/seg por 24 horas es muy sugestivo de desarrollo de vasoespasmo con peligro de isquemia cerebral.
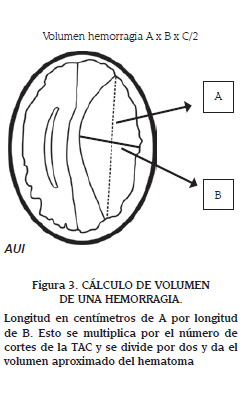
Tomografía de cráneo: Está indicada en todos los niños con TEC severo. En 1991 Marshall presentó una clasificación para los hallazgos en la tomografía: Marshall I: no hay lesiones visibles; Marshall II: cisternas abiertas, desviación de la línea media entre 0 y 0,5 cm; Marshall III: cisternas comprimidas o ausentes, desviación de la línea media entre 0 y 0,5 cm; Marshall IV: desviación de la línea media mayor a 0,5 cm (27). La TAC de cráneo sirve también para calcular el volumen del hematoma, que en algunas situaciones es la clave para decidir si es necesaria la cirugía. El volumen del hematoma se calcula así: buscar la imagen donde el hematoma se ve de mayor tamaño. En esta imagen identificar el diámetro mayor (A) y luego en sentido perpendicular a este (90°) identifique otro diámetro mayor (B) y multiplique estos dos diámetros por el numero de cortes en que se ve la hemorragia y todo lo divide por 2, como se muestra en la figura 3 (28).
Manejo quirúrgico de la hipertensión endocraneana
Aunque la craneotomía pediátrica a menudo ha sido vista como un último recurso, es un método eficaz y de bajo riesgo (28). Esta terapia, que consiste en una craneotomía en ambos huesos temporales y plastia de la duramadre, permite una expansión del tejido cerebral con disminución de la PIC. Algunos niños con edema cerebral difuso, sin lesiones quirúrgicas para drenar, pueden tener más dificultades para controlar la PIC, por lo que la craneotomía es una alternativa (3). El uso de craneotomía descompresiva puede ser de mayor beneficio para los niños que en adultos, por la mayor frecuencia de lesiones difusas (6). En niños la evidencia sugiere que es efectiva en hipertensión intracerebral que no mejora con las terapias de primera línea (7). Se debe realizar en las primeras 48 horas del trauma y mejor en las primeras 24 horas (29).
Los niños con lesión cerebral traumática e hipertensión intracraneal sostenida, sometidos a una craneotomía descompresiva temprana más tratamiento médico convencional, muestran mejores resultados funcionales favorables a largo plazo, que aquellos niños que solo reciben tratamiento médico (29). La craneotomía tiene un creciente papel en el manejo TBI, diferentes autores coinciden en no esperar a que la PIC sea intratable en pacientes que sufren difusión neurológica severa, puesto que craneotomías descompresivas realizadas precozmente, se asocian con buenos resultados en los pacientes sobrevivientes (29).
Otras medidas generales en el manejo del TEC severo
Soporte nutricional: en el TEC hay un estado catabólico generalizado, por lo que una adecuada y temprana nutrición facilita la recuperación de los niños (8,20) La nutrición enteral temprana mantiene integra la mucosa gastrointestinal y puede atenuar esa respuesta catabólica, pero hay que tener en cuenta que luego del TEC es frecuente el ileo intestinal y el retardo en el vaciamiento gástrico y por esta razón podría ser necesaria una sonda transpilorica. En lo posible se debe retardar el inicio de la nutrición parenteral (20).
Vigilancia de la glucosa en sangre es esencial en el TEC. La hiperglucemia se considera un predictor independiente de malos resultados (8). Por lo tanto, la hiperglucemia se debe evitar, pero el control estricto de la glicemia puede llevar a hipoglucemias, las cuales son deletéreas (20). La profilaxis de trombosis venosa profunda está indicada en los niños adolescentes con TEC. Puede hacerse con heparinas de bajo peso molecular y se inicia en las primeras 48 ó 72 horas postinjuria.
Daño axonal difuso
El término daño axonal difuso puede ser engañoso, ya que esta lesión ocurre principalmente en los centros de coordinación (17). En esta revisión cabe mencionar un tipo de lesión que se puede ver con frecuencia en los niños con TEC severo. Desde 1961 se ha hablado del daño axonal difuso como una lesión primaria que sigue al TEC y que se caracteriza por una degeneración subcortical, con una fractura del axón e interrupción del flujo axoplasmatico (18) y una "desconexión" del sistema reticular activante y la corteza. Clínicamente se caracteriza por un estado de coma desde el mismo momento del trauma y radiológicamente en la TAC simple de cráneo no se encuentran mayores cambios, mientras en la resonancia nuclear magnética si se han descrito algunos hallazgos como pequeños focos hemorrágicos en la corteza y cuerpo calloso por cizallamiento, alteración de la difusión de la señal por ruptura y edema del citoesqueleto. Este cizallamiento es más probable que se desarrollan en áreas entre los tejidos de diferentes densidades y viscosidades (13).
Pronóstico
De los niños que sobreviven a un TEC severo, el 60 % quedan con alguna incapacidad (7). Varios factores afectan el pronóstico del paciente (13-15) tales como la respuesta pupilar, edad del paciente, condiciones médicas asociadas, hallazgos del examen motor inicial, hipotensión, hipoxia, duración de la HTE, presencia de fiebre y una presión de perfusión baja (25). La mortalidad para los niños con TEC severo es menor (29- 31). La mayoría de los que sobreviven padecen menos discapacidades graves (31). En los niños mayores de un año de edad han mejorado los resultados neurológicos al ser comparados con los adultos (13). La genética parece estar en relación con los resultados en TEC. El polimorfismo de la apolipoproteína E afecta directamente los resultados en TEC severo. Tener el gen para la apolipoproteína E confiere riesgo de pobres resultados al sufrir un TEC (13,17).
Algunos biomarcadores como la neurona enolasa específica (NES), un biomarcador de muerte neuronal, el S100B, biomarcador de lesión o muerte del astrocito, y la proteína básica de mielina (PBM) de lesión axonal, serán un complemento a la evaluación clínica y pueden utilizarse en el diagnóstico y evaluación de la respuesta bioquímica a las diferentes estrategias de manejo en TEC. A futuro los biomarcadores prometen ayudar a desentrañar la compleja cascada de mediadores que se liberan luego del TEC (13). Una mejor compresión de lesión cerebral traumática y una actitud diligente y proactiva en la búsqueda de utilizar las mejores estrategias disponibles tienen el potencial de generar mejores resultados a favor de los niños.
CONCLUSIONES
El TEC severo en niños es una entidad que se presenta con gran frecuencia, tiene alta mortalidad y secuelas importantes por su repercusión en la vida de los niños que sufren el trauma y en sus familias. Dentro del manejo de la hipertensión endocraneana hay varias opciones, algunas ya con cierto grado de evidencia de buenos resultados, pero otras, la mayoría, solo experimentales o extrapoladas del manejo del trauma en adultos. En general, el pronóstico es regular, porque mas de la mitad de los niños que sufren un TEC severo quedarán con alguna discapacidad, aunque en realidad la mortalidad tiende a ser mas baja que en adultos. En los resultados parece ser que la genética tiene que ver y se impondrá en un futuro la medición de biomarcadores que ayuden a establecer un pronóstico.
REFERENCIAS
1. Statutory definitions of traumatic brain. Documento de Internet. Disponible en: www.tbidoc.com/statedef.html [ Links ]
2. Correa, MA, González G, Herrera MH, Orozco A. Epidemiología del trauma pediátrico en Medellín, Colombia 1992-1996. Colombia Med 2000;31:77-80. Disponible en http:// colombiamedica.univalle.edu.co [ Links ]
3. Uribe L, Fernández M. Manejo del trauma encéfalocraneano en niños y conocimientos médicos acerca del TEC en servicios de urgencias de la ciudad de Medellín. 2008. Medicina UPB enero-junio 2009. [ Links ]
4. Dirección Seccional de Salud de Antioquia. Diagnóstico de la situación de salud de Antioquia. Revista Epidemiológica de Antioquia. 1998;25:1-3. [ Links ]
5. Chung CY, Chen CL, Cheng PT, See LC, Tang SF, Wong AM. Critical score of Glasgow Coma Scale for pediatric traumatic brain injury. Pediatr Neurol. 2006 May;34(5):379-87. [ Links ]
6. Grimaldi L, Schlein CL, Bruce DA et Al. Head and neck trauma. En: Pediatric critical care medicine, basic science and clinical evidence. Wheeler D, Wong H, Shanley T, editors. 2007, Springer. [ Links ]
7. Dias MS. Traumatic brain and spinal cord injury. Pediatr Clin N Am 2004; 51: 271-303 [ Links ]
8. Posada J. Trauma de cráneo severo. En: Fundamentos de pediatría. El niño en estado crítico. CIB. Primera edición [ Links ]
9. Adelson PD, Bratton SL, Carney NA, Chesnut RM, du Coudray HE, Goldstein B, et al. Guidelines for the acute medical management of severe traumatic brain injury in infants, children, and adolescents. Chapter 5. Indications for intracranial pressure monitoring in pediatric patients with severe traumatic brain injury. Pediatr Crit Care Med. 2003 Jul;4:S19-24. [ Links ]
10. White H, Cook D, Venkatesh B. The use of hypertonic saline for treating intracranial hypertension after traumatic brain injury. Anesth Analg 2006;102(6):1836-46. [ Links ]
11. Oddo M, Levine JM, Frangos S, Carrera E, Maloney-Wilensky E, Pascual JL, et al. Effect of mannitol and hypertonic saline on cerebral oxygenation in patients with severe traumatic brain injury and refractory intracranial hypertension. J Neurol Neurosurg Psychiatry. 2009;80:916-20. [ Links ]
12. Weinstabl C, Mayer N, Hammerle AF, Spiss CK. The effect of bolus propofol administration on the intracranial pressure in craniocerebral trauma. Anaesthesist 1990;39:521-4. [ Links ]
13. Fundación ALAS. Guías para el manejo médico en la etapa aguda del traumatismo encéfalocraneano grave en infantes, niños y adolescentes. 2005. [ Links ]
14. Marik PE, Varon J, Trask T. Management of Head Trauma. Chest 2002; 122:699-711 [ Links ]
15. Adelson PD, Ragheb J, Kanev P, Brockmeyer D, Beers SR, Brown SD et al. Phase II clinical trial of moderate hypothermia after severe traumatic brain injury in children. Neurosurgery 2005; 56:740-754. [ Links ]
16. Hutchison JS, Ward RE, Lacroix J, Hébert PC, Barnes MA, Bohn DJ et al. Hypothermia the rapy after traumatic brain injury in children. N Engl J Med 2008; 358:2447-2456. [ Links ]
17. Edwards P, Arango M, Balica L, Cottingham R, El-Sayed H, Farrell B et al. Postraumatic seizures. Neurosurg Clin N Am 1991; 2: 425-35. [ Links ] 18. Edwards P, Arango M, Balica L, Cottingham R, El-Sayed H, Farrell B et al. Final results of MRC CRASH, a randomised placebo-controlled trial of intravenous corticosteroid in adults with head injury - outcomes at 6months. Lancet 2005;365:1957-9. [ Links ]
19. Stevens RD, Lazaridis C, Chalela JA. The role of mechanical ventilation in acute brain injury. Neurol Clin 2008; 26: 543-563. [ Links ]
20. Bell M, Kochanek P. Traumatic Brain Injury in Children: Recent advances in management. Indian J Pediatr. 2008 Nov;75(11):1159-65. [ Links ]
21. Bullock MR, Chesnut RM, Clifton GL, et al. The Brain Foundation and American Association of Neurological Surgeons. Guidelines for the management of severe traumatic brain injury. J Neurotrauma 2000;17:471-8. [ Links ]
22. Tilford JM, Aitken ME, Anand KJ, Green JW, Goodman AC, Parker JG et al. Hospitalizations for critically ill children with traumatic brain injuries: a longitudinal analysis. Crit Care Med. 2005 Sep;33(9):2074-81. [ Links ]
23. Mejía JA. Técnicas quirúrgicas y métodos de monitorización de la presión intracraneana. En: Neuromonitoría. Niño MC, Molina R, Cohen D. Ed Distribuna 2009. [ Links ]
24. Lang EW, Chestnut RM. Intracranial pressure monitoring and management. Neurosurg Clin N Am 1994; 5(4): 573-605. [ Links ]
25. Stiefel MF, Udoetuk JD, Storm PB, Sutton LN, Kim H, Dominguez TE et al. Brain tissue oxygen monitoring in pediatric patients with severe traumatic brain injury. J Neurosurg 2006; 105(4 Suppl):281- 286. [ Links ]
26. Randall M, Schell M, Cole D. Cerebral monitoring: Jugular venous oximetry. Anesth Analg 2000; 90:559-566. [ Links ]
27. Kishore PR, Lipper MH, Becker DP, Domingues da Silva AA, Narayan RK. Significance of CT in head injury: correlation whith intracranial pressure. Am J Roentgenol 1981; 137:829-833. [ Links ]
28. Rubiano AM. Trauma craneoencefalico: manejo actual. Tópicos en trauma, shock y sepsis. 2007;3:20-3. [ Links ]
29. Marshall LF, Gantille T, Klauber MR et al. The outcome of severe closed head injury. J Neurosur (suppl) 1991; 75:28-36. [ Links ]
30. Luerseen TG, Klauber MR, Marshall LF. Outcome from head injury related to patient´s age. J Neurosurg 1988; 68:409-416. [ Links ]
31. Michaud LJ, Rivara FP, Grady MS. Predictors of survival and severity of disability after severe brain injury in children. Neurosurgery 1992; 31:254-264. [ Links ]
Recibido: marzo 20 de 2010. Revisado: abril 27 de 2010. Aceptado: mayo 3 de 2010
Forma de citar: Fernández M, Torres JN. Manejo actual del trauma encéfalo craneano severo en niños. Rev CES Med 2010;24(1):83-96