Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina
Print version ISSN 0120-8705
CES Med. vol.25 no.1 Medellín Jan./June 2011
ARTÍCULOS DE INVESTIGACIÓN CIENTÍFICA O TECNOLÓGICA
Utilidad de la técnica genotype MTBDRplus para el diagnóstico de tuberculosis pulmonar
Utility of the genotype MTBDRplus technique for pulmonary Tuberculosis diagnosis
ÓSCAR IVÁN QUIRÓS1, GLORIA ELENA DURANGO2, SANTIAGO LEÓN ATEHORTÚA3, SIGIFREDO OSPINA4, ANA MILENA HERRERA TORRES4
1 Bact. MSc Epidemiología. Hospital Universitario de San Vicente Fundación. quirogomez@hotmail.com
2 Bact. Esp. Micología. Hospital Universitario de San Vicente Fundación.
3 MSc Microbiología. Hospital Universitario de San Vicente Fundación.
4 Esp. Microbiología y Epidemiología. Grupo de Epidemiología Hospitalaria. Hospital Universitario de San Vicente Fundación.
5 Ph.D. Patología. Grupo de investigación en Ciencias Básicas. Universidad CES.
RESUMEN
Introducción: es necesario identificar de forma simple y rápida el bacilo Mycobacterium tuberculosis (MTB) para la instauración temprana de tratamiento efectivo y de medidas de control que prevengan la transmisión de la enfermedad.
Objetivos: evaluar la utilidad de la prueba Genotype MTBDRplus para la identificación de M. tuberculosis en muestras respiratorias de pacientes atendidos en el Hospital Universitario San Vicente de Paúl Fundación entre junio y agosto de 2010.
Materiales y métodos: las muestras respiratorias fueron colectadas de 100 pacientes atendidos en el Hospital, a las cuales se les realizó baciloscopia, cultivo en medio Ogawa Kudoh y PCR por la prueba comercial Genotype MTBDRplus. La sensibilidad y especificidad de la PCR fue determinada tomando como referencia el cultivo en Ogawa Kudoh.
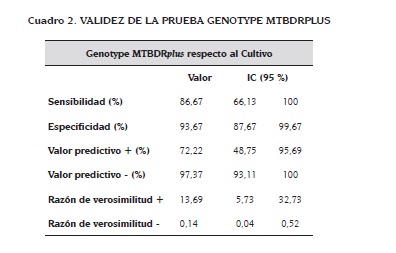
Resultados: la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo fueron 86,7 %, 93,7 %, 72,2 % y 97,4 % respectivamente. La sensibilidad en muestras con baciloscopia positiva fue 100 % y de 60 % en muestras con baciloscopia negativa. La mediana del tiempo para el reporte por PCR fue 14 días, comparado con los 60 días requeridos por el cultivo (p=0,000).
Conclusiones: La prueba de PCR Genotype MTBDRplus es una buena opción para la detección rápida de M. tuberculosis en muestras respiratorias con baciloscopia positiva.
PALABRAS CLAVES
Tuberculosis pulmonar, Reacción en cadena de la polimerasa, Cultivo, Sensibilidad, Colombia, Mycobacterium tuberculosis
ABSTRACT
Introduction: For the early establishment of effective treatment and control measures to prevent disease transmission it’s necessary to have simple and fast diagnostic tools to identify M. tuberculosis (MTB) bacilli.
Objectives: In this study, the usefulness of the Genotype MTBDRplus assay for identifying M. tuberculosis in respiratory specimens from patients at Hospital Universitario San Vicente de Paúl (HUSVP) was evaluated.
Materials and methods: Respiratory specimens were collected from 100 patients treated at the HUSVP to which smear, culture in Ogawa Kudoh medium and commercial Polymerase Chain Reaction (PCR) Genotype MTBDRplus assay were performed. The sensitivity and specificity of PCR were determined in reference to the culture in Ogawa Kudoh.
Results: The sensitivity, specificity, positive predictive value and negative predictive value were 86.7 %, 93.7 %, 72.2 % and 97.4 % respectively. Sensitivity in smear-positive samples was 100 %, and 60 % in smear-negative samples. The median time for results reporting using PCR was 14 days compared with the 60 days required by the culture (p=0.000).
Conclusions: Genotype MTBDRplus is a good choice for rapid detection of M. tuberculosis in smear positive respiratory specimens.
KEY WORDS
Pulmonary tuberculosis, Nucleic Acid Amplification Techniques, Diagnostic Reagent Kits, Sensitivity, Colombia, Mycobacterium tuberculosis
INTRODUCCIÓN
La tuberculosis (TB) es una de las principales causas de morbilidad y mortalidad por enfermedades infecciosas a nivel mundial. En el año 2007, Colombia reportó 10 950 casos, con una incidencia de 24,6 casos por cada 100 000 habitantes (1). La Organización Mundial de la Salud (O.M.S.), en el año 2008, estimó 9,4 millones de casos incidentes, y 1,3 millones de muertes debido a la enfermedad a nivel mundial (2).
A estas estadísticas se suma el hecho de que la infección por VIH puede incrementar el riesgo de desarrollar tuberculosis una vez el paciente se ha infectado con el bacilo (3). De los 9,4 millones de casos nuevos ocurridos en 2008 se estima que dos millones fueron VIH positivos y se presentaron 52 0000 muertes en esta población (2).
La O.M.S. lanzó en el año 2006 la estrategia Alto a la Tuberculosis (4), cuya finalidad es reducir la carga mundial de tuberculosis para 2015, como herramienta que contribuya a dar cumplimiento a los Objetivos de Desarrollo del Milenio, relacionados con disminuir la incidencia del VIH/SIDA, el paludismo y otras enfermedades como la TB (5). Dentro de los componentes de la estrategia están alcanzar acceso universal a un diagnóstico de alta calidad y apoyar la investigación para el desarrollo de nuevas herramientas diagnósticas y su disponibilidad efectiva y oportuna.
Actualmente, en Colombia, el principal soporte para el diagnóstico de laboratorio de la infección por M. tuberculosis (MTB) se basa en la utilización combinada de la baciloscopia y el cultivo. La baciloscopia tiene baja sensibilidad (40 a 60 %) en casos confirmados de tuberculosis pulmonar (6,7) requiriendo al menos 10 000 bacilos/ml para ser detectado por personal calificado en la lectura de las placas (8). El cultivo es más sensible pudiendo detectar entre 10 y 100 bacilos/ml de esputo (9), no obstante puede requerir de seis a ocho semanas para el asilamiento del bacilo.
Las limitaciones diagnósticas de la microscopia y la cantidad de tiempo requerido para la realización de los cultivos tradicionales ha impulsado el desarrollo de métodos de detección rápidos y sensibles en muestras clínicas. Las técnicas basadas en la amplificación de ácidos nucléicos se han convertido en una importante herramienta de diagnóstico (10,11), que tienen como principal ventaja proveer resultados mucho más rápidos, incluso en un día (12,13).
La prueba GenoType® MTDRplus (Life Science Nehren, Alemania) ha sido recomendada por la O.M.S. para la detección rápida de MTB y su resistencia a medicamentos (14). Esta prueba utiliza la amplificación por reacción en cadena de la polimerasa (P.C.R., por sus siglas en inglés) de una región del gen codificante de la subunidad 23 de ARN ribosomal para la detección del complejo M. tuberculosis, además de determinar la presencia de genes asociados a la resistencia a rifampicina (RIF) e isoniacida (INH).
El objetivo de este estudio fue determinar la validez de una P.C.R. seguida por hibridización con sondas de ADN (Kit diagnóstico Genotype® MTBDRplus de Hain Lifescience) en la detección del complejo M. tuberculosis, en muestras respiratorias de pacientes atendidos en el HUSVP, tomando el cultivo en medio sólido como el estándar de oro.
MATERIALES Y MÉTODOS
Muestras clínicas. Las muestras fueron procesadas en grupos de 10, acompañadas de un control negativo (agua estéril) y un control positivo (muestra de un paciente previamente confirmado para MTB por el método convencional). Antes del inicio de la investigación se utilizó la prueba Genotype MTBDRplus en 10 muestras con resultado desconocido para MTB, con el fin de asegurar el correcto funcionamiento de la prueba en nuestro laboratorio.
Entre junio y agosto de 2010 se colectaron 100 muestras respiratorias de pacientes atendidos en el Hospital Universitario San Vicente de Paúl (HUSVP) de Medellín. Se incluyó una muestra por paciente. Las muestras respiratorias analizadas fueron esputo, lavado broncoalveolar, secreción traqueal y aspirado traqueal. A todas las muestras se les hizo baciloscopia con tinción Ziehl-Neelsen (ZN), inoculación en cultivo Ogawa Kudoh y la prueba Genotype MTBDRplus. Los resultados de la baciloscopia estaban cegados para el investigador encargado de realizar la prueba de PCR.
Pruebas convencionales. Las muestras fueron descontaminadas por el método de N-acetyl –Lcisteína y NaOH al 2 % - NACL-NaOH (15). A cada muestra se le agregó igual volumen de NACL - NaOH. Esta mezcla fue homogenizada en vórtex por 20 segundos. Se realizó incubación por 18 minutos a temperatura ambiente (TA). Se realizó dilución 1:5 con buffer fosfato PBS. Se realizó centrifugación por 15 minutos a 3 000 g a TA y se dejó reposar por cinco minutos. Se descartó el sobrenadante y el pellet se resuspendió en 3 ml de PBS. Se utilizaron 2 ml para la inoculación en cultivo y para la realización de la baciloscopia. La porción restante se usó en la extracción de ADN. El cultivo fue incubado a 37 °C por ocho semanas y se revisó cada semana para observar crecimiento. En los casos positivos se confirmó la especie MTB mediante la prueba de la niacina de acuerdo a la técnica recomendada por la Organización Panamericana de la Salud (15).
Extracción del ADN. Se tomaron 500 ul de la porción de la muestra descontaminada para realizar la extracción de ADN, la cual fue centrifugada por 15 minutos a 10 000 g. Se descartó el sobrenadante y el pellet fue resuspendido en 100 ul de agua destilada. Se realizó inactivación por 20 minutos a 95 °C. La muestra fue sonicada por 15 minutos en baño ultrasónico y luego fue centrifugada a 13 000 g por cinco minutos. Se obtuvo el sobrenadante el cual fue transferido a un tubo nuevo. La muestra fue almacenada a -20° C hasta su amplificación.
Amplificación del ADN. La amplificación se realizó por PCR con el kit GenoType® MTDRplus (Hain Lifescience. Nehren, Alemania) usando las cantidades recomendadas por el fabricante. Por cada muestra se mezclaron 35 ul de Primers y nucleótidos (PNM), 5 ul de Buffer PCR 10X, 2 ul de MgCl2 (25mM), 3 ul de agua estéril para PCR, 0,2 ul de taq polimerasa HotStar (QIAGEN, Hilden, Alemania) y 5 ul de ADN. La amplificación se llevó a cabo por desnaturalización 15 minutos a 95 °C, seguido de 10 ciclos compuestos de 30 s a 95 °C y dos minutos a 58 °C, además 30 ciclos de 25 s a 95 °C, 40 s a 53 °C y 40 s a 70 °C. El ciclo final fue de ocho minutos a 70 °C.
Hibridización y detección. Se utilizó el Twin- Cubator® (Hain Lifescience. Nehren, Alemania) para la incubación. Se realizó desnaturalización química (NaOH) del producto amplificado a TA por 5 minutos, se adicionó solución de hibridización y se colocó una membrana con sondas de ADN durante 30 minutos a 45 °C. Se realizaron lavados rigurosos, se adicionó conjugado (estreptavidina marcada con fosfatasa alcalina) y se incubó por 30 minutos a TA. Se realizaron lavados rigurosos, se adicionó sustrato y se incubó por cinco minutos a TA.
En las membranas se determinó la presencia o ausencia de las siguientes tres bandas: banda del control del conjugado (CC), banda del control de la amplificación (AC) y banda del complejo MTB (TUB). La presencia de las tres bandas al tiempo indicó una reacción positiva para MTB. Si la banda de control de conjugado y la banda del control de amplificación estuvieron presentes y la banda de MTB no se observó, fue interpretado como un resultado negativo para complejo MTB (Figura 1).
Para la determinación del perfil de sensibilidad a los antituberculosos rifampicina (RIF) e isoniacida (INH) se realizó la lectura de las tiras observando la presencia o ausencia de sondas para detectar la secuencia silvestre o mutada de los genes rpoB, katG e inhA. Si alguna de estas bandas silvestres estuvo ausente y se observó una o varias bandas que correspondía a la secuencia de mutaciones de los genes rpoB, katG e inhA dicha cepa se determinó como resistente al antituberculoso correspondiente o a ambos (Figura 1).
Al finalizar el procesamiento, del total de las muestras se hizo una selección aleatoria del 10 %, las cuales fueron nuevamente amplificadas y detectadas por la prueba de Genotype MTBDRplus para verificar la concordancia entre los resultados.
Análisis estadístico. Se usó el programa SPSS 12,0 ® a partir del cual se calcularon medidas de frecuencia, tendencia central, dispersión y se construyeron tablas. El software Epidat 3,1 de la Organización Panamericana de la Salud fue utilizado para realizar los cálculos de validez (sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo), así como el índice de concordancia Kappa. El cálculo de sensibilidad, especificidad, razones de verosimilitud y valores predictivos de la prueba en estudio se realizó tomando como referencia el cultivo en medio sólido. Para observar diferencia entre medianas se utilizó la prueba U Mann Whitney, considerando una diferencia estadísticamente significativa si el valor de p era menor de 0,05.
Consideraciones éticas. Dado que la muestra fue obtenida con fines diagnósticos, el paciente firmó el respectivo consentimiento informado durante el proceso de atención. En todos los casos se garantizó la confidencialidad en el manejo de la información.
RESULTADOS
La edad promedio de los pacientes fue 43 años (desviación estándar 20 años) y 37 % pertenecían al sexo masculino. La principal muestra respiratoria fue esputo (61 %), seguido del lavado broncoalveolar (35 %), secreción traqueal (3 %) y aspirado traqueal (1 %). Las baciloscopias fueron negativas en el 85 % de los casos.
Al momento de toma de muestra el diagnóstico presuntivo fue tuberculosis en 19 % de los casos (pulmonar 12 %, resistencia a múltiples medicamentos 3 %, miliar 2 % y ganglionar 1 %, pleural 1 %), VIH en 11 %, neumonía en 11 %, EPOC en 9 %, cáncer de pulmón 4 % y sepsis en 2 %.
La baciloscopia y la PCR Genotype MTBDRplus concordaron en determinar negativas el 76 % de las muestras y el 11 % positivas. La PCR determinó positivas un 9 % de las muestras que la baciloscopia reportó negativas. El 4 % fueron leídas positivas para bacilos acido alcohol resistentes que la PCR determinó como negativas.
En seis cultivos no se pudo determinar la presencia o ausencia de MTB debido a contaminación del medio. De las 94 muestras restantes ambas pruebas concordaron en reportar como positivas el 13,8 % y de igual forma lo hicieron en el 78,7 % de las muestras que determinaron como negativas. En 5,3 % de los casos el cultivo dio un resultado negativo que la PCR determinó positivo. En el 2,1 % de los casos la PCR dio un resultado negativo que el cultivo determinó positivo.
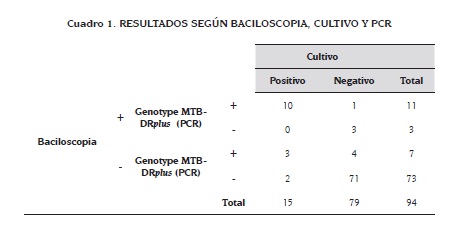
La baciloscopia, cultivo y PCR determinaron positivas el 10,6 % de las muestras, de igual forma las tres determinaron negativas 75,5 % de las muestras. Ninguna muestra con cultivo y baciloscopia positivos fue determinada negativa por PCR. La baciloscopia determinó como positivas el 3,2 % de las muestras que fueron negativas por cultivo y PCR.
El 3,2 % de las muestras que al examen inicial por baciloscopia fueron negativas fueron positivas por PCR y por cultivo. La PCR determinó positivas el 4,3 % de las muestras que por cultivo y baciloscopia fueron negativas. La baciloscopia y la PCR determinaron negativas el 2,1 % de las muestras, pero dieron resultado positivo por cultivo (Ver cuadro 1).
Los valores del análisis de sensibilidad y especificidad de la prueba PCR Genotype MTBDRplus se presentan en el cuadro 2.
Al hacer el análisis de acuerdo a los resultados de las baciloscopias, se encontró que la PCR tuvo una sensibilidad del 100 % (IC 95 %: 95 - 100), especificidad del 75 % (IC 95 %: 20 - 100), valor predictivo positivo de 90,9 % (IC 95 % 69,4 - 100), valor predictivo negativo de 100 % (IC 95 %: 83,3 -100) en muestras con baciloscopia positiva.
En muestras con baciloscopia negativa la PCR tuvo una sensibilidad del 60 % (IC 95 %: 7– 100), especificidad del 94,7 % (IC 95 %: 88,9 – 100), valor predictivo positivo de 42,9 % (IC 95 %: 0 – 86,6), valor predictivo negativo de 11,3 % (IC 95 %: 3,4 -37). Los índices de Kappa de acuerdo a las pruebas evaluadas se muestran en el cuadro 3.
El cultivo tuvo una mediana de 60 días (rango intercuartilico 60 días) en la detección de MTB. El tiempo mínimo en el que se dio un resultado por cultivo fue 18 días y el máximo 105 días. La mediana de la PCR fue 14 días (rango intercuartilico: 10-19 días) en la detección del complejo MTB. El tiempo mínimo en que se obtuvo un resultado mediante la PCR fue un día y el máximo 26 días. El tiempo promedio requerido para dar un reporte confirmado por pruebas bioquímicas de MTB en cultivo fue 92,8 días.
Se encontró diferencia estadísticamente significativa entre los tiempos requeridos para dar un reporte por cultivo y por PCR. La PCR determinó positivas 20 muestras, de estas el 50 % fue sensible a RIF e INH, el 15 % fue resistente a RIF e INH. En el 35 % de las muestras no fue posible determinar el perfil de sensibilidad.
La concordancia entre el resultado inicial y el resultado del segundo procesamiento del 10 % de las muestras seleccionadas aleatoriamente, realizado por la prueba Genotype MTBDRplus, fue del 100 %.
DISCUSIÓN
En este estudio se determinó la utilidad de la prueba Genotype MTBDRplus en el diagnóstico de MTB en muestras respiratorias con bacilosocopia positiva de pacientes atendidos en el HUSVP. La utilización combinada de los métodos tradicionales, baciloscopia y cultivo, acompañado de la PCR Genotype MTBDRplus en muestras respiratorias con baciloscopia positiva, permite un diagnóstico acertado y oportuno de MTB con la consiguiente instauración de medidas rápidas de aislamiento y de tratamiento apropiado.
Aunque el cultivo aún es considerado la prueba estándar de laboratorio para el diagnóstico de tuberculosis (9,11), las técnicas basadas en la amplificación de ácidos nucléicos se han convertido en una importante herramienta de diagnóstico (10,11), que tienen como principal ventaja proveer resultados incluso en un día (12,13).
La prueba Genotype MTBDRplus está recomendada por la O.M.S. como una herramienta diagnóstica rápida y sensible para detectar el complejo MTB y su resistencia a drogas antituberculosas de primera línea (14). Se han realizado varios estudios evaluando el rendimiento de esta prueba para la detección de resistencia a rifampicina e isoniacida en muestras con baciloscopia positiva (16-20). Sin embargo, de acuerdo a la literatura revisada por los autores, hasta el momento no se han realizado estudios evaluando la sensibilidad de la prueba en la detección de MTB.
El objetivo de esta investigación fue determinar la validez de la prueba Genotype MTBDRplus en la detección del complejo MTB en muestras respiratorias tomando como referencia el cultivo en medio solido. Se encontró que el 6 % de las cultivos se contaminó, esta proporción es similar a la reportada por Robledo et al (2006) del 5,1 % usando el mismo método de descontaminación (NALC-NaOH) en medio a base de huevo Lowenstein Jensen (21).
La prueba Genotype MTBDRplus determinó en el 5,3 % de las muestras un resultado positivo que el cultivo estableció como negativo. Dado que el cultivo es la prueba de referencia (9), este porcentaje corresponde a resultados falsos positivos de la PCR. Barnes PF y Neonakis et al (22,11), entre otros, han planteado la posibilidad de contaminación cruzada de la PCR y generación de dichos falsos positivos. A pesar de que en este estudio se incluyó un control negativo en cada montaje para validar la positividad de las PCR, cada una de las muestras debe analizarse a la luz del resultado del cultivo y en este caso, dada la proveniencia de las muestras pensar en posible contaminación cruzada.
En contraste a los resultados falsos positivos, se encontró que el 2,1 % de las muestras fueron determinadas negativas por la prueba Genotype MTBDRplus pero establecidas positivas por cultivo, indicando resultados falsos negativos de la PCR. Hofmann-Thiel et al (23) evaluaron la utilidad de una PCR con hibridización reversa para la detección de MTB, donde encontraron una proporción similar de resultados falsos negativos con 2,7 % de las muestras determinadas como tal.
Otros autores (23-25) han sugerido que resultados falsos negativos se deben a presencia de inhibidores de la PCR o a errores técnicos de laboratorio. Sin embargo, la prueba Genotype MTBDRplus trae una sonda control de amplificación que siempre dio positiva, indicando que la PCR se preparó con todos los reactivos necesarios para un resultado válido y que no existieron sustancias inhibidoras de la reacción.
Sumado al control de amplificación, en cada montaje se incluyó un control positivo para MTB con el fin de validar los resultados negativos. Dados los controles utilizados, se sugiere que estas muestras pueden contener cepas con variantes del gen para la subunidad 23 del RNA ribosomal que no pudieron detectarse por los primers diseñados para la realización de la PCR.
La sensibilidad y especificidad del 86,7 % y 93,7 %, respectivamente, determinadas para la prueba Genotype MTBDRplus tuvieron valores dentro del rango reportado por otros autores que validaron pruebas de PCR para la detección del complejo MTB en muestras respiratorias, y que tuvieron como prueba de referencia el cultivo en medio sólido: sensibilidad 83 - 99 % y especificidad 63 - 100 % (26-30).
Entre estos, Abu-Amero, en 2002, evaluó la utilidad de la prueba Cobas Amplicor para la detección del complejo MTB en 626 muestras de esputo y encontró sensibilidad del 94,4 % y especificidad del 100 % (28). Takakura et al, en 2005 evaluaron el alcance de una RT-PCR y de la prueba Cobas Amplicor para la detección del RNA ribosomal 16S del complejo MTB en 201 muestras respiratorias obtenidas de pacientes diagnosticados o con sospecha de tuberculosis, en las que se obtuvo una sensibilidad de 72,2 % para la RT-PCR y de 80,6 % para el Cobas Amplicor (30).
Davis JL et al (2009) realizaron un estudio prospectivo con 127 pacientes de quienes se procesó muestra de esputo para la evaluación de una PCR que detecta el gen secA1 del MTB, a la cual se le determinó sensibilidad del 99 % y especificidad del 88 % teniendo como referencia el resultado del cultivo (29).
Se observó variación en los valores de sensibilidad y especificidad de la prueba Genotype MTBDRplus entre muestras con baciloscopia positiva (sensibilidad 100 %, especificidad 75 %) y baciloscopia negativa (sensibilidad 60 %, especificidad 95 %). La alta sensibilidad de las muestras con baciloscopia positiva se debe a que estas tienen una mayor probabilidad de encontrarse positivas por PCR para MTB dada la previa observación en la baciloscopia de BAAR. Contrastando con las muestras en las que no se observan BAAR, las cuales tienen una menor probabilidad de obtener un resultado positivo para MTB.
Aunque la sensibilidad de la PCR disminuyó de forma notable en muestras con baciloscopia negativa es importante resaltar que en el presente estudio la prueba rápida Genotype MTBDRplus determinó positivas el 11 % de las muestras establecidas como negativas para BAAR en la baciloscopia. De estas, el 3,6 % fue posteriormente confirmado por el cultivo.
La consistencia de los resultados de las tres pruebas: baciloscopia y cultivo, PCR y baciloscopia, y PCR y cultivo (0,63, 0,55 y 0,74) fue similar a la reportada por Lima SSS et al (2008) con valores de 0,62, 0,54 y 0,78 para las respectivas parejas de pruebas (7). En la presente investigación se encontró una mediana concordancia entre la baciloscopia y cultivo, y PCR y baciloscopia, esto debido a la baja sensibilidad de la baciloscopia (66,7 %) comparada con la sensibilidad del cultivo (100 %) y la PCR (86,7 %).
El tiempo máximo de incubación del cultivo se estableció en 60 días. El cultivo que reportó resultados en menor tiempo requirió 18 días y el que necesitó mayor tiempo requirió 105 días. El tiempo promedio requerido para dar un reporte confirmado por pruebas bioquímicas de MTB en cultivo fue 92,8 días. Estas diferencias se deben a diversas causas como la excesiva contaminación que determinó el pronto desecho de algunos cultivos, la diferencia en la carga de bacilos presentes en la muestra y por consiguiente inoculados en el medio. Sumado a la necesidad de realizar repiques y reincubaciones con el fin de obtener suficiente material para la realización de pruebas bioquímicas de identificación en algunos casos.
Resultados rápidos de las pruebas de laboratorio para determinar la presencia o ausencia de MTB impactan de forma positiva en el paciente y su familia disminuyendo la ansiedad prediagnóstica; al igual que en el establecimiento de medidas de aislamiento que permitan prevenir oportunamente la transmisión de la enfermedad y para la instauración de un tratamiento adecuado. La prueba Genotype MTBDRplus permite obtener resultados hasta en seis horas. En el presente estudio se encontró que la mediana para obtener un resultado por esta técnica fue de 14 días, con un tiempo mínimo de un día y máximo de 26. Estas diferencias se deben a la necesidad que se tuvo de tener un número suficiente de muestras para el montaje por grupos que permitiese una optimización en el uso de los reactivos.
Sin embargo, se constató que existió diferencia estadísticamente significativa en el tiempo requerido por el cultivo y la PCR para dar un reporte (60 días vs 14 días). El tiempo mediano de 14 días puede disminuir si se fomenta la solicitud de la prueba por parte de los médicos. Tener un adecuado número de muestras permitirá realizar de forma rutinaria montajes con sus respectivos controles de calidad y a la vez usar de forma más eficiente los insumos.
La prueba Genotype MTBDRplus permite, además, determinar el patrón de resistencia a rifampicina e isoniacida lo que contribuye al tratamiento acertado de la enfermedad. Se ha reportado una alta sensibilidad en la detección de estas resistencias. Varios trabajos se han realizado comparando la PCR con los métodos tradicionales de susceptibilidad a drogas: Huang W. et al, en 2009, reportaron sensibilidad del 95,5 % para detectar resistencia a RIF, y del 81,8 % para INH (16), Anek-Vorapong R. et al, en 2010, reportaron sensibilidad del 100 % en RIF y del 95,3 % para INH (17), entre otros (18-20). Es necesario realizar estudios que determinen la validez de la prueba para el diagnóstico de resistencias en nuestra población.
La implementación y solicitud rutinaria de pruebas de biología molecular como la PCR Genotype MTBDRplus impactaría de manera positiva, a nivel individual en los pacientes y también a nivel colectivo, pues se podría oportunamente confirmar la infección, implementar el tratamiento más acertado, establecer medidas de control y seguimiento lo que llevaría a disminuir la propagación de la enfermedad, lo que a su vez representaría ahorros en el sistema de salud. La PCR Genotype MTBDRplus es una buena opción como técnica de detección rápida del complejo M. tuberculosis en muestras respiratorias con baciloscopia positiva en pacientes atendidos en el Hospital Universitario San Vicente de Paul.
AGRADECIMIENTOS
A Antje Beneke por su colaboración en la resolución de preguntas en el montaje y análisis de las pruebas de biología molecular.
FUENTE DE FINANCIACIÓN
Este estudio fue financiado por el Hospital Universitario San Vicente de Paúl, Medellín.
REFERENCIAS
1. Ministerio de la Protección Social. Situación de la Salud en Colombia Indicadores Básicos años 2009. [ Links ]
2. World Health Organization. Global Tuberculosis Control. A Short Update to the 2009 report. World Health Organization. 2009 2009;WHO/HTM/TB/2009.426:1-39. [ Links ]
3. Shafer R W, Edlin B R. Tuberculosis in patients infected with human immunodeficiency virus: perspective on the past decade. Clin.Infect.Dis 1996; 22 (4): 683-704. [ Links ]
4. World Health Organization. The Global Plan to Stop TB, 2006-2015. 2006 2006;(WHO/ HTM/STB/2006.35). [ Links ]
5. Organización de las Naciones Unidas. Objetivos de Desarrollo del Milenio. 2008 2008;ODM:1-52. [ Links ]
6. Raviglione M, O’Brien R. Enfermedades por Micobacterias. En: Fauci A, Braunwald B, Kasper D, Hauser S, Longo D, Jameson L, et al, editor. Harrison Principios de Medicina Interna. 17a ed. México, D.F. McGraw-Hill interamericana editores; 2008. p. 1006-1038. [ Links ]
7. Lima S S, Clemente W T, Palaci M, Rosa R V, Antunes C M, Serufo J C. Conventional and molecular techniques in the diagnosis of pulmonary tuberculosis: a comparative study. J Bras Pneumol 2008; 34 (12): 1056-1062. [ Links ]
8. Dinnes J, Deeks J, Kunst H, Gibson A, Cummins E, Waugh N, et al. A systematic review of rapid diagnostic tests for the detection of tuberculosis infection. Health Technol. Assess 2007; 11 (3): 1-196. [ Links ]
9. Dorronsoro I, Torroba L. Microbiología de la tuberculosis. An Sist Sanit Navar 2007; 30 (2): 67-84. [ Links ]
10. Wallis R S, Pai M, Menzies D, Doherty T M, Walzl G, Perkins M D, et al. Biomarkers and diagnostics for tuberculosis: progress, needs, and translation into practice. Lancet 2010; 375 (9729): 1920-1937. [ Links ]
11. Neonakis I K, Gitti Z, Krambovitis E, Spandidos D A. Molecular diagnostic tools in mycobacteriology. J Microbiol Methods 2008; 75 (1): 1-11. [ Links ]
12. Coelho A G, Zamarioli L A, Reis C M, Nascimento A C, Rodrigues Jdos S. Gene probes versus classical methods in the identification of mycobacteria. J Bras Pneumol 2008; 34 (11): 922-926. [ Links ]
13. Palomino J C. Molecular detection, identification and drug resistance detection in Mycobacterium tuberculosis. FEMS Immunol. Med.Microbiol 2009; 56 (2): 103-111. [ Links ]
14. Stop TB Partnership and World Health Organization. New Laboratory Diagnostic Tools for Tuberculosis Control. Geneva, 2008. [ Links ]
15. Organización Panamericana de la Salud. Manual para el diagnóstico bacteriológico de la tuberculosis. 2008; Parte 2. Cultivo:1-114. [ Links ]
16. Huang W L, Chen H Y, Kuo Y M, Jou R. Performance assessment of the GenoType MTBDRplus test and DNA sequencing in detection of multidrug-resistant Mycobacterium tuberculosis. J Clin Microbiol 2009; 47 (8): 2520-2524. [ Links ]
17. Anek-Vorapong R, Sinthuwattanawibool C, Podewils L J, McCarthy K, Ngamlert K, Promsarin B, et al. Validation of the GenoType MTBDRplus assay for detection of MDRTB in a public health laboratory in Thailand. BMC Infect.Dis 2010; 10: 123. [ Links ]
18. Miotto P, Piana F, Cirillo D M, Migliori G B. Genotype MTBDRplus: a further step toward rapid identification of drug-resistant Mycobacterium tuberculosis. J Clin Microbiol 2008; 46 (1): 393-394. [ Links ]
19. Hillemann D, Rusch-Gerdes S, Richter E. Evaluation of the GenoType MTBDRplus assay for rifampin and isoniazid susceptibility testing of Mycobacterium tuberculosis strains and clinical specimens. J Clin Microbiol 2007; 45 (8): 2635-2640. [ Links ]
20. Huyen M N, Tiemersma E W, Lan N T, Cobelens F G, Dung N H, Sy D N, et al. Validation of the GenoType MTBDRplus assay for diagnosis of multidrug resistant tuberculosis in South Vietnam. BMC Infect Dis 2010; 10: 149. [ Links ]
21. Robledo J A, Mejia G I, Morcillo N, Chacon L, Camacho M, Luna J, et al. Evaluation of a rapid culture method for tuberculosis diagnosis: a Latin American multi-center study. Int J Tuberc Lung Dis 2006; 10 (6): 613-619. [ Links ]
22. Barnes P F. Rapid diagnostic tests for tuberculosis: progress but no gold standard. Am J Respir Crit Care Med 1997; 155 (5): 1497-1498. [ Links ]
23. Hofmann-Thiel S, Turaev L, Hoffmann H. Evaluation of the hyplex TBC PCR test for detection of Mycobacterium tuberculosis complex in clinical samples. BMC Microbiol 2010; 10: 95. [ Links ]
24. Agudelo C A, Builes L N, Hernández M, Robledo J. Nuevos Metodos para el diagnostico del tuberculosis. Iatreia 2008; 21 (3): 321-332. [ Links ]
25. Bennedsen J, Thomsen V O, Pfyffer G E, Funke G, Feldmann K, Beneke A, et al. Utility of PCR in diagnosing pulmonary tuberculosis. J Clin Microbiol 1996; 34 (6): 1407-1411. [ Links ]
26. Moore D F, Curry J I. Detection and identification of Mycobacterium tuberculosis directly from sputum sediments by Amplicor PCR. J Clin Microbiol 1995; 33 (10): 2686-2691. [ Links ]
27. Fadda G, Ardito F, Sanguinetti M, Posteraro B, Ortona L, Chezzi C, et al. Evaluation of the Abbott LCx Mycobacterium tuberculosis assay in comparison with culture methods in selected Italian patients. New Microbiol 1998; 21 (2): 97-103. [ Links ]
28. Abu-Amero K K. Potential for the Use of Polymerase Chain Reaction (PCR) in the Detection and Identification of Mycobacterium tuberculosis Complex in Sputum Samples. Mol Biol Today 2002; 3: 39-42. [ Links ]
29. Davis J L, Huang L, Kovacs J A, Masur H, Murray P, Havlir D V, et al. Polymerase chain reaction of secA1 on sputum or oral wash samples for the diagnosis of pulmonary tuberculosis. Clin Infect Dis 2009; 48 (6): 725-732. [ Links ]
30. Takakura S, Tsuchiya S, Isawa Y, Yasukawa K, Hayashi T, Tomita M, et al. Rapid detection of Mycobacterium tuberculosis in respiratory samples by transcription-reverse transcription concerted reaction with an automated system. J Clin Microbiol 2005; 43 (11): 5435-5439. [ Links ]
Recibido: mayo 2 de 2011; revisado: mayo 10 de 2011; aceptado: junio 2 de 2011.
Forma de citar: Quirós OI, Durango GE, Atehortúa SL, Ospina S, Herrera-Torres AM. Utilidad de la técnica genotype
mtbdrplus para el diagnóstico de tuberculosis pulmonar. Rev Ces Med 25(1):42-53