Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
CES Medicina
versión impresa ISSN 0120-8705
CES Med. vol.26 no.1 Medellín ene./jun. 2012
ARTÍCULO DE REVISIÓN
Estrategias de protección pulmonar en cirugía cardiovascular
Lung protection strategies in cardiovascular surgery
RAÚL DARÍO SANTOS CERQUERA1, FREDY ARIZA CADENA2
1 Fellow anestesia cardiovascular y tórax. Universidad CES: raulsantosc@gmail.com
2 Anestesiólogo, Epidemiólogo clínico: fredyariza@hotmail.com
RESUMEN
Antecedentes: Durante la ventilación mecánica las estructuras pulmonares están sometidas a fuerzas complejas e inusuales que son particularmente relevantes en la incitación del daño pulmonar. Las respuestas inflamatoria pulmonar y sistémica secundarias en el paciente de cirugía mayor y cardiovascular, es generada en gran parte por la sobredistención/compresión de la células alveolares y de los bronquiolos terminales, los flujos turbulentos de gases o fluidos al interior del lumen bronquial, los fenómenos de isquemia/reperfusión pulmonar luego de la circulación extracorpórea y la consecuente activación del complemento, citoquinas y demás respuestas celulares pro-inflamatorias.
Métodos: Se realizó una revisión de la literatura disponible en múltiples bases indexadas de literatura médica (PubMed, ScieLO, Hinari y Cochrane) desde enero de 1990 hasta diciembre de 2011, sobre estudios clínicos aleatorizados, estudios retrospectivos y guías de práctica clínica, que identificaran las principales estrategias para ventilación mecánica protectora (VMP) en pacientes de cirugía cardiovascular y cirugía mayor.
Resultados y conclusiones: El modo óptimo de soporte ventilatorio en cirugía cardiovascular y cirugía mayor continua siendo objeto de debate. La evidencia experimental y clínica sugiere que los bajos volúmenes corrientes, bajas presiones al final de la inspiración y la instauración de alta presión al final de la espiración podrían reducir la injuria pulmonar asociada a la ventilación mecánica. Algunas recomendaciones actuales como la utilización de volúmenes corrientes de 6 a 8 ml/kg del peso ideal, han sido extractadas de grandes estudios retrospectivos realizados en otro tipo de poblaciones. Sin embargo, a la fecha no hay evidencia contundente que indique que la ventilación mecánica protectora disminuya la respuesta pro-inflamatoria, mejore la función pulmonar postoperatoria o ejerza un efecto sobre la disminución en la mortalidad o la estancia en UCI, cuando esta se compara con la ventilación convencional. Se requieren estudios con mejores diseños epidemiológicos que evalúan el real impacto de esta intervención.
PALABRAS CLAVE
Cirugía cardiaca, Cirugía torácica, Ventilación mecánica, Bypass cardiopulmonar, Citoquinas, Protección pulmonar, Revision
ABSTRACT
Background: Lung structures are exposed to complex and unusual forces during mechanical ventilation. This phenomena is particularly relevant to induce lung damage due to overdistension, generation of turbulent flows of gases and fluids into the alveolar and peripheral bronchial lumen, induction of ischemia-reperfusion lesion and inmunological activation, which are greatly responsible of the secondary systematic inflammatory response.
Methods: A search of available medical literature related to protective mechanical ventilation (PMV) in cardiovascular surgery and major surgery was conducted using different medical databases (PubMed/MEDline, SciELO, Hinari and Cochrane). RCTs, retrospective clinical studies, revision articles, case series, cases and controls studies, and clinical guides were reviewed.
Results and conclusions: The optimal way for ventilatory support in cardiovascular and major surgery is object to debate. Experimental evidence suggests that ventilation with low tidal volume, lowers pressure at the end of inspiration, and high pressure at the end of expiration, can reduce lung injury associated to ventilation. It was therefore recommended to use current volumes from 6 to 8 ml/Kg of the ideal weight and was defined by the Acute Respiratory Distress Syndrome Net as "protective pulmonary ventilation". Based on studies carried out, there is no convincing evidence that protective mechanical ventilation (Low VT with PEEP) lowers the release of cytokines, transfusion needs, mechanical ventilation times, improve post-surgery pulmonary function or a decrease in mortality, intensive care or hospital stay compared to the conventional ventilation in cardiovascular or major surgery.
KEY WORDS
Cardiac surgery, Thoracic surgery, Protective, mechanical ventilation, Cardiopulmonary bypass, Cytokines, Review
INTRODUCCIÓN
La investigación y el conocimiento de la etiología del daño pulmonar asociado a ventilación mecánica ha generado la búsqueda de estrategias que permitan la protección pulmonar a la injuria, atenuación de la respuesta pro-inflamatoria y unos mejores desenlaces en los pacientes que requieren asistencia ventilatoria.
Dependiendo del tipo de cirugía, la elección entre diferentes modos ventilatorios busca simular de la mejor manera posible, la fisiología pulmonar. En cirugía cardiovascular se han implementado múltiples estrategias ventilatorias que tienen como referente a la circulación extracorpórea (CEC), debido a su importante contribución sobre la respuesta inflamatoria pulmonar y sistémica. Lo anterior obliga al anestesiólogo y al intensivista a conocer las novedades y avances en búsqueda de mejores estrategias ventilatorias en cirugía cardiovascular y cirugía mayor, mediante el entendimiento de la fisiopatología asociada a la injuria pulmonar, como resultado de la respuesta inflamatoria multimodal asociada a la cirugía cardiovascular.
Los factores de riesgo para injuria pulmonar (IP) en el post-operatorio de cirugía cardiaca pueden dividirse en aquellos asociados directamente con la injuria pulmonar (neumonía, aspiración de contenido gástrico, embolismo graso, circulación extracorpórea) y los asociados indirectamente al proceso de una respuesta sistémica (sepsis, trauma severo con choque, transfusiones múltiples, perpetuación de la injuria pulmonar desencadenada por la misma circulación extracorpórea, entre otros) (1-4). Los métodos de ventilación protectora buscan una disminución en la liberación de factores pro inflamatorios [ej.factor de necrosis tumoral (TNF) y las interleucinas 6 y 8 (IL-6, IL-8)], en gran parte responsables de la respuesta inflamatoria que se produce posterior a la cirugía cardiaca con circulación extracorpórea (CEC) (5,6), al tiempo que la identificación de factores de riesgo para injuria pulmonar es importante para establecer estrategias ventilatorias que prevengan esta condición (7-10).
METODOLOGÍA DE LA REVISIÓN
Se realizó una búsqueda por dos investigadores independientes, de la literatura publicada durante el periodo comprendido entre enero de 1990 y diciembre de 2011 que refiriera estrategias de ventilación mecánica protectora (VMP) en cirugía cardiovascular y cirugía mayor. Las bases de datos utilizadas incluyeron la Librería Nacional de Medicina de Estados Unidos (Pubmed/Medline), SciELO, Hinari y Cochrane en búsqueda de estudios clínicos aleatorizados, estudios retrospectivos, series de casos y guías de práctica clínica publicados en idioma inglés o español. Para ello se emplearon los siguientes términos de búsqueda MeSH, solos o en combinación: "cardiac surgical procedures", "thoracic surgery", "respiration, artificial", "positive pressure ventilation", "cardiopulmonary bypass", "major surgery" "ventilator-induced lung injury" y "cytokines". Para la evaluación de los trabajos que incluyeron protocolos de investigación se utilizaron los parámetros establecidos por las guías CASPe (11) y STROBE (12) según fuera el caso. Se planteó la posibilidad de incluir estudios de revisión que analizaran la fisiopatología del fenómeno y para esto se revisaron artículos publicados durante este tiempo en revistas de alto factor de impacto.
PATOGÉNESIS DE LA INJURIA PULMONAR INDUCIDA POR LA VENTILACIÓN MECÁNICA
Durante la ventilación mecánica, las estructuras pulmonares están sometidas a fuerzas complejas e inusuales que son particularmente relevantes para el daño pulmonar y que incluyen la sobredistención o colapso repetitivos sobre las estructuras bronquiales terminales y los alvéolos y flujos turbulentos de gases o fluidos sobre la mucosa bronquial. Durante cirugía cardiaca, la isquemia/re-perfusión del pulmón posterior a circulación extracorpórea y la activación del complemento, neutrófilos y citoquinas pro inflamatorias (13,14), imponen una seria agresión pulmonar adicional que puede terminar por comprometer seriamente la dinámica ventilatoria y el intercambio gaseoso.
Existe un importante conocimiento sobre los efectos tóxicos que altas fracciones inspiradas de oxígeno (O2) pueden generar sobre las unidades alveolares. Al mismo tiempo se reconoce que la ventilación mecánica puede generar por si sola estallido alveolar/bronquial y subsecuente fuga de aire, hemorragia alveolar, incitar la formación de membranas hialinas, y producir cambios en la permeabilidad epitelial y endotelial (1,13).
Las investigaciones iniciales sobre el fenómeno de daño ultra-estructural durante la ventilación mecáncia se enfocaron principalmente en el stress capilar generado por la sobredistensión alveolar (13,15,16). Recientemente se ha observado que (al menos parcialmente) la apertura y el cierre cíclico de unidades alveolares con atelectasia y el stress excesivo en las zonas marginales entre las regiones aireadas y atelectásicas del pulmón tienen un papel importante en la génesis de la injuria pulmonar.
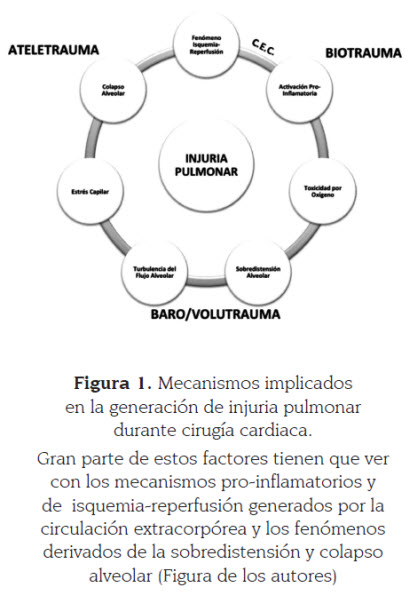
Paradójicamente, las ventilatorias donde se busca prevenir el cierre del alveolo atelectásico al final de la espiración, pueden producir reducción del espacio entre alvéolos reclutables y en consecuencia la aparición de mayor atelectasia (1,17). Además de la injuria pulmonar biofísica se sabe que el pulmón libera una cascada de mediadores, citoquinas pro-inflamatorias, bacterias y neutrófilos a la circulación sistémica causando disfunción inespecífica de órganos y contribuyendo a disfunción multiorgánica (14) (Figura 1).
Una forma práctica de clasificar los diferentes mecanismos de IPIVM podría ser de acuerdo al mecanismo desencadenante per se. De esta manera tenemos el volu-trauma como el daño directo del alvéolo por sobredistención pulmonar; el baro-trauma que corresponde al daño pulmonar inducido por presiones altas en la ventilación suministrada; el bio-trauma, indicando el daño pulmonar y de órganos distales secundario a la liberación de mediadores inflamatorios en los espacios aéreos pulmonares y a la circulación sistémica, y el atele-trauma, nombre que se ha dado al daño alveolar secundario al colapso y apertura cíclica de unidades alveolares atelectásicas (1,18) .
VENTILACIÓN MECÁNICA DURANTE CIRUGÍA Y SU RELACIÓN CON LESIÓN PULMONAR
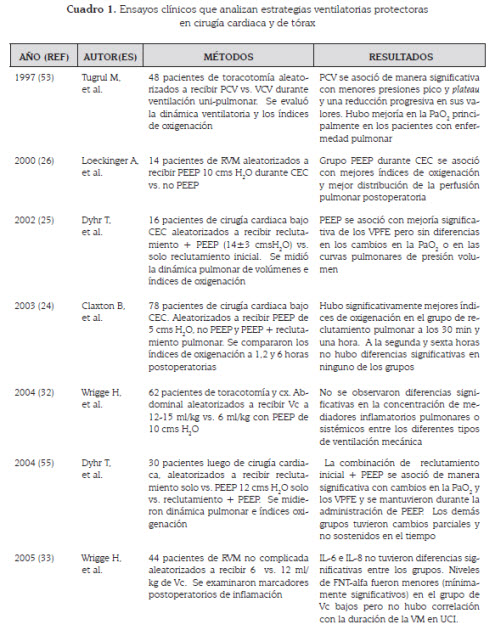
El modo óptimo de soporte ventilatorio que se asocia a una reducción significativa de complicaciones pulmonares en cirugía mayor y cardiaca es aún objeto de debate. La evidencia experimental sugiere que la ventilación con bajos volúmenes corrientes (Vc), baja presión al final de la inspiración y alta presión al final de la espiración pueden reducir la injuria pulmonar inducida por la ventilación mecánica (1,17). Una gran cantidad de trabajos han evaluado el papel de la ventilación mecánica protectora y su efecto sobre la minimización del daño pulmonar y la respuesta inflamatoria secundaria (Cuadro 1).
En el estudio de la Red Americana de Síndrome de Distress Respiratorio Agudo (ARDSnet) (18) se compararon los volúmenes corrientes tradicionales (12 ml/kg de peso ideal) con volúmenes corrientes bajos (6 ml/kg de peso ideal). Todos los pacientes recibieron ventilación asistida controlada y fueron retirados del ventilador según protocolo, los criterios para la selección de parámetros como frecuencia, PEEP, FiO2, y metas ventilatorias fueron similares para todos los pacientes. Con 861 pacientes, el estudio debió ser detenido tempranamente porque el análisis interino reportó un significativo beneficio en los pacientes que recibieron volúmenes corrientes bajos, con reducción en la mortalidad del 40 % al 31 %, incremento en el número de días libres del ventilador y disminución del compromiso orgánico no pulmonar. Aunque la tendencia en los parámetros de oxigenación fue mejor en los pacientes con volúmenes corrientes altos, la mortalidad fue significativamente mayor (19).
En un estudio de pacientes llevados a cirugía abdominal mayor y torácica mayor con lesión aguda de pulmón y distress respiratorio esta estrategia se asoció con una disminución en los niveles de marcadores inflamatorios pulmonares y sistémicos. Sin embargo, no se ha establecido si en el pulmón sano la ventilación mecánica en ausencia de un estímulo quirúrgico se asocie a la generación de citoquinas pro inflamatorias (20). En pacientes llevados a neumonectomía, la falla respiratoria post operatoria es la causa principal de morbilidad y mortalidad.
En un estudio realizado en la Clínica Mayo durante un periodo de cuatro años con 170 pacientes llevados a neumonectomía, se observó que los pacientes ventilados intraoperatoriamente con volúmenes corrientes superiores a 8,3 ml/ kg del peso ideal, tienen un riesgo mayor de presentar falla ventilatoria en el postoperatorio de neumonectomía. En este estudio se definió falla respiratoria como la necesidad de ventilación mecánica por más de 48 horas post operatorias o la necesidad de la misma después de la extubación. La causa más frecuente de falla respiratoria (18 %) en al menos la mitad de los casos fue atribuida a IPA, 17 % a edema pulmonar cardiogénico, 23 % a neumonía, 7 % a fístula bronco pleural y 3 % a tromboembolismo pulmonar. Se demostró una relación directa independiente entre la probabilidad de falla respiratoria y la utilización de volúmenes corrientes mayores de 8 ml/kg del peso ideal, por lo que se recomendó utilizar un rango entre 6 y 8 ml/kg del peso ideal (2). Este valor fue definido por la ARDSnet como "ventilación pulmonar protectora" (BMP).

La generación de atelectasias es un fenómeno frecuente en pacientes que reciben ventilación mecánica. Ocurren con mayor frecuencia en las zonas dependientes del pulmón y afectan un gran porcentaje de pacientes que reciben anestesia general. El desarrollo de las atelectasias está asociado con disminución de la compliance pulmonar, alteraciones de la oxigenación, incremento en la resistencia vascular pulmonar y el desarrollo de injuria pulmonar. Los efectos adversos de las atelectasias persisten durante el postoperatorio y tienen un impacto importante en la recuperación del paciente. Los mecanismos asociados que contribuyen a su formación son la compresión del tejido pulmonar, absorción del aire alveolar y alteración de la función del surfactante (21).
Las atelectasias durante anestesia se relacionan con el volumen de cierre y la capacidad residual funcional debido a que la vía aérea de menor calibre carece de cartílago y su apertura depende de la tracción elástica radial, del parénquima pulmonar adyacente y de la presión negativa pleural. Estas atelectasias no dependen de la técnica anestésica administrada y por lo general suelen identificarse prematuramente luego de la inducción, debido al colapso alveolar que ha sido demostrado con imágenes escanográficas donde se observa aumento de la densidad del tejido (sangre y tejido conectivo) y la ausencia de aire (21).
Durante cirugía cardiovascular, el efecto resultante de la circulación extracorpórea (CEC) se constituye en un determinante importante para la formación de atelectasias que a su vez se asocia con un mayor incremento en la formación de corto circuitos e hipoxemia (3). La alteración en la permeabilidad del endotelio pulmonar se ha considerado también como una causa de alteración del intercambio gaseoso post-CEC, pero no se ha comprobado que dicha alteración en la permeabilidad tenga mayor repercusión en el intercambio gaseoso que la que está asociada a las atelectasias (22). Llegando así a la hipótesis de que sean posiblemente las atelectasias producidas durante circulación extracorpórea las responsables del mayor deterioro en la función pulmonar.
Numerosos estudios han demostrado que una estrategia de reclutamiento pulmonar y presión positiva al final de la espiración (PEEP) mejoran la oxigenación post-CEC (3,22,23). La aplicación de PEEP de 10 cm H2O durante circulación extracorpórea ha demostrado beneficio en la prevención de la formación de atelectasias y secundariamente en la función pulmonar post-CEC. Junto con la utilización continua de PEEP durante las diferentes fases de la cirugía cardiaca se han promovido otras estrategias, tales como la insuflación de los pulmones previa a la salida de CEC, con el objeto de visualizar la expansión simétrica de los mismos y permite detectar obstrucciones significativas por secreciones o sangre en el tubo endotraqueal (24-26), pero la evidencia de su utilidad aún es escasa.
La integridad de la superficie bronco-alveolar también puede verse afectada por la ventilación mecánica ya que la inflamación pulmonar secundaria a baro y volu-trauma se caracteriza por la generación local de mediadores pro-inflamatorios y un cambio de la hemostasia alveolar hacia la pro coagulación, promoviendo depósitos de fibrina en el interior de las vías aéreas (4). Adicionalmente, productos de la coagulación como la trombina y la fibrina tienen propiedades pro-inflamatorias importantes que pueden comprometer la integridad y la función pulmonar per-se (27,28).
Un estudio aleatorizado controlado que incluyó 40 pacientes sin lesión pulmonar previa llevados a cirugía mayor con duración mayor a cinco horas, encontró que el grupo en el que se utilizaron volúmenes corrientes de 12 ml/kg sin PEEP, tenía de manera uniforme un incremento significativo en la actividad pro-coagulante, cuando estos se comparaban con un grupo en el que se utilizaron volúmenes corrientes de 6 ml/kg y 10 cm H2O de PEEP. Los volúmenes corrientes altos se asociaron a una mayor generación de fragmentos solubles de trombomodulina en los espacios bronco-alveolares, potenciando una inadecuada activación del sistema de proteína C y generando una regulación positiva en la activación del plasminógeno por efecto inhibitorio del inhibidor del activador del plasminógeno (PAI-1). Se pudo concluir que la acumulación de fibrina se produce por tres mecanismos: incremento de la actividad pro coagulante por medio de la vía extrínseca, deficiencia relativa del sistema de proteína C y la inhibición de la fibrinólisis por el PAI-1. Estos cambios en la hemostasia pulmonar también han sido descritos en neumonía y el síndorme de dificultad respiratoria del adulto (29,30). Lo que indicaría que la ventilación mecánica por si sola puede tener efectos perjudiciales en la hemostasia incluso en pacientes sin injuria pulmonar (4). A pesar de los hallazgos descritos, el resultado clínico en este estudio no fue significativamente diferente al comparar los dos grupos.
Aunque se ha considerado la ventilación mecánica con bajos volúmenes corrientes como protectora en pacientes con injuria pulmonar, aun es objetivo de discusión cual es el volumen corriente ideal en pacientes con pulmones sanos (3,-33). La ventilación mecánica con PEEP titulado sobre el punto de presión de inflexión más bajo en una curva estática de presión/volumen y bajos volúmenes corrientes ha sido la estrategia sugerida para prevenir el colapso y la sobre distensión de regiones pulmonares en pacientes con síndrome de distress respiratorio agudo (SDRA) basada en algunos estudios en donde se ha demostrado mejoría en el intercambio gaseoso de estos pacientes (34,35).
Se han observado niveles mas altos de citoquinas pro inflamatorias sistémicas e intra-alveolares en pacientes ventilados con Vc altos (10mL/kg de peso) y bajo PEEP bajo o ausente, cuando se compara con esta estrategia de ventilación protectora. En modelos de laboratorio se ha observado que el someter la célula pulmonar a stress mecánico está asociado con liberación de mediadores inflamatorios (36-38) lo cual apoya una vez mas el concepto que la ventilación mecánica convencional podría inducir la liberación de mediadores inflamatorios y por lo tanto contribuir a la injuria pulmonar a pesar de no estar completamente claro si la ventilación mecánica aislada puede producir la liberación de citoquinas inflamatorias o es únicamente la presencia de injuria pulmonar la responsable de la liberación de estos mediadores inflamatorios.
Se ha buscado establecer si la ventilación mecánica en ausencia de injuria pulmonar favorece la liberación de factores inflamatorios. En un estudio con 39 pacientes ASA I-II, sin diagnóstico de injuria pulmonar o infección sistémica, programados para cirugía electiva con anestesia general, aleatorizados en tres grupos que recibieron ventilación mecánica con volúmenes corrientes de 15 ml/kg sin PEEP, 6 ml/kg sin PEEP y 6 ml/ kg con PEEP de 10 cm H2O, se cuantificaron los niveles de factor de necrosis tumoral, interleukinas 6 y10 y del receptor antagonista IL-1 momentos antes y una hora después de instaurada la ventilación mecánica. No se observaron diferencias significativas en la liberación de estos marcadores de inflamación sistémica al comparar los grupos. Estos hallazgos van en contra de lo observado en trabajos previos, a pesar de que el seguimiento tan corto de este estudio puede no haber permitido detectar el impacto real de las terapias sobre estos marcadores a través del tiempo (39).
VENTILACIÓN MECÁNICA Y SU IMPACTO SISTÉMICO
La respuesta inflamatoria sistémica ha sido bien establecida durante cirugía cardiaca con circulación extracorporea, donde se ha encontrado un considerable aumento en los marcadores de esta respuesta (5,6,40,41). Durante la circulaciónaextracorpórea con clampeo de aorta, el corazón y los pulmones quedan excluidos de la circulación funcional. Como resultado final, se presenta una retención significativa de leucocitos y plaquetas en el lecho vascular pulmonar asociado con anormalidad de la reactividad micro vascular. La leucocitosis es por lo tanto un marcador de inflamación local y sistémica que está fuertemente asociado con complicaciones postoperatorias (42-45).
El inicio del síndrome de respuesta inflamatorio se da por la activación del complemento, neutrófilos, endotoxinas y citoquinas inflamatorias. El contacto de la sangre con superficies artificiales y el fenómeno de isquemia-reperfusión del corazón y el pulmón son las causas de este síndrome. El lecho vascular pulmonar libera citoquinas pro inflamatorias durante la reperfusión, particularmente IL-6, IL-8, IL-10 y neutrófilos polimorfo nucleares (PMN) activados por el TNFalfa (7,8,46,47).
La injuria pulmonar asociada con el bypass coronario es similar al síndrome de dificultad respiratoria del adulto causado por otras etiologías. La diferencia está en que la observada después de bypass coronario es generalmente transitoria y se resuelve dentro de las 24 horas siguientes. La prevalencia del síndrome de dificultad respiratoria del adulto después de bypass coronario es del 0,5% y cuando esta ocurre, la mortalidadspuede ser hasta del 91,6 % (48-50).
Son múltiples las estrategias estudiadas para controlar o suprimir esta respuesta. Se ha estudiado cómo los halogenados pueden tener alguna función en la supresión de esta respuesta inflamatoria, donde el sevorane ha demostrado, en términos generales, comparado con anestesia basada en opioides, un efecto inhibidor en el secuestro pulmonar de leucocitos y neutrófilos (9).
Al utilizar volúmenes corrientes de 6 ml/kg con PEEP y volúmenes corrientes de 10 ml/kg, con y sin PEEP, se observó que la BMP (VT bajos con PEEP) no se demostró disminución en la liberación de citoquinas, necesidad de transfusión, tiempo de ventilación mecánica, ni tampoco mejoría de la función pulmonar post operatoria, disminución en la mortalidad o en la estancia en cuidado intensivo u hospitalaria cuando esta se comparaba con la ventilación convencional (10,15).
ESTRATEGIAS DE PROTECCIÓN DURANTE LA VENTILACIÓN UNIPULMONAR
La ventilación de un solo pulmón es un procedimiento frecuente durante cirugía cardiotorácica. Si tenemos en cuenta los conceptos de VMP y su impacto sobre la inducción de lesión pulmonar, se decidió estudiar su comportamiento en pacientes con ventilación de un solo pulmón llevados a neumonectomía.
La estrategia de ventilación mecánica de un solo pulmón con volúmenes corrientes como los usados en la ventilación mecánica de dos pulmones es la sugerida por muchos textos guía para el manejo de estos pacientes, pero implica como se dijo anteriormente, estrés mecánico en el pulmón dependiente (51,52). Sin embargo, la capacidad pulmonar durante la ventilación a un solo pulmón está reducida cuando esta se compara con la capacidad en la ventilación de dos pulmones, por lo que el aumento de las fuerzas mecánicas sobre en el pulmón dependiente, seguido de la compresión de los vasos alveolares y el incremento de las resistencias vasculares pulmonares pueden tener efecto de sobrecarga en el alvéolo ventilado.
El uso de bajos volúmenes corrientes y presiones inspiratorias podría ser favorable para pacientes llevados a toracotomía (53,54). Durante un estudio de 32 pacientes ASA II-III, se tomaron dos grupos llevados a ventilación con un solo pulmón para cirugía torácica en donde los sujetos fueron aleatorizados a recibir volúmenes corrientes de 10 ml/kg o de 5 ml/kg. A pesar de que los niveles de FNT-alfa, elastasa PMN, IL-8 e IL-10 y moléculas de adhesión celular soluble (sICAM-I) fueron significativamente menores en el grupo de volúmenes corrientes bajos en un principio, los niveles de estos marcadores y el número de células y proteínas intraalveolares no fueron diferentes para ambos grupos luego de dos horas del inicio de la VM (51).
CONCLUSIONES
La ventilación mecánica puede modular la activación celular inmune dentro del tejido pulmonar liderando una respuesta inflamatoria local y sistémica con incremento la permeabilidad capilar. Tanto los mediadores inflamatorios liberados (citoquinas, factor activador de plaquetas, tromboxanos, prostaglandinas) como las fuerzas mecánicas extremas son responsables del daño pulmonar que ocurre durante la ventilación mecánica.
A diferencia de lo ocurrido en pacientes ventilados durante cirugía mayor, la respuesta inflamatoria secundaria generada por la circulación extracorporea durante cirugía cardiovascular es superior a la que podría generar la ventilación mecánica por si sola, adquiriendo ésta un componente multifactorial. A esto se suman la utilización de medicamentos como la protamina, el mismo trauma quirúrgico, la injuria por isquemia/ reperfusión, la activación de trombina, la utilización de hemoderivados, la liberación de inmuno-moduladores por el miocardio isquémico y el impacto producido por algunos medicamentos usados durante la anestesia. La circulación extracorporea se asocia con un cambio en la estructura del árbol bronquial secundario a las atelectasias, facilitando una mayor producción de citoquinas pro-inflamatorias por parte de los macrófagos alveolares.
Durante cirugía mayor y cardiaca son muchas las estrategias ventilatorias que se han utilizado para disminuir su impacto sobre esta potencial respuesta inflamatoria local y sistémica. Sin embargo, los estudios realizados para la evaluación de estos abordajes poseen notorios defectos en su diseño, en la homogeneidad del tipo de pacientes estudiados y su metodología de seguimiento. A pesar de existir alguna evidencia de que los volúmenes corrientes bajos y la utilización de PEEP podrían proteger la función ventilatoria postoperatoria y disminuir la respuesta inflamatoria sistémica, Hasta ahora ninguna estrategia ha demostrado realmente tener un impacto importante como para ser tomada como conducta estándar, especialmente en los pacientes llevados a cirugía cardiovascular con circulación extracorpórea. Se requieren estudios adicionales con mejores diseños que analicen el verdadero impacto de esta intervención sobre la función pulmonar y los principales desenlaces postoperatorios.
REFERENCIAS
1. Sherif A. Lung Protective Ventilation Strategies: Semin Cardiothorac Vasc Anesth 2002; 6(3): 259-269. [ Links ]
2. Evans R, Fernandez-Perez J, Keegan M, Brown D, Hubmayr R, Gagic O. Intraoperative tidal volume as a risk factor for respiratory failure after pneumonectomy. Anesthesiology 2006; 105:14-18. [ Links ]
3. Magnusson L, Zemgulis V, Wicky S, Tyden H, Thelin S, Hedenstierna G. Atelectasis is a major cause of hypoxemia and shunt after cardiopulmonary bypass: An experimental study. Anesthesiology 1997; 87:1153-63. [ Links ]
4. Choi G, Esther K. Wolthuis, Paul Bresser, Marcel Levi, Tom van der Poll, Misa Dzoljic, Margreeth B. Vroom, Marcus J. Schultz: Mechanical Ventilation with Lower Tidal Volumes andPositive End-expiratory Pressure Prevents Alveolar Coagulation in Patients without Lung Injury. Anesthesiology 2006; 105:689-95. [ Links ]
5. Kotani N, Hashimoto H, Sessler DI, Muraoka M, Wang JS, O' Connor MF, et al. Cardiopulmonary bypass produces greater pulmonary than systemic proinflammatory cytokines. Anesth Analg 2000; 90:1039-1045. [ Links ]
6. Jerrold HL, Kenichi AT. Inflammatory response to cardiopulmonary bypass. Ann Thorac Surg 2003; 75:S715-720. [ Links ]
7. Butler J, Rocker GM, Westaby S. Inflammatory response to cardiopulmonary bypass. Ann Thorac Surg 1993; 55:552-559. [ Links ]
8. Zupancich E, Paparella D, Turani F, Munch C, Rossi A, Massaccesi S, et al. Mechanical ventilation affects inflammatory mediators in patients undergoing cardiopulmonary bypass for cardiac surgery: A randomized clinical trial. J Thorac Cardiovasc Surg 2005; 130:378-83. [ Links ]
9. Eun Jung Cho, Jong Hyun Yoon, Sung Jin Hong, Sun Hee Lee, Sung Bo Sim The effects of sevoflurane on systemic and pulmonary inflammatory responses after cardiopulmonary bypass. Journal of Cardiothoracic and Vascular Anesthesia 2009; Vol 23, No 5 639- 645. [ Links ]
10. Koner O, Celebi S, Balci H, Cetin G, Karaoglu K, Cakar N. Effects of protective and conventional mechanical ventilation on pulmonary function and systemic cytokine release after cardiopulmonary bypass. Intensive Care Med 2004; 30:620-626. [ Links ]
11. Caspe. Parrillas para la lectura crítica. Disponible en: http://www.redcaspe.org/drupal/. Ultimo acceso en julio 30 de 2012. [ Links ]
12. Vandenbroucke JP, von Elm E, Altman DG, Gtzsche PC, Mulrow CD, Pocock SJ, et al. Strengthening the Reporting of Observational Studies in Epidemiology (STROBE): explanation and elaboration. Epidemiolog. 2007 Nov;18(6):805-35.31 [ Links ]
13. Slutsky AS. Lung injury caused by mechanical ventilation. Chest 1999; 116:S9-15. [ Links ]
14. Pugin J. Molecular mechanisms of lung cell activation induced by cyclic Stretch. Crit Care Med 2003; 31(4): 200-204. [ Links ]
15. Sundar S, Novack V, Jervis K, Bender P, Lerner A, Panzica P, et al. Influence of low tidal volume ventilation on time to extubation in cardiac surgical patients. Anesthesiology 2011; 114:1102-10. [ Links ]
16. Dreyfuss D, Soler P, Saumon G. Mechanical ventilation-induced pulmonary edema. Interaction with previous lung alterations. Am J Respir Crit Care Med. 1995 May;151:1568- 75. [ Links ]
17. Schultz M, Haitsma J, Slutsky A, Gajic O. What Tidal volumes should be used in patients without acute lung injury? Anesthesiology 2007; 106:1226 -31 [ Links ]
18. Eichacker PQ, Gerstenberger EP, Banks SM, Cui X, Natanson C. Meta-analysis of acute lung injury and acute respiratory distress syndrome trials testing low tidal volumes. Am J Respir Crit Care Med 2002; 166: 1510-4. [ Links ]
19. Wrigge H, Uhlig U, Zinserling J. The effects of different ventilatory settings on pulmonary and systemic inflammatory responses during major surgery. Anesth Analg 2004; 98:775-81. [ Links ]
20. Arthur S, Leonard D. Hudson: Peep or no peep - Lung recruitment may be the solution. N Engl J Med 2006; 354;17. [ Links ]
21. Duggan M, Kavanagh BP,Warltier D. Pulmonary atelectasis a pathogenic perioperative entity. Anesthesiology 2005; 102:838-54. [ Links ]
22. Macnaughton PD, Braude S, Hunter DN, Denison DM, Evans TW. Changes in lung function and pulmonary capillary permeability after cardiopulmonary bypass. Crit Care Med 1992; 20:1289-94. [ Links ]
23. Tenling A, Hachenberg T, Tyden H, Wegenius G, Hedenstierna G. Atelectasis and gas exchange after cardiac surgery. Anesthesiolog. 1998; 89:371-8. [ Links ]
24. Claxton BA, Morgan P, McKeague H, Mulpur A, Berridge J. Alveolar recruitment strategy improves arterial oxygenation after cardiopulmonary bypass. Anesthesia 2003; 58:111. [ Links ]
25. Dyhr T, Laursen N, Larsson A. Effects of lung recruitment maneuver and positive endexpiratory pressure on lung volume, respiratory mechanics and alveolar gas mixing in patients ventilated after cardiac surgery. Acta Anaesthesiol Scand 2002; 46:717-25. [ Links ]
26. Loeckinger A, Kleinsasser A, Lindner KH, Margreiter J, Keller C, Hoermann C. Continuous positive airway pressure at 10 cm H2O during cardiopulmonary bypass improves postoperative gas exchange. Anesth Analg 2000; 91:522-7. [ Links ]
27. Levi M, Schultz MJ, Rijneveld AW, van der Poll T: Bronchoalveolar coagulation and fibrinolysis in endotoxemia and pneumonia. Crit Care Med 2003; 31:S238-42 [ Links ]
28. Abraham E. Coagulation abnormalities in acute lung injury and sepsis. Am J Respir Cell Mol Biol 2000; 22:401-4. [ Links ]
29. Günther A, Mosavi P, Heinemann S, Ruppert C, Muth H, Markart P, et al. Alveolar fibrin formation caused by enhanced procoagulant and depressed fibrinolytic capacities in severe pneumonia: Comparison with the acute respiratory distress syndrome. Am J Respir Crit Care Med 2000; 161:454-62. [ Links ]
30. Choi G, Schultz MJ, van Till JW, Bresser P, Van Der Zee JS, Boermeester MA, et al. Disturbed alveolar fibrin turnover during pneumonia is restricted to the site of infection. Eur Respir J 2004; 24:786-9 [ Links ]
31. Ranieri VM, Suter PM, Tortorella C, De Tullio, R, Dayer JM, Brienza A, et al. Effect of mechanical ventilation on inflammatory mediators in patients with acute respiratory distress syndrome: A randomized controlled trial. JAMA 1999; 282:54-61. [ Links ]
32. Wrigge H, Uhlig U, Zinserling J, Behrends- Callsen E, Ottersbach G, Fischer et al. The effects of different ventilatory settings on pulmonary and systemic inflammatory responses during major surgery. Anesth Analg 2004; 98:775-81. [ Links ]
33. Wrigge H, Uhlig U, Baumgarten G, Menzenbach J, Zinserling J, Ernst M, et al. Mechanical ventilation strategies and inflammatory responses to cardiac surgery: A prospective randomized clinical trial. Intensive Care Med 2005; 31:1379-87. [ Links ]
34. Amato MB, Barbas CS, Medeiros DM, Schettino G-P, Lorenzi Filho G, Kairalla RA, et al. Beneficial effects of the 'open lung approach' with low distending pressures in acute respiratory distress syndrome: A prospective randomized study on mechanical ventilation. Am J Respir Crit Care Med 1995; 152:1835-46. [ Links ]
35. Amato MB, Barbas CS, Medeiros DM, Magaldi RB, Schettino GP, Lorenzi FG, et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med 1998; 338:347-54. [ Links ]
36. Tremblay LN, Slutsky AS: Ventilator-induced injury. From barotrauma to biotrauma. Proc Assoc Am Physicians 1998; 110:482-8. [ Links ]
37. Chiumello D, Pristine G, Slutsky AS. Mechanical ventilation affects local and systemic cytokines in an animal model of acute respiratory distress syndrome. Am J Respir Crit Care Med 1999; 160:109-16. [ Links ]
38. Tremblay L, Valenza F, Ribeiro SP, Li J, Slutsky AS. Injurious ventilatory strategies increase cytokines and c-fos m-RNA expression in an isolated rat lung model. J Clin Invest 1997; 99:944 -52. [ Links ]
39. Wrigge H, Zinserling J, Stu 'ber F, von Spiegel T, Hering R, Wetegrove S, et al. Effects of mechanical ventilation on release of cytokines into systemic circulation in patients with normal pulmonary function. Anesthesiology 2000; 93:1413-1417. [ Links ]
40. Meldrum DR, Cleveland JC Jr, Cain BS, Meng X, Harken AH. Increased myocardial TNFalpha in a crystalloid perfused model of cardiac ischemia-reperfusion injury. Ann Thorac Surg. 1998; 65:439-443. [ Links ]
41. Wan S, Desmet JM, Barvais L, Gold- stein M, Vincent JL, LeClerc JL. Myocardium is a major source of proinflammatory cytokines in patients undergoing cardiopulmonary bypass. J Thorac Cardiovasc Surg 1996; 112:806-811. [ Links ]
42. Hans G, Sottiaux TM, Lamy ML, Joris JL. Ventilatory management during routine anesthesia. European Journal of Anaesthesiology 2009; 26:1-8. [ Links ]
43. Larmann J, Theilmeier G. Inflammatory response to cardiac surgery: cardiopulmonary bypass versus non-cardiopulmonary bypass surgery. Best Prac Res Clin Anaesth 2004; 18:425-438. [ Links ]
44. Cameron D. Initiation of white cell activation during cardiopulmonary bypass: Cytokines and receptors. J Cardiovasc Pharmacol 1996; 27:S1-S5 (suppl 1). [ Links ]
45. Massaudy P, Zahler S, Becker BF. Significant leukocyte and platelet retention during pulmonary passage after declamping of the aorta in CABG patients. Eur J Med Res 1999; 4:178-182. [ Links ]
46. Reis Miranda D, Gommers D, Struijs A, Dekker R, Mekel J, Feelders R, et al. Ventilation according to the open lung concept attenuates pulmonary inflammatory response in cardiac surgery. Eur J Cardiothorac Surg 2005; 28:889-95. [ Links ]
47. Picone A, Lutz C, Finck C, Carney D, Gatto LA, Paskanik A, et al. Multiple sequential insults cause post-pump syndrome. Ann Thorac Surg 1999; 67:978- 985 [ Links ]
48. Massaudy P, Zahler S, Becker BF. Evidence for inflammatory responses of the lungs during coronary artery bypass grafting with cardiopulmonary bypass. Chest 2001; 119:31-36. [ Links ]
49. Wan S, LeClerc JL, Vincent JL.: Inflammatory response to cardiopul- monary bypass: mechanisms involved and possible therapeutic strategies. Chest 1997; 112:676-692 [ Links ]
50. Asimakopoulos G, Taylor KM, Smith PL, Ratnatunga CP. Prevalence of acute respiratory distress syndrome after cardiac surgery. J Thorac Cardiovasc Surg 1999; 117:620-621. [ Links ]
51. Schilling T, Kozian A, Huth C, Bu 'hling F, Kretzschmar M, Welte T, et al. The pulmonary immune effects of mechanical ventilation in patients undergoing thoracic surgery. Anesthesia Analgesia. 2005; 101:957-65. [ Links ]
52. Brodsky JB, Fitzmaurice B. Modern anesthetic techniques for thoracic operations. World J Surg 2001; 25:162-6. [ Links ]
53. Tugrul M, Camci E, Karadeniz H. Comparison of volume controlled with pressure controlled ventilation during one-lung anaesthesia. Br J Anaesth 1997; 79:306-10. [ Links ]
54. De Abreu MG, Heintz M, Heller A. Onelung ventilation with high tidal volumes and zero positive end-expiratory pres- sure is injurious in the isolated rabbit lung model. Anesth Analg 2003; 96:220-8. [ Links ]
55. Dyhr T, Nygård E, Laursen N, Larsson A. Both lung recruitment maneuver and PEEP are needed to increase oxygenation and lung volume after cardiac surgery. Acta Anaesthesiol Scand. 2004 Feb; 48(2):187-97. [ Links ]
56. Sundar S, Novack V, Jervis K, Bender SP, Lerner A, Panzica P, et al. Influence of low tidal volume ventilation on time to extubation in cardiac surgical patients. Anesthesiology. 2011 May;114(5):1102-10. [ Links ]
Recibido en: julio 12 de 2011. Revisado en: febrero de 2012. Aceptado en: junio 10 de 2012
Forma de citar: Santos-Cerquera RD, Ariza-Cadena F. Estrategias de protección pulmonar en cirugía cardiovascular. Rev CES Med 2012; 26(1): 85-98