Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina
Print version ISSN 0120-8705
CES Med. vol.26 no.1 Medellín Jan./Jun. 2012
ARTÍCULO DE REVISIÓN
Cardiomiopatía de Takotsubo, el gran imitador del infarto agudo del miocardio
Takotsubo cardiomyopathy, the great imitator of acute myocardial infarction
SARA ROJAS JIMÉNEZ1, JOHAN SEBASTIÁN LOPERA VALLE1
1 Estudiante de pregrado de Medicina; integrante del Semillero de Investigación de la Facultad de Medicina SIFAM; Escuela de Ciencias de la Salud, Universidad Pontificia Bolivariana:sararojasji@gmail.com
RESUMEN
Aproximadamente el 2 % de los casos de síndrome coronario agudo corresponden realmente a otra entidad diagnóstica conocida como cardiomiopatía de Takotsubo, cuyo reconocimiento por parte del personal asistencial es crucial debido a la alta incidencia de infarto del miocardio en nuestro medio. La CTT se caracteriza por la disfunción transitoria, de horas a semanas, del ventrículo izquierdo, el cual presenta un patrón de movimiento único, anormal y no explicable por enfermedades como isquemia coronaria, lesión valvular aórtica, miocarditis, entre otras. Su nombre se deriva de la morfología típica del ventrículo izquierdo en olla de pulpo (Takotsubo) que se observa mediante ecocardiografía o ventriculografía. Estos pacientes presentan signos y síntomas clínicamente idénticos al síndrome coronario agudo, junto con alteraciones electrocardiográficas y elevación de biomarcadores cardíacos. Se origina con mayor frecuencia en mujeres de mediana edad (entre 50 y 70 años), y es precipitado generalmente por estrés físico o psicológico severo. Ni la etiología ni los mecanismos fisiopatológicos exactos de la CTT son claramente conocidos, pero en las últimas dos décadas se han formulado una serie de teorías que hoy en día siguen siendo investigadas. A pesar de la existencia de importantes conclusiones a favor de estas teorías, continúan apareciendo inconsistencias que impiden determinar una etiología válida para todos los casos. Además de brindar una explicación más precisa acerca de las aproximaciones fisiopatológicas, esta revisión de tema amplía conceptos relacionados con el diagnóstico, tratamiento, complicaciones y pronóstico de la entidad clínica en cuestión.
PALABRAS CLAVE
Cardiomiopatía de Takotsubo, Infarto del miocardio, Insuficiencia cardíaca, Revisión de tema
ABSTRACT
Approximately 2% of the cases of acute coronary syndrome actually correspond to another diagnostic entity known as Takotsubo cardiomyopathy (TTC), whose recognition by physicians is crucial due to the high incidence of myocardial infarction in our community. TTC is characterized by transient dysfunction, of hours to weeks, of the left ventricle, which develops a pattern of unique and abnormal movement that can't be explained due to others pathologies like coronary ischemia, aortic injury, miocarditis, among others. Its name is derived of the typical morphology of octopus pot (TakoTsubo) that acquires the left ventricle when it's observed through echocardiography or ventriculography. These patients present signs and symptoms clinically identical to acute coronary syndrome, along with electrocardiographic alterations and elevated cardiac biomarkers. It has a bigger frequency in middle-age women (between 50 and 70 years old), and it's generally precipitated by severe physical or psychological stress. Neither the etiology nor the exact pathophysiological mechanisms of TTC are clearly known, but in the last two decades a number of theories have been formulated that today are object of investigations. Despite the existence of serious conclusions in favor of these theories, there are many inconsistencies that impede the determination of a valid etiology for every case. Besides the more precise explanation about the pathophysiological ways, this paper extends some concepts related to the diagnosis, treatment, complications and prognosis of the clinical entity.
KEY WORDS
Takotsubo cardiomyopathy, Myocardial infarction, Heart failure, Short review
INTRODUCCIÓN
La cardiomiopatía de Takotsubo (CTT), entidad clínica descrita hace un poco más de dos décadas, es también conocida como síndrome de Takotsubo, discinesia apical transitoria del ventrículo izquierdo (1), cardiomiopatía inducida por estrés (2), síndrome de disfunción transitoria del ventrículo izquierdo, síndrome del corazón roto y apical ballooning. Se caracteriza por la disfunción transitoria, de horas a semanas, del ventrículo izquierdo, el cual presenta un patrón de movimiento único, anormal y no explicable por enfermedades como isquemia coronaria, lesión valvular aórtica, miocarditis, entre otras.
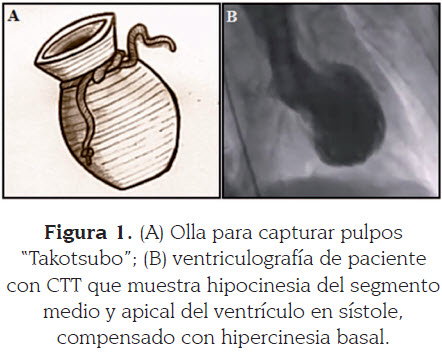
Dicho evento genera una morfología característica que se evidencia a través de técnicas imaginológicas que muestran acinesia, hipocinesia o discinesia del ápice cardiaco, el cual luce redondeado e hipocontráctil durante la sístole (compromiso que afecta igualmente la mitad distal de las paredes anterior, inferior y lateral), asociado a una base estrecha, debido a hipercinesia compensatoria de las paredes basales (3-5), con fracción de eyección baja que se recupera en su totalidad en un mes aproximadamente, por lo que su pronóstico es excelente (1).
El síndrome coronario agudo (SCA) es su manifestación clínica característica (6), además presenta alteraciones electrocardiográficas y elevación de los biomarcadores cardíacos (8); predomina en mujeres de mediana edad (entre 50 y 70 años) (1,7,8), y es precipitado generalmente por severo estrés físico o psicológico (1,2,9).
Según Kurowski y cols., existe una presentación clínica "atípica" que constituye más de un tercio de los pacientes (cercana al 40 %) (10), en la que el trastorno de contractilidad se limita a la porción media del ventrículo izquierdo con preservación relativa del ápice (11). Esta variante se asocia con la supresión de la hipercontratilidad basal, conformando el denominado "Takotsubo invertido" (12). Igualmente, se ha reportado el compromiso del ventrículo derecho en aproximadamente el 26 % de los pacientes (13) y se han documentado, así mismo, casos de afectación biventricular (14).
Este síndrome fue descrito por primera vez en el año 1990 por Sato et al. (15), quienes asemejaron la morfología que adopta el ventrículo izquierdo en la ventriculografía a un frasco de fondo redondo y de cuello estrello utilizado en Japón para capturar pulpos, término del cual se derivó el nombre de este síndrome (del japonés Tako, que significa pulpo, y Tsubo, que significa olla) (Figura 1) (4,15).
El primer reporte del síndrome fue realizado por un grupo de autores en 1989, quienes describieron un caso de disfunción reversible del ventrículo izquierdo asociado a feocromocitoma, aunque no usaron el término Takotsubo (15). En el año 2001, Tsuchihashi y cols. describen en Japón la primera serie de 88 pacientes (4), consiguiendo de esta manera la consolidación de la CTT como entidad independiente. Desde entonces se han documentado más series de casos en Bélgica (1), Estados Unidos. (16,17), y otros países de Europa (18). En el año 2006 la American Heart Association, en su clasificación de las miocardiopatías, la incorpora como miocardiopatía primaria adquirida (19).
EPIDEMIOLOGÍA
La prevalencia real de la CTT es incierta a pesar del incremento exponencial de las publicaciones desde 1989 hasta la actualidad. Algunas de las cifras estimadas proceden típicamente de ciertas series de pacientes con sospecha de SCA (20), todas éstas incluidas en una revisión bibliográfica (21). Estos pacientes representaron aproximadamente el 1,7 % al 2,2 % de los casos con SCA. Una reciente revisión informó que la CTT representó alrededor del 2 % de todos los pacientes con dolor torácico y elevación del segmento ST (9,22).
La incidencia de la cardiomiopatía de Takotsubo en aquellos pacientes con diagnóstico de infarto agudo de miocardio (IAM) se ha estimado entre 1,5 % y 2,2 %, alcanzando hasta el 6 % al 12 % entre las mujeres con sospecha de IAM de la pared anterior (1).
Típicamente, la CTT es mucho más común en mujeres que en hombres (1,2,7,10,23). En una revisión de diez series prospectivas, las mujeres representaron entre el 80 y el 100 % de los casos, con una edad media de 61 a 76 años (4,9); aunque recientemente se ha descrito que la media de edad de aparición de la presentación atípica es entre los 30 y 32 años de edad (24).
A pesar del predominio femenino, se ha encontrado una mayor proporción de hombres entre los que tienen CTT precipitada por el estrés físico (25). La razón de la alta prevalencia en las mujeres posmenopáusicas es desconocida, pero una hipótesis propone la baja concentración de estrógenos circulantes en plasma y sus implicaciones microvasculares como causa principal (6).
Informes recientes muestran que la condición es común en todo el mundo (2), sin asociación con áreas geográficas o grupos étnicos (1,8,26), aunque se ha descrito un leve predominio en asiáticos (27).
ETIOLOGÍA
La etiología de la CTT no ha sido reconocida claramente hasta el momento. En un 65 % a 80 % de los casos se ha identificado un factor estresante que, en alrededor del 50 % de éstos, es físico o emocional, mientras que el porcentaje restante no tienen desencadenantes asociados. Generalmente, el síndrome involucra a pacientes en estado de salud previamente normal que atraviesan por un episodio de estrés, el cuál predispone al 70 % de los individuos a una exposición excesiva a catecolaminas (28), situación que se propone como evento causal de la disfunción miocárdica (4).
La presentación de la CTT en su variante típica o atípica parece depender de las respuestas variables y propias a la estimulación adrenérgica, considerando factores genéticamente heredables como la síntesis, almacenamiento, liberación y catabolismo de la adrenalina que pueden variar de un individuo a otro (20). Recientemente, se han reportado casos familiares de CTT, lo que plantea la posibilidad de la existencia de predisposición genética (29,30).
Varias teorías se han propuesto a lo largo de la historia para tratar de esclarecer con exactitud la etiología de la CTT (31-35). Se han identificado igualmente un sinnúmero de condiciones clínicas que constituyen factores de estrés fisiológico, entre las cuales se enuncian: aturdimiento cardiaco neurogénico, insuficiencia respiratoria aguda, lesiones traumáticas, anafilaxia, sepsis, pancreatitis, intoxicación, rabdomiolisis, crisis hipertensiva, enfermedad tiroidea, hipertermia/ hipotermia, entre otras (36).
En cuanto a la predisposición genética para padecer la CTT, no se han identificado mutaciones o polimorfismos involucrados (37); sin embargo Kleinfeldt y cols. detectaron una mutación en el gen FMR1 en los pacientes que presentaron el primer episodio de esta entidad (38).
FISIOPATOLOGÍA
Autores como Bybee y Prasad (5) han revisado los diversos síndromes relacionados con la CTT y han descrito cuatro categorías o escenarios de presentación diferentes, que probablemente representan un espectro del mismo síndrome que se explica bajo los mismos mecanismos fisiopatológicos (39). Estas categorías son:
1. Cardiomiopatía de Takotsubo clásica, cuya presentación asemeja a un SCA.
2. Disfunción ventricular izquierda, asociada con enfermedad intracraneal aguda, especialmente hemorragia subaracnoidea.
3. Miocardiopatía transitoria, que ocurre durante otra enfermedad crítica, especialmente la sepsis (40,41).
4. Cardiomiopatía transitoria, asociada con feocromocitoma o administración de catecolaminas exógenas.
Por otro lado, el resultado de las biopsias de miocardio ventricular izquierdo en los pacientes con CTT muestra hallazgos similares. Típicamente se presentan infiltrados intersticiales de linfocitos mononucleares, leucocitos y macrófagos, además de fibrosis miocárdica y necrosis en bandas de contracción que se asocia con estados clínicos de exceso de catecolaminas (42), sin evidencia de miocarditis (4,43). Los cambios inflamatorios y la presencia de bandas de contracción en el tejido biopsiado, permiten distinguirla de la necrosis de coagulación propia del IAM (42).
A pesar de que la etiología y los mecanismos fisiopatológicos exactos de la CTT no son claramente conocidos, se han formulado una serie de teorías que se describirán a continuación.
Discinesia ventricular secundaria a catecolaminas
Más de un 70 % de los pacientes con CTT tienen niveles séricos anormalmente elevados de catecolaminas plasmáticas (4,9), generados posiblemente por el estrés emocional o físico que precede al suceso. Se ha demostrado que suelen tener niveles de 7 a 34 veces por encima del valor normal y de 2 a 3 veces mayores que los niveles de pacientes con IAM de cara anterior (4). El daño de los cardiomiocitos debido al aumento excesivo del tono simpático, con la subsecuente liberación de catecolaminas, es hoy en día la teoría más respaldada (32), debido en parte al reporte reciente de presentación de casos tras la administración de catecolaminas en diferentes contextos clínicos (44-46), el padecimiento de este síndrome en pacientes con feocromocitoma (35) y su reproducción en modelos animales tras la infusión de adrenalina (47).
La presentación típica de CTT tiene su explicación en estudios que demostraron que la distribución más densa de receptores b-adrenérgicos se encuentra en el segmento apical del corazón, por lo que la concentración anormalmente elevada de catecolaminas se traduce cardiotóxicamente en un efecto inotrópico negativo apical, y por lo tanto, en la afección de forma selectiva de la función cardiaca propia de este síndrome (48-50).
Adicionalmente, se ha planteado la hipótesis de que los altos niveles de adrenalina desencadenan un cambio en la señalización intracelular de los cardiomiocitos tras la saturación de los receptores B2 adrenérgicos, concretamente en el acoplamiento de la proteína Gs a la proteína Gi (48). De hecho, se ha encontrado que el polimorfismo de la proteína G acoplada al receptor kinasa Leu41, es significativamente más frecuente en esta enfermedad y se asocia a mayor sensibilización B- adrenérgica que puede predisponer a la miocardiopatía causada por la repetición de picos de catecolaminas (51,52). Además, reproduciendo la CTT en un modelo de roedores, ésta se puede prevenir al conseguir el bloqueo de los receptores a y B adrenérgicos (49).
Por otro lado, al determinar que los estrógenos pueden regular los receptores adrenérgicos cardíacos y atenuar la respuesta a su activación, se ha identificado una razón plausible del predominio del síndrome en las mujeres posmenopáusicas (49).
A pesar de que esta teoría tiene serias consideraciones que están a su favor, no termina por aclarar con precisión el origen del síndrome, pues no obstante la medición plasmática de catecolaminas en múltiples estudios, no se ha podido comprobar la existencia de una elevada concentración de éstas a nivel local (miocardio apical) durante la fase aguda del evento; sin embargo, demostrar esta última premisa no explicaría el fenómeno en su totalidad, ya que es un hallazgo inespecífico que acompaña la mayoría de enfermedades agudas. En adición, se ha determinado que en algunos pacientes los niveles de estas sustancias son normales, por lo que la teoría no podría abarcarse universalmente (53).
Teoría de los espasmos coronarios
Teniendo en cuenta el carácter reversible de la alteración, surge la teoría de un espasmo microvascular, ya que espasmos coronarios oclusivos pueden generar isquemia transmural con elevación del segmento ST en ausencia de enfermedad coronaria obstructiva (54). Se han observado espasmos multi-vasos espontáneos en 1,4 % de los pacientes y provocables con acetilcolina en 15 a 30 % de los sujetos estudiados (7); no obstante, los resultados han variado ampliamente en las diferentes series que van desde 0 a 100 % (1,4). Este resultado sugiere que, aunque los espasmos pueden desempeñar un papel en la CTT, no explica la mayoría de los casos ni el compromiso en la contractilidad apical o la existencia de casos atípicos.
Oclusión transitoria de la placa aterosclerótica
Algunos investigadores plantean la hipótesis de que la ruptura transitoria de una placa aterosclerótica en una variante anatómica de la arteria descendente anterior, que se extiende hacia apical y diafragmáticamente, seguida de la precoz reperfusión debido a una combinación de trombosis y vasoconstricción, da lugar a las características únicas clínicas de este síndrome (43). Sin embargo, en la CTT, el área de miocardio afectado es mucho mayor que la distribución normal de una arteria coronaria única, además, esta anatomía coronaria no se observa en todos los pacientes afectados, por lo que se ha sugerido como una explicación alternativa en algunos casos (21,55).
Teoría de la disfunción microvascular
Muchos investigadores han interpretado hallazgos consistentes en la disminución de la perfusión miocárdica en ausencia de lesiones obstructivas coronarias, como una evidencia directa de la afección de la microcirculación coronaria, siendo éste el mecanismo causante del síndrome (13,56). Ciertamente, se ha comprobado que la función de la microvascularización coronaria se afecta de forma difusa disminuyendo la reserva del flujo coronario inmediatamente después del inicio del evento (1,56); no obstante, este hallazgo no implica una relación de causalidad, ya que la reducción transitoria de la reserva coronaria puede ser efecto secundario al aumento del estrés mecánico sobre la pared ventricular como consecuencia a la discinesia apical (57).
Obstrucción del tracto de salida del ventrículo izquierdo (OTSVI)
En el espectro de la CTT, la OTSVI de forma severa y transitoria se generaría gracias a alteraciones morfológicas del miocardio, específicamente a la presencia, comúnmente en mujeres mayores, de un septum en la parte medial del tabique interventricular de morfología sigmoide, asociado a una orientación anormal en la inserción de la válvula mitral (58). Dicha obstrucción produce isquemia subendocárdica secundaria a la reducción de la perfusión miocárdica ante una intensa estimulación adrenérgica o deshidratación, con un notable aumento de la demanda de oxígeno, reducción del flujo de sangre y aumento en el estrés de la pared. El resultado final de la obstrucción es el aturdimiento miocárdico en el segmento apical que no corresponde a un territorio específico de una arteria coronaria (7); pero, debido a que esta morfología no está presente en todos los pacientes, se ha concluido que es probable que la OTSVI agrave el síndrome en algunos casos.
Teoría de la descendente anterior (DA) recurrente
Ibáñez y cols. publicaron una serie de 11 pacientes con sospecha de IAM, arterias coronarias normales y disfunción ventricular transitoria tipo CTT. Estudiaron la anatomía coronaria de los pacientes, así como de 44 controles ajustados por edad y sexo: 22 con coronarias normales y 22 con infarto agudo de miocardio, en relación con oclusión en la arteria coronaria DA. Esta arteria tenía una longitud mayor y un segmento diafragmático recurrente más largo que los controles, estableciendo un índice de recurrencia. Este índice fue mayor en los pacientes con disfunción ventricular transitoria tipo CTT, que en controles y en pacientes con infarto. Los pacientes control con infarto presentaban una ventriculografía idéntica a la de los enfermos con CTT cuando su índice de recurrencia era alto (59).
PRESENTACIÓN CLÍNICA
Los pacientes con CTT presentan signos y síntomas clínicamente idénticos al SCA (2,7). Los motivos de consulta más comunes son dolor torácico en 67,8 %, y disnea en 17,8 % de los pacientes (9). Otros síntomas referidos son palpitaciones, síncope, náuseas, diaforesis, ansiedad, entre otros (2,7). Generalmente, el cuadro es de instauración rápida y ocurre después de un episodio de estrés emocional en 27 % de los pacientes, de estrés físico en 39 %, mientras que el 34 % restante no posee un factor de estrés asociado (9).
La severidad de los síntomas varía desde los más leves previamente enunciados hasta la necesidad de balón de contra pulsación intraaótico o soporte inotrópico en 20 % de los pacientes (7). Las manifestaciones clínicas más graves son el choque cardiogénico (1) en el 4,2 % de los pacientes y la fibrilación ventricular en 1,5 % de los mismos (9).
DIAGNÓSTICO
El diagnóstico de la CTT debe sospecharse al tener un inicio súbito de dolor torácico o disnea, precipitado por un estrés físico o emocional, con cambios electrocardiográficos sugestivos de infarto agudo, asociado a elevación leve o moderada de los biomarcadores cardiacos, observación de la morfología típica en olla de pulpo (Takotsubo) del ventrículo izquierdo en la ecocardiografía o ventriculografía, sin evidencia de obstrucción coronaria al cateterismo cardiaco y resolución completa de la disfunción ventricular izquierda en las próximas semanas (36).
Hallazgos electrocardiográficos
Tal como en la sospecha de SCA, el electrocardiograma en la CTT debe ser el examen inicial a realizar en el servicio de urgencias, aunque puede ser completamente normal o tener cambios inespecíficos en 15 % de los casos (60-63). El hallazgo más común es la elevación del segmento ST en las derivaciones precordiales en 81,6 % de los casos (18,60). Esta elevación se presenta con una prominencia levemente mayor en las derivaciones precordiales anteriores (V2-V3) (61), con ausencia en la derivación V1 (62).
Con frecuencia, este hallazgo se acompaña de la inversión profunda de la onda T en 64,3 % de los pacientes (9), de forma usual durante la fase aguda. Característicamente, la ausencia de cambios recíprocos en las derivaciones inferiores muestra una alta sensibilidad y especificidad para diferenciar CTT del IAM (63).
Otros hallazgos que se describen son la prolongación del intervalo QT dentro de las primeras 48 horas (1), hallazgo que algunos autores reportan como el más común (1) y que no se ve con frecuencia después de un IAM (7). Se ha descrito también la presencia de ondas Q en 31,8 % de los casos (9) y la presencia de ondas U prominentes, lo cual ha sido propuesto como un hallazgo electrocardiográfico adicional para apoyar el diagnóstico de la CTT.
Biomarcadores cardiacos
Típicamente, la mayoría de los pacientes con CTT presentan niveles levemente elevados de los biomarcadores cardiacos, mientras que en el SCA la elevación es 10 veces mayor (1). El aumento de la presión diastólica final del ventrículo izquierdo como resultado del miocardio aturdido genera niveles elevados del péptido natriurético cerebral, principalmente en pacientes con insuficiencia cardíaca izquierda (64).
Cateterismo cardiaco y ecocardiografía
El diagnóstico de CTT suele confirmarse tras la verificación de la ausencia de enfermedad aterotrombótica en las arterias coronarias (1), por lo cual resulta indispensable la realización de una coronariografía precoz. Aproximadamente, el 80,6 % de los pacientes con CTT no presentan obstrucciones ateroescleróticas, el resto suelen tener una leve estenosis luminal inferior al 50 %. La función ventricular puede ser evaluada mediante la ventriculografía, y por lo general los pacientes presentan una fracción de eyección (FE) de 20 a 49 % (2,4,7,9), que mejora tras un periodo de días a semanas, logrando una fracción de eyección entre el 60 y el 76 % (2,7,43). Tanto la ventriculografía como la ecocardiografía permiten observar la morfología característica del síndrome en su forma típica (1,7,9) y atípica (10).
Resonancia magnética cardiaca
La resonancia magnética cardiaca puede establecer el diagnóstico de la CTT con precisión mediante la visualización de alteraciones de la contractilidad segmentaria, la cuantificación de la función ventricular, la identificación de lesiones reversibles en el miocardio por la presencia de edema ventricular que no está relacionado con un territorio vascular específico y la ausencia de necrosis y fibrosis (65). Además, en la resonancia magnética cardiaca se observa ausencia de realce tardío de gadolinio en múltiples territorios coronarios, a diferencia de un infarto de miocardio y la miocarditis, en los que ocurre lo contrario (66,67).
Criterios diagnósticos
A pesar de que aun no hay un consenso mundial sobre los criterios diagnósticos de la CTT, investigadores de la Clínica Mayo propusieron unos criterios en el año 2004 (con modificación reciente) (6), que hoy en día son de uso común (1). Hay raras excepciones a estos criterios, tales como pacientes en los que la alteración contráctil se limita a un territorio coronario único y aquellos con aterosclerosis coronaria obstructiva.
Los cuatro criterios basados fundamentalmente en la presentación clínica (1,68), permiten discriminar fácilmente este síndrome de otras enfermedades como el IAM. Deben estar presentes los siguientes cuatro criterios para hacer el diagnóstico:
1. Discinesia o acinesia transitoria de los segmentos apicales y medios del ventrículo izquierdo de distribución vascular correspondiente a más de una arteria epicárdica.
2. Ausencia de enfermedad coronaria obstructiva o evidencia de ruptura aguda de placa en la angiografía.
3. Nueva aparición de anomalías en el trazado electrocardiográfico, como elevación del segmento ST o inversión de la onda T.
4. Ausencia de traumatismo craneoencefálico reciente o hemorragia subaracnoidea, feocromocitoma, miocarditis, miocardiopatía hipertrófica o aturdimiento miocárdico de origen isquémico.
TRATAMIENTO
En la actualidad no existen ensayos clínicos que permitan evaluar los tratamientos propuestos para la CTT. Debido a que esta es clínicamente indistinguible de un SCA, generalmente el tratamiento inmediato de estos pacientes incluye el manejo de la isquemia coronaria. Una vez que se diagnostica el síndrome, el tratamiento a administrar es principalmente de apoyo debido a que la función cardiaca se recupera en pocas semanas. El tratamiento conservador con la hidratación y la supresión de la tensión física o emocional, por lo general da lugar a una rápida resolución de los síntomas y cambios en el electrocardiograma. Algunos autores han señalado incluso la recuperación completa sin necesidad de tratamiento (9).
Se propone la administración de bloqueadores ß o agonistas a-adrenérgicos, añadidos a inhibidores de la enzima conversora de angiotensina, ya que disminuyen o anulan el gradiente dinámico que se genera en el tracto de salida del ventrículo izquierdo durante la fase aguda; esto, junto a la no administración de agonistas ß adrenérgicos, facilita la recuperación de los pacientes (2,7,31,33,47).
COMPLICACIONES
Las complicaciones tardías de la CTT son poco frecuentes, debido a que el síndrome es reversible y el daño no es permanente. La tasa de complicaciones es alrededor del 19 % (27) y gran parte de estas ocurren durante la fase aguda de la enfermedad. Las principales complicaciones descritas son: insuficiencia cardíaca izquierda con o sin edema agudo de pulmón, choque cardiogénico, regurgitación mitral por movimiento anterior sistólico del aparato valvular mitral, arritmias ventriculares, formación de trombos intramurales en el ventrículo izquierdo, ruptura de la pared libre del ventrículo izquierdo, entre otras (69,70).
PRONÓSTICO
El pronóstico para los pacientes con CTT es generalmente favorable, sin secuelas a largo plazo una vez que la fase aguda ha pasado, con recuperación de la función cardíaca en cuatro a ocho semanas en 95 % de los pacientes (70), teniendo en cuenta que las estimaciones de las tasas de mortalidad han variado desde 1 hasta 3,2 % (9,27). La reincidencia se considera poco común y ha sido reportada en el 3,5 al 10 % de los casos (7, 9, 34,60).
AGRADECIMIENTOS
Al Semillero de Investigación de la Facultad de Medicina (SIFAM) y a sus docentes Lina Martínez e Isabel Ortiz por incentivar en sus estudiantes el espíritu investigativo.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
REFERENCIAS
1. Bybee KA, Kara T, Prasad A, Lerman A, Barsness GW, Wright RS, et al. Systematic review: transient left ventricular apical ballooning: a syndrome that mimics ST-segment elevation myocardial infarction. Ann Intern Med 2004 Dec 7; 141(11):858-65. [ Links ]
2. Sharkey SW, Lesser JR, Zenovich AG, Maron MS, Lindberg J, Longe TF, et al. Acute and reversible cardiomyopathy provoked by stress in women from the United States. Circulation 2005; 111: 472-479. [ Links ]
3. Sato M, Fujita S, Saito A, Ikeda Y, Kitazawa H, Takahashi M, et al. Increased incidence of transient left ventricular apical ballooning (so-called "Takotsubo" cardiomyopathy) after the mid-Niigata Prefecture earthquake. Circ J 2006; 70: 947-953. [ Links ]
4. Wittstein IS, Thiemann DR, Lima JA, Baughman KL, Schulman SP, Gerstenblith G, et al. Neurohumoral features of myocardial stunning due to sudden emotional stress. N Engl J Med 2005 Feb 10; 352(6):539-48. [ Links ]
5. Bybee KA, Prasad A. Stress-related cardiomyopathy syndromes. Circulation 2008 Jul 22; 118(4):397-409. [ Links ]
6. Prasad A, Lerman A, Rihal CS. Apical ballooning syndrome (Tako-Tsubo or stress cardiomyopathy): a mimic of acute myocardial infarction. Am Heart J 2008 Mar; 155(3):408-17. [ Links ]
7. Tsuchihashi K, Ueshima K, Uchida T, Ohmura N, Kimura K, Owa M, et al. Angina Pectoris- Myocardial Infarction Investigations in Japan. Transient left ventricular apical ballooning without coronary artery stenosis: a novel heart syndrome mimicking acute myocardial infarction. J Am Coll Cardiol 2001 Jul; 38(1):11-8. [ Links ]
8. Hertting K, Krause K, Harle T, Boczor S, Reimers J, Kuck KH. Transient left ventricular apical ballooning in a community hospital in Germany. Int J Cardiol 2006; 112:282-8. [ Links ]
9. Gianni M, Dentali F, Grandi AM, Sumner G, Hiralal R, Lonn E. Apical ballooning syndrome or takotsubo cardiomyopathy: a systematic review. Eur Heart J 2006 Jul; 27(13):1523-9. [ Links ]
10. Kurowski V, Kaiser A, von Hof K, Killermann DP, Mayer B, Hartmann F, et al. Apical and midventricular transient left ventricular dysfunction syndrome (tako-tsubo cardiomyopathy): frequency, mechanisms, and prognosis. Chest 2007; 132: 809-816. [ Links ]
11. Robles P, Alonso M, Huelmos AI, Jiménez JJ, López Bescós L. Images in cardiovascular medicine. Atypical transient left ventricular ballooning without involvement of apical segment. Circulation 2006 Apr 11; 113(14):e686-8. [ Links ]
12. Blessing E, Steen H, Rosenberg M, Katus H, Frey N. Recurrence of takotsubo cardiomyopathy with variant forms of left ventricular dysfunction. J Am Soc Echocardiogr 2007; 20: 439.e11-439.e12. [ Links ]
13. Elesber AA, Prasad A, Bybee KA, Valeti U, Motiei A, Lerman A, et al. Transient cardiac apical ballooning syndrome: prevalence and clinical implications of right ventricular involvement. J Am Coll Cardiol 2006 Mar 7; 47(5):1082-3. [ Links ]
14. Novak G, Kross K, Follmer K, Brofferio A, Shirani J. Transient biventricular apical ballooning: a unique presentation of the "broken heart" Clin Cardiol 2007; 30:355-8 [ Links ]
15. Sato H, Tateishi H, Uchida T. Takotsubo-type cardiomyopathy due to multivessel spasm. In: Kodama K, Haze K, Hon M, eds. Clinical aspect of myocardial injury: from ischemia to heart failure [in Japanese]. Tokyo: Kagakuhyouronsha, 1990:56-64. [ Links ]
16. Nef HM, Möllmann H, Akashi YJ, Hamm CW. Mechanisms of stress (Takotsubo) cardiomyopathy. Nat Rev Cardiol 2010 Apr; 7(4):187-93. [ Links ]
17. Manfredini R, Boari B, Salmi R, Malagoni AM, Manfredini F. Circadian variation of cardiovascular and other stress-related events. In: Encyclopedia of Stress, Second Edition. Fink G (Ed.). Academic Press, Oxford, UK, 2007. 500-504. [ Links ]
18. Manfredini R, Boari B, Salmi R, Gallerani M, Felisatti M, Mandini S, et al. Circadian variation of cardiovascular events and morning blood pressure surge. Vasc Dis Prev 2008; 5,246-251. [ Links ]
19. Maron BJ, Towbin JA, Thiene G, Antzelevitch C, Corrado D, Arnett D, et-al. American Heart Association contemporary definitions and classification of the cardiomyopathies. Circulation 2006; 113:1807-16. [ Links ]
20. Sharkey SW, Windenburg DC, Lesser JR, Maron MS, Hauser RG, Lesser JN, et al. Natural history and expansive clinical profile of stress (tako-tsubo) cardiomyopathy. J Am Coll Cardiol 2010 Jan 26;55(4):333-41. [ Links ]
21. Haghi D, Roehm S, Hamm K, Harder N, Suselbeck T, Borggrefe M, et al. Takotsubo cardiomyopathy is not due to plaque rupture: an intravascular ultrasound study. Clin Cardiol 2010 May; 33(5):307-10. [ Links ]
22. Koeth O, Zeymer U, Schiele R, Zahn R. Inferior ST-elevation myocardial infarction associated with Takotsubo cardiomyopathy. Case Report Med 2010. pii: 467867 [ Links ]
23. Del Nogal F, Meyer E, Villar M, Blasco MA, Díaz R, Grande JM. Síndrome de tako-tsubo. Discinesia transitoria del ventrículo izquierdo. Presentación de nuestra casuística Med Intensiva 2011; 35:307-11. [ Links ]
24. Mansencal N, El Mahmoud R, Pillière R, Dubourg O. Relationship between pattern of Tako-Tsubo cardiomyopathy and age: from midventricular to apical ballooning syndrome. Int J Cardiol 2010 Jan 7; 138(1):e18-20. [ Links ]
25. Haghi D, Fluechter S, Suselbeck T, Saur J, Bheleel O, Borggrefe M, et al. Takotsubo cardiomyopathy (acute left ventricular apical ballooning syndrome) occurring in the intensive care unit. Intensive Care Med 2006; 32:1069-1074. [ Links ]
26. Auer J, Porodko M, Berent R, Punzengruber C, Weber T, Lamm G, et al. Left ventricular apical ballooning-A novel cardiac disease mimicking acute coronary syndrome: A case report in a Caucasian patient. Int J Cardiol 2006;106:398-400. [ Links ]
27. Donohue D, Movahed MR. Clinical characteristics, demographics and prognosis of transient left ventricular apical ballooning syndrome. Heart Fail Rev 2005 Dec; 10(4):311-6. [ Links ]
28. Soares-Filho GL, Felix RC, Azevedo JC, Mesquita CT, Mesquita ET, Valença AM, et al. Broken heart or takotsubo syndrome: support for the neurohumoral hypothesis of stress cardiomyopathy. Prog Neuropsychopharmacol Biol Psychiatry 2010 Feb 1; 34(1):247-9. [ Links ]
29. Pison L, De Vusser P, Mullens W. Apical ballooning in relatives. Heart 2004; 90:e67. [ Links ]
30. Kumar G, Holmes DR, Prasad A. "Familial" apical ballooning syndrome (Takotsubo cardiomyopathy). Int J Cardiol 2009; 3:78. [ Links ]
31. Lee VH, Connolly HM, Fulgham JR, Manno EM, Brown RD Jr, Wijdicks EF. Tako-tsubo cardiomyopathy in aneurysmal subarachnoid hemorrhage: an underappreciated ventricular dysfunction. J Neurosurg 2006; 105:264-70. [ Links ]
32. Wong AK, Vernik WJ, Wiegers SE, Howell JA, Sinha AC. Perioperative Takotsubo cardiomyopathy identified in the operating room prior to induction of anesthesia. Anesth Analg 2010; 110:712-5. [ Links ]
33. Singh NK, Rumman S, Mikell FL, Nallamothu N, Rangaswamy C. Stress cardiomyopathy: clinical and ventriculographic characteristics in 107 North American subjects. Int J Cardiol Epub ahead of print, January 18, 2009. [ Links ]
34. Elesber AA, Prasad A, Lennon RJ, Wright RS, Lerman A, Rihal CS. Four-year recurrence rate and prognosis of the apical ballooning syndrome. J Am Coll Cardiol 2007; 50:448-52 [ Links ]
35. Kassim TA, Clarke DD, Mai VQ, Clyde PW, Mohamed Shakir KM. Catecholamine-induced cardiomyopathy. Endocr Pract 2008; 14:1137-49. [ Links ]
36. Derrick D. The "broken heart syndrome": understanding Takotsubo cardiomyopathy. Crit Care Nurse 2009 Feb; 29(1):49-57; [ Links ] quiz 58. Review. Erratum in: Crit Care Nurse 2009 Apr; 29(2):24.
37. Handy AD, Prasad A, Olson TM. Investigating genetic variation of adrenergic receptors in familial stress cardiomyopathy (apical ballooning syndrome). J Cardiol. 2009 Dec; 54(3):516-7. [ Links ]
38. Kleinfeldt T, Schneider H, Akin I, Kische S, Gökmen Turan R, Nienaber CA, et al. Detection of FMR1-gene in Takotsubo cardiomyopathy: a new piece in the puzzle. Int J Cardiol 2009 Nov 12; 137(3):e81-3. [ Links ]
39. Hessel EA 2nd, London MJ. Takotsubo (stress) cardiomyopathy and the anesthesiologist: enough case reports. Let's try to answer some specific questions! Anesth Analg 2010 Mar 1; 110(3):674-9. [ Links ]
40. Park JH, Kang SJ, Song JK, Kim HK, Lim CM, Kang DH, et al. Left ventricular apical ballooning due to severe physical stress in patients admitted to the medical ICU. Chest 2005 Jul; 128(1):296-302. [ Links ]
41. Haghi D, Fluechter S, Suselbeck T, Saur J, Bheleel O, Borggrefe M, et al. Takotsubo cardiomyopathy (acute left ventricular apical ballooning syndrome) occurring in the intensive care unit. Intensive Care Med 2006 Jul; 32(7):1069-74. [ Links ]
42. American College of Cardiology. Heart disease and stroke statistics: 2007 update at a glance. Disponible en: http://www.americanheart.org/downloadable/heart/1166711577754HS [ Links ]
43. Ibanez B, Navarro F, Cordoba M, M-Alberca P, Farre J. Tako-tsubo transient left ventricular apical ballooning: is intravascular ultrasound the key to resolve the enigma? Heart 2005; 91:102-104. [ Links ]
44. Litvinov IV, Kotowycz MA, Wassmann S. Iatrogenic epinephrine-induced reverse Takotsubo cardiomyopathy: direct evidence supporting the role of catecholamines in the pathophysiology of the "broken heart syndrome". Clin Res Cardiol 2009; 98:457-62. [ Links ]
45. Abraham J, Mudd, JO, Kapur N, Klein K, Champion HC, Wittstein IS. Stress cardiomyopathy after intravenous administration of catecholamines and beta-receptor agonists. J Am Coll Cardiol 2009; 53:1320-5. [ Links ]
46. Suk EH, Kim DH, Kweon TD, Na SW, Shin JA. Stress-induced cardiomyopathy following cephalosporin-induced anaphylactic shock during general anesthesia. Can J Anaesth 2009; 56:432-6. [ Links ]
47. Izumi Y, Okatani H, Shiota M, Nakao T, Ise R, Kito G, et al. Effects of metoprolol on epinephrine- induced takotsubo-like left ventricular dysfunction in non-human primates. Hypertens Res 2009; 32:339-46. [ Links ]
48. Lyon AR, Rees PS, Prasad S, Poole-Wilson PA, Harding SE. Stress (Takotsubo) cardiomyopathy-- a novel pathophysiological hypothesis to explain catecholamine-induced acute myocardial stunning. Nat Clin Pract Cardiovasc Med 2008 Jan; 5(1):22-9. [ Links ]
49. Ueyama T, Kasamatsu K, Hano T, Yamamoto K, Tsuruo Y, Nishio I. Emotional stress induces transient left ventricular hypocontraction in the rat via activation of cardiac adrenoceptors: a possible animal model of 'tako-tsubo' cardiomyopathy. Circ J 2002; 66: 712-713. [ Links ]
50. Dorfman TA, Iskandrian AE. Takotsubo cardiomyopathy: State-of-the-art review. J Nucl Cardiol. Jan-Feb 2009; 16(1):122-34. [ Links ]
51. Sharkey SW, Maron BJ, Nelson P, Parpart M, Maron MS, Bristow MR. Adrenergic receptor polymorphisms in patients with stress (takotsubo) cardiomyopathy. J Cardiol. 2009 Feb; 53(1):53-7. [ Links ]
52. Spinelli L, Trimarco V, Di Marino S, Marino M, Iaccarino G, Trimarco B. L41Q polymorphism of the G protein coupled receptor kinase 5 is associated with left ventricular apical ballooning syndrome. Eur J Heart Fail. 2010 Jan; 12(1):13-6. [ Links ]
53. Madhavan M, Borlaug BA, Lerman A, Rihal CS, Prasad A. Stress hormone and circulating biomarker profile of apical ballooning syndrome (Takotsubo cardiomyopathy): insights into the clinical significance of B-type natriuretic peptide and troponin levels. Heart. 2009 Sep; 95(17):1436-41. [ Links ]
54. Ako J, Sudhir K, Farouque HM, Honda Y, Fitzgerald PJ. Transient left ventricular dysfunction under severe stress: brain-heart relationship revisited. Am J Med. 2006; 119(1):10-17. [ Links ]
55. Delgado GA, Truesdell AG, Kirchner RM, Zuzek RW, Pomerantsev EV, Gordon PC, et al. An angiographic and intravascular ultrasound study of the left anterior descending coronary artery in takotsubo cardiomyopathy. Am J Cardiol 2011 Sep 15; 108(6):888-91. [ Links ]
56. Kume T, Akasaka T, Kawamoto T, Yoshitani H, Watanabe N, Neishi Y, et al. Assessment of coronary microcirculation in patients with Takotsubo-like left ventricular dysfunction. Circ J 2005; 69: 934-939. [ Links ]
57. Malafronte C, Farina A, Tempesta A, Lobiati E, Galbiati R, Cantu E, et al. Tako-tsubo: a transitory impairment of microcirculation? A case report. Ital Heart J 2005; 6:933-8. [ Links ]
58. Merli E, Sutcliffe S, Gori M, Sutherland GG. Tako-Tsubo cardiomyopathy: new insights into the possible underlying pathophysiology. Eur J Echocardiogr 2006; 7:53-61. [ Links ]
59. Ibáñez B, Navarro F, Farré J, Marcos-Alberca P, Orejas M, Rábago R, et-al. Asociación del síndrome de Tako-Tsubo con la arteria coronaria descendente anterior con extensa distribución por el segmento diafragmático. Rev Esp Cardiol 2004; 57:209-16. [ Links ]
60. Prasad A. Apical ballooning syndrome: an important differential diagnosis of acute myocardial infarction. Circulation 2007; 115(5):56-59 [ Links ]
61. Sharkey SW, Lesser JR, Menon M, Parpart M, Maron MS, Maron BJ. Spectrum and significance of electrocardiographic patterns, troponin levels, and thrombolysis in myocardial infarction frame count in patients with stress (tako-tsubo) cardiomyopathy and comparison to those in patients with ST-elevation anterior wall myocardial infarction. Am J Cardiol 2008 Jun 15;101(12):1723-8. [ Links ]
62. Kosuge M, Ebina T, Hibi K, Morita S, Okuda J, Iwahashi N. Simple and accurate electrocardiographic criteria to differentiate Takotsubo cardiomyopathy from anterior acute myocardial infarction. J Am Coll Cardiol Jun 1 2010; 55(22):2514-6. [ Links ]
63. Ogura R, Hiasa Y, Takahashi T, Yamaguchi K, Fujiwara K, Ohara Y, et al. Specific findings of the standard 12-lead ECG in patients with 'Takotsubo' cardiomyopathy: comparison with the findings of acute anterior myocardial infarction. Circ J. 2003 Aug; 67(8):687-90. [ Links ]
64. Song BG, Park SJ, Noh HJ, Jo HC, Choi JO, Lee SC, et al. Clinical characteristics, and laboratory and echocardiographic findings in Takotsubo cardiomyopathy presenting as cardiogenic shock. J Crit Care 2010 Jun; 25(2):329-35. [ Links ]
65. Eitel I, von Knobelsdorff-Brenkenhoff F, Bernhardt P, Carbone I, Muellerleile K, Aldrovandi A, et al. Clinical characteristics and cardiovascular magnetic resonance findings in stress (takotsubo) cardiomyopathy. JAMA. Jul 20 2011; 306(3):277-86. [ Links ]
66. Gerbaud E, Montaudon M, Leroux L, Corneloup O, Dos Santos P, Jaïs C, et al. MRI for the diagnosis of left ventricular apical ballooning syndrome (LVABS). Eur Radiol. 2008 May; 18(5):947-54. [ Links ]
67. Cummings KW, Bhalla S, Javidan-Nejad C, Bierhals AJ, Gutierrez FR, Woodard PK. A pattern-based approach to assessment of delayed enhancement in nonischemic cardiomyopathy at MR imaging. RadioGraphics 2009; 29 : 89-103 [ Links ]
68. Bybee KA, Rihal CS. Transient left ventricular apical ballooning. Ann Intern Med. 2005; 142:678-9. [ Links ]
69. Sakai K, Ochiai H, Katayama N, Nakamura K, Arataki K, Kido T, et al. Ventricular septal perforation in a patient with Takotsubo cardiomyopathy. Circ J 2005;69:365-7. [ Links ]
70. Lee PH, Song JK, Sun BJ, Choi HO, Seo JS, Na JO, et al. Outcomes of patients with stress-induced cardiomyopathy diagnosed by echocardiography in a tertiary referral hospital. J Am Soc Echocardiogr. 2010 Jul; 23(7):766-71. [ Links ]
Recibido en: enero 24 de 2012. Revisado en: junio de 2012. Aceptado en: julio 24 de 2012
Forma de citar: Rojas-Jiménez S, Lopera-Valle JS. Cardiomiopatía de Takotsubo, el gran imitador del infarto agudo del miocardio. Rev. CES Med 26(1): 107-120