Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina
Print version ISSN 0120-8705
CES Med. vol.27 no.1 Medellín Jan./June 2013
Artículos de investigación científica o tecnológica
Estudio etiológico y epidemiológico de las micosis cutáneas en un laboratorio de referencia - Antioquia - Colombia
Etiological and epidemiological study on superficial mycoses performed in a referral laboratory center - Antioquia -Colombia
MARÍA ADELAIDA MEJÍA-ARANGO1, CATALINA SANTA-VÉLEZ2, MANUELA CADAVID-SIERRA2, LINA MARÍA VÉLEZ1,
LINA MARÍA COLMENARES2, BERTA NELLY RESTREPO-JARAMILLO3, NORA CARDONA-CASTRO4
1 Residentes de Dermatología Universidad Pontificia Bolivariana
2 Residentes de Dermatología Universidad CES. mamu13@msn.com
3 Médica, M.Sc. Epidemiología I.C.M.T.-CES
4 Médica M.Sc. PhD(c) I.C.M.T.-CES
Recibido: noviembre 26 de 2012. Revisado: febrero 11 de 2013. Aceptado: marzo 15 de 2013
RESUMEN
Introducción: las micosis superficiales son infecciones frecuentes de los tejidos queratinizados, causadas por levaduras, dermatofitos, mohos ambientales. Su etiología varía de acuerdo a la población de estudio.
Objetivo: determinar la frecuencia etiológica y algunas características poblacionales y clínicas de los pacientes con diagnóstico presuntivo de micosis superficiales, que consultaron al Instituto Colombiano de Medicina Tropical (I.C.M.T.) durante el período 2008 al 2011.
Materiales y métodos: se realizó un estudio descriptivo de corte retrospectivo en el que se analizaron los datos poblacionales y los resultados micológicos de 2 282 muestras provenientes de 1 645 pacientes con diagnóstico presuntivo de micosis superficiales.
Resultados: el 71,8 % de los pacientes fueron de género femenino y la edad promedio fue 44,3 años. De las 2 282 muestras se reportó identificación micológica en 82,6 %, siendo los microorganismos más frecuentemente aislados Candida spp (25 %), Fusarium spp, Trichophyton mentagrophytes y Candida krusei (10 % cada uno) y Rhodotorula spp en 8 %. La onicomicosis, tanto de manos como de pies, fue la infección fúngica superficial encontrada con mayor frecuencia.
Conclusiones: las micosis superficiales son enfermedades comunes, con variaciones en su frecuencia según la edad, el sexo y la región de donde provienen los pacientes. Su diagnóstico oportuno constituye una de las principales herramientas para un tratamiento adecuado y bien dirigido, evitando así fallas terapéuticas y aparición de cepas de hongos resistentes.
PALABRAS CLAVE
Micosis superficiales, Dermatofitos, Levaduras, Mohos ambientales.
ABSTRACT
Introduction: Superficial mycoses are frequent infections caused by yeasts, dermatophytes and environmental molds on keratinized tissue.
Objectives: To characterize the species of dermatophytes, yeasts and environmental molds that cause superficial mycoses and to analyze their relationship to sex, age and localization in patients evaluated at the Tropical Medical Institute in Valle de Aburrá Antioquia during the time period 2008-2011.
Materials and methods: A descriptive retrospective cross-sectional study was performed, and 2282 samples from 1645 patients were included. Patients of all ages were included with a presumptive diagnosis of a superficial mycosis. A KOH was performed with culture of material from the lesions. The characterization of the fungi was done according to morphology and biochemical studies.
Results: Out of 1645 patients 1182 (71.8 %) were women and the average age was 44.3 years. From the 2282 samples taken the mycological identification could be done in 82,6 % of them and the microorganisms most frequently isolated were Candida spp (25 %); Fusarium spp, Trichophyton mentagrophytes and Candida Krusei each represented 10 % and Rhodotorula was isolated in 8 % of samples. Hand and feet onychomycosis was the most frequent superficial fungal infection.
Conclusions: Superficial mycoses are frequent pathologies that vary according to age, sex and the diagnostic methods used. The pertinent diagnosis constitutes one of the main tools for a timely and efficacious treatment, avoiding therapeutic failures and the appearance of resistant strains.
KEY WORDS
Superficial mycosis, Dermatophytes, Yeasts, Molds.
INTRODUCCIÓN
La epidemiología de las micosis ha mostrado cambios en las últimas décadas como consecuencia de las modificaciones en las condiciones ambientales, la distribución de los agentes etiológicos, el envejecimiento de la población, el aumento de las terapias inmunosupresoras y de enfermedades como el VIH, además del incremento de la resistencia secundaria al uso indiscriminado de agentes anti fúngicos; lo cual se refleja en cambios en los patrones clínicos (1,2).
Las micosis superficiales se encuentran entre las formas más frecuentes de infecciones en los humanos. Se estima que afectan un 20-25 % de la población mundial y su incidencia está constantemente en incremento (2-4). La distribución de las infecciones dermatofíticas y sus agentes causales varían según la región geográfica y está influenciada por varios factores, como el tipo de población, clima, estilo de vida, migración, prácticas culturales, condiciones socioeconómicas, entre otras (1,3,5).
La onicomicosis es una condición común que representa más del 50 % de los problemas de la unidad ungular y es por lo tanto la enfermedad más prevalente en ésta. Además, corresponde al 30 % de todos los casos de micosis superficiales (6). La incidencia aumenta con la edad, llegando a presentarse hasta en el 60 % de las personas mayores de 60 años (7,8). Así mismo se considera una de las micosis superficiales con mayor dificultad en el diagnóstico y el tratamiento (9).
La variabilidad observada en la presentación de las diferentes micosis, hace necesario el desarrollo de estudios que permitan caracterizar la frecuencia, etiología y formas de presentación más comunes para lograr un adecuado diagnóstico y manejo terapéutico. Por las razones antes expuestas, se realizó un estudio con el fin de caracterizar las especies de dermatofitos, levaduras y mohos ambientales que causan micosis superficiales, en pacientes evaluados en el Instituto Colombiano de Medicina tropical (I.C.M.T.), en Sabaneta-Antioquia.
MATERIALES Y MÉTODOS
Se realizó un estudio descriptivo de corte, retrospectivo. Se revisaron los reportes de los pacientes evaluados en el laboratorio de micología del Instituto Colombiano de Medicina Tropical, Sabaneta-Antioquia, entre el 1 de enero del 2008 al 31 de diciembre del 2011. Se construyó una base de datos en Excel y se analizaron las siguientes variables: ciudad de procedencia del paciente, año de registro, edad, género, localización anatómica de la lesión, y reporte del examen directo y cultivo.
Las muestras de los pacientes fueron tomadas y procesadas de acuerdo a métodos estandarizados. Estas muestras procedían de descamación de la piel, de pelos tomados por tracción, detritos subungulares y fragmentos de uña. El material obtenido se evaluó a la microscopía directa con KOH al 20 %, definiendo el examen directo como positivo cuando se observó cualquiera de los siguientes elementos fúngicos: filamentos compatibles con hifas, filamentos hialinos, levaduras con seudohifas o sin ellas.
Finalmente, el cultivo de la muestra se llevó a cabo en agar Sabouraud dextrosa y agar Mycosel (Beckton Dickinson)® de acuerdo a los métodos estandarizados (Manual of Clinical Microbiology ASM). Se consideró el diagnóstico etiológico de micosis en quienes presentaron crecimiento de colonias de hongos en el cultivo. La identificación de las especies se realizó por evaluación de la morfología y pruebas bioquímicas.
Con relación a las levaduras se clasificaron presuntivamente como Candida albicans o Candida spp previo al 2010, año a partir del cual se implementó el uso del CHROMagarCandida®, permitiendo la identificación de las demás especies de Candida.
En los casos específicos de pitiriasis versicolor, se realizó microscopía directa, lo que permitió el diagnóstico a nivel de género Malassesia complex, sin ser necesaria la posterior realización de cultivo.
La base de datos y el procesamiento de la información se realizó en Microsoft Excel®. Las variables cualitativas se describieron con frecuencias relativas y absolutas. Las variables cuantitativas se describieron como promedios, valores mínimos y máximos.
Consideraciones éticas
De acuerdo con la Resolución 008430 de 1993 del Ministerio de Salud, este estudio se clasifica como investigación sin riesgo, ya que se basa en la toma de datos de registros del laboratorio. Se preservaron todos los principios éticos, la confidencialidad y el anonimato de los pacientes.
RESULTADOS
Se analizaron los resultados de laboratorio de 2 282 muestras provenientes de 1 645 pacientes; de estos, 1 182 eran de género femenino, correspondiente al 71,8 %, para una relación hombre: mujer 1:3. Esta relación se conservó para todos los subgrupos, excepto para los menores de 10 años, en quienes el género masculino fue más frecuente.
El rango de edad fue de 1 a 93 años, con un promedio y desviación estándar de 44,3±17,6 años. El mayor porcentaje de pacientes se encontró en el grupo entre los 51 a 70 años (30,6 %), seguido de los grupos entre los 36 a 50 años (27,9 %), 21 a 35 (21 %), 11 a 20 y mayores de 70 (6 % cada grupo) y en menores de 10 años (4 %). En un 5,5 % de los pacientes no se logró obtener el dato de la edad.
El número de pacientes evaluados por año es el siguiente: en el 2008 fueron captados 492 pacientes, siendo el año con mayor frecuencia; en el 2009 se captaron 431 pacientes; en el 2010, 371 pacientes y 351 pacientes en el 2011. Lo que representa una disminución del 28,6 % entre el primer y el último año.
De las 2 282 muestras estudiadas se logró el aislamiento del agente etiológico en 1884 muestras (82,6 %). El 17,4 % restante corresponde a Malassezia, crecimiento de bacterias, no crecimiento en el cultivo o ausencia de datos. De los 1 884 aislamientos, las localizaciones más frecuentes fueron uñas en un 76,4 %, plantas en un 11,6 %, cuerpo en un 9,2 % y otras localizaciones (pliegue inguinal, cuero cabelludo y palmas) en un 2,8 %.
De acuerdo a la localización de las lesiones según el grupo etario, en los menores de 10 años fue más frecuente el compromiso del cuero cabelludo, correspondiendo a un 70 % (14/20) de los casos. El compromiso de la cara se presentó en todos los subgrupos, excepto en mayores de 50 años; mientras que el compromiso plantar e interdigital fue raro en la infancia, evidenciándose un aumento de la frecuencia con la edad y encontrando el mayor número de casos entre 36 y 50 años (35,8 %).
Al analizar el comportamiento de la onicomicosis, tanto en las manos como en los pies, fue poco frecuente en la infancia y el compromiso aumentó con la edad, evidenciándose el mayor número de casos en el subgrupo de los pacientes entre 51 y 70 años, correspondiente al 39,7 % (81/204) en el caso de las uñas de las manos y al 34,5 % (425/1 233) en el caso de las uñas de los pies.
En general, las mujeres fueron quienes más infecciones micóticas presentaron en todas las localizaciones, exceptuando las halladas en el pliegue inguinal, sitio en el cual el 84 % (21/25) de los afectados fueron hombres.
Los agentes más frecuentes fueron: Candida spp en un 25 %, seguido por una amplia diferencia de T. mentagrophytes, C. kruzei, Fusarium spp cada uno representando un 10 % y Rhodotorula spp en un 8 % (ver cuadro 1).
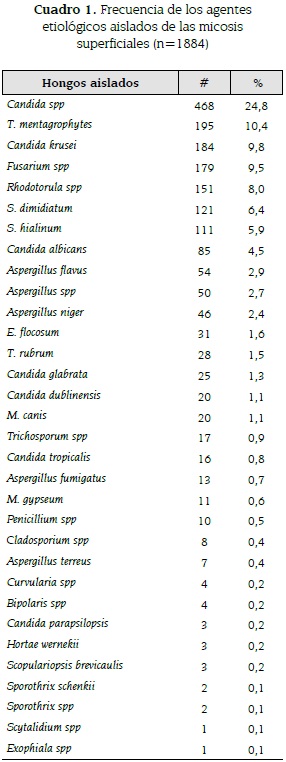
En 15 pacientes se hizo diagnóstico de pitiriasis versicolor, por presentar hallazgos compatibles con Malassezia spp en el examen microscópico directo. Adicionalmente, como hallazgo incidental, ya que no eran lesiones clínicamente sugestivas de esporotricosis y las muestras no se obtuvieron por biopsia, se aislaron dos casos de infección por Sporotrix schenkii de lesiones en miembros superiores y un caso de infección por Sporotrix spp en muestras de miembro superior.
Durante los años evaluados en el estudio, Candida spp fue el agente fúngico más cultivado, y sólo a partir del 2010 cuando comienza la clasificación de las diferentes especies por medio del CHROMOagarCandida ®, se observa que la especie más predominante es Candida krusei, ocupando el primer lugar con un 33,7 % (134/398) en los cultivos del 2011. Se encontró que, año tras año, los microorganismos predominantes fueron los mismos, con sólo pequeñas variaciones en la frecuencia de presentación de estos.
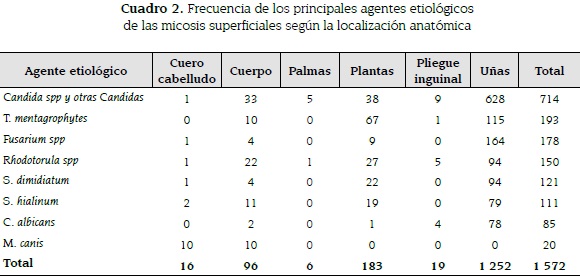
Las principales micosis encontradas según su localización fueron: en cuero cabelludo la tiña capitis producida por M. canis en 62,5 % (10/16), en plantas y región interdigital de pies la tiña pedis producida por T. mentagrophytes en un 36,6 % (67/183) y en pliegue inguinal. La micosis superficial más común fue el intertrigo candidiásico representando un 47,4 % (9/19) (ver cuadro 2).
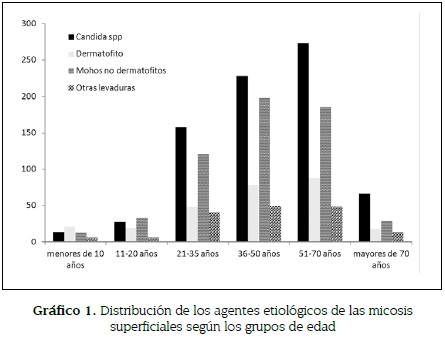
La distribución de los agentes causales según la edad fue: en los menores de 10 años el aislamiento más común los dermatofitos, encontrándose en un 38,9 % (21/54); en el grupo de los 11 a los 20 años, los mohos no dermatofitos en un 39,1 % (34/87), y en los mayores de 21 años el más común fue Candida spp con un 44,1 % (725/1645), seguida por mohos no dermatofitos correspondiente a un 32,5 % (534/1645) (ver gráfico 1).
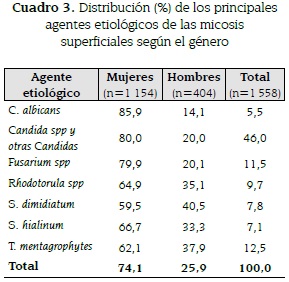
Tanto en mujeres como en hombres, el agente etiológico más común fue Candida spp y otras Candidas. En hombres, se encontró una mayor frecuencia de Rhodothorula spp, S. dimidiatum, S. hialinum y T. mentagrophytes, con respecto a la encontrada en el género femenino.
Las mujeres presentaron cultivo positivo en un 97,6 % (1154/1182), mientras el aislamiento por cultivo en hombres sólo se logró en un 87,3 % (404/463) (p<0,001). En el cuadro 3 se describen las frecuencias de los agentes etiológicos según el género.
El 76,4 % (n=1 884) de todos los aislamientos correspondió a onicomicosis, lográndose hacer este diagnóstico en 1 021 pacientes. En el 12,8 % de los pacientes se encontró onicomicosis de las manos, mientras que las uñas de los pies estuvieron más comprometidas, encontrándose afectadas en 887 pacientes (86,9 %) y en tres pacientes no se reportó la localización. La relación de onicomicosis fue de 3,6 mujeres por cada hombre. El promedio de edad de los pacientes con onicomicosis fue de 47,8±16,2 años. El 64,6 % de los pacientes tenían entre 36 y 70 años y el 7,6 % eran mayores de 70 años.
Tanto en manos como en pies, Candida spp fue el hongo aislado con mayor frecuencia, seguida de C. albicans y C. krusei en manos y Fussarium spp y C. krusei en pies. Igualmente, Candida spp fue la más común en todos los grupos etáreos, a excepción de los pacientes entre 11 y 20 años con onicomicosis de los pies, en quienes los mohos fueron los más comúnmente aislados. T. mentogrophytes y T. rubrum se aislaron en el 10,8 % de los casos, con mayor frecuencia en las uñas de los pies (ver gráfico 2).
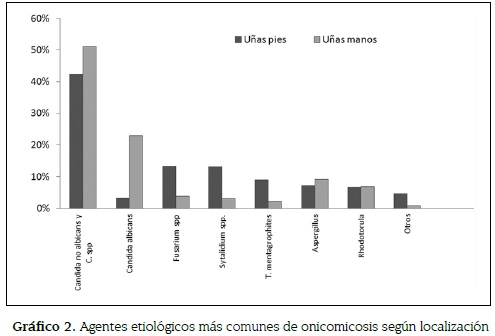
A 461 pacientes se les aislaron dos o más hongos, correspondiendo en el 17,7 % a las uñas de las manos y en el 22,8 % a las uñas de los pies. Las combinaciones más frecuentes en las manos fueron C. albicans con C. dublinensis en 11 pacientes, Candida spp y Aspergillus spp en tres pacientes y otras combinaciones entre diferentes especies de Candida con Aspergillus, Rhodotorula y S. hialinum en ocho pacientes. En uñas de los pies las principales combinaciones fueron entre Fusarium, Rhodotorula, S. hialinum, T. mentagrophytes, S. dimidiatum con Candida spp en 71 pacientes.
Se encontró una concordancia entre los resultados del KOH y el cultivo de un 93,3 %, hallando 87 % (1773/2 050) de concordantes positivos y 7 % (139/2050) de concordantes negativos.
DISCUSIÓN
Las infecciones fúngicas son más comunes en países tropicales y subtropicales por el clima caliente y húmedo que hace que sea más fácil el crecimiento y la diseminación de los hongos. La forma de presentación varía de acuerdo al estado inmune del paciente (el cual depende a su vez de la edad y el género), la localización anatómica de la infección y la virulencia de la cepa o especie infectante (10).
Las micosis superficiales son aquellas que afectan el estrato córneo y no causan ningún tipo de reacción inflamatoria; las subcutáneas, las que comprometen áreas más profundas de la piel, generalmente por inoculación del hongo y pueden afectar tejido graso, músculo o hueso; y las micosis profundas causan enfermedades sistémicas y el origen de la infección más importante es la vía respiratoria y el tracto gastrointestinal (11).
Las micosis superficiales se limitan al pelo, las uñas, la epidermis y las mucosas. Rara vez constituyen una grave amenaza para la vida del paciente, pero su importancia radica en la amplia distribución mundial, su frecuencia en aumento, trasmisión y morbilidad, además, de la presentación cada vez más frecuente en pacientes inmunocomprometidos (11-15). Además es importante diagnosticarlas y si no se aísla el agente causal tener en cuenta otros diagnósticos diferenciales como la psoriasis ungueal o el melanoma, ya que estas infecciones pueden causar melanoniquia (16). Hay aproximadamente 100 000 especies de hongos distribuidos mundialmente, siendo los patógenos más relevantes los dermatofitos y las levaduras (3).
La prevalencia de las micosis superficiales según el género, varía de acuerdo a resultados de diferentes estudios, mostrando algunos mayor frecuencia en el género masculino (2,3,17), mientras que otros reportes (18,19), como es el caso de este estudio, en el que son más frecuentes en el género femenino.
La mayor frecuencia de presentación en mujeres encontrada en este estudio puede explicarse por un mayor índice de consulta por parte de éstas, principalmente por las implicaciones cosméticas de estas enfermedades. Vena et al. (2) y Mazon et al. (21) encontraron que la distribución es similar en ambos géneros para todas las localizaciones, exceptuando las micosis del área inguinal, las cuales tienen mayor predominio en hombres.
La edad de presentación más frecuente de las micosis cutáneas en esta investigación es similar a lo publicado en la literatura internacional, que reporta que la mayoría de micosis superficiales se presentan entre los 30 y 60 años (18-22).
La localización de las lesiones en los grupos etáreos encontrada en nuestro estudio corresponde a lo reportado en otros artículos, en donde el compromiso del cuero cabelludo es más frecuente en menores de 10 años y las infecciones ungulares, tanto de manos como de pies, aumentan su frecuencia en mayores de 30 años (2,12,19,20).
Con respecto a los agentes etiológicos aislados, encontramos que los dermatofitos más comunes en nuestro centro fueron T. mentagrophytes, E. floccosum, T. rubrum y M. canis en orden descendente, resultados que no corresponden a la mayoría de los reportados en la literatura. Según Seebacher et al. (18), los dermatofitos más comunes en Europa del norte y central son T. rubrum, seguido de T. mentagrophytes y en Europa del sur y los países árabes M. canis y T. verrucosum, que son dermatofitos zoofílicos.
Sin embargo, hay países como Polonia donde es más común el T. mentagrophytes que el T. rubrum, similar a lo hallado en nuestro estudio. Igualmente en Estados Unidos y México la micosis cutánea más común es producida por Candida spp, seguida por T. rubrum, hallazgos también compatibles con nuestros resultados (23).
Otros reportes de países más cercanos al nuestro, difieren también en la frecuencia de presentación de los agentes causales de micosis. En Brasil, los dermatofitos aislados más frecuentemente fueron T. rubrum, T. tonsurans, M. canis, T. mentagrophytes. En México, por el contrario, fueron T. rubrum, T. mentagrophytes, T. tonsurans, M. canis y E. floccosum (3).
La tiña capitis es la micosis superficial más común en América del Norte (3). En Estados Unidos la prevalencia entre los niños en edad escolar es de 3-8 % y es producida principalmente por T. tonsurans, mientras que en Canadá el agente más común de tiña capitis es el Trichopyton spp (12).
Esta infección afecta principalmente los niños entre los tres y los nueve años, es más común en condiciones de hacinamiento, zonas urbanas, bajas condiciones socioeconómicas y en niños afroamericanos. La prevalencia varía notablemente alrededor del mundo, desde menos del 1 % en Madrid y Palestina, hasta ser mayor del 50 % en Etiopía, donde el Trichophyton violaceum es endémico. Al igual que nuestros hallazgos, en Europa el agente más común de tiña capitis fue M. canis (3, 12,19, 23).
La tiña corporis es producida por la infección de piel glabra por dermatofitos, siendo T. rubrum el principal agente productor de la enfermedad a nivel mundial, otras especies reportadas son T. mentagrophytes, E. floccosum, M. canis. Especies geofílicas como el M. gypseum son una causa rara, presentes en menos de 1 % (12). En nuestro estudio, a diferencia de la literatura revisada, encontramos que las micosis que afectan el cuello, el tronco y las extremidades, no fueron producidas predominantemente por dermatofitos.
En cuanto a la tiña pedis el microrganismo más frecuente fue T. mentagrophytes, compatible con lo reportado en Italia y contrario a los datos encontrados de Estados Unidos, México, Grecia, Argelia y Libia en donde fue T. rubrum el agente más frecuente (23). La tiña cruris tiene como principales agentes reportados E. floccosum, T. mentagrophytes y T. rubrum, los cuales también fueron los más comúnmente aislados en nuestro caso (22).
La pitiriasis versicolor es uno de los trastornos pigmentarios más frecuentes en el mundo, es producida por las diferentes especies de Malassesia y se ve de forma frecuente en los climas tropicales, con una prevalencia mayor de 40 %. Afecta cualquier edad, pero la mayoría de los casos se presentan en la adolescencia y en adultos jóvenes, ya que las hormonas y el aumento del sebo pueden ser importantes para su desarrollo (5,24).
En nuestro estudio se encontraron escasos reportes de directos positivos compatibles con Malassezia, y esto es explicado por la poca necesidad de confirmar el diagnóstico micológico, ya que es una entidad fácilmente identificable por sus manifestaciones clínicas y sólo en algunas ocasiones requiere realizar otros exámenes antes de iniciar tratamiento.
La esporotricosis es causada por el hongo dimórfico Sporotrix schenckii, tiene distribución mundial pero afecta principalmente a personas de áreas tropicales y subtropicales (25). Se han reportado grandes grupos de brotes de esta micosis, generalmente causados por el contacto con material de ambientes contaminados como en minas o cultivos (11). Afecta ambos sexos y todas las edades, pero la mayoría de los pacientes son menores de 30 años y los niños menores de 10 años son los más afectados (11,23,25,26). El número reducido de casos encontrados de infección por Sporotrix schenkii, puede deberse a que los pacientes con lesiones clínicamente compatibles con esporotricosis son remitidos a otras instituciones, donde se les realiza biopsia para su estudio, procedimiento que no se realiza en nuestro centro.
En este estudio se observó una buena concordancia entre el KOH y el cultivo, sugiriendo que los protocolos utilizados permiten diagnósticos precisos y el personal del laboratorio se encuentra bien capacitado en estas prácticas. El 2,1 % de los casos en los que el cultivo fue negativo, a pesar de observarse estructuras micóticas al examen directo con KOH, podría explicarse por la disminución de la viabilidad del hongo patógeno, alta contaminación del medio de cultivo por hongos ambientales y el tipo de agente micótico predominante (17).
La frecuencia de especies de hongos aisladas en cultivos se mantuvo constante año tras año reflejando posiblemente una tendencia de microrganismos, lo cual puede estar influenciada por las condiciones climáticas y de humedad que se encuentra en el área del Valle de Aburrá evaluada.
En cuanto a los dermatofitos encontramos el siguiente comportamiento: T. mentagrophytes y T. rubrum permanecieron estables en el número de aislamientos año tras año, el aislamiento de M. Canis aumentó y de E. flocossum disminuyó, datos que se pueden comparar con lo encontrado por Vena et al. (2) en su estudio, donde evaluaron la frecuencia de las micosis entre el 2005 y el 2010 en Italia, presentando la misma tendencia en cuanto a T. mentagrophytes y E. flocosum, pero difiere en lo encontrado para T. Rubrum y M. canis, ya que en su estudio los aislamientos de estos, aumentaron y disminuyeron respectivamente con los años.
La onicomicosis es una infección común, representa el 50 % de todos los problemas de las uñas y el 30 % de todas las infecciones fúngicas cutáneas (6, 28). Sin embargo, en nuestro estudio encontramos que la onicomicosis fue la micosis más frecuente representando un 78,5 % de todos los aislamientos; datos similares a los hallados por Cruz et al., en un estudio realizado en Chile, donde encontraron que la presentación clínica más frecuente (58,1 %) entre las micosis superficiales fue la onicomicosis de los pies (19). La gran frecuencia de esta afección hallada en nuestro estudio puede deberse, además de que es una micosis ciertamente prevalente, a que es un motivo de consulta frecuente y el estudio micológico es imprescindible para realizar un adecuado enfoque terapéutico; mientras que otros tipos de micosis, puede que no requieran demostración microbiológica porque la clínica sea muy sugestiva y el médico tratante considere el inicio de tratamiento sin confirmación etiológica.
En los países con clima templado la onicomicosis tiene como principal etiología los dermatofitos, causando el 90 % de las infecciones micóticas de los pies y el 50 % de las de las manos (2,3,30), en contraste a países con clima húmedo y caliente, en donde el principal agente de onicomicosis es Candida seguida de mohos no dermatofitos (29), reporte este que coincide con el nuestro.
Los datos sobre la distribución de los agentes etiológicos varía según la publicación: en la mayoría proponen que los dermatofitos más frecuentemente aislados son T. rubrum, T. mentagrophytes y E. floccosum; la levadura más importante y más frecuentemente aislada es Candida albicans, la cual generalmente compromete las uñas de las manos, pero se puede ver hasta en el 10 % de las uñas de los pies; entre los mohos el Scopulariopsis brevicaulis es el más común y afecta principalmente uñas previamente dañadas (6,16, 28-30).
Encontramos similares resultados a los nuestros en otros estudios realizados en Colombia. En un estudio de Cali, entre los agentes causales de onicomicosis hubo un predominio de levaduras (40,7 %), principalmente especies de Candida. En el 38 % se aislaron dermatofitos y en 14 % mohos no dermatofitos (31) y en otro realizado en Medellín, también encontramos algunas similitudes como predominio del compromiso en uñas de pies, siendo en estos más frecuentes el T. rubrum (17,5 %), Candida parapsilosis (16,7 %), Fusarium spp. (13,8 %), T. mentagrophytes (11,5 %) y Scytalydium dimidiatum (Natrassia spp.) (10,1 %). Mientras que en las manos los principales agentes fueron especies de Candida, con predominio de C. albicans (23,4 %), seguidos de C. parapsilosis (20,8 %), C. tropicalis (7,5 %), C. guilliermondii (4,8 %) y otras especies no determinadas de Candida (12,4 %) (18).
En cuanto al sexo, los hombres son los más afectados en la mayoría de los estudios y la onicomicosis por levaduras es más común en mujeres (17,19,32,33). Estos datos difieren en gran proporción con los nuestros, pues encontramos marcado predominio de onicomicosis en las mujeres, esto podría estar explicado porque al ser un problema principalmente estético las mujeres son quienes más consultan; igualmente este no es un estudio poblacional que demuestre la real prevalencia según el sexo.
La edad de presentación coincide con la mayoría de reportes sobre las onicomicosis. Igualmente la menor frecuencia de presentación en menores de 10 años ha sido documentada en otros estudios (17,18,28,34).
El papel de mohos no dermatofitos en los aislamientos de onicomicosis, no está bien esclarecido y existe mucha controversia en cuanto a cómo interpretarlos al hallarlos en cultivos de uñas anormales, ya que estos pueden ser contaminantes (23,29). En nuestro caso, encontramos gran número de combinaciones, que deben ser interpretadas con cuidado, pues en algunos casos se trata de microorganismos contaminantes que no requieren tratamiento y pueden desviar la atención al tratar de realizar un correcto enfoque.
Una limitación con la que contó el presente estudio, fue la de no contar con la asociación entre los datos epidemiológicos y la clínica de las lesiones. Esto se tendrá en cuenta para futuros reportes y se hará una retroalimentación al personal de laboratorio, sobre la recolección de los datos y la importancia de la adecuada descripción de las lesiones clínicas.
CONCLUSIÓN
Los resultados arrojados de este estudio pueden ser de gran interés ya que ofrece una aproximación a la epidemiología local de las micosis en piel más frecuentes, los agentes etiológicos más comunes, su distribución según edad y sexo, y otros datos, que permiten al clínico hacerse una idea sobre el comportamiento de esta afección común, y de esta forma lograr mejores enfoques diagnósticos y terapéuticos.
AGRADECIMIENTOS
A María Amparo Lotero, Natalí Moreno, Marcela Romero y a todo el personal del laboratorio del Instituto Colombiano de Medicina Tropical.
REFERENCIAS
1. Ameen M. Epidemiology of superficial fungal infections. Clin Dermatol 2010; 28(2): 197-201. [ Links ]
2. Vena GA, Chieco P, Posa F, Garofalo A, Bosco A, Cassano N. Epidemiology of dermatophytoses: retrospective analysis from 2005 to 2010 and comparison with previous data from 1975. New Microbiol 2012 abr; 35(2):207-13. [ Links ]
3. Havlickova B, Czaika VA, Friedrich M. Epidemiological trends in skin mycoses worldwide. Mycoses 2008 sep; 51 Suppl 4:2-15. [ Links ]
4. Das S, Goyal R, Bhattacharya SN. Laboratory-based epidemiological study of superficial fungal infections. J Dermatol. 2007 Apr; 34(4):248-53. [ Links ]
5. Schwartz RA. Superficial fungal infections. Lancet 2004 oct 25; 364(9440):1173-82. [ Links ]
6. Faergemann J, Baran R. Epidemiology, clinical presentation and diagnosis of onychomycosis. Br J Dermatol 2003 sep; 149 Suppl 65:1-4. [ Links ]
7. Anane S, Chtourou O, Chedi A, Triki S, Belhaj S, Kaouech E et al. Onychomycosis in the elderly. Ann Dermatol Venereol 2007 Oct; 134(10 Pt 1):743-7. [ Links ]
8. Pérez JE, Cárdenas C, Hoyos AM. Características clínicas, epidemiológicas y microbiológicas de la onicomicosis en un laboratorio de referencia, Manizales (Caldas), 2009. Infectio 2011; 15(3):168-76. [ Links ]
9. Mendoza N, Palacios C, Cardona N, Gómez LM. Onicomicosis: afección común de difícil manejo. Rev Asoc Colomb Dermatol 2012; 20(2):149-58. [ Links ]
10. Criado PR, Oliveira CB, Dantas KC, Takiguti FA, Benini LV, Vasconcellos C. Superficial mycosis and the immune response elements. Ann Bras Dermatol 2011 Jul-Aug; 86(4):726-31. [ Links ]
11. Hsu LY, Wijaya L, Shu-Ting Ng E, Gotuzzo E. Tropical fungal infections. Infect Dis Clin North Am 2012 jun; 26(2):497-512. [ Links ]
12. Kelly B P. Superficial Fungal Infections. Pediatrics in Review. 2012 abr 2; 33(4):e22-e37. [ Links ]
13. Seebacher C, Bouchara J-P, Mignon B. Updates on the epidemiology of dermatophyte infections. Mycopathologia 2008 dic; 166 (5-6):335-52. [ Links ]
14. Hainer BL. Dermatophyte infections. Am Fam Physician 2003 Jan 1; 67(1):101-8. [ Links ]
15. Lorch Dauk KC, Comrov E, Blumer JL, O'Riordan MA, Furman LM. Tinea capitis: predictive value of symptoms and time to cure with griseofulvin treatment. Clin Pediatr (Philad). 2010 mar; 49(3):280-6. [ Links ]
16. Finch J, Arenas R, Baran R. Fungal melanonychia. J Am Acad Dermatol. 2012 May; 66(5):830-41. [ Links ]
17. Nazar J, Gerosa P, Díaz O. Onicomicosis: epidemiología, agentes causales y evaluación de los métodos diagnósticos de laboratorio. Rev Argent Microbiol 2012; 44(1):21-5. [ Links ]
18. Zuluaga de C A, De Bedout C, Tabares A, Cano LE, Restrepo A, Arango LE, et al. Comportamiento de los agentes etiológicos de las onicomicosis en un laboratorio de micología de referencia (Medellín 1994-2003). Med Cutan Iber Lat Am 2005; 33(6):251-6. [ Links ]
19. Cruz Ch R, Ponce E, Calderón R L, Delgado V N, Vieille O P, Piontelli L E. Superficial mycoses in the city of Valparaiso, Chile: period 2007-2009. Rev Chilena Infectol 2011 oct; 28(5):404-9. [ Links ]
20. Gupta AK, Jain HC, Lynde CW, Watteel GN, Summerbell RC. Prevalence and epidemiology of unsuspected onychomycosis in patients visiting dermatologists' offices in Ontario, Canada--a multicenter survey of 2001 patients. Int. J. Dermatol 1997 oct; 36(10):783-7. [ Links ]
21. Mazón A, Salvo S, Vives R, Valcayo A, Sabalza MA. Etiologic and epidemiologic study of dermatomycoses in Navarra (Spain). Rev Iberoam Micol 1997 jun; 14(2):65-8. [ Links ]
22. Padilla A, Sampedro A, Sampedro P, Delgado V. Clinical and epidemiological survey of dermatophytoses in Jaen (Spain). Rev Iberoam Micol 2002 mar; 19(1):36-9. [ Links ]
23. Seebacher C, Bouchara J-P, Mignon B. Updates on the epidemiology of dermatophyte infections. Mycopathologia 2008 may 14;166(5-6):335-52. [ Links ]
24. Ramadán S, Sortino M, Bulacio L, Marozzi M, López C, Ramos L. Prevalence of Malassesia species in patients with pityriasis versicolor in Rosario, Argentina. Rev Iberoam Micol 2012; 29(1):14-19. [ Links ]
25. La Hoz RM, Baddley JW. Subcutaneous fungal infections. Curr Infect Dis Rep 2012 oct;14(5):530-9. [ Links ]
26. Lupi O, Tyring SK, McGinnis MR. Tropical dermatology: Fungal tropical diseases. J of the Am Acad of Dermatol 2005 dic; 53(6):931-51. [ Links ]
27. Rubio G, Sánchez G, Porras L, Alvarado Z. Sporotrichosis: prevalence, clinical and epidemiological features in a reference center in Colombia. Rev Iberoam Micol 2010 jun 30; 27(2):75-9. [ Links ]
28. Rodríguez-Pazos L, Pereiro-Ferreirós MM, Pereiro M Jr, Toribio J. Onychomycosis observed in children over a 20-year period. Mycoses 2011 sep; 54(5):450-3. [ Links ]
29. Kaur R, Kashyap B, Bhalla P. Onychomycosis--epidemiology, diagnosis and management. Indian J Med Microbiol 2008 jun; 26(2):108-16. [ Links ]
30. Ghannoum MA, Hajjeh RA, Scher R, Konnikov N, Gupta AK, Summerbell R, et al. A large-scale North American study of fungal isolates from nails: the frequency of onychomycosis, fungal distribution, and antifungal susceptibility patterns. J Am Acad Dermatol 2000 oct; 43(4):641-8. [ Links ]
31. Álvarez MI, González LA, Castro LA. Onychomycosis in Cali, Colombia. Mycopathologia 158:181-6. [ Links ]
32. Manzano-Gayosso P, Méndez-Tovar LJ, Arenas R, Hernández-Hernández F, Millán-Chiu B, Torres-Rodríguez JM, et al. Onychomycosis-causing yeasts in four Mexican dermatology centers and their antifungal susceptibility to azolic compounds. Rev Iberoam Micol 2011 mar;28(1):32-5. [ Links ]
33. Welsh O, Vera Cabrera L, Welsh E. Onychomycosis. Clin Dermatol 2010; 28: 151-9. [ Links ]
34. Kaur R, Kashyap B, Bhalla P. Onychomycosis: epidemiology, diagnosis and management. Indian J Med Microbiol 2008; 26: 108-16. [ Links ]













