Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina
Print version ISSN 0120-8705
CES Med. vol.27 no.2 Medellín July/Dec. 2013
Artículos de investigación científica o tecnológica
Actividad insecticida de extractos vegetales sobre larvas de Aedes aegypti, Diptera: Culicidae
Insecticidal activity of vegetal extracts against Aedes aegypti larvae, Diptera: Culicidae.
SANTIAGO AMARILES-BARRERA1, CARLOS MARIO GARCÍA-PAJÓN2, GABRIEL PARRA-HENAO3
1Biólogo. Grupo Biología CES-EIA, Universidad CES, Medellín, Colombia. Laboratorio de Entomología, Instituto Colombiano de Medicina Tropical. Medellín-Colombia.
2Ingeniero Químico. PhD. Laboratorio de Productos Naturales, Universidad Nacional de Colombia. Colombia.
3Biólogo. PhD. Laboratorio de Entomología, Instituto Colombiano de Medicina Tropical. Colombia.
RESUMEN
Introducción: ante la aparición cada vez más frecuente de resistencia de Aedes aegypti a los insecticidas tradicionales, se hace necesario el estudio de extractos vegetales que puedan ser usados como alternativas de control.
Objetivo: determinar la actividad insecticida de extractos metanólicos de Gliricidia sepium, Sapindus saponaria y Annona muricata sobre larvas de tercer estadío de Ae. aegypti.
Materiales y métodos: mediante percolación metanólica de macerados de las especies vegetales se obtuvieron extractos totales y mediante diluciones de cada extracto se realizaron bioensayos sobre larvas de tercer estadio de Ae. aegypti, cepas Rockefeller y Silvestre. Se realizó análisis PROBIT para la determinar la concentración letal media (LC50) de los extractos evaluados.
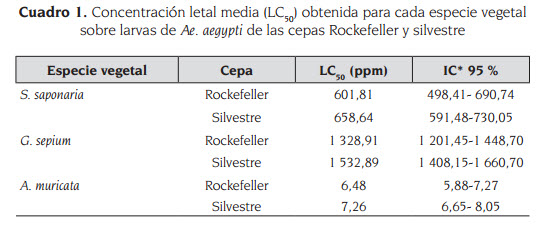
Resultados: los valores de LC50 hallados para cada uno de los extractos vegetales fueron: A.muricata, 6,48 ppm (IC 95 %: 5,88-7,27); S.saponaria, 601,81 ppm (IC 95 %: 498,41- 690,74); G. sepium, 1328,91 ppm (IC 95 %: 1 201,45-1 448,70), para la cepa Rockefeller. A. muricata, 7,26 ppm (IC 95 %: 6,65-8,05); S. saponaria, 658,64 ppm (IC 95 %: 591,48-730,05); G. sepium, 1 532,89 ppm (IC 95 %: 1 408,15-1 660,70), para la cepa silvestre.
Conclusión: Los resultados obtenidos son promisorios para el control de estadios inmaduros de Ae. aegypti.
PALABRAS CLAVE
Ae. aegypti, Bioensayos, Control vectorial, Dengue, Extractos vegetales .
ABSTRACT
Introduction: Given the increasingly frequent occurrence of resistance of Ae. aegypti to conventional insecticides, it becomes necessary to study plant extracts that can be used as alternative for control.
Objective: To establish the insecticidal activity of metanolic extracts of Gliricidia sepium, Sapindus saponaria and Annona muricata against third instar Ae. aegypti larvae.
Materials and methods: A percolation with methanol of macerated plant species to obtain total extracts was performed and then using dilutions of each extract was proceeded to perform bioassays on third stage larvae of Ae. aegypti, strains Rockefeller and wildtype. PROBIT analysis was performed to determine the median lethal concentration (LC50) of the extracts tested.
Results: LC50 values found for each of extract are: A. muricata, 6,48 ppm (CI 95 %: 5,88 - 7,27); S. saponaria, 601,81 ppm (CI 95 %: 498,41 - 690,74); G. sepium, 1 328,91 ppm (CI 95 %: 1 201,45 - 1 448,70), Rockefeller strain. A. muricata, 7,26 ppm (CI 95 %: 6,65 - 8,05); S. saponaria, 658,64 ppm (CI 95 %: 591,48 -730,05); G. sepium, 1 532,89 ppm (CI 95 %: 1 408,15 - 1 660,70), for wildtype strain.
Conclusion: The results are promising for the control of immature stages of Ae. aegypti.
KEY WORDS
Ae. aegypti, Bioassay, Vector control, Dengue, Vegetal extracts.
INTRODUCCIÓN
El dengue es una enfermedad infecciosa que puede ser producida por cuatro serotipos diferentes del virus dengue y es transmitido por mosquitos Aedes (Stegomyia) aegypti (Linnaeus, 1762). Presenta una amplia distribución en las regiones de clima tropical y subtropical del mundo, manifestándose principalmente en zonas semiurbanas y urbanas, en donde el mosquito Ae. aegypti es el principal vector (1). En Colombia esta especie se ha reportado en el 95 % de los municipios ubicados por debajo de 2 200 msnm (2).
Esta enfermedad representa un serio problema de salud pública en el país debido a su alta incidencia en la población. Desde finales del año 2008 hasta inicios del 2010 el Sistema de Vigilancia en Salud Pública de Colombia (SIVIGILA) reportó un incremento del 616,9 %. En 2011, la tasa de morbilidad global de dengue fue de 128,2/100000 (dengue: 122,8/100 000 habitantes y dengue grave: 5,4/100000 habitantes) (3). En el país circulan los cuatro serotipos, de los cuales, DENV-2 (44 %) y DENV-1 (41 %) son los más frecuentes (4).
Se estima que cerca de 25 millones de personas que habitan en zonas urbanas con transmisión endémica de dengue están en riesgo de adquirir esta enfermedad. El dengue es una de las enfermedades infecciosas que mayor carga social y económica impone a la población en riesgo, representando un evento de especial interés en salud pública (1).
Debido que no hay un tratamiento específico para esta enfermedad y a la ausencia de vacunas para realizar tratamientos a gran escala, según la Organización Mundial de la Salud (OMS), actualmente el único método de controlar o prevenir la transmisión de los virus del dengue consiste en la lucha contra los vectores por medio de insecticidas químicos, entre ellos los más usados en Colombia son los organofosforados y los piretroides tales como deltametrina, lambdacialotrina, ciflutrina, malation, para el control de adultos y temefos para control de larvas; y de la gestión del medio, mejorando las condiciones físicas de las viviendas para eliminar el hábitat de los mosquitos (1,5,6).
El uso extendido e indiscriminado en Colombia de insecticidas de síntesis para el control de vectores ha favorecido la aparición, propagación e incremento constante de resistencia a la mayoría de insecticidas disponibles actualmente en el mercado por parte de Ae. aegypti (7,8). De otro lado, se ha encontrado un grave riesgo de contaminación ambiental (9) destrucción de la fauna benéfica (10,11) y el subsecuente desequilibrio en los diferentes ecosistemas (10).
Es evidente entonces la necesidad de desarrollar nuevas estrategias de control, diferentes a las planteadas actualmente, para disminuir así la presión de los insecticidas de síntesis (7,8). Como métodos alternativos para el control de los vectores se han evaluado en laboratorio y en campo el uso de controladores biológicos tales como depredadores, hongos entomopatógenos y extractos naturales de plantas, los cuales han demostrado ser efectivos controlando las poblaciones de mosquitos y evitando el desarrollo de resistencia (12-19).
Los insecticidas de origen botánico han sido usados tradicionalmente en las comunidades humanas en muchos lugares del mundo para el manejo de los insectos plaga (20). Hoy en día se ha encontrado que estos pueden ser utilizados como alternativas eficaces en los programas integrados de control de mosquitos vectores, con la ventaja de ser altamente específicos, sin afectar la fauna benéfica (21-24), fácilmente biodegradables, de bajo costo (25,26), no requieren de metodologías complejas para la extracción de sus compuestos activos, son de disponibilidad inmediata y pueden ser preparados artesanalmente por medio de tratamientos caseros y ser aplicados inmediatamente sin la necesidad de instrumentos especializados (27).
En esta investigación se presentan y analizan los resultados de evaluaciones realizadas bajo condiciones de laboratorio de la actividad insecticida efectiva de los extractos etanólicos de Gliricidia sepium (Jacquin. Kunth ex Walpers, 1842), Sapindus saponaria (Linnaeus, 1753) y Annona muricata (Linnaeus, 1753) sobre larvas de tercer instar de Ae. aegypti, usando la cepa Rockefeller como referencia para comprobar la efectividad de los extractos.
MATERIALES Y MÉTODOS
El trabajo se desarrolló en el laboratorio de Biología de la Escuela de ingeniería de Antioquia, sede Zúñiga, el laboratorio de Química de los Productos Naturales y los Alimentos de la Escuela de Química de la Universidad Nacional de Colombia, sede Medellín, y el Instituto Colombiano de Medicina Tropical - CES (ICMT- CES). Todos los solventes empleados fueron grado analítico y se redestilaron antes de ser utilizados.
Las evaluaciones de toxicidad en Ae.aegypti se realizaron sobre larvas de la cepa susceptible Rockefeller y una cepa silvestre de Medellín. Las semillas de A. muricata se obtuvieron de frutos comerciales en la ciudad de Medellín, las raíces de G. sepium se obtuvieron de árboles ubicados en el municipio de Santa Bárbara, Antioquia y los frutos de S. saponaria se recolectaron en los predios de la Universidad Nacional de Colombia, Sede Medellín, procedentes de un árbol sano.
Los extractos vegetales se prepararon a partir de 500 gramos del material vegetal seco y triturado de cada especie, el cual se sometió a extracción exhaustiva mediante percolación con tres litros de metanol al 96 %; el extracto obtenido se filtró y se destiló a presión reducida en un rotaevaporador a temperatura controlada de 40°C. El material obtenido se recogió en botellas de vidrio de color ámbar y se almacenó refrigerado a 4°C para así de evitar errores en los resultados por degradación de los extractos por acción de la luz y el calor.
Para determinar la concentración (partes por millón -ppm-) de los extractos se tomó de la solución madre (extracto total) una muestra de 0,5000 gramos de cada extracto homogenizado, los cuales fueron adicionados a cápsulas de papel aluminio que previamente se habían pesado secas y vacías en una balanza analítica (±0,0001g). A cada cápsula se le adicionaron 0,5000 gramos del extracto homogenizado y se llevó a estufa a 90 °C durante 10 minutos, una vez eliminado el solvente se volvió a pesar. Las mediciones descritas se realizaron por triplicado para cada especie y se calculó la concentración promedio. Las evaluaciones de actividad biológica se llevaron a cabo con el volumen restante de cada extracto que había sido refrigerado a 4°C.
Se establecieron bioensayos para evaluar la toxicidad de los extractos utilizando un diseño completamente al azar. Para todos los bioensayos se usaron larvas de Ae.aegypti de tercer estadío con el mismo tiempo en el estadio. Con el fin de evitar sesgos en los bioensayos, todas las larvas se obtuvieron a partir de huevos puestos a eclosionar simultáneamente para lograr homogeneidad fisiológica.
La muestras utilizadas en las evaluaciones de actividad se prepararon mediante dilución a partir del extracto metanólico concentrado. Los extractos crudos usados en los bioensayos se aplicaron a concentraciones lo suficientemente altas para permitir detectar el efecto de los constituyentes menores. Las concentraciones usadas fluctuaron en el rango de 0 a 2 500 ppm. En el bioensayo de toxicidad sobre larvas de Ae. aegypti se realizaron cuatro repeticiones, estando conformada la unidad experimental por 80 larvas de tercer estadío en copas de polipropileno de 30mL. Los conteos de mortalidad se realizaron a las 24 horas.
Para el análisis estadístico se utilizó el paquete estadístico Statgraphics Centurion XV ®. Los bioensayos de toxicidad se analizaron mediante el procedimiento PROBIT para la determinación de la concentración letal media (LC50) de los extractos evaluados.
RESULTADOS
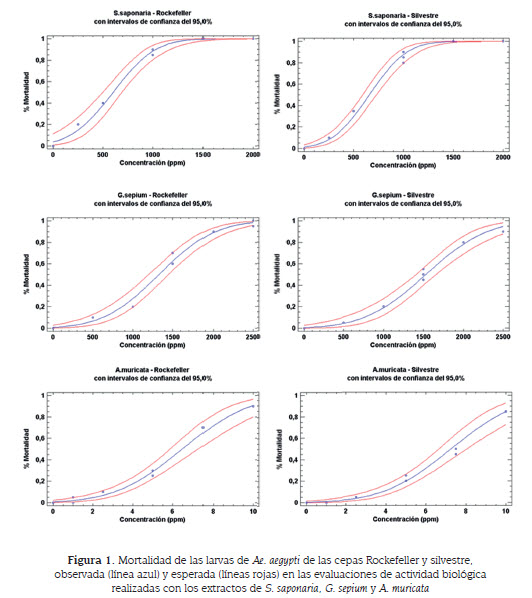
En el cuadro 1 y la figura 1 se presentan los datos de LC50 obtenidos con los extractos metanólicos de las especies vegetales sobre las larvas de las cepas Rockefeller y silvestre de Ae. aegypti.
Los extractos evaluados produjeron mortalidad en las larvas de Ae. aegypti a las 24 horas. En la evaluación de toxicidad para la cepa Rockefeller se observó que el extracto de A. muricata es el más activo con una concentración letal media de 6,48 ppm (IC 95 %: 5,88 - 7,27), seguido por el extracto de S. saponaria con una LC50 de S. saponaria, 601,81 ppm (IC 95 %: 498,41- 690,74) y finalmente el extracto de G. sepium con una LC50 de 1 328,91 ppm (IC 95 %: 1 201,45 - 1 448,70), y para la cepa silvestre el extracto de A. muricata también demostró ser el más activo con una concentración letal media de 7,26 ppm (IC 95 %: 6,65 - 8,05), seguido por el extracto de S. saponaria con una LC50 de 658,64 ppm (IC 95 %: 591,48 - 730,05) y finalmente el extracto de G. sepium con una LC50 de1 532,89 ppm (IC 95 %: 1 408,15 - 1 660,70).
DISCUSIÓN
Con la realización de los bioensayos se halló que los tres extractos vegetales presentan una notoria actividad biológica en ambas cepas de Ae. aegypti. En estos resultados se puede evidenciar que la cepa Rockefeller tuvo una mayor sensibilidad a los metabolitos presentes en los extractos vegetales con concentraciones letales inferiores a las observadas en la cepa silvestre; de forma contraria la cepa silvestre presentó una menor sensibilidad a los metabolitos en los extractos vegetales.
Esta diferencia puede deberse a la continua exposición que ha tenido la cepa silvestre de Ae. aegypti ante diferentes xenobióticos en el ambiente, entre ellos piretroides y organofosforados tales como deltametrina, lambdacialotrina, ciflutrina, malation y temefos que se han usado para el control tradicional en Colombia de Ae. aegypti.
Adicionalmente, la exposición ante el hidrocarbono aromático policíclico benzo(a)pireno derivado de la combustión de combustibles fósiles y el herbicida glifosato, usado comúnmente en la agricultura (28-30), han causado que los mosquitos de la cepa silvestre desarrollen mecanismos de resistencia hacia piretroides, carbamatos y organofosforados (5,29,31).
En este estudio los bioensayos fueron realizados con extractos vegetales totales por lo que se puede pensar que algunos de los compuestos presentes en estos extractos vegetales pueden tener grupos funcionales similares a los de los organofosforados, piretroides y otros xenobióticos (32,33) ante los cuales la cepa silvestre de Ae. aegypti por haber estado expuesta anteriormente a insecticidas de síntesis, ha podido desarrollar mecanismos de resistencia hacia los extractos vegetales; aunque es algo inusual (34) y debido a esto se pudo presentar una menor sensibilidad hacia los extractos vegetales por parte de la cepa silvestre de Ae. aegypti.
Los compuestos reportados que presentan actividad biológica en las plantas del género Annona son acetogeninas bistetrahidrofuránicas y monotetrahidrofuránicas. Específicamente en las semillas de A. muricata, la acetogeninas, muricatacina y anonnacina han demostrado ser algunas de las moléculas biológicamente más activas (35,36).
Sanabria et al., en 2009, reportaron efecto larvicida del extracto acuoso de A. muricata, siendo este altamente prometedor, debido a que, a partir de la concentración más baja del 5 %, se demostró su efecto letal sobre larvas de Ae. aegypti al tener una efectividad similar al larvicida comercial (temefos al 1 %) (37).
Parra-Henao et al., en 2007, hallaron actividad insecticida del extracto etanólico de semillas de A. muricata sobre larvas de cuarto estadío de la cepa susceptible Rockefeller del mosquito Ae. aegypti, mostrando una concentración letal media de 900 ppm sobre las larvas en un tiempo de exposición de 24 horas (38).
Robledo et al., en 2008, encontraron actividad insecticida eficaz de extractos etanólicos de semillas de A. muricata sobre ninfas de últimos estadios de Periplaneta americana de seis poblaciones del surocciodente colombiano (39).
Adicionalmente álvarez et al., también en 2008, reportaron actividad de acetogeninas fraccionadas a partir de extractos hojas, ramas y semillas de Annona cherimolia y Annona montana sobre Oncopeltus fasciatus (Hemiptera: Lygaeidae) y observaron diferentes porcentajes de mortalidad al ser aplicados en el abdomen de los insectos (40).
Con respecto a la especie S. saponaria también se encontró actividad insecticida. Los principales compuestos que tienen actividad insecticida de S. saponaria son las saponinas y sapogeninas triterpénicas (41,42). En estudios sobre plantas con actividad biológica se halló que el extracto etanólico de frutos de S. saponaria ha demostrado generar alteraciones morfológicas y actividad insecticida sobre larvas de Ae. aegypti (43). Adicionalmente, se ha reportado que la mortalidad causada por el contacto directo del extracto de S. saponaria en insectos de la especie Trialeurodes vaporariroum, es generada por convulsiones debido a disminución en el consumo de oxígeno y ataxia (42,44).
De otro lado, en la especie G. sepium, Rastrelli et al., determinaron que los principales compuestos activos de la planta son pterocarpanos, isoflavonas y saponinas triterpénicas (45), además de la presencia de pinitol (46), hidrocarbonos y cumarinas (47). Nazliet et al., en 2008 demostraron que extractos etanólicos de G. sepium tienen actividad repelente en mosquitos adultos de la especie Ae. aegypti con un porcentaje de repelencia máxima del 78 %, mientras que el aceite de citronela (Pelargonium citrosum) tuvo una repelencia de 74 %, el cuál es el más usado comercialmente (48).
A pesar de que la especie G. sepium tuvo una actividad insecticida eficaz, demostró tener una concentración letal media inferior a los valores encontrados en las especies A. muricata y S. saponaria, según esto se recomienda utilizar solventes alternativos al metanol para realizar las percolaciones con raíces de G. sepium con el fin de extraer fracciones polares diferentes a las extraídas con el metanol.
Otro aspecto a tener en cuenta podría ser el uso de otras partes de la planta tales como hojas, en donde los metabolitos secundarios responsables de la actividad biológica pueden encontrarse en una mayor cantidad o menos opacados por metabolitos primarios. Sharma et al., en 1998, evaluaron la actividad larvicida de G. sepium sobre larvas de Anopheles stephansi, Ae. aegypti y Culex quinquefasciatus y encontraron que los extractos etanólicos de las hojas frescas de G. sepium causaron mortalidad en Ae. aegypti desde una concentración de 250 ppm (49).
Observando los resultados de los extractos de las tres especies vegetales bajo las recomendaciones de la Agencia de Cooperación Técnica Alemana (GTZ), estos se pueden considerar promisorios para el control de larvas de Ae. aegypti debido a que los valores de LC50 obtenidos en estas evaluaciones se encuentran por debajo de la concentración máxima (5 000 ppm) recomendada para condiciones de trabajo en laboratorio (50).
Debido a que todos los bioensayos fueron realizados con extractos vegetales totales en donde los compuestos activos principales están en una menor proporción y mezclados con otras sustancias que pueden tener una baja o nula actividad biológica tales como carbohidratos, carotenos, sales minerales, xantofilas, clorofilas, glucósidos y algunos lípidos, se recomienda fraccionar los extractos vegetales totales para concentrar y purificar los metabolitos biológicamente activos, y de esta manera se podría dilucidar y clasificar estos compuestos.
Gracias a que los procedimientos para realizar percolaciones con extractos de origen botánico son de fácil acceso y de bajo costo, los extractos vegetales en este estudio se realizaron de forma continua y sin contratiempos.
En conclusión se halló que los resultados obtenidos son promisorios para el control de estadios inmaduros de Ae. aegypti. En este estudio se realizaron evaluaciones con las cepas Rockefeller y silvestre de Ae. aegypti, es necesario realizar evaluaciones adicionales con cepas de diferentes regiones del país con el fin de verificar la efectividad de los extractos vegetales y poder estandarizar una concentración letal media de los extractos vegetales sobre larvas de Ae. aegypti en Colombia.
Adicionalmente, se recomiendan realizar evaluaciones de los extractos vegetales en organismos no objetivos con la finalidad de determinar su eco toxicidad. Además, por el hecho de tratarse de un experimento elaborado en su totalidad en laboratorio, la realización de bioensayos de los extractos vegetales en campo podría permitir determinar la eficacia, estabilidad e inocuidad de los mismos sobre el medio ambiente.
Agradecimientos
A la Dirección de Investigaciones de la Universidad CES por el apoyo financiero a esta investigación. A las biólogas Ana Victoria Gómez González y Laura María Pinto Gutiérrez por facilitar elementos de laboratorio y apoyar el proceso experimental. Al Pecet de la U. de A. por suministrar huevos de la cepa Rockefeller de Ae. aegypti y al Laboratorio de Entomología Médica de la U. de A. por suministrar huevos de la cepa silvestre de Ae .aegypti.
Conflicto de interés
Los autores declaramos que no existe conflicto de intereses en los resultados presentados en este artículo.
Financiamiento
Este trabajo se realizó con el apoyo financiero de la Dirección de Investigaciones de la Universidad CES.
REFERENCIAS
1. OMS. Dengue y dengue hemorrágico {Internet}. {cited 2011 Nov 4}. Available from: http://www.who.int/mediacentre/factsheets/fs117/es/. [ Links ]
2. Rodríguez G, Velandia C, Boshell J. Fiebre amarilla, la enfermedad y su control. Instituto Nacional de Salud; 2003. [ Links ]
3. Bello SL. COMPORTAMIENTO EPIDEMIOLÓGICO DEL DENGUE EN COLOMBIA AÑO 2011. Inst Nac Salud. 1 - 16. [ Links ]
4. Restrepo BN, Piedrahita LD, Agudelo IY, Parra-Henao G, Osorio JE. Frequency and Clinical Features of Dengue Infection in a Schoolchildren Cohort from Medellin, Colombia. J Trop Med 2012;1-9. [ Links ]
5. Santacoloma L, Chaves B, Brochero HL. Susceptibilidad de Aedes aegypti a DDT, deltametrina y lambdacialotrina en Colombia. Rev Panam Salud Publica. 2010;27(1):66 - 73. [ Links ]
6. Ministerio de Salud. Guía Integral de Manejo de las Enfermedades Transmitidas por Vectores. Malaria, Dengue y Leishmaniasis. Módulo 4. Santafe de Bogotá; 1996. [ Links ]
7. Ocampo CB, Salazar-Terreros MJ, Mina NJ, McAllister J, Brogdon W. Insecticide resistance status of Aedes aegypti in 10 localities in Colombia. Acta Trop. 2011 Apr;118(1):37-44. [ Links ]
8. Fonseca-González I, Cárdenas R, Quiñones ML, McAllister J, Brogdon WG. Pyrethroid and organophosphates resistance in Anopheles (N.) nuneztovari Gabaldón populations from malaria endemic areas in Colombia. Parasitol Res. 2009 Oct;105(5):1399-409. [ Links ]
9. World Health Organization. Dengue: guidelines for diagnosis, treatment, prevention, and control. New ed. Geneva: World Health Organization; 2009. [ Links ]
10. Rodríguez M, Bisset J, Mila L, Calvo E, Díaz C, Soca L. Niveles de resistencia a insecticidas y sus mecanismos en una cepa de Aedes aegypti de Santiago de Cuba. Rev Cubana Med Trop. 1999;51(2):83-8. [ Links ]
11. Rojas J, Mazarri M, Sojo M, García G. Evaluación de la efectividad de Bacillus sphaericus cepa 2362 sobre larvas de Anopheles nuñeztovariz. Mérida, Venezuela. Invest Clin. 2001;42(2):131-46. [ Links ]
12. Koldenkova L, García Avila I, Garcés Fonseca J, González Broche R. The predatory capacity of the larvivorous fish Poecilia reticulata (Peters, 1985) (Cyprinodontiformes: Poecillidae) in a natural breeding-ground for the mosquito Culex quinquefasciatus Say, 1823. Rev Cubana Med Trop. 1988 Apr;40(1):21-6. [ Links ]
13. García I. Insectos acuáticos biorreguladores de las larvas de mosquitos presentes en los cuerpos de agua de Santo Domingo, República Dominicana. Rev Cubana Med Trop. 1993;45(3):213-4. [ Links ]
14. García Avila I, Vivar Guzmán R, Quezada Márquez J, Huamán Mayta P. Insectos acuáticos biorreguladores de larvas de mosquito presentes en los" Pantanos de Villa", Lima, Perú. Rev Cubana Med Trop. 1996;48(3):227-8. [ Links ]
15. Rodríguez J, González R. Evaluación de la capacidad depredadora de Osteopilus septentrionales (Anura: Hylidae) sobre larvas de Culex quinquefasciatus (Diptera: Culicidae) en condiciones de laboratorio y de semicampo. Bol Malariol y San Amb. 2000;XL((1 y 2)):9-12. [ Links ]
16. Lópes J, Arantes OMN, Cenci MA. Evaluation of a new formulation of Bacillus thuringiensis israelensis. Braz J Biol Rev Brasleira Biol. 2010 Nov;70(4):1109-13. [ Links ]
17. Paula AR, Carolino AT, Silva CP, Samuels RI. Susceptibility of adult female Aedes aegypti (Diptera: Culicidae) to the entomopathogenic fungus Metarhizium anisopliae is modified following blood feeding. Parasit Vectors. 2011;4(91):1-7. [ Links ]
18. García-Munguía AM, Garza-Hernández JA, Rebollar-Tellez EA, Rodríguez-Pérez MA, Reyes-Villanueva F. Transmission of Beauveria bassiana from male to female Aedes aegypti mosquitoes. Parasit Vectors. 2011;4(24):1 - 6. [ Links ]
19. Pohlit AM, Quinard ELJ, Nunomura SM, Tadei WP, Hidalgo A de F, Pinto AC da S, et al. Screening of plants found in the State of Amazonas, Brazil for activity against Aedes aegypti larvae. Acta Amaz. 2004;34:97 - 105. [ Links ]
20. Jacobson, Martin. Insecticides from plants: a review of the literature, 1941-1953 {Internet}. U.S. Dept. of Agriculture; 1958 {cited 2011 Sep 17}. Available from: http://naldr.nal.usda.gov/NALWeb/Agricola_Link.asp?Accession=CAT10310196. [ Links ]
21. Mehlhorn H, Schmahl G, Schmidt J. Extract of the seeds of the plant Vitex agnus castus proven to be highly efficacious as a repellent against ticks, fleas, mosquitoes and biting flies. Parasitol Res. 2005 Mar;95(5):363-5. [ Links ]
22. Elango G, Bagavan A, Kamaraj C, Abduz Zahir A, Abdul Rahuman A. Oviposition-deterrent, ovicidal, and repellent activities of indigenous plant extracts against Anopheles subpictus Grassi (Diptera: Culicidae). Parasitol Res. 2009 Nov;105(6):1567-76. [ Links ]
23. Rahuman AA, Bagavan A, Kamaraj C, Saravanan E, Zahir AA, Elango G. Efficacy of larvicidal botanical extracts against Culex quinquefasciatus Say (Diptera: Culicidae). Parasitol Res. 2009 Jun;104(6):1365-72. [ Links ]
24. Enan E, Beigler M, Kende A. Insecticidal action of terpenes and phenols to cockroaches: effect on octopamine receptors. Paper presented at the International Symposium on Plant Protection, Gent, Belgium. 1998. [ Links ]
25. Dharmagadda VSS, Naik SN, Mittal PK, Vasudevan P. Larvicidal activity of Tagetes patula essential oil against three mosquito species. Bioresour Technol. 2005 Jul;96(11):1235-40. [ Links ]
26. Cseke L. Nat Prod Plants. 2nd ed. Boca Raton FL: CRC/Taylor & Francis; 2006. p. 143 -159. [ Links ]
27. Parra-Henao G, García Pajón CM, Cotes Torres JM. Actividad insecticida de extractos vegetales sobre Rhodnius prolixus y Rhodnius pallescens (Hemiptera: Reduviidae). Bol Mal Salud Amb. 2007;47(1):125 -137. [ Links ]
28. Poupardin R, Reynaud S, Strode C, Ranson H, Vontas J, David J-P. Cross-induction of detoxification genes by environmental xenobiotics and insecticides in the mosquito Aedes aegypti: impact on larval tolerance to chemical insecticides. Insect Biochem Mol Biol. 2008 May;38(5):540-51. [ Links ]
29. Riaz MA, Poupardin R, Reynaud S, Strode C, Ranson H, David J-P. Impact of glyphosate and benzo{a}pyrene on the tolerance of mosquito larvae to chemical insecticides. Role of detoxification genes in response to xenobiotics. Aquat Toxicol Amst Neth. 2009 Jun 4;93(1):61-9. [ Links ]
30. Johnson-Restrepo B, Olivero-Verbel J, Lu S, Guette-Fernández J, Baldiris-Avila R, O'Byrne-Hoyos I, et al. Polycyclic aromatic hydrocarbons and their hydroxylated metabolites in fish bile and sediments from coastal waters of Colombia. Environ Pollut. 2008 Feb;151(3):452-9. [ Links ]
31. Strode C, Wondji CS, David J-P, Hawkes NJ, Lumjuan N, Nelson DR, et al. Genomic analysis of detoxification genes in the mosquito Aedes aegypti. Insect Biochem Mol Biol. 2008 Jan;38(1):113-23. [ Links ]
32. Mareggiani G. Manejo de insectos plaga mediante sustancias semioquímicas de origen vegetal. Manejo Integrado Plagas Costa Rica. 2001;60:22-30. [ Links ]
33. Shawkat MS, Majid R K. EXTRACTION OF PYRETHRINS FROM Chrysanthemum cinerariaefolium PETALS AND STUDY ITS ACTIVITY AGAINST BEETLE FLOUR Tribolium castanum. Iraqi J Sci. 2011;52(4):456-63. [ Links ]
34. Burfield T, Reekie S-L. Mosquitoes, malaria and essential oils. Int J Aromather. 2005;15:30-41. [ Links ]
35. Rupprecht JK, Hui YH, McLaughlin JL. Annonaceous acetogenins: a review. J Nat Prod. 1990 Apr;53(2):237-78. [ Links ]
36. Matthew J. Rieser, John F. Kozlowski, Karl V. Wood, Jerry L. McLaughlin. Muricatacin: A simple biologically active acetogenin derivative from the seeds of annona muricata (annonaceae). 1991;32(9):1137-40. [ Links ]
37. Sanabria L, Segovia EA, González N, Alcaraz P, Vera N de Bilbao. Actividad larvicida de extractos vegetales acuosos en larvas de Aedes aegypti (primeros ensayos). Mem Inst Investig Cienc Salud. 2009 Diciembre;7(2):26-31. [ Links ]
38. Parra-Henao G, García Pajón CM, Cotes Torres JM. Actividad insecticida de extractos vegetales sobre Aedes aegypti (Diptera: Culicidae) vector del dengue en Colombia. CES Med. 2007;21(1):47-54. [ Links ]
39. Robledo PC, González R, Jaramillo GI, Restrepo J. Evaluación de la toxicidad de acetogeninas anonáceas sobre ninfas de periplaneta americana L. (Dictyoptera:Blattidae). Boletín del museo de entomología Universidad del Valle. 2008;9(1):54 -61. [ Links ]
40. Alvarez O, Ayala I, Moya P. Toxic effects of annonaceous acetogenins on Oncopeltus fasciatus. J Pest Sci. 2008;81:85-9. [ Links ]
41. Herrera N, Correa E, Cardona D. Estructura y actividad de sapogeninas triterpénicas. Scientia et technica. 2007;33:87 - 90. [ Links ]
42. Porras MF, López A. Effect of extracts from Sapindus saponaria on the glasshouse whitefly Trialeurodes vaporariorum (Hemiptera: Aleyrodidae). Rev Colomb Entomol. 2009;35(1):7 -11. [ Links ]
43. Ferreira C, Cavasin G M, Garcia da Silva H H. Study of the morphohistological modifications in larvae of Aedes aegypti (Diptera, Culicidae) submitted to the pure ethanolic extract of Sapindus saponaria Lin. (Sapindaceae). Revista de Patologia Tropical. 35(1):37 -57. [ Links ]
44. Molina N. Uso de extractos botánicos en control de plagas y enfermedades. Manejo integrado de plagas. Boletin de Costa Rica. 2001;50:56-67. [ Links ]
45. Rastrelli L, Caceres A, De Simone F, Aquino R. Studies on the constituents of Gliricidia sepium (Leguminosae) leaves and roots: isolation and structure elucidation of new triterpenoid saponins and aromatic compounds. J Agric Food Chem. 1999 Apr;47(4):1537-40. [ Links ]
46. Calle J, Rivera A, Joseph-Nathan P. Pinitol from the Leaves of Gliricidia sepium. Planta Med. 1987 Jun;53(3):303. [ Links ]
47. Herath HMTB, Dassanayake RS, Priyadarshani AMA, De Silva S, Wannigama GP, Jamie J. Isoflavonoids and a pterocarpan from Gliricidia sepium. Phytochemistry. 1998;47:117-9. [ Links ]
48. Nazli R, Akhter M, Ambreen S, Solangi AH, Sultana N. Insecticidal, nematicidal and antibacterial activities of Gliricidia sepium. Pak J Bot. 2008;40(6):2625-9. [ Links ]
49. Sharma N, Qadry J, Subramanium B, Verghese T, Rahman S, Sharma S, et al. Larvicidal activity of gliricidia sepium against mosquito larvae of anopheles stephansi, aedes aegypti and culex quinquefasciatus. Pharmaceutical Biology. 1998;36(1):3-7. [ Links ]
50. Hellpap C. Steps for developing botanical pesticides. Manuscrito G.T.Z; 1993. [ Links ]
Recibido: agosto 14 de 2013 Revisado: octubre 28 de 2013 Aceptado: noviembre 3 de 2013