Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
CES Medicina
versão impressa ISSN 0120-8705
CES Med. vol.27 no.2 Medellín jul./dez. 2013
Reporte de casos
Púrpura de Schönlein-Henoch con compromiso abdominal, descripción de un caso y revisión de la literatura
Henoch-Schönlein Purpura with abdominal involvement. Case report and a review of the literature
JUAN JOSÉ LÓPEZ1, DIANA ÁNGEL2, DIOCEL LANCHEROS3
1Médico Pediatra Hospital El Tunal. juanj.lopezp26@yahoo.es. Grupo de investigación en infancia. Hospital el Tunal. Bogotá-Colombia.
2Médica Pediatra Hospital El Tunal Bogotá. diana.angelb@gmail.com. Grupo de investigación en infancia. Hospital el Tunal. Bogotá-Colombia.
3Médico Pediatra Hospital El Tunal. Grupo de investigación en infancia. Hospital el Tunal. Bogotá-Colombia.
Recibido: octubre 22 de 2012 Revisado: abril 25 de 2013 Aceptado: mayo 6 de 2013
RESUMEN
La púrpura de Schönlein-Henoch es la vasculitis de pequeños vasos más frecuente en la infancia. Se manifiesta principalmente por una púrpura palpable, artritis, dolor abdominal y compromiso renal. El compromiso gastrointestinal es muy variable, siendo su manifestación más frecuente el dolor abdominal, con diferentes grados de severidad. Para su manejo se han utilizado desde analgésicos comunes hasta inmunosupresores.
Se presenta el caso de un niño que consulta por intenso dolor abdominal, por lo que es llevado a cirugía, luego presenta las típicas lesiones en piel. El dolor se intensifica llegando a comprometer la ingesta y disminuir su peso. El manejo con diferentes analgésicos y corticoides, incluso a dosis altas, no logró resultados, por lo que se utiliza inmunoglobulina G humana en dosis de 1 g/kg/día, por dos días, por vía intravenosa, con rápida y sostenida resolución del dolor, pudiendo el paciente volver a comer.
PALABRAS CLAVE
Púrpura de Schönlein-Henoch, Dolor abdominal, Inmunoglobulina.
ABSTRACT
Henoch-Schönlein purpura (PSH) is the most common small blood vessels vasculitis of childhood. It is characterized by palpable purpura, arthritis, abdominal pain and renal involvement. Gastrointestinal manifestations are highly variable; its most frequent is abdominal pain with varying degrees of severity. The management is supportive and with analgesics and immunosuppressive agents.
We present a child who developed severe abdominal pain, so much that he was underwent surgery. After that, He presented the typical skin lesions: palpable purpura. His abdominal pain intensified, his food intake decreased and then his weight decreased progressively. The management failed with different analgesics and corticosteroids even at high doses. Then we administered intravenous gammaglobulin 1 gr/kg/day for two days with rapid and sustained resolution of pain and improvement of food intake.
Although Henoch-Schönlein purpura is generally a benign and rapid recovery condition, some cases like the one described, show that some patients need more individualized handling, leaving so much to investigate and learn from this disease.
KEY WORDS
Henoch-Schönlein purpura, Abdominal pain, Immunoglobulin.
DESCRIPCIÓN DEL CASO CLÍNICO
Se trata de un paciente masculino de nueve años de edad, quien es llevado al servicio de urgencias por cuadro de dolor abdominal de un día de evolución que no mejoró con la administración de acetaminofén y butil bromuro de hioscina. En el examen físico de ingreso presentaba deshidratación grado II y dolor al palpar el hemiabdomen superior, sin signos de irritación peritoneal. Se hospitaliza para hidratación intravenosa, observación y estudios adicionales.
El cuadro hemático y el uroanálisis fueron normales. Al reiniciar la vía oral se incrementa el dolor abdominal. Se realiza ecografía abdominal que reporta bazo accesorio como variante anatómica; la amilasemia y las funciones renal y hepática fueron normales. La radiografía simple de abdomen reportó abundante materia fecal como único hallazgo.
Recibe manejo con líquidos endovenosos, metoclopramida, ranitidina, enemas evacuantes; sin embargo, persiste con dolor abdominal incapacitante localizado en hipocondrio izquierdo, marcada hiporexia y vómito postprandial. Al segundo día es llevado a laparoscopia diagnóstica más apendicectomía, sin observarse hallazgos patológicos.
Al cuarto día aparecen lesiones purpúricas tenues en tobillos, que permanecen sin progresión los dos días siguientes. Se sospecha púrpura de Schönlein-Henoch por lo que se amplían estudios para descartar compromiso de otros órganos, siendo negativos. Al séptimo día hay progresión de las lesiones purpúricas y al octavo día llegan a comprometer no solo miembros inferiores sino también tronco, brazos, antebrazos, e inicia dolor articular en tobillos.
El dolor abdominal persiste intermitentemente, siendo incapacitante, sin demostrase complicaciones como sangrado o invaginación intestinal; se maneja con prednisolona, vitamina C, analgésicos tipo acetaminofén, dipirona y tramadol, antiespasmódico y metronidazol (por hallazgo de trofozoitos de E. hystolitica en coproscópico), sin conseguir mejoría del cuadro. En el décimo día se adiciona colchicina.
Los análisis periódicos de función renal así como uroanálisis, hemograma, eritrosedimentación, transaminasas, endoscopia digestiva alta e imágenes no demuestran alteraciones. Ante la ansiedad del paciente y la familia se solicita intervención por psicología y psiquiatría.
Para el día 17 se indican tres pulsos de metilprednisolona y antibioticoterapia de amplio espectro por presencia de fiebre y leucocitosis con neutrofilia. Presenta además pérdida de peso y se documenta anemización sin pérdidas sanguíneas evidentes.
Hay recuperación transitoria del dolor abdominal, pero este reincide, especialmente tras la ingesta de alimentos. En el día 22 de hospitalización se inicia inmunoglobulina G humana a dosis de 1 g/kg/d por dos días, presentando una rápida mejoría clínica, con desaparición del dolor abdominal, mejor aceptación de los alimentos, disminución de las lesiones de la piel y tolerando el retiro de los analgésicos. Egresa el día 26, sin reaparición del dolor abdominal y aceptando vía oral.
REVISIÓN DE LA LITERATURA
La púrpura de Schönlein-Henoch hace parte de las vasculitis sistémicas primarias que compro meten los pequeños vasos. Entre el 80 a 90 % de los casos tienen presentación unifásica, 10 a 20 % polifásica y menos del 5 % crónica o continua (1).
Lo habitual es la presencia de púrpura palpable no trombocitopénica, dolor abdominal tipo cólico y artritis, aunque la principal causa de morbilidad es el compromiso renal, pudiendo llevar a falla renal crónica hasta en el 1-2 % de los casos.
El compromiso renal es más común en quienes el compromiso extra-renal y generalmente dura más de seis semanas (2). En el 25 % de los casos el exantema aparece después de otras manifestaciones (3). También puede producir compromiso pulmonar, del sistema nervioso central, cardiaco, ocular, genitourinario, déficit de la vitamina K y del factor VIII de la coagulación (1,3-6).
Las recaídas son más frecuentes cuando el compromiso inicial es severo, hay nefritis, inflamación aguda dada por elevación de la velocidad de sedimentación globular o en aquellos que recibieron tratamiento con corticoides (7).
La púrpura de Schönlein-Henoch es la vasculitis más común de la infancia, afectando a todos los grupos etarios en todo el mundo. La incidencia estimada es de cerca de 20/100 000 niños menores de 17 años por año, con un pico de incidencia de 70/100 000 entre los 4 a 6 años. Es ligeramente más frecuente en varones (proporción hombre a mujer: 1,2:1 a 1,8:1) y menos frecuente en la raza negra (7).
No se conoce la patogénesis de la púrpura de Schönlein-Henoch. Surge con frecuencia después de la exposición o contacto con diversos microorganismos infectantes, fármacos y otros estímulos (8), los cuales serían el gatillo de una respuesta inmune que llevarían a la formación de complejos inmunes de IgA1, que se depositarían en la pared de los vasos sanguíneos de personas susceptibles (2), aunque sin una relación causal claramente demostrada (1).
Una infección respiratoria alta o fiebre precede una a tres semanas el inicio de los síntomas en cerca del 90 % de los niños (2). El estreptococo del grupo A es el más frecuentemente involucrado (hasta en una tercera parte de los casos), pero también se han descrito muchos otros microrganismos como virus, bacterias, parásitos, micobacterias, vacunas, alérgenos alimentarios, picaduras de insectos, exposición al frio, fármacos y enfermedades neoplásicas (1,4,9).
La colitis pseudomembranosa asociada a Clostridium difficile puede desarrollarse con o después de la púrpura de Schönlein-Henoch (10). Algunos autores han encontrado una alta incidencia (58,3 %) de Helicobacter pylori con el desarrollo de recaídas (81,3 %) (11).
Se ha presentado en grupos familiares, sugiriendo un componente genético. La susceptibilidad genética es sugerida por el análisis de los polimorfismos de DRB1 (12). Se han descrito otros factores relacionados como la delección de los genes que codifican la fracción C4 del complemento, la presencia del gen DQA1 y la delección del gen de la enzima convertidora de la angiotensina (1). El riesgo de desarrollar complicaciones gastrointestinales severas se relaciona negativamente con el polimorfismo de la molécula de adhesión intercelular I (ICM-1), la cual también puede reducir el riesgo de compromiso renal (12).
Los desencadenantes de la púrpura de Schönlein-Henoch pueden ser ciertos microorganismos que comparten un determinante antigénico con las células endoteliales de los pequeños vasos en los humanos. La hipótesis es que tras la invasión de un patógeno se produce una respuesta inmune con subtipos de IgA que reaccionan en forma cruzada contra antígenos específicos (aún no identificados) que son depositados en las células endoteliales. Se considera que este depósito ocurre por un mecanismo diferente a la clásica interacción antígeno-anticuerpo (13).
La IgA que se deposita es específicamente IgA1 polimérica anormal (con un alto contenido en serina y prolina), ya sea circulante o por formación in situ, con activación de la vía alterna del complemento (1-4), citoquinas, factores de crecimiento, factor de necrosis tumoral, interleucinas (especialmente 1 y 6), moléculas de adhesión, radicales libres de oxígeno, prostanoides, leucotrienos, complejo de ataque a la membrana, proteínas inmunoestimuladoras, etc. (1).
Microscópicamente, a nivel de las paredes de los vasos sanguíneos del intestino, se observa depósito de IgA y, en menor extensión, de IgG, C3, fibrinógeno e IgM, al igual que la presencia de linfocitos, neutrófilos y ocasionalmente histiocitos (2,3,7). Estos depósitos de IgA1 pueden ser vistos en la mucosa de biopsias de duodeno en ausencia de vasculitis, pero también pueden no estar presentes en lesiones necróticas o antiguas (2).
La vasculitis ocasiona edema y hemorragia en varios órganos, incluyendo el tracto gastrointestinal (intestino, páncreas, vesícula biliar), en donde puede presentarse una vasculitis necrosante (5, 12). En algunos pacientes se ha encontrado una producción elevada de óxido nítrico, desconociendo su importancia real (1). Elevados niveles séricos de amiloide A se han visto asociados con la presencia de manifestaciones gastrointestinales, así como a una mayor duración de la enfermedad (14).
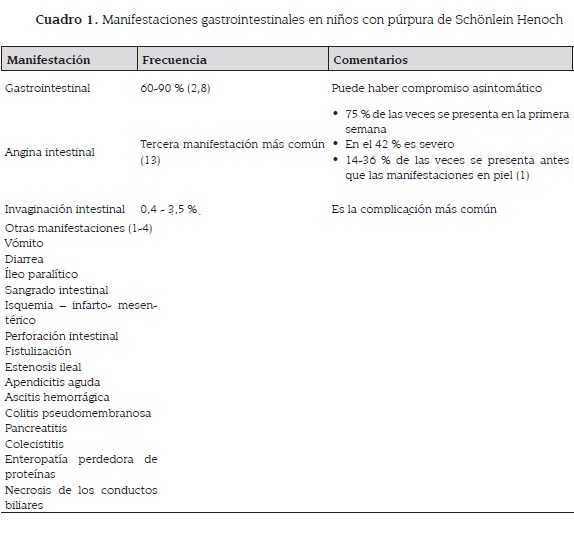
Las manifestaciones gastrointestinales se presentan en cerca del 60 al 90 % de los casos (2,8). La presencia de sangre oculta en materia fecal, hipoalbuminemia sin proteinuria y de alfa 1 antitripsina en materia fecal en los pacientes sin síntomas gastrointestinales, sugiere que el compromiso de la mucosa intestinal es más común de lo que indica la historia clínica (cuadro 1) (7).
El dolor abdominal (angina intestinal) es la tercera manifestación más común, siendo especialmente periumbilical (13), secundario al edema y la hemorragia de la submucosa (7, 8). En cerca del 75 % de los pacientes, el dolor se presenta en la primera semana después de la aparición del exantema, pero puede llegar a presentarse hasta más de un mes después e incluso a los 150 días (2,8). Puede ser severo en cerca del 42 % de los casos (7).
En el 14 a 36 % los síntomas preceden a la aparición de las lesiones en la piel (1) y cuando esto sucede es casi imposible hacer el diagnóstico, siendo difícil de diferenciar de otras emergencias abdominales como la apendicitis aguda (4,5). Generalmente, el dolor es de tipo cólico, pudiendo ser muy intenso y recurrente, empeorando con la alimentación (5).
También se puede presentar vómito, diarrea, íleo paralítico, sangrado intestinal, invaginación intestinal, isquemia mesentérica con infarto, perforación intestinal, fistulización, estenosis ileal, apendicitis aguda, ascitis hemorrágica y colitis pseudomembranosa. Puede presentarse pancreatitis (incluso hemorrágica), colecistitis y enteropatía perdedora de proteínas (1-4).
Cerca del 9 % de los pacientes pueden tener compromiso hepatobiliar, con aumento de las transaminasas (75 %), de la gamma glutamil transpeptidasa (30 %), hepatomegalia detectada por ecografía (75 %) y edema de la pared de la vesícula biliar (25 %), los cuales disminuyen 3 a 7 días después de iniciar el manejo con esteroides (2).
También se ha descrito un caso de necrosis isquémica de los conductos biliares con cirrosis biliar posterior y trasplante hepático (15). El 75 % de los niños presentan dolor a la palpación abdominal pero solo el 9 % tendrán dolor de rebote (2). El sangrado intestinal en forma de hematoquecia se presenta en el 25 % de los casos y la hematemesis en cerca del 10 % (2). La isquemia mesentérica con infarto y perforación intestinal pueden generar una gran morbilidad y mortalidad.
La enteropatía perdedora de proteínas puede acompañarse de hipoalbuminemia y edemas (8). La invaginación ocurre en el 2 al 3 %, originándose principalmente en el íleon (90 %) o yeyuno (7 %), ocurriendo máxime entre los cinco a siete años. La deposición en jalea de grosella con la sensación de vacío a la palpación en el cuadrante inferior derecho sugiere el diagnóstico. En niños que han sido explorados por laparotomía se ha observado una excesiva cantidad de líquido peritoneal. Rara vez la obstrucción del intestino delgado puede desarrollarse de una fístula entero-entérica o de la formación de una estrechez tardía (2).
Todas estas manifestaciones pueden presentarse en el curso de días o semanas y variar en el orden de su presentación (7).
No hay hallazgos de laboratorio que hagan el diagnóstico de púrpura de Schönlein-Henoch. Se podrá encontrar en el cuadro hemático leucocitosis (10 000 a 20 000) con desviación a la izquierda en el 50 % de los casos, trombocitosis, leve anemia normocrómica. Cuando el recuento de los glóbulos blancos es mayor de 20 000/ mm3 y la eritrosedimentación está elevada, existe la posibilidad de sobreinfección bacteriana (7). Puede haber leve aumento de la velocidad de sedimentación globular mayor de 20 mm/h en el 57 % de los pacientes (cuadro 2) (9).
Los anticuerpos antinucleares no son útiles para el diagnóstico, excepto para excluir otras enfermedades, al igual que el factor reumatoideo. La IgA sérica puede estar elevada en el 50-70 % de los pacientes (7), especialmente la IgA1 polimérica (12), disminuyendo a sus niveles normales cuando los síntomas desaparecen, aunque permanecen altos por más de 12 meses en aquellos con nefritis severa (6).
El factor XIII de la coagulación puede estar significativamente disminuido (6). Los niveles del complemento en suero generalmente son normales, aunque se ha descrito la asociación entre la púrpura de Schönlein-Henoch y el déficit congénito del complemento C2 (16).
Los anticuerpos anti nucleares rara vez son positivos (17). En el 10 % de los pacientes puede detectarse la presencia de anticuerpos anticitoplasma de los neutrófilos (2) del isotipo IgA (IgA-ANCA) (12). La IgE se encuentra aumentada, posiblemente por la prevalencia de los linfocitos Th2 (12). El factor reumatoide isotipo IgA puede ser encontrado en un poco más de la mitad de los pacientes afectados (6).
Las crioglobulinas pueden estar altas, especialmente cuando hay compromiso renal, al igual que el leucotrieno E4 (6). La sangre oculta en materia fecal es frecuentemente positiva (50 %) y debe estudiarse siempre (8). El daño endotelial puede activar la coagulación y elevar los niveles de dímero D en cerca de 10 veces lo normal (2).
La ecografía abdominal puede evidenciar el edema de la pared intestinal de tipo difuso o focal, líquido libre peritoneal, menor peristaltismo de las asas comprometidas, dilatación intestinal (8) y en casos más graves ensanchamiento de la pared duodenal con desdiferenciación o ausencia de la estratificación de las capas del duodeno, asociándose con mayor riesgo de complicaciones, por lo que constituye el examen de elección para diagnosticar invaginación intestinal (5).
El estudio ecográfico seriado durante el curso de la enfermedad puede ayudar a determinar si las lesiones se extienden o se resuelven y si reaparece la peristalsis, al igual que si se presentan complicaciones como la invaginación o la perforación (2). Esto ha permitido, en conjunto con la tomografía computada, ser más conservadores en el manejo y evitar así cirugías innecesarias. La ecografía doppler color puede ser útil para demostrar el flujo de los vasos sanguíneos (6).
Los estudios radiológicos a nivel del intestino delgado pueden mostrar impresiones digitales que corresponden al edema y hemorragia que se presenta en la submucosa, al igual que asas dilatadas, disminución de la motilidad intestinal, espasmo, úlceras y pseudotumor, especialmente en yeyuno e íleon (2,7).
En el intestino delgado o en el colon se pueden ver improntas que representan la hemorragia y el edema submucosos, espasmos, ulceraciones e imágenes de pseudotumor en yeyuno e íleon, pudiendo confundirse con enfermedad de Crohn, esclerodermia y enfermedades linfoproliferativas (2). El colon por enema puede no ser útil para detectar la invaginación, ya que ésta generalmente se presenta en el intestino delgado (7).
Generalmente la endoscopia no es necesaria, aunque puede excluir otras entidades si el diagnóstico no es claro. Podrá evidenciar lesiones purpúricas coalescentes, especialmente en la segunda porción del duodeno, gastritis (edema difuso de la mucosa, eritema en parches y múltiples erosiones) y punteado eritematoso o cambios ulcerativos en el colon (2, 8).
No existe un tratamiento específico para la púrpura de Schönlein-Henoch, siendo este generalmente de soporte, dirigido al alivio del dolor, adecuada hidratación y nutrición (7). La mayoría de los pacientes tienen resolución de la enfermedad con medidas conservadoras, siendo suficiente para muchos el solo descanso. Una cuarta parte no requerirán tratamiento (17).
Se debe hospitalizar a los niños que presentan importante dolor abdominal por el riesgo de hemorragia, invaginación o perforación. Se deben colocar líquidos intravenosos y si es necesario una sonda nasogástrica (2,8). Cuando el dolor abdominal es prolongado puede ser necesario utilizar nutrición enteral e incluso la parenteral (7).
Los fármacos que se han utilizado en el manejo de la enfermedad se describen a continuación (cuadro 3):
Acetaminofén y los antiinflamatorios no esteroideos. Con estos últimos no se ha demostrado que aumenten la probabilidad de hemorragia gastrointestinal (4) y deben usarse para controlar el dolor articular y abdominal, aunque se contraindican si hay un sangrado digestivo activo o glomerulonefritis (7).
Corticoesteroides: se utilizan cuando no hay respuesta a los analgésicos y se presenta un importante compromiso gastrointestinal (afectación de la ingesta, interferencia con las actividades o se requiere hospitalizar), aliviando el dolor generalmente más rápido, disminuyendo el riesgo de intususcepción (aunque controvertido), de procedimientos gastrointestinales (endoscopia, imágenes, cirugía), recurrencias y el riesgo de compromiso renal, pero no su afectación a largo plazo.
Los corticoides disminuyen la inflamación, pero la patofisiología de la enfermedad no se ve afectada (7). La dosis es de 1 a 2 mg/kg/día (máxima dosis de 60 a 80 mg al día) por una a dos semanas, disminuyéndolos posteriormente lentamente (25 % por semana) en 4 a 8 semanas, ya que se puede presentar reagudización de los síntomas (3, 4, 7), los cuales mejoran con la restitución de los mismos (2).
Si no se tolera la prednisona se puede utilizar la metilprednisolona a una dosis de 0,8 a 1,6 mg/ kg/día (máxima dosis de 64 mg/día) (6). En un estudio retrospectivo comparando el uso de prednisona (1-2 mg/kg/día) con placebo, se encontró que en el 44 % de los que recibieron corticoides a las 24 horas mejoraron el dolor abdominal comparado con el 14 % de los que no lo recibieron; a las 48 horas el dolor se resolvió en el 65 % de los que recibieron el tratamiento y solo en el 45 % de quienes no (aunque la diferencia no fue estadísticamente significativa), pero a las 72 horas la resolución del dolor fue similar en ambos grupos (75 % ) (18).
Factor XIII: Puede mejorar los síntomas gastrointestinales y las lesiones observadas por endoscopia, especialmente cuando se detecta su deficiencia (17).
Mofetil micofenolato: se ha utilizado en casos con severo compromiso gastrointestinal que no han respondido a los corticoides, pero hacen falta más estudios que avalen su utilidad en esta situación (19, 20).
Inmunoglobulina intravenosa: ha sido utilizada en algunos pacientes con enfermedad severa (3), especialmente ante la presencia de hemorragias gastrointestinales en las que fracasaron los corticoides o su uso estaba contraindicado (8), pero la experiencia de utilización es escasa, ya que existen muy pocos casos publicados (21). En 1993, Heldrich y colaboradores describen el caso de un niño de cinco años en quien los síntomas gastrointestinales desaparecieron rápidamente tras la administración de inmunoglobulina intravenosa 400 mg/kg/día durante cuatro días (22).
En 1994, Rostoker publica un trabajo sobre el uso de la inmunoglobulina en dos pacientes con púrpura de Schönlein-Henoch y en nueve pacientes con nefropatía Ig A con enfermedad renal de mal pronóstico. Todos recibieron altas dosis de inmunoglobulinas (2 g/kg cada mes) durante tres meses consecutivos, seguida de inmunoglobulinas intramuscular (contenido de preparación, el 16,5 %, 0,35 ml/kg cada 15 días) durante otros seis meses, con resultados favorables (23).
Hamidou, en 1996, reporta en un hombre de 56 años con púrpura de Schönlein-Henoch, diarrea con sangre y persistente íleo adinámico, quien presenta una dramática mejoría con el uso de inmunoglobulina intravenosa (24). En 1997, Ruellan describe en un hombre de 19 años con severas manifestaciones digestivas y púrpura de Schönlein-Henoch, mejorando tras la administración de inmunoglobulina intravenosa (25).
En el 2001, Lamirau et al. reportan el caso de un niño de 10 años con púrpura de Schönlein-Henoch y dolor abdominal, tratado con corticoides y mejoría transitoria, presentando dolor abdominal, rectorragia, hematemesis y pérdida de peso, requiriendo nutrición parenteral, por lo que administran inmunoglobulina intravenosa 1 gr/kg/día durante dos días, desapareciendo los síntomas a los dos días, reiniciando la vía oral a los siete días y suspendiendo los corticoides a los 30 días, y permaneciendo asintomático durante los tres años en los que se le hizo seguimiento (26).
En 2006, Fagbemi et al. describen una niña de nueve años con dolor abdominal y hemorragia gastrointestinal masiva en múltiples sitios (estómago, intestino delgado y colon), manifestada como hematemesis y melenas, las cuales se presentaron antes de la aparición de las lesiones en piel, y quien es tratada con inmunoglobulina intravenosa como primera opción, ante el riesgo del uso de corticoides, a una dosis de 2 gr/kg/ día, con una rápida respuesta y permaneciendo bien durante 2 años de seguimiento (27).
Bento et al., en 2010, describen el caso de un hombre de 55 años con antecedente de glomeruloesclerosis en estado terminal, quien se presenta con hemoptisis y hemorragia gastrointestinal quien no responde a los corticoesteroides, la ciclofosfamida ni a la inmunoglobulina intravenosa, falleciendo, aunque no indica la dosis utilizadas de inmunoglobulina (28).
El mecanismo de acción de la inmunoglobulina parece deberse a los efectos inmunomoduladores mediados por el dominio Fc de la IgG, la inhibición de la activación del complemento, un efecto no específico en la liberación de citoquinas por los macrófagos y células T y reducción en la liberación del FNT-alfa y la IL-1 (29).
Rituximab: se utiliza cuando el compromiso gastrointestinal y renal no ha respondido a los corticoides u otros inmunosupresores a la dosis de 375 mg/m2 una vez a la semana durante cuatro semanas, reportando una rápida resolución de la sintomatología, no eventos adversos y remisiones prolongadas (30).
El manejo quirúrgico puede ser necesario en los casos raros de hemorragia gastrointestinal masiva, obstrucción, invaginación, perforación intestinal y colecistitis (2,8).
Generalmente, el pronóstico a largo plazo es bueno, presentando la mayoría de los niños un curso agudo y autolimitado, y resolviéndose el episodio generalmente en un mes (7), a excepción de los que presentan importante compromiso renal (4). Habitualmente la morbilidad de la fase aguda se debe a las complicaciones gastrointestinales (invaginación, isquemia intestinal, perforación intestinal, pancreatitis) y, a largo plazo, por las complicaciones renales (7).
CONCLUSIONESA pesar de que la púrpura de Schönlein-Henoch es la vasculitis más común en la infancia, aún queda mucho por investigar y aprender sobre su etiopatogenia y manejo. El presente caso muestra un niño con dolor abdominal intratable y disminución de peso y diagnóstico de púrpura de Schönlein-Henoch, siendo la inmunoglobulina intravenosa el único tratamiento que pudo mejorar su condición. Existen pocos reportes donde se ha utilizado este tratamiento para controlar el dolor abdominal intratable y la hemorragia gastrointestinal de la púrpura de Schönlein-Henoch cuando otras medidas no han sido eficaces, pero aún quedan muchas preguntas por resolver, como definir a quiénes se les debería aplicar, el momento ideal, la dosis óptima, su administración en uno o en varios días, etc. Contestar estas preguntas será difícil, teniendo en cuenta las pocas veces en que ha sido empleada y su utilización principalmente como medicamento de rescate.
BIBLIOGRAFíA
1. González LE, Meza Martínez AI. Púrpura de Henoch-Schonlein y compromiso renal. En: Restrepo de Rovetto C, Castaño I, Manuel Restrepo J, editores. Enfoques en Nefrología Pediátrica. Asociación Colombiana de Nefrología Pediátrica. Cali (Colombia): Arte, diseño; 2010. p. 167-173. [ Links ]
2. Kirshner BS. Undetermined colitis and other inflamatory diseases. En: W Allan Walker and cols, eds. Pediatric Gastrointestinal Disease. Pathopysiology, Diagnosis, Manegement. 4a ed. Canada: BC Decker; 2004. p. 855-859. [ Links ]
3. Ardoin SP, Fels E. Henoch-Schonlein purpura. En: Kliegman RM, et al eds. Nelson Texbook of Pediatrics. 19ª ed. United States of America: Elsevier; 2011. p. 868-871. [ Links ]
4. Dedeoglu F, Sundel RP. Vasculitis en la infancia. Clínicas Pediátricas de Norteamérica (edición en español). Elsevier-Masson 2005;52:547-575. [ Links ]
5. Athreya BH. Vasculitis en niños. Clínicas Pediátricas de Norteamérica (edición en español). MacGraw-Hill Interamericana 1995;42:1167-1188. [ Links ]
6. Kawasaki Y, Suzuki H. Henoch-Schonlein Nephritis. En: Geary DF, Schaefer F, eds. Comprehensive Pediatric Nephrology: Philadelphia: Mosby Elsevier; 2008. p. 343-351. [ Links ]
7. Dedeoglu F, Kim S, Sundel R. Clinical manifestations and diagnosis of Henoch-Schonlein purpura. UptoDate, Versión Abril 2013. [ Links ]
8. Miñana IV. Manifestaciones gastrointestinales de las enfermedades sistémicas. En: Arguelles Martín F, García Novo MD, Pavón Relinchón P, Román Riechmann E, Silva García G, Sojo Aguirre A, eds. Tratado de gastroenterología, hepatología y nutrición pediátrica aplicada de la SEGHNP: Majadahonda (Madrid): Ergon; 2011. p. 353-356. [ Links ]
9. Chen O, Zhu XB, Ren P, Wang YB, Sun RP, Wei DE. Henoch Schonlein Purpura in children: clinical analysis of 120 cases. African Health Sciences 2013;13(1):94-99. [ Links ]
10. Ebert EC. Gastrointestinal Manifestations of Henoch-Schonlein Purpura. Dig Dis Sci 2008;53:2011-2019. [ Links ]
11. Wang BH, Zhou LQ, Zuo YH. Relationship between Helicobacter pylori involvement in children. Zhongguo Zhongguo Dang Dai Er Ke Za Zhi 2007;9(4):367-369. [ Links ]
12. Coppo R, Amore S. Henoch-Schonlein purpura. En: Avner ED, Harmon WE, Niaudet P, Yoshikawa N eds. Pediatric Nephrology. 7a ed. Berlin: Springer; 2009. p. 1111-1126. [ Links ]
13. González LM, Krysicka Janniger C, Schwartz RA. Pediatric Henoch-Schonlein purpura. Int J Dermatol 2009;48:1157-1165. [ Links ]
14. He X, Zhao Y, Li Y, Kang S, Ding Y, Luan J et al. Serum amyloid a levels associated with gastrointestinal manifestations in Henoch-Schönlein purpura. Inflammation 2012;35(4):1251-1255. [ Links ]
15. Viola S, Meyer M, Fabre M, Tounian P, Goddon R, Dechelotte P et al. Ischemic necrosis of bile ducts complicating Schönlein-Henoch purpura. Gastroenterology 1999;117:211-214. [ Links ]
16. McCallum RM, Bylund DJ. Vasculitis. En: Henry JB, ed. Henry. El laboratorio en el diagnóstico clínico. Madrid: Marbán; 2005. p. 996-997. [ Links ]
17. Lesko Daniel C. Leucocytoclastic vasculitis and Henoch-Schonlein purpura. En: Koopman WJ, Moreland LW eds. Arthritis & Allied Conditions. A Texbook of Rheumatology. 15a ed. Lippincott Williams & Wilkins; 2005. p. 86. [ Links ]
18. Rosenblum ND, Winter HS. Steroid effects on the course of abdominal pain in children with Henoch-schonlein purpura. Pediatrics 1987 ;79:1018-1021. [ Links ]
19. Martin S, Cramer CH, Heikenen J, Gitomer JJ. Gastrointestinal symtoms of Henoch-Schonlein purpura treated with mycophenolate mofetil. J Pediatr Gastroenterol Nutr 2006; 43:245-247. [ Links ]
20. Nikibakhsh AA, Mahmoodzadeh H, Karamyyar M, Hejazi S, Noroozi M, Macooie AA et al. Treatment of complicated Henoch-Schonlein purpura with mycophenolate mofetil: A retrospective case series report. International Journal of Rheumatology: 254316. Epub 2010 Jun 15. [ Links ]
21. Kawasaki Y. The pathogenesis and treatment of pediatric Henoch-Schonlein purpura nephritis. Clin Exp Nephrol 2011;15:648-657. [ Links ]
22. Heldrich FJ, Minkin S, Gatdula CL. Intravenous immunoglobulinin Henoch-Schonlein purpura: a case study. Md Med J 1993;42:577-579. [ Links ]
23. Rostoker G, Desvaux-Belghiti D, Pilatte Y, Petit-Phar M. High dose immunoglobulin therapy for severe Ig A nephropathy and Henoch-Schonlein purpura. Ann Intern Med 1994; 120:476-484. [ Links ]
24. Hamidou MA, PottierMA, Dupas B. Intravenou s immunoglobulinin Henoch-Schonlein purpura. Ann Intern Med 1996; 125:1013-1014. [ Links ]
25. Ruellan A, Khatibi M, Staub T, Martin T, Storck D, Christmann D et al. Purpura rhumatoide et immunoglobulines intraveineuses. Rev Med Interne 1997;18:727-729. [ Links ]
26. Lamireau T, Rebouissoux L, Hehunstre J-P. Intravenous immunoglobulin therapy for severe digestive manifestations of Henoch-Schönlein purpura. Acta Paediatr 2001;90:1081-1082. [ Links ]
27. Fagbemi AA, Torrente F, Hilson AJ, Thomson MA, Heuschkel RB, Murch SH. Massive gastrointestinal haemorrage in isolated intestinal Henoch-Schonlein purpura with response to intravenous inmunoglobulin infusion. Eur J Pediatr 2007;166:915-919. [ Links ]
28. Bento J, Magalhães A, Souto Moura C, Hespanhol V. Henoch-Schönlein purpura: a clinical case with dramatic presentation. BMJ Case Reports 2010; disponible en: www//doi:10.1136/bcr.12.2009.2555. [ Links ]
29. Aries PM, Hellmich B, Gross WL. Intravenous immunoglobulin therapy in vasculitis. Speculation or evidence?. Clinical Reviews in Allergy and Immunology 2005;29:237-245. [ Links ]
30. Donnithorne KJ, Atkinson TP, Hinze CH, Nogueira JB, Saeed SA, Askenazi DJ et al. Rituximab therapy for severe refractory chronic Henoch-Schonlein Purpura. J Pediatr 2009;155:136-139. [ Links ]