Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina
Print version ISSN 0120-8705
CES Med. vol.28 no.1 Medellín Jan./June 2014
Artículos de revisión
Uso de las emulsiones lipídicas en intoxicaciones por anestésicos locales y otras intoxicaciones: evidencia actual
Use of lipid emulsions in poisoning by local anesthetics and other poisonings: current evidence
JORGE EDUARDO CÁRDENAS-ÁLVAREZ1, MARIE CLAIRE BERROUET-MEJÍA2 (B)
1Residente de tercer año de Medicina de urgencias. Universidad CES. jorgeduarcaral@yahoo.com
2Médica toxicóloga. Profesora Universidad CES. Toxicóloga - Hospital General de Medellín- Clínica SOMA
RESUMEN
Objetivo: realizar una revisión narrativa con la evidencia de la composición, mecanismo de acción e indicaciones para el uso de emulsiones lipídicas como antídoto, en la toxicidad por anestésicos locales y otras intoxicaciones.Métodos: se realizó una búsqueda bibliográfica en PubMed, Scielo y Lilacs usando las palabras claves "lipid emulsion", "therapy toxicology", "lipid therapy toxicology", "intravenous lipid therapy toxicology", "fat emulsion toxicology" "local anesthetic toxicity" y "lipid sink", identificando información relevante relacionada con su fisiopatología y su uso publicada entre 1960 y 2013.
Resultados: las emulsiones lipídicas usualmente se han utilizado como suplemento nutricional, su uso también se aprobó para el tratamiento de la intoxicación por anestésicos locales como bupivacaína gracias a diferentes mecanismos de acción como: el efecto de inmersión lipídica, lipid flux y los efectos en el transporte de ácidos grasos en la mitocondria, entre otros. Aunque los resultados en intoxicaciones con beta-bloqueadores, bloqueadores de canales de calcio y antidepresivos tricíclicos han sido controversiales y no deben anteponerse al manejo tradicional, registros como el LIPAEMIC evidencian mejoría en resultados como escalas de coma Glasgow, algunas variables hemodinámicas y mayor sobrevida.
Conclusiones: no existe una forma de predecir la respuesta a la terapia lipídica ni las consecuencias y hasta la fecha no deben reemplazar tratamientos que el médico considere apropiados para el manejo del paciente.
PALABRAS CLAVE
Terapia de emulsiones lipídicas, Toxicología, Toxicidad por anestésicos locales, Terapia de lípidos intravenosos, Captación lipídica.
ABSTRACT
Objective: To perform a narrative review with evidence of the composition mechanism of action and indications for the use of lipid emulsions as an antidote in local anesthetic toxicity and other poisonings.Methods: We performed a bibliographic research by using PubMed, Scielo and Lilacs using the keywords "lipid emulsion therapy toxicology", "lipid therapy toxicology", "intravenous lipid therapy toxicology", "fat emulsion toxicology" and "lipid sink", identifying relevant information related to, published between 1960 and 2013.
Results: Lipid emulsions have been used as a nutritional supplement, its use is also approved for the treatment of poisoning by local anesthetics such as bupivacaine through different mechanisms of action such as: the effect of lipid sink, lipid flux and effects on transport fatty acids in mitochondria, among others. Although the results in other poisonings as beta-blockers, calcium channel blockers and tricyclics have been controversial and should not take precedence over traditional management. LIPAEMIC record show improved results as Glasgow coma scale, hemodynamic variables and survival.
Conclusion: There is no way to predict the response to lipid therapy nor the consequences, and that's why until this day it should not replace any treatment that the physician considers appropriate for the management of his patient.
KEY WORDS
Lipid emulsion therapy, Toxicology, Local anesthetic toxicity, Lipid therapy toxicology, Lipid sink.
GENERALIDADES
Desde 1979 Albright comenzó a evidenciar la necesidad de otras medidas adicionales en la toxicidad de los agentes anestésicos locales, debido a la poca respuesta a las medidas de reanimación que presentaban los pacientes (1). En 1997, a partir de un reporte de caso de una paciente con deficiencia severa de carnitina, quien presentó colapso y paro cardiaco bajo anestesia general con bupivacaina, se comienza a plantear los riesgos de la administración de estos medicamentos en pacientes con trastornos del metabolismo de ácidos grasos (2).
Posteriormente, en el año 2000, se demostró que la bupivacaína era un inhibidor de la carnitina acil carnitina translocasa, enzima necesaria para el transporte mitocondrial de los ácidos grasos en la célula miocárdica (3). A partir de estos hallazgos bioquímicos, Weinberg publica los resultados de un modelo animal en el que ratones y perros fueron expuestos a dosis letales de bupivacaína parenteral y reanimados de forma exitosa después de la aplicación de emulsión lipídica intravenosa. Mas adelante aparecieron los primeros reportes de casos en pacientes con intoxicación por bupivacaína (4-7).
Los reportes de caso de la utilidad de emulsiones lipídicas en intoxicaciones diferentes a los anestésicos locales, como por ejemplo lamotrigina y bupropion, iniciaron la controversia alrededor de su uso, encontrado varios reportes de casos y artículos a favor y en contra de las emulsiones lipídicas como antídoto (8).
El objetivo del presente artículo es revisar la literatura científica sobre algunos aspectos básicos de las emulsiones lipídicas como composición, mecanismo de acción en intoxicaciones, indicaciones aprobadas y su potencial utilidad en toxicología.
COMPOSICIÓN
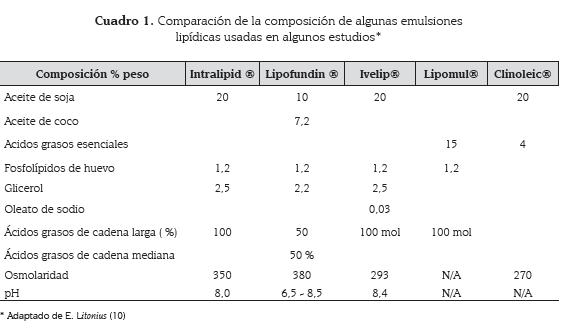
Las emulsiones lipídicas parenterales se utilizan como suplementos nutricionales y vehículos de algunos medicamentos como propofol. Están compuestas de triglicéridos y fosfolípidos, cuyas cantidades y características varían dependiendo el fabricante (cuadro 1) (9-11).
GENERALIDADES SOBRE SU METABOLISMO
El metabolismo de las emulsiones lipídicas difiere al de los lípidos enterales, principalmente por la ausencia de su paso por el intestino y metabolismo hepático (12). Es así como los quilomicrones artificiales son rápidamente cubiertos por apolipoproteínas para luego ser metabolizados por la lipoprotein lipasa, una enzima ubicada en la pared interna del endotelio vascular extrahepático, la cual es especialmente importante para el tejido muscular, incluidocorazón, pulmones y tejido adiposo, ya que hidroliza los triglicéridos externos de la partícula, generando ácidos grasos libres y monoglicéridos que son rápidamente captados por los tejidos circundantes o transportados al hígado (12).
Durante este proceso los quilomicrones van perdiendo su contenido graso dando como resultado partículas mucho más pequeñas y pobres en triglicéridos y fosfolípidos, pero ricas en colesterol. Estas partículas -llamadas remanentesson transportadas por el torrente sanguíneo al hígado, donde la lipasa hepática hidroliza los triglicéridos y fosfolípidos restantes. Durante este proceso la semivida de los quilomicrones artificiales es de aproximadamente una hora (12).
Los liposomas artificiales, otros componentes de las emulsiones, son menores en diámetro que los quilomicrones artificiales y contienen sólo 8 % de triglicéridos. Una vez en el torrente sanguíneo adquieren apolipoproteínas y colesterol de otras partículas y membranas celulares. Su metabolismo intravascular también implica la acción de la lipoproteín lipasa y la lipasa hepática, generando partículas enriquecidas en colesterol, ésteres de colesterol y fosfolípidos, que son captadas por el retículo endotelial y por algunas otras células como los hepatocitos. La vida media de estos liposomas es aproximadamente de dos a tres días y una vez ingresan a la célula son almacenados o utilizados como sustrato energético (12).
MECANISMOS DE ACCIÓN DE LOS LÍPIDOS EN PACIENTES INTOXICADOS
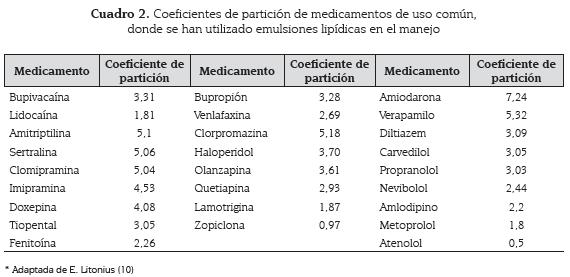
Dentro de los factores que determinan el proceso de absorción de cualquier xenobiótico están la liposolubilidad, la cual es determinada a través del coeficiente de partición o reparto, que es la razón entre las concentraciones de una sustancia en las dos fases de una mezcla formada por dos disolventes inmiscibles en equilibrio (13).
Entendiendo que uno de los principales constituyentes de la membrana celular son los fosfolípidos, se puede afirmar que entre más liposoluble sea una sustancia, mayor paso tendrá a través de las membranas celulares (13).
Uno de los mecanismos de acción atribuidos a las emulsiones, y tal vez el más importante, es el de captación o inmersión lipídica, conocido en inglés como lipid sink, que consiste en la creación de una interface lipídica plasmática que atrae moléculas del citoplasma hacia el plasma y las atrapa, principalmente en los liposomas, para posteriormente transportarlas lejos de los sitios efectores hacia órganos donde puedan ser metabolizadas y eliminadas (14).
Considerando este mecanismo, es posible explicar su mayor efectividad en relación con la liposolubilidad de la sustancia a tratar, puesto que entre mayor sea el coeficiente de partición mayor será la afinidad por la interface lipídica en el plasma y por ende mayor la extracción del medicamento (14,15). Este mecanismo de captación lipídica ha sido evaluado en animales inyectados con bupivacaína marcada radiológicamente, evidenciándose una eliminación más rápida del plasma al administrarla con una dosis de emulsión lipídica (15).
Sin embargo, se han obtenido resultados paradójicos encontrando éxito en la reanimación de pacientes intoxicados con sustancias de baja liposolubilidad y se ha fracasado con sustancias altamente liposolubles (cuadro 2) (16-20). Esta discordancia ha cuestionado el mecanismo inmersión lipídica como un único mecanismo de acción (21)
Además del efecto de inmersión lipídica, varios autores han propuesto que la acción de los lípidos se puede explicar por un efecto directo inhibiendo el transporte de ácidos grasos en la mitocondria (22-24). Adicionalmente, se encontró que las emulsiones lipídicas tenían la capacidad de facilitar los gradientes de calcio a través de las membranas asociándose a protección a la célula miocárdica después de la isquemia y reperfusión, aparte de producir un efecto inotrópico positivo (24,25).
Otro mecanismo citoprotector incluye mediadores antinflamatorios que resultan en la fosforilación de la enzima glucógeno sintasa kinasa beta (GSK-ß) y en la inhibición de los poros de transición mitocondrial (26). Se postula que este mecanismo atenúa el daño por reperfusión, lo cual se demostró en modelos animales experimentales con bupivacaina (26).
Aunque se esbozan otros mecanismos, como un efecto directo en las ATPasas de la célula miocárdica, influencia en canales iónicos y el estímulo de receptores adrenérgicos, hasta el momento no han sido estudiados en detalle como los anteriores y su impacto clínico es incierto (27).
EVIDENCIA CIENTÍFICA Y SEGURIDAD QUE APOYAN EL USO DE EMULSIONES LIPÍDICAS
En el momento hay una gran iniciativa mundial por reportar todos los casos donde se haya o no logrado una reanimación exitosa de cualquier tipo de intoxicación con el uso de emulsiones lipídicas. Ejemplo de ello es la página de internet http://www.lipidrescue.org/ creada por el Dr. Weinberg con el ánimo de hacer una recolección de casos lo suficientemente grande para tener la evidencia necesaria que apoye a futuro recomendaciones más fuertes y posibiliten mejores estudios (28).
En la revisión de la literatura, es este autor uno de los que más escribe sobre el tema en sus artículos, hace énfasis en la utilidad de las emulsiones lipídicas, principalmente en el escenario de la toxicidad sistémica por anestésicos locales cuando otras alternativas han fallado. Los mecanismos por los cuales el autor expone las emulsiones lipídicas han mostrado utilidad en reportes de casos y modelos experimentales son: efecto de inmersión lipídica, efectos mitocondriales y con respecto a la toxicidad especifica por bupivacaina se plantea un efecto llamado por el autor lipid flux, que consiste en la capacidad de las emulsiones de permitir la recuperación de la carnitin-acilcarnitin translocasa mejorando el metabolismo de los miocardiocitos (28-32).
En todas sus publicaciones Weinberg evidencia la dificultad y necesidad de diseñar e implementar estudios aleatorizados en seres humanos.
Partiendo de este hecho, es importante señalar que, como en la mayoría de casos en toxicología, encontrar un buen grado de recomendación y evidencia es difícil, por tanto se hace necesario considerar reportes de caso y estudios en animales (28-31).
Vale la pena resaltar el registro LIPAEMIC que rastrea casos entre el 2009 y 2012 sobre el uso de emulsiones lipídicas en intoxicados. En el mismo se encontraron 48 usos en los 61 centros que participaron; los 10 casos reportados de toxicidad por anestésicos locales fueron exitosos reportando mejoría, en otras intoxicaciones como bloqueadores de canales calcio, inhibidores de enzima convertidora de angiotensina, antidepresivos tricíclicos, beta-bloqueadores, entre otras, el estudio describe mejoría en la escala de coma de Glasgow y en las cifras de presión arterial posterior a la administración de lípidos. Y dentro de los eventos adversos se encontró hiperamilasemia y broncoespasmo. La principal deficiencia del estudio fue el monitoreo de los niveles de las diferentes sustancias (32).
Con respecto a los efectos adversos asociados se han descrito una gran variedad de efectos relacionados a la infusión de lípidos. Los más comunes se dividen en propios de la emulsión o por la manipulación de la mezcla (33). Dejando de lado la posible contaminación que se puede presentar durante la preparación de las emulsiones cuando se usan como nutrición parenteral, los efectos secundarios tienden a ser menores al 1 % e incluyen principalmente reacciones como fiebre escalofrío, náusea, cefalea, dolor de espalda, dolor torácico, disnea y en algunos casos cianosis (33).
La dosis de lípidos para nutrición parenteral en adultos es hasta de 3 g/kg/día, infundidos en tres a seis horas y en niños de 0,4 a 4 g/kg/día para 24 horas (34). Las dosis usadas para tratamiento con terapia lipídica están por encima de las dosis habituales y cobran importancia el riesgo de sobrecarga de lípidos (35). Esta complicación cursa con fiebre, ictericia, hepatomegalia, esplenomegalia, dificultad respiratoria y hemorragia espontánea; también puede cursar con leucopenia, trombocitopenia, hipofibrinogenemia y coagulopatía que pueden llevar a la muerte (34,36). Estas complicaciones se observan cuando se administran dosis superiores a la capacidad metabólica del individuo (34-36).
Por otro lado, en algunos casos se evidencia que se administran rutinariamente dosis superiores a las regularmente establecidas para la práctica clínica, sin tener efectos adversos, por lo cual la cantidad no parecería ser problema (34).
En cuanto a la velocidad, infusiones superiores a 0,5 ml/kg/h de una infusión lipídica al 20 % se han asociado a síndrome de sobrecarga lipídica (35). Al respecto existe al menos un estudio realizado con ratas que demostró que una infusión rápida -a las dosis recomendadas para la infusión en los pacientes intoxicados- no terminaba en daño histológicamente comprobado en cerebro, páncreas, riñón o corazón (35).
Ha sido reportada hiperamilasemia, inclusive llevando a complicaciones como pancreatitis, pero se debe recordar que la elevación de amilasas en paciente críticos es multifactorial (37-38). Considerando lo anterior es importante la medición de amilasas y lipasas en los dos primeros días luego del uso de lípidos, tal como lo recomiendan algunas guías.
En lo referente a la población pediátrica hay reportes de casos que muestran efectividad y en general buena tolerancia a la terapia, teniendo en cuenta que por su metabolismo son más propensos a desarrollar el síndrome de sobrecarga lipídica y complicaciones respiratorias severas, en especial los recién nacidos prematuros (39-41).
La evidencia en pacientes gestantes se reduce a un reporte de caso en el que una joven de 18 años con embarazo a término presentó signos de intoxicación justo después de aplicársele un bloqueo regional con bupivacaína, y quien retornó luego a circulación espontanea con terapia lipídica (42). Por lo tanto, si el beneficio supera el riesgo, como es generalmente el caso cuando una paciente amerita esta terapia, podría usarse con los mismos esquemas (42).
Una serie de nueve casos de intoxicaciones por diferentes xenobióticos en pacientes con colapso circulatorio, reporta un porcentaje de sobrevida del 55 %, asociada al uso de emulsiones lipídicas, aunque también describe aparición de eventos adversos de gravedad variable como daño renal o pulmonar, trombosis venosa profunda, amputación digital e hiperlipidemia (19).
CONTROVERSIAS EN LA REANIMACIÓN CON LÍPIDOS
La hipoxia y la acidosis disminuyen el efecto de las emulsiones lipídicas en la intoxicación por bupivacaína (43). Considerando lo anterior, no hay duda que una ventilación y un masaje cardiaco óptimo deben estar presentes antes de iniciar la terapia lipídica (43).
La adrenalina es parte fundamental del protocolo de reanimación y su interacción con la terapia lipídica es una de las grandes preguntas aun sin responder (30,44). La polémica parte de estudios realizados en animales, donde la vasopresina, adrenalina y la terapia de emulsión lipídica fueron comparadas en modelos de ratas intoxicadas con bupivacaína. Si bien es cierto en la gran mayoría se evidenció superioridad de los lípidos sobre los medicamentos vasoconstrictores como terapia de resucitación, en uno de los trabajos el resultado fue mejor con adrenalina y vasopresina que con lípidos (30,45-47).
Este último modelo cuenta con una peculiaridad y es que los animales eran sometidos, además de la bupivacaína, a hipoxia, hasta entrar en paro cardiorrespiratorio, para entonces comenzar a reanimarlos con uno u otro medicamento, pues este era el objetivo de los autores con el ánimo de recrear situaciones de la vida real (47,48).
Entendiendo que la asfixia, la acidosis y la administración de altas dosis de adrenalina, impiden el funcionamiento apropiado de la terapia lipídica (30,43,46,49,) queda la inquietud de si el modelo usado en la investigación era el apropiado para desvirtuar los estudios en ratas, o si por el contrario ratifica la necesidad de usar las emulsiones lipídicas antes de acumular altas dosis de adrenalina y acidosis por hipo perfusión (30, 43,46,49). Finalmente, los consensos orientan hacia el uso temprano de los lípidos y abstenerse de usar vasopresina (29,31).
El mejor compuesto lipídico para terapia permanece siendo un misterio (44). Hasta la fecha intralipid® es el más usado en investigación y en la práctica clínica (10). Sin embargo, hay estudios realizados donde el cambio de la composición de las emulsiones mostró resultados a favor de otras preparaciones experimentales de emulsiones lipídicas (50,51).
Si bien es cierto la mayoría de reportes han sido realizados con intralipid®, es posible considerar el uso de otras infusiones lipídicas con una concentración del 20 % lo cual cobra importancia en nuestro medio donde se cuenta con otras marcas diferentes a intralipid® (49-51).
Una característica de varios modelos animales es la comparación de terapia lipídica contra el placebo y no contra manejos específicos para la intoxicación, lo cual genera polémica y disminuye la aplicabilidad de los resultados generales en humanos. Pero es muy importante recordar que estos escenarios de laboratorio difieren de la mayoría de reportes de casos en humanos, en los que se ha utilizado la terapia lipídica cuando la primera y hasta segunda línea de manejo han fracasado (52).
EMPLEO DE LAS EMULSIONES
En un estudio de las recomendaciones que se están dando en Estados Unidos por los directores de los centros de control de información toxicológica, se reporta que 67 % de los centros que respondieron la encuesta del estudio, tienen un protocolo para el uso de emulsiones lipídicas en casos de sobredosis agudas (53). En casos de intoxicación aguda por un solo fármaco como bupivacaína, verapamilo, amitriptilina o un xenobiótico desconocido que curse con paro cardíaco, 96 % de los directores recomendó la terapia lipídica para bupivacaína, 80 % para verapamilo, 69 % amitriptilina y 27 % otro xenobiótico (53).
En el escenario de colapso circulatorio por un solo xenobiótico recomendaron la terapia en un 89 % de los casos, si este fuese por bupivacaína, 62 % de los casos por verapamilo, 56 % para amitriptilina y 18 % para otros xenobióticos. Adicionalmente, el estudio concluye que la mayoría de directores encuestados considera segura la terapia lipídica, pero que la recomiendan para pacientes en paro cardíaco o compromiso hemodinámico severo (53).
El Colegio Americano de Toxicología Médica plantea que no hay criterios que indican o contraindican el uso de las emulsiones lipídicas y el momento de iniciarlas queda a discreción del médico tratante. En pacientes hemodinámicamente inestables o con convulsiones intratables por un xenobiótico altamente liposoluble, la terapia con lípidos es una opción razonable así el paciente no se encuentre en paro cardiorrespiratorio (54). Para ello se propone el siguiente esquema:
1. Iniciar la emulsión lipídica al 20 % a 1,5 ml/kg en dos a tres minutos.
2. El bolo se puede repetir si el paciente no retorna a circulación espontanea.
3. Continuar una infusión a 0,25 ml/kg/ min en bomba de infusión por una hora.
4. En caso de inestabilidad, la cantidad de infusión podría aumentarse o inclusive repetirse el bolo.
5. La infusión debe dejarse por una hora, a no ser que la estabilidad hemodinámica del paciente dependa de ella (figura 1).
Dentro de la lista de chequeo de toxicidad sistemática asociada anestésicos locales la Sociedad Americana de Anestesia Regional y Medicina del Dolor (ASRA, por sus siglas en inglés), en su versión del 2012, propone la utilización de benzodiacepinas para el manejo de las convulsiones, evitando la utilización de vasopresina, bloqueadores de canales de calcio y betabloqueadores, disminuir la dosis de epinefrina a menos de 1mcg/kg. La dosis de la emulsion lipídica es igual a la planteada por el Colegio Americano de Toxicología pero resalta el hecho de no superar 10ml/ kg en los primeros 30 minutos (55,56).
No sobra aclarar que si bien el propofol contiene un 10 % de vehículo lipídico, la dosis necesaria para el aporte adecuado del lípido llevaría a una sobredosis de propofol, cuyos efectosseguramente llevarían a mayor deterioro del paciente (54,57)
Las contraindicaciones absolutas al medicamento son alergia al huevo, soja y maní, principalmente, así como síndrome hemofagocítico. Debe usarse con precaución en pacientes con trastornos del metabolismo de los lípidos, enfermedad hepática, pulmonar y sobrecarga de volumen (11,54).
CONCLUSIONES
Desde el 2006 está aprobado el uso de emulsiones lipídicas en el manejo de la toxicidad sistémica asociada a anestésicos locales (específicamente bupivacaina) gracias a diferentes mecanismos de acción, dentro de los cuales se destacan los efectos lipid sink, lipid flux y los efectos mitocondriales (31). La comprensión de estos mecanismos han llevado a utilizar las emulsiones lipídicas en otros escenarios de toxicología. Continua siendo una decisión del médico tratante el iniciarlas, sopesando el riesgo sobre el beneficio y como medida adicional a las maniobras de resucitación y antídotos propios del tóxico en caso de disponerse del mismo.
Como falta evidencia y estudios mejor diseñados no hay forma de asegurar el éxito de la terapia lipídica ni las consecuencias, es por esto que hasta la fecha no deben remplazar tratamientos que el médico considere apropiados.
CONFLICTOS DE INTERESES
Los autores no manifestamos ningún conflicto de interés o algún tipo de patrocinio o financiación. El objetivo de la presente publicación es solo académico.
Limitaciones
Esta revisión busca aportar aspectos básicos sobre las emulsiones lipídicas y su utilidad en intoxicaciones, sabiendo que solo se revisaron tres bases de datos, que hay escasez de la información en castellano y que la mayoría de la información en inglés hace alusión a la utilidad en anestésicos locales. Faltan estudios de mejor calidad en cuanto al uso de las emulsiones en intoxicaciones por otros medicamentos; también continua siendo una decisión del médico tratante el iniciarlas, sopesando el riesgo sobre el beneficio y como medida adicional a las maniobras de resucitación y antídotos propios del tóxico en caso de disponerse del mismo y no es posible recomendarlas como primera línea de manejo
REFERENCIAS
1. Albright GA. Cardiac arrest following regional anesthesia with etidocaineor bupivacaine. Anesthesiology. 1979; 51:285-287. [ Links ]
2. Weinberg GL, Laurito CE, Geldner P, Pygon BH, Burton BK. Malignant ventricular dysrhythmias in a patient with isovaleric acidemia receiving general and local anesthesia for suction lipectomy. J Clin Anesth. 1997; 9:668-670. [ Links ]
3. Weinberg GL, Palmer JW, VadeBoncouer TR, Zuechner MB, Edelman G,Hoppel CL. Bupivacaine inhibits acylcarnitine exchange in cardiac mitochondria. Anesthesiology. 2000; 92:523-528. [ Links ]
4. Weinberg GL, VadeBoncouer T, Ramaraju GA, Garcia-Amaro MF, Cwik MJ. Pretreatment or resuscitation with a lipid infusion shifts the dose response to bupivacaine-induced asystole in rats. Anesthesiology. 1998; 88:1071-1075. [ Links ]
5. Weinberg G, Ripper R, Feinstein DL, Hoffman W. Lipid emulsion infusion rescues dogs from bupivacaine-induced cardiac toxicity. Reg Anesth Pain Med. 2003; 28:198-202. [ Links ]
6. Rosenblatt MA, Abel M, Fischer GW, Itzkovich CJ, EisenkraftJB. Successful use of a 20 % lipid emulsion to resuscitate a patient after a presumed bupivacaine-related cardiac arrest. Anesthesiology. 2006; 105:217- 8. [ Links ]
7. McCutchen T, Gerancher JC: Early intralipid therapy may have prevented bupivacaineassociated cardiac arrest. Reg Anesth Pain Med. 2008; 33.178- 80. [ Links ]
8. Sirianni AJ, Osterhoudt KC, Calello DP, Mueller AA, Waterhouse MR, Goodkin MB, et al. Use of lipid emulsion in the resuscitation of a patient with prolonged cardiovascular collapse after overdose of bupropion and lamotrigine. Ann Emerg Med. 2008; 51:412-415. [ Links ]
9. Hamann P, Dargan PI, Parbat N, Ovaska H, Wood DM. Availability of and use of Intralipid (lipid rescue therapy, lipid emulsion) in England and Wales. Emerg Med J. 2010; 27(8):590-2 [ Links ]
10. Litonius E. Treatment of acute intoxication with intravenous lipid emulsion, animal and human studies. Doctoral dissertation. University of Helsinki, Faculty of Medicine, Institute of Clinical Medicine, Anaesthesia and Intensive Care. Department of Clinical Pharmacology. 2012- 08-31. Helsinsky. Finland. URL: http://urn.fi/URN:ISBN:978-952-10-8168-2 Acceso en julio 02 de 2013. [ Links ]
11. Ministerio de Sanidad, Política Social e Igualdad. Agencia española de Medicamentos y Productos Sanitarios. Ficha técnica Intralipid 200. Hallado enhttp://www.aemps.gob.es/cima/especialidad.do?metodo=verFichaWordPdf&codigo=43165&formato=pdf&formulario=FICHAS&file=ficha.pd. Acceso en agosto 2013. [ Links ]
12. Xavier M de Ao. Servei de Farmacia. Emulsiones lipídicas en nutrición parenteral. Hospital del Mar. Consorci Parc Mar de Salut. Barcelona. http://www.fresenius-kabi.es/aula/nutrinfo.asp?id=14 Acceso 3 de julio 2013. [ Links ]
13. Lain LO, Buxton; Benet L. Pharmacokinetics: the dynamics of drug absorption, distribution, metabolism, and elimination. In: Brunton LL, ed. Goodman and Gilman's the Pharmacological Basis of Therapeutics. 12th ed. New York, NY: McGraw-Hill; 2010: chap 2. [ Links ]
14. French D, Smollin C, Rua W, Wong A, Drasner K, Wu A. Partition constant and volume of distribution as predictors of clinical efficacy of lipid rescue for toxicological emergencies. Clinical Toxicology. 2011; 49:801-809. [ Links ]
15. Weinberg GL, Ripper R, Murphy P, Edelman LB, Hoffman W, Strichartz G, DL. Lipid infusion accelerates removal of bupivacaine and recovery from bupivacaine toxicity in the isolated rat heart. Reg Anesth Pain Med. 2006; 31:296-303. [ Links ]
16. Arora NP, Berk WA, Aaron CK, Williams KA. Usefulness of intravenous lipid emulsion for cardiac toxicity from cocaine overdose.Am J Cardiol. 2013; 111(3):445-7. [ Links ]
17. Cave G, Harvey M, Quinn P, Heys D. Hypertonic sodium bicarbonate versus intravenous lipid emulsion in a rabbit model of intravenous flecainide toxicity: no difference, no sink. Clin Toxicol (Philad). 2013; 51(5):394-7. [ Links ]
18. F. Taftachi, H. Sanaei-Zadeh, B. Sepherian, N. Zamani. Lipid emulsion improves Glasgow Coma Scale and decreases blood glucose level in the setting of acute non-local anestheticdrug poisoning: A randomized controlled trial. Eur Rev Med Pharmacol Sci. 2012; 16(Suppl 1): 38-42. [ Links ]
19. Geib AJ, Liebelt E, Manini AF Clinical experience with intravenous lipid emulsion for drug induced cardiovascular collapse: On behalf of the Toxicology Investigators' Consortium. J Med Toxicol. 2012; 8:10-14. [ Links ]
20. Mehmet S. Ozcan, Guy Weinberg. Update on the use of lipid emulsions in local anesthetic systemic toxicity: a focus on differential efficacy and lipid emulsion as part of advanced cardiac life support. Int Anesthesiol Clinics. 2011; 49(4):91-103. [ Links ]
21. Kuo I, Akpa BS. Validity of the lipid sink as a mechanism for the reversal of local anesthetic systemic toxicity a physiologically based pharmacokinetic model study. Anesthesiology. 2013; 118(6):1350-61. [ Links ]
22. Wolfe JW, Butterworth JF. Local anesthetic systemic toxicity: update on mechanisms and treatment. Curr Opin Anaesthesiol. 2011 Oct;24(5):561-6. [ Links ]
23. Litonius E, Tarkkila P, Neuvonen PJ, Rosenberg PH. Effect of intravenous lipid emulsion on bupivacaine plasma concentration in humans. Anaesthesia. 2012 Jun;67(6):600-5. [ Links ]
24. Partownavid P, Umar S, Li J, Rahman S, Eghbali M. Fatty acid oxidation and calcium homeostasis are involved in the rescue of bupivacaine induced cardiotoxicity by lipid emulsionin rats. Crit Care Med. 2012; 40: 2431-2437. [ Links ]
25. Rahman S, Eghbali M, Huang JM, Xian H, Bacaner M. Long-chain fatty acids activate calcium channels in ventricular myocytes. Proc Natl Acad Sci .USA 1992; 89:6452-6456. [ Links ]
26. Rahman S, Li J, Bopassa JC, Umar S, Iorga A, Partonawid P, Eghbali M. Phosphorylation of GSK-3ß mediates intralipid-induced cardioprotection against ischemia/ reperfusion injury. Anesthesiology. 2011; 115:242-253. [ Links ]
27. Nogué S, Corominas N, Soy D, Cino J. Intravenous lipid emulsion: A new antidote for use in resuscitation. Emergencias. 2011; 23: 378-385. [ Links ]
28. Weinberg G, Warren L. Lipid resuscitation: listening to our patients and learning from our models. Anesthesia-Analgesia 2012 Apr; 114(4):710-2. [ Links ]
29. Rothschild L, Bern S, Oswald S, Weinberg G. Intravenous lipid emulsion in clinical toxicology. Scandinavian J Trauma Resusc Emerg Med. 2010; 18: 51. [ Links ]
30. Weinberg G, Suresh S. Local anesthetic systemic toxicity and animal models for rescue paradigms: can pigs fly? Paediatr Anaesth. 2012 Feb; 22(2):121-3 [ Links ]
31. Killoran PV, Cattano D. From bedside to bench and back: perfecting lipid emulsion therapy for local anesthetic toxicity. Anesthesiology. 2011 Dec; 115(6):1151-2 [ Links ]
32. Cave G1, Harvey M, Willers J, Uncles D, Meek T, Picard J, Weinberg G. LIPAEMIC Report: results of clinical use of intravenous lipid emulsion in drug toxicity reported to an online lipid registry. J Med Toxicol. 2014 Jan 11 [ Links ]
33. Turner-Lawrence D, Kerns II D. Intravenous Fat Emulsion: A Potential Novel Antidote. J Medical Toxicol 2008; 4(2): 109-14008 Jun; 4(2):109-14. [ Links ]
34. Hojsak I, Kolacek S. Fat Overload syndrome after the rapid infusion of SMOFlipid Emulsion. J Parenter Enteral Nutr. 2014; 38(1):119-21. [ Links ]
35. Hiller DB, Di gregorio G, Kelly K, Ripper R, Edelman L, Boumendjel L, Boumendjel R, et al. Safety of high volume lipid emulsion infusion: A first approximation of LD50 in rats. Reg Anesth Pain Med. 2010; 35(2):140-4. [ Links ]
36. Ma J, Wang Y, Zhao S, Meng Q, Qian Y. Fever of unknoun origin in an elderly adult with lipid overload syndrome. J Am Geriatr Soc. 2012; 60(5):984-5. [ Links ]
37. Weinberg G. Hyperamylasemia following lipid resuscitation: pancreas or parotid? Anesthesia-analgesia. September 2012 Sep; 115(3):739. [ Links ]
38. Weinberg G. Limits to lipid in the literature and lab: what we know, what we don't know. Anesth Analg 2009; 108(4):1062-4. [ Links ]
39. Presley J, Chyka P. Intravenous lipid emulsion to reverse acute drug toxicity in pediatric patients. Ann Pharmacother 2013; 47:735- 743. [ Links ]
40. Levene MI, Wiggelsworth JS, Desai R. Pulmonary fat accumulation after intralipid infusion in the preterm infant. Lancet. 1980; 2(8199):815-8. [ Links ]
41. American Academy of Pediatrics. Use of intravenous fat emulsion in pediatric patients. Pediatrics. 1981; 68:(5):738-43. [ Links ]
42. Bern S, Weinberg G. Local anesthetic toxicity and lipid resuscitation in pregnancy. Curr Opin Anesthesiol. 2011; 24:262-267. [ Links ]
43. Weinberg G, Di Gregorio G, Ripper R, Kelly K, Massad M, Edelman L, et al. Resuscitation with lipid versus epinephrine in a rat model of bupivacaine overdose. Anesthesiology. 2008; 08:907-13. [ Links ]
44. Weinberg. Lipid emulsion infusion resuscitation for local anesthetic and other drug overdose. Anesthesiology. 2012; 117:180-7. [ Links ]
45. Di Gregorio G, Schwartz D, Ripper R, Kelly K, Feinstein D, Minshall R, et al. Lipid emulsion is superior to vasopressin in a rodent model of resuscitation from toxin-induced cardiac arrest. Crit Care Med. 2009; 37(3):993-9. [ Links ]
46. Hiller, Di Gregorio G, Ripper R, Kelly K, Massad M, Edelman L, et al. Epinephrine impairs lipid resuscitation from bupivacaine overdose a threshold effect. Anesthesiology. 2009; 111:498-505. [ Links ]
47. Mayr VD, Mitterschiffthaler L, Neurauter A, Gritsch C, Wenzel V, Müller T, et al. A comparison of the combination of epinephrine and vasopressin with lipid emulsion in a porcine model of asphyxial cardiac arrest after intravenous injection of bupivacaine. Anesth Analg. 2008; 106:1566 -71. [ Links ]
48. Hicks SD, Salcido DD, Logue ES, Suffoletto BP, Empey PE, Poloyac SM, et al. Lipid emulsion combined with epinephrine and vasopressin don't improve survival in a swine model of bupivacaine-induced cardiac arrest. Anesthesiology 2009; 111:138-46. [ Links ]
49. Harvey M, Cave G, Kazemi A. Intralipid infusion diminishes return of spontaneous circulation after hypoxic cardiac arrest in rabbits. Anesth Analg. 2009; 108:1163- 8. [ Links ]
50. Li Z, Xia Y, Dong X, Chen H, Xia F, Wang X, et al. Lipid resuscitation of bupivacaine toxicity: Long-chain triglyceride emulsion provides benefits over long- and medium-chain triglyceride emulsion. Anesthesiology. 2011; 115:1219-28. [ Links ]
51. Lokajova J, Holopainen JM, Wiedemr SK. Comparison of lipid sinks in sequestering common intoxicating drugs. J Sep Sci. 2012; 35(22):3106-12. [ Links ]
52. Cave G, Harvey M, Graudins A. Review article: Intravenous lipid emulsion as antidote: A summary of published human Experience. Emerg Med Australas. 2011; 23: 123-141. [ Links ]
53. Christian MR, Pallash EM, Wahl M, Mycyk MB. Lipid Rescue 911: Are poison centers recommending intravenous fat emulsion therapy for severe poisoning? J Med Toxicol 2013; 9(3):231-4. [ Links ]
54. ACMT Position statement: interim guidance for the use of lipid resuscitation therapy American College of Medical Toxicology. J Med Toxicol. 2011; 7:81-82 [ Links ]
55. Neal J, Bernards C, Butterworth J, Di Gregorio G, Drasner K, Hejtmanek M, et al. ASRA practice advisory on local anesthetic systemic toxicity. Reg Anesth Pain Med 2010; 35(2):152-612. [ Links ]
56. Neal JM1, Mulroy MF, Weinberg GL; American Society of Regional Anesthesia and Pain Medicine. American Society of Regional Anesthesia and Pain Medicine checklist for managing local anesthetic systemic toxicity: 2012 version. Reg Anesth Pain Med. 2012 Jan-Feb;37(1):16-8 [ Links ]
57. KC Lui, YF Chow. Safe use of local anaesthetics: prevention and management of systemic toxicity. Hong Kong Med J. 2010; 16:470-5. [ Links ]
Recibido en: agosto 7 de 2013. Revisado en: marzo 15 de 2014. Aceptado en: abril 21 de 2014.