Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina
Print version ISSN 0120-8705
CES Med. vol.28 no.1 Medellín Jan./June 2014
Revisión de tema
Toxicidad sistémica por anestésicos locales
Systemic toxicity by local anesthetics
JULIÁN ESTEBAN QUINTANA-PUERTA1, VALENTINA CIFUENTES-HOYOS2
1Anestesiológo HPTU y Clínica Las Américas.
2Residente de Anestesiología Universidad CES.
RESUMEN
Los anestésicos locales son medicamentos de uso generalizado y, aunque se consideran seguros, ocasionalmente pueden producir toxicidad con alteración del sistema nervioso central y cardiovascular y potencial compromiso de la vida. La prevención parece haber disminuido la toxicidad de los anestésicos locales y es más efectiva que el tratamiento. El manejo de la toxicidad sistémica por anestésicos locales se basa en medidas de reanimación y soporte, aunque las emulsiones lipídicas emergen como antídoto efectivo. El objetivo de este artículo es revisar las medidas disponibles según la evidencia actual, consistentes en soporte cardiopulmonar, manejo de convulsiones y uso de antídoto (emulsiones lipídicas)*.
PALABRAS CLAVEAnestésicos locales,Toxicidad de medicamentos, Emulsiones grasas intravenosas.
ABSTRACT
Toothpastes use for caries prevention are considered the most effective preventive strategy, although it is necessary to implement appropriate protocols based on individual risk, severity and age of the child, in order to prevent irreversible side effects. The purpose of this study was to evaluate the remineralizing effects on white spot lesions of fluoridated toothpastes.
KEY WORDS
Clinical trial, Fluoride, Remineralization, Toothpaste, White spot lesion.
INTRODUCCIÓN
Los anestésicos locales cambiaron la Medicina cuando fueron introducidos en el siglo XIX. El primer anestésico local, la cocaína, hoy se usa poco debido a sus múltiples efectos adversos y sus modernos sucesores se consideran, en general, efectivos y seguros (1). Probablemente los especialistas que más utilicen anestésicos locales (en frecuencia y en volumen) sean los anestesiólogos; aunque su uso es generalizado entre las diversas especialidades médicas.
El riesgo de toxicidad sistémica por anestésicos locales sigue siendo real, y los reportes son múltiples (2). Esta es una revisión narrativa para difundir el estado del arte de la prevención y el tratamiento de esta complicación, potencialmente mortal. No se revisan aquí los temas de miotoxicidad o de daño nervioso que se producen con la inyección de un anestésico local intramuscular o intraneural.
EPIDEMIOLOGÍA
No se conoce con exactitud la incidencia de la toxicidad sistémica por anestésicos locales. En diferentes estudios, los resultados han sido variables: la tasa va desde 0,1/1 000 hasta 6,9/1 000, según el procedimiento anestésico revisado (2). En una revisión de casos se encontró que la técnica anestésica más comúnmente asociada con la toxicidad por anestésicos locales fue la epidural (33 %), seguida por el bloqueo axilar (17 %) y el bloqueo interescalénico (13 %) (3). Aunque en general la incidencia es baja con todos los anestésicos locales, la bupivacaína es la de mayor tasa de complicaciones (4).
PREVENCIÓN
La toxicidad se puede presentar por; inyección intravascular, absorción del anestésico en un tejido, acumulación de metabolitos activos o una combinación de todos (3). El paciente que reciba anestésicos locales en dosis potencialmente tóxicas debe tener monitoría continua de signos vitales y acceso venoso permeable.
Se recomienda la aspiración de agujas y catéteres antes de la infiltración de los anestésicos locales, pero puede fallar en la identificación de una inyección intravascular en por lo menos 2 % de las ocasiones; por eso no debe ser la técnica única y se debe combinar con otras técnicas, como la prueba de epinefrina, propuesta por Moore y Batra en 1981 (2).
La adición de epinefrina al anestésico local ayuda a evidenciar de manera temprana la inyección intravascular y además disminuye la absorción del anestésico local, prolongando la acción anestésica e incrementando la intensidad del bloqueo (en especial aquellos anestésicos menos lipofílicos, como la lidocaína).
La adición de 10 a 15 mcg de epinefrina tiene una sensibilidad del 80 % para la detección de la inyección intravascular en adultos: si la frecuencia cardíaca incrementa por lo menos 10 latidos por minuto, o se presenta un incremento en la presión arterial sistólica de 15 mm Hg o más; en niños, la epinefrina intravascular a dosis de 0,5 mcg/kg se asocia con un incremento de 15 mm Hg en la presión arterial sistólica (5). El test de epinefrina es poco confiable en pacientes de edad avanzada, pacientes sedados, que estén tomando betabloqueadores, o bajo anestesia general o neuroaxial (6).
La adición de epinefrina tiene riesgos en los pacientes con angina, hipertensión no controlada, arritmias cardíacas, insuficiencia útero-placentaria y en pacientes que estén en tratamiento con inhibidores de las mono-amino-oxidasas (7); sin embargo, no hay evidencia suficiente para contraindicar el uso de epinefrina en pacientes hipertensos. También es relevante el sitio de aplicación: se encontró que al aplicar 5 mcg/ml de epinefrina (1:200 000) disminuye aproximadamente un 50 %, la concentración plasmática pico de la lidocaína después de una infiltración subcutánea; mientras que después de un bloqueo intercostal, una epidural o un bloqueo del plexo braquial la disminución es sólo de un 20 a 30 % (4).
Tradicionalmente se han usado altos volúmenes de anestésico local para la realización de bloqueos, que con la aparición de la ecografía han demostrado ser mucho mayores a los que se requiere para obtener anestesia (8). Una de las supuestas ventajas de la anestesia regional guiada por ecografía es la disminución de la dosis de anestésico local, con lo que se podría disminuir el riesgo de toxicidad (9).
La guía ecográfica de un bloqueo puede reducir la frecuencia de inyecciones vasculares, pero no hay ensayos clínicos que confirmen o refuten la reducción de la toxicidad por anestésicos locales; además, algunos reportes de caso han descrito la inyección intravascular sintomática a pesar del uso de la ecografía. De igual manera, la reducción de volumen podría reducir también la duración de la analgesia para el paciente (10,11).
Así, dentro de ciertos límites, la reducción de la dosis con el uso de guía ecográfica puede ser importante para los pacientes con mayor riesgo de sufrir toxicidad por anestésicos locales (esto es, en los extremos de la vida -menores de cuatro meses o mayores de 70 años-, desnutridos, pacientes con hepatopatías, pacientes con defectos en la conducción cardíaca o historia de enfermedad cardíaca isquémica) (4,12).
La velocidad con la cual el anestésico local es absorbido hacia la circulación es directamente proporcional al flujo sanguíneo del tejido donde se inyecta, e inversamente proporcional a la liposolubilidad y a la unión a proteínas del medicamento (4). También afectan el nivel plasmático del anestésico local, el sitio de bloqueo, la vasoactividad intrínseca de los anestésicos locales (específicamente, la ropivacaína tiene efecto vasoconstrictor), el uso de epinefrina y factores relacionados con el paciente como disfunción cardíaca, renal, y hepática; son de menor importancia el peso y el índice de masa corporal (2).
Concentraciones plasmáticas similares de lidocaína se alcanzan después de la inyección de 300 mg en un bloqueo de nervio intercostal, 500 mg en una epidural, 600 mg en un bloqueo de plexo braquial, o 1 000 mg, en una infiltración subcutánea en miembros inferiores (4).
En Estados Unidos las dosis máximas recomendadas para la bupivacaína sin epinefrina es de 175 mg y con epinefrina, 225 mg; para la levobupivacaína sin epinefrina 150 mg y con epinefrina no hay dosis recomendadas; y para la lidocaína sin epinefrina 300 mg y con epinefrina sube hasta 500 mg. Estas dosis máximas recomendadas varían entre países y no se basan en estudios clínicos, sino en extrapolación de in-vestigación en animales (4).
Se recomienda que la dosis sea individualizada en cada paciente, usando la dosis más baja efectiva posible y que la inyección del anestésico local sea fraccionada, administrando 3 a 5 ml con aspiración entre ellas para evidenciar inyección intravascular, teniendo pausas de 30 a 45 segundos entre dosis, para evidenciar posibles síntomas (4).
Hace algunos años se introdujeron ciertos anestésicos locales con modificaciones químicas que buscaban hacerlos menos tóxicos; se trata de estereoisómeros de la bupivacaína, como la ropivacaína y la levobupivacaína (3). No han eliminado por completo el riesgo, por lo que se tienen que seguir teniendo en cuenta las demás recomendaciones; sin embargo, sí son menos tóxicas, por lo que se debe considerar su uso, especialmente en los pacientes con mayor riesgo (2,6).
MANIFESTACIONES CLÍNICAS
La toxicidad sistémica por anestésicos locales tiene un amplio espectro de manifestaciones, que van desde síntomas prodrómicos (tinitus, agitación, sabor metálico, disartria, adormecimiento perioral, confusión, obnubilación y mareo) hasta convulsiones, depresión del sistema nervioso central y coma, paro respiratorio, hipotensión, arritmias ventriculares y paro cardíaco (3).
Los síntomas del sistema nervioso central son la presentación clínica más común y se ha descrito que anteceden a la toxicidad cardiovascular. Sin embargo, no se presenta siempre el patrón de presentación que va progresando de síntomas del sistema nervioso central a manifestaciones cardiovasculares. Las presentaciones atípicas son más frecuentes cuando la aplicación del anestésico local se hace en pacientes bajo anestesia general o sedaciones profundas. De igual manera, se describen casos de pacientes con anestésicos locales más potentes (por ejemplo, la bupivacaína) en los que sus primeras manifestaciones son cardiovasculares (incluidos pacientes que debutan con paro cardiorrespiratorio) (13).
El mecanismo propuesto de las manifestaciones del sistema nervioso central es el bloqueo inicial de vías inhibitorias de la corteza cerebral produciendo la fase prodrómica excitatoria, pero un aumento de la dosis inhibe vías excitatorias y produce directamente los efectos depresores generalizados del sistema nervioso central. Es más probable que se generen convulsiones cuando hay mayor potencia del anestésico local. Todos los síntomas dependen de la concentración plasmática del anestésico, y si ésta es lo suficientemente alta, el paciente puede presentarse con depresión del sistema nervioso central (13).
El anestésico local produce disminución de la velocidad de despolarización en las fibras de Purkinje y en el miocito ventricular, disminuyendo la disponibilidad de canales de sodio y prolongando los períodos refractarios absoluto y relativo, lo que genera una prolongación del PR y del QRS, con depresión de las células marcapaso, que puede producir bradicardia sinusal y paro (7).
Los anestésicos locales también tienen un efecto inotrópico negativo dependiente de la dosis. Se puede presentar al inicio un período excitatorio produciéndose bigeminismo y trigeminismo, además de arritmias ventriculares por re-entrada; a bajas concentraciones producen vasoconstricción y a altas concentraciones vasodilatación periférica, generan importantes aumentos de la presión arterial pulmonar y de la resistencia vascular pulmonar. En resumen, el paciente puede presentar arritmias, bloqueos, hipotensión y asistolia (2,3,13).
Si la toxicidad sistémica se presenta luego de una inyección intravascular, en particular en las arterias vertebrales o carótidas (como podría suceder accidentalmente con un bloqueo de miembros superiores) no se presentan pródromos, sino que el paciente presenta convulsiones con las consecuentes taquicardia, hipertensión y arritmias; la excitación cardiovascular se continúa entonces con depresión cardíaca, bradicardia, disminución de la contractilidad e hipotensión (2).
El momento en que se presenta la toxicidad sistémica por anestésicos locales es variable: la presentación inmediata (menos de 60 segundos) sugiere la inyección intravascular del anestésico con acceso directo al cerebro, mientras que la presentación tardía (1 a 5 minutos) sugiere inyección intravascular parcial o intermitente, disminución en el tiempo de circulación o en la absorción de los tejidos. Debe recordarse que como la toxicidad por los anestésicos locales se puede presentar incluso después de 15 minutos de la inyección, los pacientes que reciben dosis potencialmente toxicas, deben ser monitorizados hasta 30 minutos después de su administración de estos (3).
TRATAMIENTO
Depende de la severidad y las manifestaciones presentes. Durante muchos años el manejo consistía en medidas de soporte, pero ahora contamos con lo que parece ser un antídoto adecuado: la infusión de lípidos intravenosos. Aunque la evidencia en el manejo de la toxicidad sistémica por anestésicos locales no es del más alto nivel, debido a los impedimentos éticos que aparecen en la investigación en toxicología y situaciones de emergencia, existen unas medidas que parecen ser efectivas.
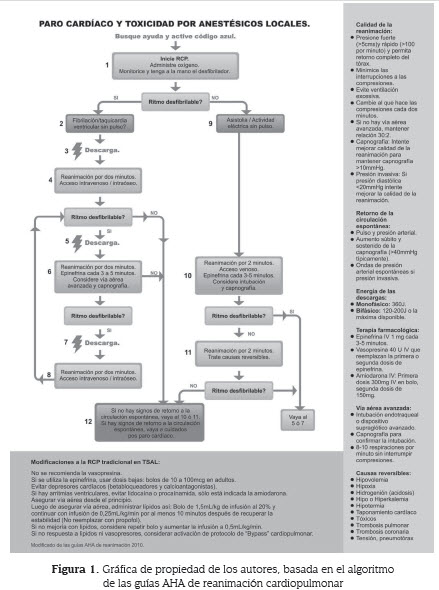
En el paro cardíaco, el algoritmo de reanimación cardiopulmonar de la Asociación Americana del Corazón (AHA, por sus siglas en inglés) sigue siendo el estándar, pero hay que tener en cuenta algunas modificaciones específicas para la situación (ver figura 1). Si las manifestaciones son menos severas, los principios de soporte y monitoría son útiles (2,13).
Con la aparición de cualquier síntoma debe pensarse de inmediato en el manejo de la vía aérea: se debe administrar oxígeno y evaluar la permeabilidad de la vía aérea, y si se considera que no está adecuadamente permeable, proceder a intubar al paciente (2). Esto contrasta con la recomendación actual de la American Heart Association (AHA, por sus siglas en inglés) en reanimación, donde la prioridad es la circulación, mientras que el manejo de la vía aérea es secundario (14); la razón es que la acidosis, la hipoxemia y la hipercapnia empeoran el pronóstico del paciente (2).
Si se identifica una arritmia esta debe manejarse, nuevamente, según las guías de la AHA, que plantean que en las taquicardias inestables se debe hacer cardioversión, en tanto que las estables recibirán manejo farmacológico; y si hay bradicardias, pensar en marcapasos transcutáneo o transvenoso y soporte con cronotrópicos positivos (adrenalina o dopamina) (14).
La presencia de síntomas cardiovasculares debe hacer pensar en el uso inmediato de emulsiones lipídicas (2). Los antiarrítmicos son la alternativa de soporte cuando no hay respuesta a las emulsiones o cuando no hay disponibilidad de las mismas. Debe recordarse que no se debe administrar lidocaína o calcio-antagonistas como antiarrítmicos y, si se requiere un antiarrítmico, la alternativa adecuada es la amiodarona (2,13).
Con los síntomas de toxicidad cardiovascular se deben tener en mente el uso de vasoactivos e inotrópicos como medidas de soporte, pero hay que tener en cuenta algunas consideraciones (13): si hay paro cardiorrespiratorio el uso de dosis altas de epinefrina empeora el pronóstico neurológico, por lo que la recomendación de la AHA de suministrar 1 mg de epinefrina cada 3 a 5 minutos, no aplica en esta situación (14), teniendo mejor respuesta con dosis entre 10 y 100 mcg en intervalos similares (15).
El uso de vasopresina también se ha asociado a peor desenlace funcional, en especial si se usa 2014conjuntamente con emulsiones lipídicas, pues impiden que la vasopresina tenga efecto vasopresor. La opción de la AHA de aplicar vasopresina 40 U, en remplazo de la primera o segunda dosis de epinefrina, tampoco se recomienda en este contexto (16).
En pacientes con paro cardiorrespiratorio por toxicidad sistémica por anestésicos locales, se han reportado casos de reanimaciones prolongadas con buen desenlace. El hecho de ser un paro presenciado por una causa potencialmente reversible hace que el pronóstico sea bueno si se utilizan las medidas adecuadas. En este sentido, en las instituciones en que haya disponibilidad de soporte cardiovascular extracorpóreo, se debe activar el equipo rápidamente si no hay respuesta a las medidas de reanimación iniciales y a la infusión de emulsiones lipídicas (2,13).
Aparte de las medidas de soporte ya mencionadas, el tratamiento de los síntomas neurológicos de toxicidad sistémica, es el uso de una benzodiacepina en dosis bajas (midazolam, 1 a 2 mg IV en adultos) (2). En ocasiones hay disponibilidad inmediata de un inductor (propofol o tiopental sódico) y se acepta que dosis bajas de ellos son alternativas aceptables, aunque se debe tener especial cuidado, por su efecto hipotensor, en los pacientes que están inestables (2).
En general, la infusión de emulsiones lipídicas se acepta en el manejo de la toxicidad sistémica por anestésicos locales con síntomas cardiovasculares; sin embargo, los pacientes con síntomas del sistema nervioso central que no responden a las medidas iniciales o que parecen ir empeorando progresivamente, también podrían ser tratados con estas (17). Una alternativa es el uso de relajantes, que aunque no eliminan las convulsiones, por lo menos evitan la contracción muscular sostenida y la acidosis metabólica secundaria a esta, que empeoran el pronóstico del paciente (17).
EMULSIONES LIPÍDICAS
En 1998, Weinberg hipotetizó que, dada la liposolubilidad de la bupivacaína, la infusión de lípidos podría ser un antídoto para la intoxicación por este anestésico local. Para ello probó su modelo en ratas anestesiadas (18) y posteriormente en perros (19). Los animales fueron intoxicados con bupivacaína y posteriormente todos aquellos que recibieron aceite de soya -componente de la nutrición parenteral total- retornaron a la circulación espontánea, mientras que ninguno de los animales que servían como controles y recibieron solución salina lo hizo (18-20).
Desde 2001 se han presentado reportes de caso de la exitosa aplicación clínica de lípidos en pacientes con toxicidad sistémica por anestésicos locales (20-22). Aunque hoy en día sólo tenemos evidencia de laboratorio y reportes de caso para recomendar la infusión de emulsiones lipídicas, es probable que nunca tengamos una evidencia superior, dadas las limitaciones éticas para elaborar estudios de intervención en situaciones de emergencia (2,24).
Se han propuesto múltiples mecanismos de acción para las emulsiones lipídicas, desde apertura de los canales de sodio hasta la reactivación del metabolismo mitocondrial de ácidos grasos, pero el más aceptado es el depósito lipídico (en inglés, lipid sink), en el cual la emulsión grasa captura el anestésico local (que es liposoluble), disminuyendo las concentraciones libres y favoreciendo la difusión desde el sitio de acción (25-34).
Las emulsiones que están estudiadas en toxicidad son las que contienen lípidos de cadena larga con concentración del 20 % (17). La presentación comercial más usada en los reportes ha sido el intralipid® (24). La dosis recomendada, basada en consenso de expertos, es un bolo de 1,5 ml/kg seguido de una infusión a 0,25 ml/kg/ min, por hasta 10 minutos luego de recuperar la estabilidad hemodinámica. Si no hay respuesta adecuada, se puede repetir el bolo y se puede duplicar la velocidad de la infusión a 0,5 ml/kg/ min, sin pasar de una dosis total de 10 ml/kg en treinta minutos (2).
Se ha reportado como efecto secundario una hipertrigliceridemia de duración corta, que puede interferir con la realización de algunos exámenes de laboratorio (35). También se ha encontrado una elevación transitoria de amilasas en un paciente asintomático, por lo que existe un riesgo teórico de pancreatitis (36,37). Aunque es claro que si hay paro cardíaco el paciente debe recibir la emulsión lipídica, en situaciones con menor compromiso las indicaciones no están tan claras. De allí que la recomendación es aplicarla tempranamente si hay síntomas de inestabilidad o si el compromiso parece ir empeorando de manera rápida y progresiva (2,13,24).
Luego de la proliferación de reportes de caso de uso de emulsiones lipídicas para el tratamiento de intoxicación con bupivacaína en los quirófanos, otras especialidades consideraron útil el modelo y han reportado su utilización en intoxicación por múltiples medicamentos lipofílicos, incluyendo antidepresivos tricíclicos, beta-bloqueadores, calcioantagonistas, quetiapina, haloperidol, bupropion, glifosato, entre otros (22,23,37-41), pero todavía queda mucho por esclarecer respecto a su uso (24).
CONCLUSIONES
Aunque los anestésicos locales son, en general, medicamentos seguros, la toxicidad sistémica sigue siendo una amenaza debido al uso generalizado de estos medicamentos. La prevención es fundamental, y hay evidencia indirecta de que la mejor estrategia es la combinación de múltiples medidas de prevención: siempre disminuir la dosis total, diluyendo el medicamento en la medida de lo posible; aspirar antes de la inyección, utilizar marcadores intravasculares como la adrenalina y asociarlos a monitorización continua de signos vitales, mantener comunicación continua con el paciente e interrogar por síntomas de toxicidad, y utilizar ecografía en la medida de lo posible.Sin embargo, también se debe estar preparado para manejar esta complicación, teniendo en cuenta los principios de la reanimación cardiopulmonar, con algunas modificaciones: siempre pensar en un manejo agresivo de la vía aérea y la ventilación, hacer soporte hemodinámico y manejar las arritmias, evitando los anestésicos locales como antiarrítmicos y las dosis altas de adrenalina; también pensar en hacer reanimaciones por largos períodos y donde está disponible, se podría utilizar el soporte extracorpóreo. Los lípidos endovenosos son la alternativa de tratamiento más prometedora, y se investiga su utilidad en intoxicación con otros medicamentos lipofílicos, de los cuales ya hay múltiples reportes de caso de uso exitoso.
REFERENCIAS
1. Miller R. Miller's anesthesia. 7th ed. Philadelphia PA: Churchill Livingstone/Elsevier; 2010. [ Links ]
2. Neal JM, Bernards CM, Butterworth JF, Di Gregorio G, Drasner K, Hejtmanek MR, et al. ASRA Practice advisory on local anesthetic systemic toxicity. Regional Anesthesia and Pain Medicine. 2010 Mar; 35(2):152-61. [ Links ]
3. Di Gregorio G, Neal JM, Rosenquist RW, Weinberg GL. Clinical presentation of local anesthetic systemic toxicity: a review of published cases, 1979 to 2009. Reg Anesth Pain Med. 2010 Apr; 35(2):181-7. [ Links ]
4. Rosenberg PH, Veering BT, Urmey WF. Maximum recommended doses of local anesthetics: a multifactorial concept. Reg Anesth Pain Med. 2004 Dec; 29(6):564-575; discussion 524. [ Links ]
5. Guay J. The epidural test dose: a review. Anesth. Analg. 2006 Mar; 102(3):921-9. [ Links ]
6. Mulroy MF, Hejtmanek MR. Prevention of local anesthetic systemic toxicity. Reg Anesth Pain Med. 2010 Apr; 35(2):177-80. [ Links ]
7. Mulroy MF. Systemic toxicity and cardiotoxicity from local anesthetics: incidence and preventive measures. Reg Anesth Pain Med. 2002 Dec; 27(6):556-61 [ Links ]
8. Neal JM, Gerancher JC, Hebl JR, Ilfeld BM, McCartney CJL, Franco CD, et al. Upper extremity regional anesthesia: essentials of our current understanding, 2008. Reg Anesth Pain Med. 2009 Apr; 34(2):134-70. [ Links ]
9. Eichenberger U, Stöckli S, Marhofer P, Huber G, Willimann P, Kettner SC, et al. Minimal local anesthetic volume for peripheral nerve block: a new ultrasound-guided, nerve dimension-based method. Reg Anesth Pain Med. 2009 Jun; 34(3):242-6. [ Links ]
10. Zetlaoui PJ, Labbe J-P, Benhamou D. Ultrasound guidance for axillary plexus block does not prevent intravascular injection. Anesthesiology. 2008 Apr; 108(4):761. [ Links ]
11. Neal JM. Ultrasound-guided regional anesthesia and patient safety. Regional Anesthesia and Pain Medicine. 2010 Mar; 35(Suppl 1):S59-S67. [ Links ]
12. Polaner DM, Drescher J. Pediatric regional anesthesia: what is the current safety record? Paediatr Anaesth. 2011 Jul;21(7):737-42. [ Links ]
13. Drasner K. Local Anesthetic Toxicity. ASA Refresher Courses in Anesthesiology. 2011;39(1):33-40. [ Links ]
14. Neumar RW, Otto CW, Link MS, Kronick SL, Shuster M, Callaway CW, et al. Part 8: Adult advanced cardiovascular life support: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2010 Oct; 122(18_suppl_3):S729-S767. [ Links ]
15. Hiller DB, Gregorio GD, Ripper R, Kelly K, Massad M, Edelman L, et al. Epinephrine impairs lipid resuscitation from bupivacaine overdose: a threshold effect. Anesthesiology. 2009 Sep; 111(3):498-505. [ Links ]
16. Hicks SD, Salcido DD, Logue ES, Suffoletto BP, Empey PE, Poloyac SM, et al. Lipid emulsion combined with epinephrine and vasopressin does not improve survival in a swine model of bupivacaine-induced cardiac arrest. Anesthesiology. 2009 Jul; 111(1):138-46. [ Links ]
17. Weinberg GL. Treatment of local anesthetic systemic toxicity (LAST). Reg Anesth Pain Med. 2010 Apr; 35(2):188-93. [ Links ]
18. Weinberg GL, VadeBoncouer T, Ramaraju GA, Garcia-Amaro MF, Cwik MJ. Pretreatment or resuscitation with a lipid infusion shifts the dose-response to bupivacaine-induced asystole in rats. Anesthesiology. 1998 Apr; 88(4):1071-5. [ Links ]
19. Weinberg G, Ripper R, Feinstein DL, Hoffman W. Lipid emulsion infusion rescues dogs from bupivacaine-induced cardiac toxicity. Reg Anesth Pain Med. 2003 Jun; 28(3):198- 202. [ Links ]
20. Weinberg GL, Ripper R, Murphy P, Edelman LB, Hoffman W, Strichartz G, et al. Lipid infusion accelerates removal of bupivacaine and recovery from bupivacaine toxicity in the isolated rat heart. Reg Anesth Pain Med. 2006 Aug; 31(4):296-303. [ Links ]
21. Jamaty C, Bailey B, Larocque A, Notebaert E, Sanogo K, Chauny J-M. Lipid emulsions in the treatment of acute poisoning: a systematic review of human and animal studies. Clin Toxicol (Phila). 2010 Jan;48(1):1-27. [ Links ]
22. Rosenblatt MA, Abel M, Fischer GW, Itzkovich CJ, Eisenkraft JB. Successful use of a 20 % lipid emulsion to resuscitate a patient after a presumed bupivacaine-related cardiac arrest. Anesthesiology. 2006 Jul; 105(1):217-8. [ Links ]
23. Rothschild L, Bern S, Oswald S, Weinberg G. Intravenous lipid emulsion in clinical toxicology. Scand J Trauma Resusc Emerg Med. 2010; 18:51. [ Links ]
24. Weinberg GL. Lipid emulsion infusion: resuscitation for local anesthetic and other drug overdose. Anesthesiology. 2012 Jul; 117(1):180-7. [ Links ]
25. Kuo I, Akpa BS. Validity of the lipid sink as a mechanism for the reversal of local anesthetic systemic toxicity: a physiologically based pharmacokinetic model study. Anesthesiology. 2013 Jun; 118(6):1350-61. [ Links ]
26. Rahman S, Li J, Bopassa JC, Umar S, Iorga A, Partownavid P, et al. Phosphorylation of GSK3ß; mediates intralipid-induced cardioprotection against ischemia/reperfusion injury. Anesthesiology. 2011 Aug; 115(2):242-53. [ Links ] 27. Mottram AR, Valdivia CR, Makielski JC. Fatty acids antagonize bupivacaine-induced I(Na) blockade. Clin Toxicol (Phila). 2011 Oct; 49(8):729-33. [ Links ] 28. Partownavid P, Umar S, Li J, Rahman S, Eghbali M. Fatty-acid oxidation and calcium homeostasis are involved in the rescue of bupivacaine-induced cardiotoxicity by lipid emulsion in rats. Crit. Care Med. 2012 Aug; 40(8):2431-7. [ Links ] 29. Stehr SN, Ziegeler JC, Pexa A, Oertel R, Deussen A, Koch T, et al. The effects of lipid infusion on myocardial function and bioenergetics in l-bupivacaine toxicity in the isolated rat heart. Anesth. Analg. 2007 Jan; 104(1):186-92. [ Links ] 30. Litonius E, Tarkkila P, Neuvonen PJ, Rosenberg PH. Effect of intravenous lipid emulsion on bupivacaine plasma concentration in humans. Anaesthesia. 2012 Jun; 67(6):600-5. [ Links ] 31. French D, Smollin C, Ruan W, Wong A, Drasner K, Wu AHB. Partition constant and volume of distribution as predictors of clinical efficacy of lipid rescue for toxicological emergencies. Clin Toxicol (Phila). 2011 Nov; 49(9):801-9. [ Links ] 32. Niiya T, Litonius E, Petäjä L, Neuvonen PJ, Rosenberg PH. Intravenous lipid emulsion sequesters amiodarone in plasma and eliminates its hypotensive action in pigs. Ann Emerg Med. 2010 Oct; 56(4):402-408.e2. [ Links ] 33. Weinberg G, Lin B, Zheng S, Di Gregorio G, Hiller D, Ripper R, et al. Partitioning effect in lipid resuscitation: further evidence for the lipid sink. Crit. Care Med. 2010 Nov;38(11):2268-9. [ Links ] 34. Mazoit J-X, Le Guen R, Beloeil H, Benhamou D. Binding of long-lasting local anesthetics to lipid emulsions. Anesthesiology. 2009 Feb; 110(2):380-6. [ Links ] 35. West PL, McKeown NJ, Hendrickson RG. Iatrogenic lipid emulsion overdose in a case of amlodipine poisoning. Clin Toxicol (Phila). 2010 May; 48(4):393-6. [ Links ] 36. Marwick PC, Levin AI, Coetzee AR. Recurrence of cardiotoxicity after lipid rescue from bupivacaine-induced cardiac arrest. Anesth. Analg. 2009 Apr; 108(4):1344-6. [ Links ] 37. Weinberg G. Hyperamylasemia following lipid resuscitation: pancreas or parotid? Anesth. Analg. 2012 Sep; 115(3):739. [ Links ] 38. Bartos M, Knudsen K. Use of intravenous lipid emulsion in the resuscitation of a patient with cardiovascular collapse after a severe overdose of quetiapine. Clin Toxicol (Philad). 2013 Jul; 51(6):501-4. [ Links ] 39. Sirianni AJ, Osterhoudt KC, Calello DP, Muller AA, Waterhouse MR, Goodkin MB, et al. Useof lipid emulsion in the resuscitation of a patient with prolonged cardiovascular collapse after overdose of bupropion and lamotrigine. Ann Emerg Med. 2008 Apr; 51(4):412- 415, 415.e1. [ Links ] 40. Harvey M, Cave G. Case report: successful lipid resuscitation in multi-drug overdose with predominant tricyclic antidepressant toxidrome. Int J Emerg Med. 2012; 5(1):8. [ Links ] 41. Jovic-Stosic J, Gligic B, Putic V, Brajkovic G, Spasic R. Severe propranolol and ethanol overdose with wide complex tachycardia treated with intravenous lipid emulsion: a case report. Clin Toxicol (Phila). 2011 Jun; 49(5):426-30. [ Links ]