Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina
Print version ISSN 0120-8705
CES Med. vol.28 no.2 Medellín July/Dec. 2014
Reporte de caso
Malformación congénita de la vía aérea pulmonar
Congenital pulmonary airway malformation
JORGE ENRIQUE GUZMÁN-VÉLEZ1, MARÍA MONICA OSSA-GALVIS2
1Pediatra Clínica Infantil Santa Ana, profesor Universidad CES. Medelín, Colombia
2Médica general, Universidad CES. Medelín, Colombia
RESUMEN
La malformación congénita de la vía aérea pulmonar, anteriormente llamada malformación adenomatoidea quística pulmonar, es una rara anormalidad en el desarrollo de las vías respiratorias terminales. Las lesiones son de distribución y tamaños variables, usualmente unilaterales. El diagnóstico puede realizarse desde el periodo prenatal mediante ecografía gestacional, encontrándose en ocasiones, graves repercusiones fetales como hidrops fetal, el cual es el mayor predictor de muerte. En los recién nacidos la enfermedad se manifiesta con dificultad respiratoria aguda; en los niños y adultos con infecciones pulmonares recurrentes y complicaciones como absceso pulmonar, hemoptisis, neumotórax y manifestaciones extrapulmonares. En pacientes sintomáticos está indicado el tratamiento quirúrgico para prevenir infecciones y la transformación neoplásica; sin embargo, sigue siendo controversial el tratamiento profiláctico frente al tratamiento expectante en pacientes asintomáticos.
Se presenta el caso de una paciente femenina de cuatro años de edad con infecciones pulmonares recurrentes; las radiografías de tórax y la tomografía pulmonar sugieren malformación adenomatoidea quística, la cual es confirmada posteriormente por estudio patológico.
PALABRAS CLAVE
Malformación adenomatoidea quística, Malformaciones pulmonares, Quistes pulmonares, Neumonía recurrente
ABSTRACT
Congenital pulmonary airway malformation, previously known as congenital cystic adenomatoid malformation, is a rare developmental anomaly of the terminal respiratory structures. Cysts can vary in size, distribution, and are most commonly unilateral. The diagnosis can be made prenatally using ultrasound scanning; the fetal lesions can be associated with hydrops fetalis, which is the major predictor of death. In newborns, it manifests as acute respiratory distress, in children and adults, manifestations include recurrent lung infections, with complications such as lung abscess, hemoptysis, pneumothorax and extrapulmonary anomalies. Surgical treatment is indicated in symptomatic patients to prevent infections and the potential neoplastic transformation, however prophylactic surgery versus expectant treatment remains controversial in asymptomatic patients. We present a 4 year old female patient with recurrent pulmonary infections whose thoracic x-ray and pulmonary computed axial tomography suggests cystic adenomatoid malformation, subsequently confirmed by pathological study.
KEY WORDS
Congenital cystic adenomatoid malformation, Congenital pulmonary malformations, Pulmonary cyst, Recurrent pneumonia
DESCRIPCIÓN DEL CASO
Se trata de una paciente femenina de cuatro años de edad, con un cuadro clínico de un mes de evolución consistente en fiebre de 39 oC, asociada a tos productiva verde, emetizante, disnea, hiporexia y pérdida de peso subjetiva.
La niña había sido hospitalizada en 11 ocasiones por síndrome bronco-obstructivo recurrente e infecciones respiratorias virales y bacterianas. La última hospitalización fue 10 meses antes del ingreso que motivó esta presentación por un diagnóstico de tuberculosis por criterios epidemiológico, clínico y radiológico positivos, pero prueba tuberculínica (PPD) negativa y baciloscopia inicial negativa, sin información de cultivo para Mycobacterium tuberculosis.
Recibió primera y segunda fase de tratamiento antituberculoso, con bacilocopia negativa al cuarto mes de tratamiento. La madre refirió que un mes antes de la presente consulta, la paciente tuvo un nuevo contacto con tía materna diagnosticada de tuberculosis y quien estaba sin tratamiento.
La paciente es producto del tercer embarazo. La madre presentó anemia durante la gestación, amenaza de parto pre-término a los siete meses sin causa desencadenante clara y se realizó cuatro ecografías obstétricas que reportaban feto pequeño para la edad gestacional. El parto fue por cesárea, con presentación en podálica, nacida a término, con adaptación neonatal espontánea, peso y talla adecuado para la edad gestacional y neurodesarrollo posterior apropiado. Otros antecedentes de la historia clínica fueron: dilatación de conducto nasolacrimal izquierdo, vacunación completa para la edad según programa de inmunización del gobierno colombiano, recibió lactancia materna hasta los dos años, no había presentado alergias, exposición a tóxicos o traumas.
En los antecedentes familiares la madre reportaba una primera gestación sin complicaciones, segunda gestación con parto pretérmino y muerte al nacer por malformación pulmonar no clara, período intergenésico corto de tres meses entre la segunda y tercera gestación. Abuela materna, tío materno y prima materna con diagnóstico de asma.
Al momento del ingreso al servicio de hospitalización se encontró una paciente en buenas condiciones generales, afebril, con peso y talla adecuado para la edad, sin signos de dificultad respiratoria, con oximetría de 85 % y requerimiento de oxígeno por cánula nasal a 1 l/min. En la auscultación pulmonar se encontró murmullo vesicular conservado en ambos campos pulmonares con crépitos en ápex pulmonar izquierdo y el resto del examen físico es normal.
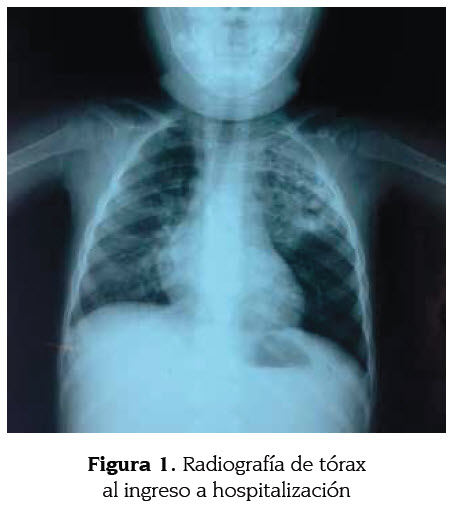
Los exámenes paraclínicos iniciales fueron leucocitos 8 200, neutrófilos 66 %, linfocitos 30 %, monocitos 2 %, plaquetas 388 000, proteína C reactiva 0,4 mg/dl, hemoglobina 12,8, hematocrito 39,3. En los rayos X de tórax se encontraron imágenes de múltiples quistes en lóbulo superior izquierdo y escasos infiltrados alveolares (figura 1).
Se ingresó con diagnóstico de neumonía adquirida en la comunidad versus reactivación de la tuberculosis pulmonar, por lo que se le inició tratamiento antibiótico con ampicilina-sulbactam y claritromicina. Se tomaron muestras de IgM para Mycoplasma pneumonie con resultado positivo y se tomaron baciloscopias y cultivos de jugo gástrico, que fueron negativos.
Al revisar las historias médicas anteriores, llamó la atención las múltiples hospitalizaciones por infecciones respiratorias, así como la discrepancia clínica y radiológica en la que persistía una imagen radiopaca multilobulada del lóbulo superior izquierdo.
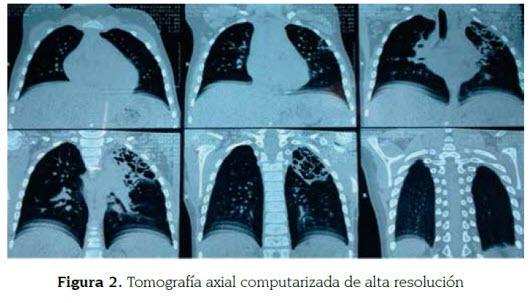
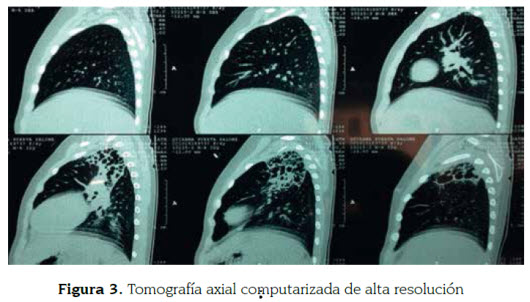
Se solicitó tomografía axial computarizada de alta resolución (figuras 2 y 3), para descartar malformaciones pulmonares congénitas (malformación adenomatoide quística), la cual reportó: "Extensa lesión con aumento de la atenuación en el segmento apicoposterior del lóbulo pulmonar superior izquierdo, de 5 cm x 4,5 cm x 3,5 cm aproximadamente, que se asocia con múltiples espacios quísticos en su interior de tamaños variables (el mayor de 2 cm), de paredes delgadas y contornos multilobulados, algunos de ellos conectándose entre sí. Se observan cambios inflamatorios del intersticio peribroncovascular en este segmento y del parénquima adyacente, sin retracciones de las estructuras vasculares ni de la vía aérea que sugiera atelectasia. No se identifican niveles hidroaéreos, calcificaciones, adenopatías mediastinales ni derrame pleural. Tráquea y bronquios fuentes permeables y de localización normal. Los hallazgos descritos en lóbulo pulmonar izquierdo están en relación con malformación adenomatoidea quística congénita tipo 1".
En la lectura mencionan, además, como diagnóstico diferencial, una remota posibilidad de bronquiectasias gigantes de posible origen postinfeccioso.
Se solicitaron pruebas inmunológicas, con valores normales de inmunoglobulinas y linfocitos,descartándose entonces inmunodeficiencia primaria; prueba negativa para VIH y ecocardiografía 2D color que reportó corazón sano.
La paciente fue valorada por cirujano de tórax y es programada para toracoscopia transparietal, en la que se realizó liberación de adherencias, pero por imposibilidad de mantener la ventilación unipulmonar de la paciente, se decide convertir a toracotomía; se realizó extracción de lóbulo superior izquierdo para estudio anatomo- patológico.
La descripción macroscópica (figura 4) reportó espécimen de 10 x 7 x 3 cm, en la que se identifican múltiples cavidades de diferentes tamaños, anastomosantes de localización principalmente periféricas que compromete aproximadamente el 60 % del lóbulo resecado.
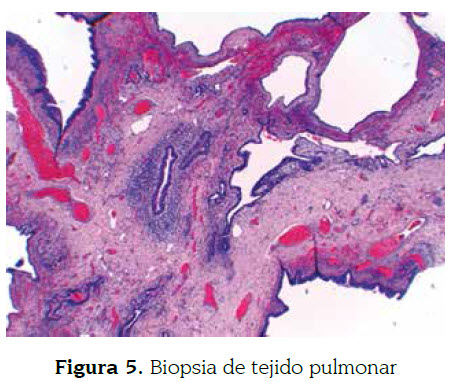
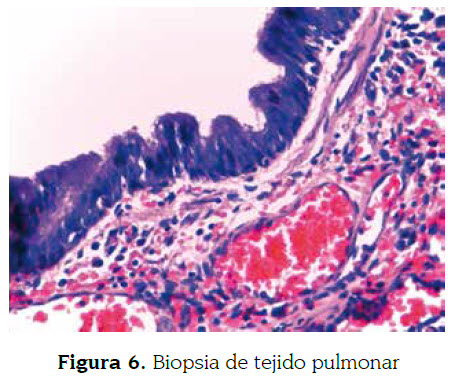
En la descripción microscópica se observa la presencia de espacios quísticos de diferente tamaño, que se intercomunican entre ellos, tapizados por un epitelio cilíndrico ciliado pseudoestratificado, acompañado de focos de atresia bronquial y rodeados por un estroma congestivo vascularizado lo que corresponde al diagnóstico de malformación adenoidea quística (figuras 5 y 6).
DISCUSIÓN
La malformación congénita de la vía aérea pulmonar, anteriormente llamada malformación adenomatoidea quística, es una anormalidad en el desarrollo de las vías respiratorias terminales, esporádica, no relacionada con predisposición Figura 4. Lóbulo superior izquierdo resección para patología Figura 5. Biopsia de tejido pulmonar Figura 6. Biopsia de tejido pulmonar diagnóstico de malformación adenoidea quística (figuras 5 y 6). genética, predilección de género, raza, edad o factores ambientales. Tiene una incidencia de 1 en: 25 000 hasta 1 en 35 000 por año (1) y corresponde al 25 % de las malformaciones congénitas pulmonares (2).
La malformación surge por un desarrollo embrionario pulmonar anormal, específicamente por la detención en la fase pseudoglandular (semana 7-17 gestación), generando hiperplasia compensatoria de las vías aéreas distales con reemplazo del parénquima pulmonar normal por quistes, de tamaños y distribución variable (3).
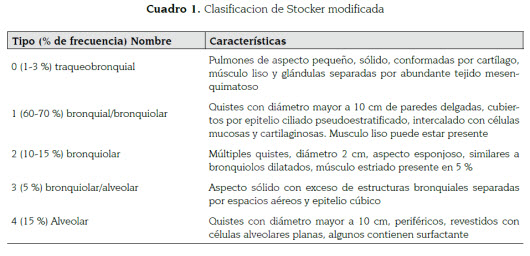
En 1977 Stocker et al. (4) clasificaron la enfermedad de acuerdo a las características clínicas y patológicas en tipo 1, 2 y 3. Posteriormente adicionaron dos tipos (0-4) a la clasificación original, según el lugar de origen de las lesiones (2): tipo 0, traqueobronquial; 1, bronquial/bronquiolar; 2; bronquiolar, 3, bronquiolar/alveolar; y, 4, alveolar (cuadro 1).
El término malformación congénita de la vía aérea pulmonar se introdujo por primera vez en esa publicación (2), debido a que el espectro de los tipos corresponde a características anatómicas y microscópicas de la vía aérea respiratoria y al hecho de que los cambios quísticos y adenomatoideos no están presentes en todos los tipos. La malformación más frecuente es la tipo 1 que corresponde al 60 a 70 % de los casos, es de manifestación tardía, resecable, de buen pronóstico, aunque se ha relacionado en menos del 1 % de los pacientes con carcinoma bronquioalveolar (5).
Dependiendo del tipo de lesión, 4 a 26 % de los casos se han asociado a otras malformaciones congénitas (6). Las tipo 0 y 2 se asocian a malformaciones cardiovasculares como tetralogía de Fallot y tronco arterioso común, agenesia/ disgenesia renal y atresia intestinal (7). La tipo 3 es la forma sólida y puede comprimir el mediastino, generando en el 80 % de los casos, polihidramnios y muerte fetal (2). La tipo 4 es de quistes periféricos, asociados a blastoma pleuropulmonar (cuadro 1) (8,9).
El diagnóstico prenatal se realiza mediante ecografía gestacional, generalmente entre la semana 18-20 de gestación, donde se observan masas pulmonares ecodensas, homogéneas, las cuales pueden desplazar el mediastino, generando hipoplasia pulmonar, compresión o atresia esofágica, con posterior polihidramnios e hidrops fetal (10,11).
El hidrops fetal es el mayor predictor de muerte fetal in útero y se puede estimar el riesgo de desarrollarlo, calculando la relación entre el volumen de la lesión pulmonar dividido por el valor de la circunferencia de la cabeza normal para la edad gestacional: si el valor es mayor a 1,6 se considera alto riesgo para desarrollar hidrops fetal (12). Otro hallazgo ecográfico importante es la regresión espontánea del crecimiento.
El diagnóstico postnatal se realiza mediante la sospecha clínica, diagnóstico imaginológico y patológico. La presentación clínica es variable, desde asintomática hasta graves complicaciones pulmonares. Usualmente, se presenta con dificultad respiratoria en el recién nacido; en la infancia con infecciones respiratorias recurrentes y en la vida adulta con complicaciones como abscesos pulmonares, neumotórax espontáneos, pioneumotórax, hemoptisis y émbolos gaseosos (7,13,14).
El diagnóstico imaginológico se puede realizar mediante radiografía de tórax, en la que se observan lesiones quísticas, sólidas o mixtas que afecta uno o varios lóbulos, desviación del mediastino, derrame pleural, pericárdico o neumotórax. En la tomografía axial computarizada de alta resolución aparecen lesiones quísticas multiloculadas de paredes delgadas, rodeadas de parénquima pulmonar normal, pueden tener niveles hidroaéreos o sobreinfección (15)
Dentro de los diagnósticos diferenciales se encuentran hernia diafragmática congénita, fistula traqueo-esofágica, secuestro pulmonar, quistes y tumores pulmonares, enfisema/hiperinsuflación lobar congénito, agenesia pulmonar y malformaciones vasculares (16,17).
El tratamiento prenatal consiste en la administración de esteroides, lobectomía fetal vía histerectomía, y shunt pleuro-amniótico para efusiones pleurales (18-20). En el periodo postnatal, cuando el paciente se encuentra sintomático, está indicada la corrección quirúrgica, aunque sigue siendo controversial en los pacientes asintomáticos. Dentro de las posibles justificaciones para la cirugía profiláctica durante el primer año de vida están prevenir infecciones/sepsis, neumotórax o malignidad, y en general tiene menos complicaciones postoperatorias en comparación a la cirugía de urgencia (21). Otros autores proponen el manejo expectante del paciente hasta la aparición de síntomas o complicaciones, basados en la resolución espontánea de las lesiones hasta en un 15 % de los pacientes (22-24).
La lobectomía se prefiere sobre la segmentectomía debido a las lesiones residuales en el 15 % de los casos con esta técnica (21). La toracoscopia requiere ventilación unipulmonar y es posible realizarla incluso en neonatos, aunque se prefiere toracotomía en aquellos pacientes con lesiones como enfisema alveolar, antecedente de neumonía y atelectasias (cinco de cada seis pacientes con antecedente de infección requieren conversión a toracotomía) (25). Los beneficios de la toracoscopia son menor estancia hospitalaria, diminución del dolor postoperatorio y mejor resultado estético comparado con la toracotomía convencional (26-28).
Los principales factores que indican pobre pronóstico incluyen compromiso pulmonar bilateral, hidrops fetal y otras malformaciones congénitas (7,29). El pronóstico de los pacientes también depende del tipo de la lesión: la de tipo 0 es considerada letal; el tipo 1 tiene el mejor pronóstico; el tipo 2 depende de las anormalidades asociadas que pueden llegar a ser severas; el tipo 3 tiene un pobre pronóstico, debido a que usualmente los quistes son grandes, generando severa hipoplasia pulmonar, efecto de masa con compromiso cardiovascular temprano o in útero con hidrops fetal (30).
CONCLUSIÓN
Se presenta un caso de malformación congénita de la vía aérea pulmonar, una enfermedad congénita que en nuestro medio no es diagnosticada frecuentemente, quizás por la dificultad de realizar ecografías gestacionales de alta resolución.
El caso sirve para llamar la atención al personal médico y paramédico de los países en desarrollo donde es difícil acceder a sofisticados recursos tecnológicos para realizar una buena historia clínica de cada paciente, acompañado de un examen físico completo, revisando las enfermedades previas, motivos de hospitalizaciones y exámenes realizados. El diagnóstico precoz, especialmente en los pacientes pediátricos, mejora el pronóstico de la gran mayoría de enfermedades y la calidad de vida.
CONFLICTOS DE INTERÉS
Los autores no presentan conflicto de interés.
CONSENTIMIENTO INFORMADO
La madre autorizó mediante consentimiento informado y por escrito para la publicación del caso y la reproducción de las imágenes en una revista científica.
AGRADECIMIENTOS
Dr. Wilfredy Castaño Ruiz- Cirujano de Tórax. Hospital General de Medellín.
Dr. Alvaro Restrepo Pareja. Patólogo, Hospital General de Medellín.
Dr. Ricardo Posada Saldarriaga, Neumólogo Pediatra. Universidad CES.
BIBLIOGRAFÍA
1. Priest JR, Williams GM, Hill DA, Dehner LP, Jaffé A. Pulmonary cysts in early childhood and the risk of malignancy. Pediatr Pulmonol. 2009;44:14-30. [ Links ]
2. Stocker JT. Cystic lung disease in infants and children. Fetal Pediatr Pathol. 2009; 28: 155-184. [ Links ]
3. Fromont-Hankard G, Philippe- homette P, Delezoide AL, Nessmann C, Aigrain Y, Peuchmaur M. Glial cellderived neurotrophic factor expression in normal human lung and congenital cystic adenomatoid malformation. Arch Pathol Lab Med 2002; 126:432-6. [ Links ]
4. Stocker JT, Drake RM: Congenital cystic adenomatoid malformation of the lung. Classification and morphologic spectrum. Hum Pathol 1977, 8:155-171. [ Links ]
5. Kaslovsky RA, Purdy S, Dangman BC, Mc- Kenna BJ, Brien T, Ilves R. Bronchioloalveolar carcinoma in a child with congenital cystic adenomatoid malformation. Chest 1997; 112:548-51. [ Links ]
6. Annam V, Korishetty SI, Yelikar BR, Hippargi SB, Shivalingappa DB. Bilateral congenital cystic adenomatoid malformation, stocker type III with associated findings and review of literature. Indian J Pathol Microbiol. 2010; 53(2):331-3. [ Links ]
7. Laje P, Liechty KW. Postnatal management and outcome of prenatally diagnosed lung lesions. Prenat Diagn. 2008; 28:612-618. [ Links ]
8. Nur S, Badr R, Sandoval C, Brudniki A, Yeh A. Syndromic presentation of a pleuropulmonary blastoma associated with congenital cystic adenomatoid malformation: a case report. J Pediatr Surg 2007; 42:1772-5. [ Links ]
9. MacSweeney F, Papagiannopoulos K, Goldstraw P, Sheppard MN, Corrin B, Nicholson AG. An assessment of the expanded classification of congenital cystic adenomatoid malformations and their relationship to malignant transformation. Am J Surg Pathol 2003; 27:1139-1146. [ Links ]
10. Laberge JM, Flageole H, Pugash D, Khalife S, Blair G, Filiatrault D, Russo P, et al. Outcome of the prenatally diagnosed congenital cystic adenomatoid lung malformation: a Canadian experience. Fetal Diagn Ther. 2001; 16:178-186. [ Links ]
11. Gornall AS, Budd JL, Draper ES, Konje JC, Kurinczuk JJ. Congenital cystic adenomatoid malformation: accuracy of prenatal diagnosis, prevalence and outcome in a general population. Prenat Diagn. 2003;23:997- 1002. [ Links ]
12. Crombleholme TM, Coleman B, Hedrick H, Liechty K, Howell L, Flake AW, Johnson M, Adzick NS. Cystic adenomatoid malformation volume ratio predicts outcome in prenatally diagnosed cystic adenomatoid malformation of the lung. J Pediatr Surg 2002; 37:331-8. [ Links ]
13. Kim YJ, Kim do Y, Seo JW, Lee SA, Hwang JJ, Kim HJ, Lee KY. A Case of congenital cystic adenomatoid malformation infected with mycobacterium avium-intracellulare complex. Tuberc Respir Dis (Seoul). 2013;74(1):28-31. [ Links ]
14. McDonough RJ, Niven AS, Havenstrite KA. Congenital pulmonary airway malformation: a case report and review of the literature. Respire Care.2012 Feb; 57(2):302-6. [ Links ]
15. Jain A, Anand K, Singla S, Kumar A. Congenital cystic lung diseases. J Clin Imaging Sci. 2013 Jan 30;3:5. [ Links ]
16. Ryan CA, Finer NN, Etches PC, Tierney AJ, Peliowski A. Congenital diaphragmatic hernia: associated malformations-cystic adenomatoid malformation, extralobular sequestration, and laryngotracheoesophageal cleft: two case reports. J Pediatr Surg. 1995;30:883-885. [ Links ]
17. Nadeem M, Elnazir B, Greally P. Congenital pulmonary malformation in children. Scientifica, vol. 2012, Article ID 209896, 7 pages. [ Links ]
18. Curran PF, Peranteau WH, Wilson RD, Liechty KW, Johnson MP, Bebbington MW, Hedrick HL, Flake AW, Adzick NS. Effect of maternal betamethasone administration on prenatal congenital cystic adenomatoid malformation growth and fetal survival. Fetal Diagn Ther 2007; 22:365-71. [ Links ]
19. Knox EM, Kilby MD, Martin WL, Khan KS. In utero pulmonary drainage in the management of primary hydrothorax and congenital cystic lung lesion: a systematic review. Ultrasound Obstet Gynecol 2006; 28:726-34. [ Links ]
20. Adzick NS. Management of fetal lung lesions. Clin Perinatol 2003; 30:481-92. [ Links ]
21. Stanton M, Njere I, Ade-Ajayi N, Patel S, Davenport M. Systematic review and metaanalysis of the postnatal management of congenital cystic lung lesions. J Pediatr Surg 2009; 44:1027-33. [ Links ]
22. Butterworth SA, Blair GK. Postnatal spontaneous resolution of congenital cystic adenomatoid malformations. J Pediatr Surg 2005; 40:832-4. [ Links ]
23. Chow PC, Lee SL, Tang MH, Chan KL, Lee CP, Lam BC, Tsoi NS. Management and outcome of antenatally diagnosed congenital cystic adenomatoid malformation lung. Hong Kong Medical Journal 2007; 13:31-9. [ Links ]
24. Villegas IA, Morán CL, Vaquero M. Cystic adenomatoid malformations of the lung: presentation of 5 cases and review. Cir Pediatr. 2008 Jan;21(1):46-8. [ Links ]
25. Puligandla PS, Laberge JM. Congenital Lung Lesions. Clin Perinatol 2012; 39: 331-347. [ Links ]
26. Rahman N, Lakhoo K. Comparison between open and thoracoscopic resection of congenital lung lesions. J Pediatr Surg 2009; 44:333-6. [ Links ]
27. Vu LT, Farmer DL, Nobuhara KK, Miniati D, Lee H. Thoracoscopic versus open resection for congenital cystic adenomatoid malformations of the lung. J Pediatr Surg 2008; 43:35-9. [ Links ]
28. Kotecha S, Barbato A, Bush A, Claus F, Davenport M, Delacourt C, Deprest J, Eber E, Frenckner B, Greenough A, Nicholson AG, Antón-Pacheco JL, Midulla F. Antenatal and postnatal management of congenital cystic adenomatoid malformation. Paediatr Respir Rev. 2012 Sep;13(3):162-70. [ Links ]
29. Bunduki V, Ruano R, da Silva MM, Miguelez J, Miyadahira S, Maksoud JG, Zugaib M. Prognostic factors associated with congenital cystic adenomatoid malformation of the lung. Prenat Diagn 2000; 20:459-64. [ Links ]
30. Sfakianaki AK, Copel JA. Congenital cystic lesions of the lung: congenital cystic adenomatoid malformation and bronchopulmonary sequestration. Rev Obstet Gynecol. 2012; 5(2):85-93. [ Links ]
Recibido en: junio 25 de 2013. Revisado en: marzo 3 de 2014. Aceptado en: octubre 3 de 2014.