Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
CES Medicina
versión impresa ISSN 0120-8705
CES Med. vol.28 no.2 Medellín jul./dic. 2014
Revisión de tema
Sarcoidosis cutánea
Cutaneus sarcoidosis
FRANCHEZCA ZAPATA-GONZÁLEZ1, LUZ ADRIANA VÁSQUEZ-OCHOA2, JUAN ESTEBAN ARROYAVE-SIERRA2, MARÍA ISABEL ARREDONDO-OSSA2, VERÓNICA MOLINA-VÉLEZ2, DELSY YURLEDY DEL RÍO-COBALEDA2
1Dermatóloga Universidad CES, Medelín, Colombia franchezca@gmail.com
2Grupo Dermatología HPTU. Medelín, Colombia
RESUMEN
La sarcoidosis en una enfermedad granulomatosa que puede afectar casi cualquier órgano. Se presenta más frecuentemente entre la tercera y la cuarta década de la vida y hasta el momento su etiología es desconocida, aunque se sugiere que factores ambientales, exposición a algunos microrganismos y la predisposición genética pueden ser importantes en su desarrollo. La piel puede comprometerse hasta en un 30 % en los pacientes con sarcoidosis sistémica, con manifestaciones específicas, dentro de las cuales la de tipo papular es la más común, o inespecíficas, como el eritema nodoso. Debido a que las lesiones cutáneas proveen un sitio accesible para realizar el diagnóstico de la enfermedad, es importante aprender a reconocerlas. En esta revisión se hace un repaso de las manifestaciones cutáneas más frecuentes de la sarcoidosis y de su tratamiento, para ello se realizó una búsqueda en las bases de datos de Pubmed, Hinari y Cochrane hasta febrero del 2013, empleando palabras clave como sarcoidosis, y sarcoidosis cutánea, en artículos publicados en castellano e inglés, durante los últimos 10 años.
PALABRAS CLAVE
Sarcoidosis cutánea, Manifestaciones extrapulmonares de la sarcoidosis, Tratamiento, Revisión.
ABSTRACT
Sarcoidosis is a granulomatous disease that can affect almost any organ. It occurs most commonly between the third and fourth decade and its etiology is unknown, but it is suggested that environmental factors, exposure to certain microorganisms and genetic predisposition may be important in its development. The skin may be affected in 30 % of patients with systemic sarcoidosis, presenting in this organ specific manifestation, being the papular de most common, or unspecific as erythema nodosum, which is a reactive phenomenon of the disease in which there are non-granulomas. Because skin lesions provide an accessible place for diagnosis of the disease, it is important to learn to recognize. In this review, we repass in the most common cutaneous manifestations of sarcoidosis and its treatment, for that we researched in the databases PubMed, Cochrane Hinari and until February 2013, using keywords such as sarcoidosis, and cutaneous sarcoidosis, in articles published in Spanish and English, for the past 10 years.
KEY WORDS
Cutaneus sarcoidosis, Extrapulmonary manifestations of sarcoidosis, Treatment, Review.
INTRODUCCIÓN
La sarcoidosis es un desorden multisistémico de origen desconocido caracterizado por la formación de granulomas no caseificantes. Además de la piel puede afectar cualquier otro órgano y es capaz de imitar una gran variedad de enfermedades, por eso en dermatología es conocida como la "gran simuladora" (1,2).
En este artículo se hace una revisión de la sarcoidosis en relación a su epidemiología, manifestaciones clínicas, métodos de diagnóstico y tratamiento, haciendo énfasis en las manifestaciones cutáneas de la enfermedad. Para ello se realizó una búsqueda en las bases de datos de Pubmed, Hinari y Cochrane hasta febrero de 2013, empleando palabras clave como sarcoidosis y sarcoidosis cutánea, en artículos publicados en castellano e inglés, durante los últimos 10 años.
Epidemiología
La sarcoidosis afecta personas de todas las razas y ocurre en todas las edades; sin embargo, usualmente se desarrolla antes de los 50 años con un pico de incidencia entre la tercera y cuarta década. Es más frecuente en el sexo femenino con una relación mujer/hombre de 1,2:1 en caucásicos, y 1,3:1 en afroamericanos (1-4). En general el estilo de vida no influye en la presentación de la sarcoidosis, no obstante se ha visto que el hábito de fumar podría ser un factor protector contra el desarrollo de ésta (5-7).
Las lesiones cutáneas suelen presentarse más en el género femenino y manifestaciones clínicas como el lupus pernio, nódulos, placas, lesiones psoriasiformes y el compromiso ungular tienen una mayor frecuencia en pacientes afroamericanos, mientras que el eritema nodoso, por otra parte, es frecuente en escandinavos, y tiene una baja prevalencia en japoneses (8,9). Los pacientes de raza negra suelen presentar una enfermedad más grave y aguda comparados con los pacientes de raza blanca (2).
En Colombia no hay datos de prevalencia o incidencia de sarcoidosis y hay pocos reportes de caso de esta enfermedad en el país. La revisión clínica más completa de casos de sarcoidosis en Colombia, fue realizada en 1976 en el Hospital Santa Clara de Bogotá, en donde se reunieron 51 casos de dicha enfermedad. En los resultados analizados en este artículo se encontró que el compromiso en piel era el más frecuente (25 % de los pacientes) luego de la sarcoidosis pulmonar; datos muy similares a los reportados en la literatura mundial (10).
Etiología
El concepto actual sobre la patogénesis de la sarcoidosis, es que ésta se debe a una respuesta inmune mediada por linfocitos Th1 (linfocitos colaboradores por sus siglas en inglés helper tipo 1) en respuesta a antígenos ambientales en un huésped susceptible. A pesar de que varios agentes ambientales e infecciosos han sido propuestos, no se ha probado una relación definitiva (11).
En el estudio ACCES (por sus siglas en inglés de Estudio etiológico caso-control sobre la sarcoidosis) se reclutaron 736 casos de sarcoidosis y 706 controles y se les pidió que llenaran un extenso cuestionario sobre su ocupación y exposiciones ambientales. Se encontró que ocupaciones como la cría de aves, la fabricación de automóviles, ser profesor de secundaria o de la escuela intermedia, trabajar en el desmotado de algodón y la exposición a la radiación, insecticidas, pesticidas, moho y ambientes húmedos se hallaban significativamente más en el grupo de los pacientes con sarcoidosis cuando se comparaban con los controles (7,12).
Varios agentes infecciosos han sido también implicados en el desarrollo de la sarcoidosis, de ellos Mycobacterium tuberculosis ha sido el más estudiado, debido en gran medida a la similitud histológica de ambas entidades. Los intentos por aislar la micobacteria en muestras de tejido con sarcoidosis no han conseguido resultados consistentes; sin embargo, el empleo de nuevas técnicas como la reacción en cadena de la polimerasa (PCR) y los estudios inmunológicos utilizando ELISPOT (ensayo de puntos por inmunoabsorción unida a enzimas), parece aumentar la evidencia en favor de un posible vínculo entre ambas enfermedades (2,13,14). Además, la detección molecular de la M. tuberculosis ha sido relacionada con un peor pronóstico en sarcoidosis, y con mayor tendencia a la cronicidad (15). Otros agentes microbianos como el Propionibacterium acnes, varios virus (Epstein Barr, citomegalovirus, Herpes simple, Coxsackie B y herpes humano tipo 8), hongos, espiroquetas, especies de Borrelia y Tropheryma whipplei, han sido sugeridos como agentes etiológicos de la sarcoidosis; sin embargo, la mayoría de estudios carece de evidencia fuerte para apoyar dicha relación (2,16-18).
Se ha reportado desarrollo de sarcoidosis luego de la administración de interferón alfa para el tratamiento de hepatitis C (19) y hay varios reportes de caso con inhibidores del factor de necrosis tumoral alfa (38 casos en total, 22 casos con etanercept, 10 casos con adalimumab y seis casos con infliximab) (20,21).
Genética
La evidencia que apoya la influencia de la genética en la patogénesis de la sarcoidosis proviene del agrupamiento familiar de esta enfermedad (22,23), mayor suceptibilidad y severidad de la enfermedad en ciertos grupos raciales (1) y del aumento de la incidencia de sarcoidosis en gemelos monocigóticos comparada contra gemelos dicigóticos (24,25).
En el estudio ACCES se demostró que los padres y hermanos de los pacientes con sarcoidosis tenían cinco veces más riesgo de desarrollar la enfermedad que los controles (26,27). Varios genes han sido implicados en la patogénesis de la enfermedad, entre ellos se destacan el complejo mayor de histocompatibilidad, la anexina 11, el gen de la butirifilina like 2, el factor de necrosis tumoral, la interleuquina-1 y el receptor de vitamina D entre otros (17).
Patogénesis
El paso inicial en la formación del granuloma sarcoidal es el reconocimiento y fagocitosis de un antígeno por una célula presentadora de antígenos (CPA). Posteriormente esta célula le presenta las partículas inmunogénicas no degradables a los linfocitos T CD4, desencadenando una respuesta inmune celular, con secreción de citoquinas (factor de necrosis tumoral -FNT-, interleuquina -IL- 12, IL-15, IL-18, proteína inflamatoria de macrófago tipo 1, proteína monocítica quimiotáctica tipo 1 y factor estimulador de colonias de granulocitos macrófagos -GM-CSF-) que generan a su vez inflamación granulomatosa en los órganos blanco (28,29).
Los granulomas constituyen la principal característica de la sarcoidosis. Son colecciones de macrófagos y células epitelioides rodeadas de linfocitos. En granulomas más maduros, los fibroblastos y el colágeno lo encapsulan y en algunos casos se produce esclerosis que altera la función y arquitectura orgánicas (26).
CLÍNICA
Lesiones cutáneas
Las manifestaciones cutáneas de la sarcoidosis se presentan en 20-35 % de los pacientes y usualmente se despliegan al inicio de la enfermedad (11,30). Cerca de 30 % de los pacientes con lesiones cutáneas aisladas desarrollará una sarcoidosis sistémica luego de un período de tiempo que varía entre un mes y un año (31). Estas manifestaciones son clasificadas como específicas (granulomas no caseificantes presentes en la biopsia) o inespecíficas (lesiones reactivas sin formación de granulomas) (cuadro 1) (32).
Lesiones cutáneas inespecíficas
El eritema nodoso es la manifestación inespecífica más común se presenta en 25 % de los casos de sarcoidosis. Clínicamente se observa como nódulos eritematosos subcutáneos de 0,8 a 4 cm sobre la cara anterior de las piernas, que sanan entre tres y ocho semanas sin dejar cicatriz; representa una reacción de hipersensibilidad a un sinnúmero de estímulos, incluyendo medicamentos infecciones y enfermedades inflamatorias (33,34). En la histología se aprecia una paniculitis septal sin formación de granulomas (35).
El eritema nodoso usualmente se presenta en el contexto de una sarcoidosis transitoria que no requiere tratamiento. La triada de eritema nodoso, poliartritis aguda (a menudo con inflamación periarticular de tobillos) y linfadenopatía hiliar bilateral es conocida como el síndrome de Löfgren, una forma aguda y auto limitada de sarcoidosis que generalmente se resuelve en menos de dos años (32).
Otras manifestaciones cutáneas inespecíficas como calcificaciones, eritema multiforme, prurito, acropaquia, edema en miembros inferiores, pioderma gangrenoso y síndrome de Sweet son poco comunes. (34,35)
Lesiones cutáneas específicas
Se manifiestan en 9-15 % de todos los pacientes con sarcoidosis. La piel comprometida puede ser hiperpigmentada, hipopigmentada o violácea y puede haber cambios epidérmicos como atrofia, descamación telangiectasias o ulceración (35).
Pápulas y placas
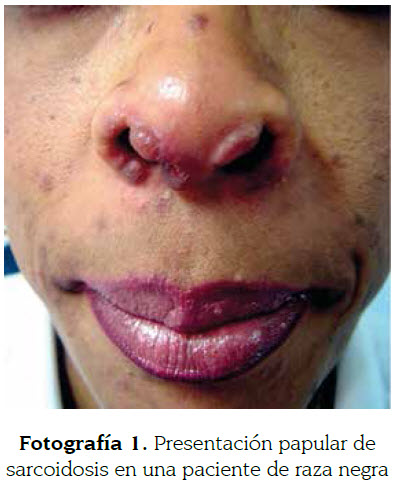
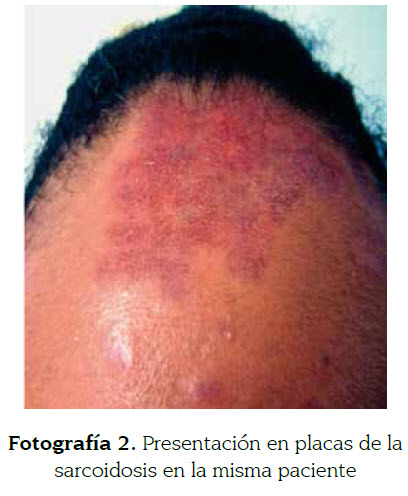
Las pápulas son las lesiones cutáneas más específicas de la sarcoidosis (fotografía 1). Consisten en lesiones elevadas de menos de 5 mm. Generalmente se localizan en la cara, especialmente a nivel peripalpebral y en pliegues nasogenianos. Tienen buen pronóstico y sanan sin dejar cicatriz. Cuando se les aplica presión con un vidrio o con el dermatoscopio (diascopia), el color eritemato- violáceo se atenúa y aparece un color amarillo-café (descrito como jalea de manzana). Las placas pueden aparecer de novo o provenir de la confluencia de pápulas (fotografía 2). Son lesiones de más de 5 mm que ocupan una extensión relativamente grande en comparación a su altura. Generalmente se localizan en la espalda, glúteos, cara y superficie extensora de las extremidades; sanan dejando cicatrices y se encuentran asociadas a un curso crónico (9,32,35). La sarcoidosis fotodistribuida es una rara forma de sarcoidosis papular inducida por el sol con prueba negativa de fotoprovocación y que debe ser diferenciada de la erupción solar polimorfa y del lupus cutáneo (32).
Lupus pernio
Clínicamente se presenta como placas violáceas infiltradas localizadas en la nariz, mejillas, labios, orejas, y dedos de manos y pies; puede ser desfigurante infiltrando incluso el cartílago y el hueso. Suele ser más común en mujeres que en hombres, tiene un curso crónico y se encuentra asociada a formas de sarcoidosis fibrosante crónica, incluyendo el compromiso del tracto respiratorio superior (SURT, por sus siglas en inglés) y la presencia de quistes óseos. Usualmente es refractaria al tratamiento con esteroides sistémicos y otros inmunosupresores. Las lesiones angiolupoides pueden ser una variante del lupus pernio diferenciadas por la presencia de telangiectasias prominentes (35,36).
Sarcoidosis en cicatrices
La sarcoidosis cutánea puede ocurrir en cicatrices, tatuajes, alrededor de cuerpos extraños e incluso en lesiones de herpes zoster. Se presenta como pápulas o placas induradas, pruriginosas o dolorosas. Tanto cicatrices como tatuajes previos deben ser examinados cuidadosamente cuando se tenga la sospecha de sarcoidosis, puesto que pueden facilitar el diagnóstico de la misma, brindando un sitio accesible para su estudio histológico. Para realizar el diagnóstico no basta con ver los granulomas no caseificantes en la biopsia (puesto que estos pueden verse en relación con un cuerpo extraño); debe hacerse una correlación clínica y excluirse otras enfermedades granulomatosas como infecciones (37,38).
Nódulos subcutáneos
La sarcoidosis subcutánea o sarcoide de Darier Roussy es considerada como un desorden inflamatorio que compromete exclusivamente la grasa subcutánea. Se caracteriza por múltiples nódulos de 0,5 a 2 cm, localizados con mayor frecuencia en las extremidades superiores, de forma bilateral y asimétrica. A diferencia del eritema nodoso no es doloroso y no presenta eritema. Ocurre principalmente en mujeres entre la quinta y sexta década y en la mayoría de los casos se asocia a sarcoidosis sistémica, reportándose esta última hasta en el 80 % de los casos (39,40). La sarcoidosis tumoral es rara pero se han reportado tumores de hasta 10-30 cm en la región lumbosacra (32).
Sarcoidosis macular o hipopigmentada
Es más frecuente en pacientes de raza negra. Se presenta como áreas maculares hipopigmentadas. Las biopsias de estas lesiones usualmente fallan en demostrar la presencia de granulomas. Las áreas induradas dentro de las máculas deben ser biopsiadas para aumentar la posibilidad de encontrar granulomas (9,35)
Sarcoidosis ulcerativa
Son lesiones ulceradas que pueden desarrollarse de novo o en lesiones preexistentes atróficas y a menudo son secundarias a trauma. Ocurren más frecuentemente en mujeres y en pacientes de raza negra. Clínicamente se presentan como úlceras necróticas con bordes violáceos enrollados y una base atrófica, rodeadas de placas amarillentas hiperpigmentadas con telangiectasias. Generalmente se producen en miembros inferiores (área pretibial) y aunque pueden simular muchas enfermedades ulcerativas, el hallazgo de granulomas no caseificantes ayuda a guiar el diagnóstico (9,34,35).
Sarcoidosis verrugosa
La sarcoidosis verrugosa consiste en placas nodulares, hiperqueratósicas, sobreelevadas y bien delimitadas. Generalmente se localiza en los miembros inferiores y los pacientes suelen tener afectación sistémica, sobre todo pulmonar (35).
Sarcoidosis eritrodérmica
La eritrodermia se define como un eritema con o sin descamación que cubre más de 90 % de la superficie corporal. En la sarcoidosis no se ha reportado un compromiso tan extenso y el término sarcoidosis eritrodérmica se emplea para pacientes que presentan áreas extensas de piel con eritema, induración y descamación. La biopsia de estas áreas evidencia inflitración difusa de granulomas en la dermis (9,35).
Sarcoidosis ictiosiforme
Es una presentación poco frecuente de la sarcoidosis, sólo uno de los casos previamente publicados no se ha asociado a sarcoidosis multisistémica. Las lesiones se presentan como escamas grandes adheridas en el centro, que simulan las escamas de un pez. Se presenta principalmente en los miembros inferiores, sobre todo en el área pretibial. En la histología se observan características combinadas de ictiosis y sarcoidosis (41)
Sarcoidosis psoriasiforme
Constituye una forma infrecuente de sarcoidosis, representa el 0,9 % de las manifestaciones cutáneas de la enfermedad. Algunos casos ocurren en lesiones preexistentes de psoriasis. Clínicamente es difícil diferenciar ambas condiciones. Sin embargo, las lesiones de psoriasis suelen ser más eritematosas e hiperqueratósicas y sanan sin dejar cicatriz (35,42).
Sarcoidosis en mucosas
La sarcoidosis afecta las mucosas en raras ocasiones; puede haber compromiso de la región oral, nasal y anogenital. Los caucásicos presentan mayor compromiso de la cavidad oral y las lesiones más frecuentes en este sitio son nódulos o edema localizado; también se presentan úlceras, gingivitis e hiperplasia gingival. Los labios suelen ser los más comprometidos seguidos del paladar duro y blando, las encías la lengua y las amígdalas (30,43).
En la región genital la sarcoidosis se presenta como lesiones ulceradas, placas violáceas e hipopigmentadas, a nivel vulvar, perianal o escrotal asociado o no a linfadenopatías inguinales (30).
Cambios en cuero cabelludo y uñas
Las lesiones en cuero cabelludo se presentan más en pacientes de raza negra, pueden ocasionar alopecia cicatricial o no cicatricial en un patrón localizado o difuso. Se han reportado múltiples morfologías desde lesiones que asemejan una alopecia areata, hasta placas y nódulos infiltrativos. Generalmente se asocian a otras manifestaciones en piel y a compromiso pumonar (9,44).
La inflamación sarcoidal alrededor de la matriz ungular puede generar anormalidades en las uñas (hiperqueratosis subungular, acropaquia, pitting, traquioniquia, paroniquia, pterigio, onicolisis, surcos longitudinales y decoloración del lecho ungular). El compromiso ungular constituye un marcador de enfermedad crónica (45). La mayoría de los casos se encuentran asociados con quistes óseos digitales, dactilitis sarcoidal y lupus pernio (9,30).
Otras formas
Se han reportado algunas manifestaciones cutáneas de la sarcoidosis muy poco frecuentes que simulan otras enfermedades de la piel, incluyendo morfea, lupus discoide, liquen nítidus, pústulas foliculares, eritema palmar, verruga vulgar, erupción solar polimorfa, eritema giratum, y liquen escleroso entre otras (9,34,35).

DIAGNÓSTICO
El diagnóstico de la sarcoidosis es un proceso secuencial que incluye la recolección de información clínica, el estudio histológico en la cual se documente inflamación granulomatosa, exclusión de infección y otras causas conocidas de formación de granulomas y compromiso de al menos dos órganos; en general no se requiere confirmación histológica del segundo órgano (cuadro 2) (47)
No se debe asumir que los granulomas cutáneos aislados representan sarcoidosis y hay que intentar descartar otros diagnósticos, tales como tuberculosis, infección por hongos o micobacterias atípicas, reacción a cuerpo extraño (berilio, zirconio, tatuajes, parafina, otros) y nódulos reumatoides (cuadro 2).
Existen varias condiciones clínicas que no requieren biopsia para hacer el diagnóstico; el síndrome de Löfgren (adenopatía hiliar bilateral en la radiografía de tórax, eritema nodoso, fiebre, artralgias/artritis), el síndrome de Heerfordt (uveítis, parotiditis, fiebre), adenopatía hiliar bilateral en radiografía de tórax y los signos positivos de panda (captación en parótida y glándula lacrimal) y lambda (captación hiliar bilateral y paratraqueal derecha) en la gamagrafía con galio 67 (46).
PRONÓSTICO
En general, la sarcoidosis tiene un buen pronóstico. Muchos pacientes se encuentran asintomáticos y la resolución espontánea ocurre hasta en un 60 % de los casos. Sin embargo, algunos presentan una enfermedad progresiva y crónica con una mortalidad de 1 a 5 %, debida principalmente a falla respiratoria, compromiso cardiaco o del sistema nervioso central (48,49).
Entre los factores de mal pronóstico se encuentran la raza negra, ser mayor 40 años, tener compromiso extratorácico o pulmonar avanzado (estadio mayor a II o una capacidad vital forzada menor de 1,5 litros), tener lupus pernio, una duración de la enfermedad mayor a dos años o compromiso esplénico. En general, el compromiso cutáneo se asocia a una enfermedad crónica; sin embargo, el eritema nodoso asociado a fiebre y artralgias tiene buen pronóstico, resolviéndose espontáneamente en 4 a 8 semanas (9,46,50).
TRATAMIENTO
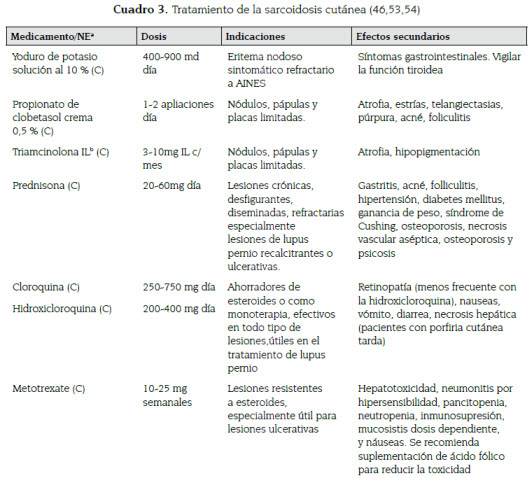
Debido a que la enfermedad puede permanecer estable o remitir espontáneamente, el tratamiento no es necesario para todos los pacientes con sarcoidosis; además, el tratamiento sistémico conlleva a diversos efectos secundarios. En las lesiones de piel se recomienda tratamiento en aquellas lesiones sintomáticas, cosméticamente inaceptables para el paciente y en lesiones de lupus pernio (ver cuadro 3) (32,46).
Usualmente el eritema nodoso es un proceso autolimitado que no requiere tratamiento. En caso de síntomas severos o persistencia de las lesiones se pueden emplear antinflamatorios no esteroideos, yoduro de potasio y esteroides (35,51).
El tratamiento tradicional para la sarcoidosis cutánea son los esteroides, que pueden ser empleados de forma tópica, intralesional o sistémica. Cuando las lesiones son muy extensas o no responden al tratamiento tópico, se pueden emplear esteroides sistémicos en dosis que varían entre 20-60 mg diarios de prednisona por varias semanas y son disminuidos gradualmente, dependiendo de la respuesta clínica (52,53).
Los antimaláricos, como la cloroquina e hidroxicloroquina han demostrado ser útiles en el tratamiento de la sarcoidosis cutánea y tienen un mejor perfil de seguridad que los esteroides; sin embargo, se deben realizar exámenes oftalmológicos cada 6 -12 meses para detectar la toxicidad retiniana que pueden ocasionar, especialmente en el caso de la cloroquina (54).
El metotrexate es otro ahorrador de esteroides empleado en el tratamiento de la sarcoidosis. Es utilizado en dosis que van de 10 - 25 mg semanales y se puede demorar hasta seis meses en lograr la máxima respuesta, aunque sus efectos se pueden observar desde el primer mes (35,46). Las tetraciclinas, tanto la doxiciclina como la minociclina, han demostrado utilidad en el tratamiento de la sarcoidosis cutánea (excluyendo el lupus pernio) en varias series de casos. Aunque hay quienes abogan que su papel en el manejo de la sarcoidosis tiene que ver con el efecto antimicrobiano en contra del P. acnes, la mayoría de autores relaciona los efectos benéficos de las tetraciclinas con su papel antinflamatorio (46,53). Más recientemente se han empleado antagonistas del factor de necrosis tumoral α para el tratamiento de la sarcoidosis. Especialmente infliximab ha probado ser útil en el tratamiento del lupus pernio (35).
Otros medicamentos y procedimientos que han demostrado utilidad en el manejo de la sarcoidosis cutánea, en algunas series de casos, son la azatioprina, talidomida, leflunomida, pentoxifilina, alopurinol, isotretinoína, cirugía con láser y la terapia fotodinámica (9,35,46,54).

CONCLUSIONES
Las manifestaciones cutáneas de la sarcoidosis tienen múltiples morfologías, de ahí su reputación de "gran simuladora". Tener en mente las distintas presentaciones cutáneas de la sarcoidosis, facilita el diagnóstico temprano de esta enfermedad ya que la piel es un sitio accesible para la toma de biopsias e implica una baja morbilidad para el paciente.
En vista de los pocos datos epidemiológicos propios y de la severidad de la enfermedad es importante comenzar a realizar una casuística local para determinar en comportamiento de la sarcoidosis en nuestro medio.
El tratamiento actual de la sarcoidosis cutánea se encuentra respaldado por una serie de experimentos no controlados, estudios descriptivos, series de casos y recomendaciones de expertos. En vista de los efectos desfigurantes que puede acarrear dicha enfermedad se recomienda la realización de estudios controlados aleatorizados para definir el manejo de elección
AGRADECIMIENTOS
A la Dra. Carolina Velásquez por las fotografías 1 y 2
BIBLIOGRAFÍA
1. Rybicki BA, Major M, Popovich J Jr, Maliarik MJ, Iannuzzi MC. Racial differences in sarcoidosis incidence: a 5-year study in a health maintenance organization. Am J Epidemiol. 1997; 145(3):234-41. [ Links ]
2. Lazarus A. Sarcoidosis: epidemiology, etiology, pathogenesis, and genetics. Dis Mon 2009; 55(11):649-60. [ Links ]
3. Jones N, Mochizuki M. Sarcoidosis: epidemiology and clinical features. Ocul Immunol and Inflamm 2010; 18(2):72-9. [ Links ]
4. Statement on sarcoidosis. Joint Statement of the American Thoracic Society (ATS), the European Respiratory Society (ERS) and the World Association of Sarcoidosis and Other Granulomatous Disorders (WASOG) adopted by the ATS Board of Directors and by the ERS Executive Committee, February 1999. Am J Respir Crit Care Med 1999; 160(2):736-55. [ Links ]
5. Douglas JG, Middleton WG, Gaddie J, Petrie GR, Choo-Kang YF, Prescott RJ, et al. Sarcoidosis: a disorder commoner in nonsmokers? Thorax 1986; 41(10):787-91. [ Links ]
6. Hosoda Y, Sasagawa S, Yasuda N. Epidemiology of sarcoidosis: new frontiers to explore. Curr Opin Pulm Med 2002; 8(5):424-8. [ Links ]
7. Newman LS, Rose CS, Bresnitz EA, Rossman MD, Barnard J, Frederick M, et al. A case control etiologic study of sarcoidosis: environmental and occupational risk factors. Am J Respir Crit Care Med 2004; 170(12):1324-30. [ Links ]
8. Sharma OP. Sarcoidosis Around the world. Clin Chest Med 2008; 29(3):357-63. [ Links ]
9. Heath CR, David J, Taylor SC. Sarcoidosis: Are there differences in your skin of color patients? J Am Acad Dermatol 2012; 66(1):121. e1-121.e14. [ Links ]
10. Valovis R. Sarcoidosis estudio clínico de 51 casos y revisión de la literatura. Acta Med Colomb 1977; 2 (2):101-10. [ Links ]
11. Hamzeh N. Sarcoidosis. Med Clin North Am 2011; 95(6):1223-34. [ Links ]
12. Rossman MD, Kreider ME. State of the Art. Lesson Learned from ACCESS (a case controlled etiologic study of sarcoidosis). Proceedings of the American Thoracic Society 2007 Aug 15;4 (5):453-6. [ Links ]
13. Gupta D, Agarwal R, Aggarwal AN, Jindal SK. Molecular evidence for the role of mycobacteria in sarcoidosis: a meta-analysis. Eur Respir J 2007 (3):508-16. [ Links ]
14. Gupta D, Agarwal R, Aggarwal AN, Jindal SK. Sarcoidosis and tuberculosis: the same disease with different manifestations or similar manifestations of different disorders. Curr Opin Pulm Med 2012 (5):506-16. [ Links ]
15. Grosser M, Luther T, Fuessel M, Bickhardt J, Magdolen V, Baretton G. Clinical course of sarcoidosis in dependence on HLA-DRB1 allele frequencies, inflammatory markers, and the presence of M. tuberculosis DNA fragments. Sarcoidosis Vasc Diffuse Lung Dis 2005; (1):66-74. [ Links ]
16. Chen ES, Moller DR. Etiology of Sarcoidosis. Clinics in Chest Medicine. 2008 Sep; 29 (3):365-77. [ Links ]
17. Ali M, Atwan A, Gonzalez M. Cutaneous sarcoidosis: updates in the pathogenesis. J Eur Acad Dermatol 2009. (7); 24:747-55. [ Links ]
18. Bachelez H, Senet P, Cadranel J, Kaoukhov A, Dubertret L. The use of tetracyclines for the treatment of sarcoidosis. Arch Dermatol 2001; 137 (1):69-73. [ Links ]
19. Doyle MK, Berggren R, Magnus JH. Interferon- induced sarcoidosis. J Clin Rheumatol 2006 (5):241-8. [ Links ]
20. Tong D, Manolios N, Howe G, Spencer D. New onset sarcoid-like granulomatosis developing during anti-TNF therapy: an underrecognised complication. Intern Med 2012; 42(1):89-94. [ Links ]
21. Fok KC, Ng WWS, Henderson CJA, Connor SJ. Cutaneous sarcoidosis in a patient with ulcerative colitis on infliximab. J Crohns Colitis 2012; 6(6):708-12. [ Links ]
22. Iannuzzi MC. Genetics of sarcoidosis. Monaldi Arch Chest Dis. 1998; 53(6):609-13. [ Links ]
23. Rybicki BA, Iannuzzi MC, Frederick MM, Thompson BW, Rossman MD, Bresnitz EA, et al. Familial aggregation of sarcoidosis. A case-control etiologic study of sarcoidosis (ACCESS). Am J Respir Crit Care Med 2001; 164 (11):2085-91. [ Links ]
24. Familial associations in sarcoidosis. A report to the Research Committee of the British Thoracic and Tuberculosis Association. Tubercle 1973; 54 (2):87-98. [ Links ]
25. Rybicki BA, Kirkey KL, Major M, Maliarik MJ, Popovich J Jr, Chase GA, et al. Familial risk ratio of sarcoidosis in African-American sibs and parents. Am J Epidemiol. 2001; 153 (2):188-93. [ Links ]
26. Iannuzzi MC, Rybicki BA, Teirstein AS. Sarcoidosis. N Engl J Med 2007; 357 (21):2153-65. [ Links ]
27. Iannuzzi MC, Fontana JR. Sarcoidosis: clinical presentation, immunopathogenesis, and therapeutics. JAMA 2011; 305 (4):391-9. [ Links ]
28. Zissel G, Prasse A, Müller-Quernheim J. Immunologic response of sarcoidosis. Semin Respir Crit Care Med 2010(4); 31:390-403. [ Links ]
29. Bordignon M, Rottoli P, Agostini C, Alaibac M. Adaptive immune responses in primary cutaneous sarcoidosis. Clin Dev Immunol 2011; 2011:1-6. [ Links ]
30. Fernandez-Faith E, McDonnell J. Cutaneous sarcoidosis: differential diagnosis. Clinics in Dermatology 2007 May; 25 (3):276-87. [ Links ]
31. Mañá J, Marcoval J, Graells J, Salazar A, Peyrí J, Pujol R. Cutaneous involvement in sarcoidosis. Relationship to systemic disease. Arch Dermatol; 1997; 133(7):882-8. [ Links ]
32. Haimovic A, Sanchez M, Judson MA, Prystowsky S. Sarcoidosis: A comprehensive review and update for the dermatologist. J Am Acad Dermatol 2012; 66(5):699.e1-699.e18 [ Links ]
33. Katta R. Cutaneous sarcoidosis: a dermatologic masquerader. Am Fam Physician 2002; 15(8);65:1581-4. [ Links ]
34. Lodha S, Sanchez M, Prystowsky S. Sarcoidosis of the skin: a review for the pulmonologist. Chest 2009;136(2):583-96. [ Links ]
35. Marchell R, Judson M. Cutaneous Sarcoidosis. Semin Respir Crit Care Med 2010; 31(4):442-51. [ Links ]
36. Sharma OP, Papanikolaou IC. Lupus pernio: a tale of four characters in search of a malady. Sarcoidosis Vasc Diffuse Lung Dis 2009; 26(2):167-71. [ Links ]
37. Hong YC, Na DJ, Han SH, Lee YD, Cho YS, Han MS. A case of scar sarcoidosis. Korean J Intern Med 2008; 23(4):213-5. [ Links ]
38. Rose AS, Tielker MA, Knox KS. Hepatic, ocular, and cutaneous sarcoidosis. Clin Chest Med 2008; 29(3):509-24. [ Links ]
39. Ahmed I, Harshad SR. Subcutaneous sarcoidosis: is it a specific subset of cutaneous sarcoidosis frequently associated with systemic disease? J Am Acad Dermatol 2006; 54(1):55-60. [ Links ]
40. Marcoval J, Moreno A, Mañá J, Peyri J. Subcutaneous Sarcoidosis. Dermatol Clin. 2008;26(4) :553-6. [ Links ]
41. Kelley BP, George DE, LeLeux TM, Hsu S. Ichthyosiform sarcoidosis: A case report and review of the literature. Dermatol Online J 2010; 16(8):5. [ Links ]
42. Sakemi H, Oiwa H. Psoriasiform plaques of sarcoidosis. Intern Med 2009; 48 (5):391. [ Links ]
43. Bouaziz A, Le Scanff J, Chapelon-Abric C, Varron L, Khenifer S, Gleizal A, et al. Oral involvement in sarcoidosis: report of 12 cases. QJM 2012; 105(8):755-67. [ Links ]
44. Katta R, Nelson B, Chen D, Roenigk H. Sarcoidosis of the scalp: a case series and review of the literature. J Am Acad Dermatol 2000; 42(4):690-2. [ Links ]
45. Momen SE, Al-Niaimi F. Sarcoid and the nail: review of the literature. Clin Exp Dermatol 2013; 38(2):119-25. [ Links ]
46. Marchell RM, Thiers B, Judson MA. Sarcoidosis. Fitzpatrick's Dermalology in General Medicine. 7th ed. United States of America: McGraw-Hill; 2008. p. 1494-93. [ Links ]
47. Judson MA. The diagnosis of sarcoidosis. Clin Chest Med 2008; 29(3):415-27. [ Links ]
48. Dempsey OJ, Paterson EW, Kerr KM, Denison AR. Sarcoidosis. BMJ 2009; 33:b3206- b3206. [ Links ]
49. Nagai S, Handa T, Ito Y, Ohta K, Tamaya M, Izumi T. Outcome of Sarcoidosis. Clin Chest Med 2008; 29(3):565-74. [ Links ]
50. Lazar C, Culver D. Treatment of Sarcoidosis. Semin Respir Crit Care Med 2010; 31(4): 501-18. [ Links ]
51. Schwartz RA, Nervi SJ. Erythema nodosum: a sign of systemic disease. Am Fam Physician 2007; 75(5):695-700. [ Links ]
52. Badgwell C, Rosen T. Cutaneous sarcoidosis therapy updated. J Am Acad Dermatol 2007; 56(1):69-83. [ Links ]
53. Doherty CB, Rosen T. Evidence-based therapy for cutaneous sarcoidosis. Drugs 2008; 68(10):1361-83. [ Links ]
54. Baughman RP, Lower EE. Evidence-based therapy for cutaneous sarcoidosis. Clin Dermatol 2007; 25(3):334-40. [ Links ]
Recibido en: abril 14 de 2013. Revisado en: mayo 19 de 2014. Aceptado en: abril 22 de 2014.