Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina
Print version ISSN 0120-8705
CES Med. vol.29 no.1 Medellín Jan./June 2015
Micotoxicosis y micotoxinas: generalidades y aspectos básicos
Mycotoxicosis and mycotoxins: generalities and basic aspects
HÉCTOR ALEJANDRO SERRANO-COLL,1 NORA CARDONA-CASTRO2
1 MD. Estudiante Maestría Medicina Tropical, ICMT-CES. Medellín, Colombia. hectorserranocoll@hotmail.com
2 MD. Ph. Investigadora. Instituto Colombiano de Medicina Tropical - Universidad CES, Medellín, Colombia. ncardona@ces.edu.co.
RESUMEN
El término micotoxicosis hace referencia a un amplio grupo de intoxicaciones causadas por la inhalación, el contacto directo o la ingestión de alimentos que han sido contaminados con micotoxinas, las cuales son metabolitos tóxicos producidos por una gran variedad de hongos filamentosos, entre los que se destacan los géneros Aspergillus, Fusarium, Claviceps, Penicillium y Stachybotrys. Esta es una revisión que analiza el impacto clínico de ciertas micotoxinas (aflatoxinas, ocratoxinas, fumonisinas, tricotecenos) en la génesis de las micotoxicosis en los seres humanos.
PALABRAS CLAVE
Toxicidad, Micotoxicosis, Micotoxinas, Aflatoxinas, Ocratoxinas Fumonisinas Tricotecenos.
ABSTRACT
Mycotoxicosis refers to a large group of poisoning by inhalation, contact or ingestion of food that has been contaminated with mycotoxins, toxic secondary metabolites, produced by a variety of filamentous fungi, Aspergillus, Fusarium, Claviceps, Penicillium and Stachybotrys. This is a review that analyzes the clinical impact of certain mycotoxins (aflatoxins, ochratoxins, fumonisins, trichothecenes) in the genesis of mycotoxicosis in human beings.
KEY WORDS
Toxicity, Mycotoxicosis, Mycotoxins, Aflatoxins, Ochratoxins, Fumonisins, Trichotecenes.
INTRODUCCIÓN
Aspergillus, Fusarium, Claviceps, Penicillium y Stachybotrys son mohos contaminantes habituales del ecosistema agropecuario (1). Las micotoxicosis han sido descritas desde la antigüedad y para algunos investigadores fueron la causa de la última de las diez plagas de Egipto (2,3). Los primeros casos documentados de estas intoxicaciones datan de la Edad Media en Europa, en donde se denominó a este cuadro clínico como "fuego del infierno", debido a las alucinaciones, psicosis, delirios, convulsiones, sensación de quemazón y necrosis distal, que producían como resultado de la ingestión de alimentos preparados con cereales contaminados con alcaloides del cornezuelo o Claviceps puerpurea (3,4).
La micotoxicología moderna nace en 1962 gracias al descubrimiento de las aflatoxinas, a raíz de una crisis veterinaria que ocurrió cerca de Londres y en la que murieron alrededor de 100 000 pavos a causa de esta micotoxina (5,6).
Las micotoxinas son producidas principalmente por hongos filamentosos bajo unas condiciones óptimas de temperatura que oscilan entre los 20-25 °C, requieren de un pH entre 4 y 8 y una humedad relativa de 80 a 90 % (7). Por su capacidad toxigénica las micotoxinas más importantes son: aflatoxinas, ocratoxinas, tricotecenas (deoxinivalenol- toxina T2) y las fumonisinas (8).
La exposición a sus metabolitos tóxicos puede generar carcinogénesis, teratogénesis, inmunosupresión y cuadros clínicos de neurotoxicidad, nefrotoxicidad, hepatotoxicidad, mielotoxicidad, toxicidad pulmonar y endocrina (9,10); siendo los mecanismos más importantes para la aparición de tales manifestaciones el estrés oxidativo y la genotoxicidad inducida por micotoxinas (11).
En esta revisión se analiza el impacto de las micotoxicosis en seres humanos inducida por micotoxinas producidas esencialmente por los géneros Aspergillus y Fusarium.
MICOTOXICOSIS INDUCIDA POR HONGOS DEL GéNERO ASPERGILLUS
Aspergillus es un género de hongos filamentosos, hialinos, saprofitos, ubicuos, pertenecientes al phylum Ascomicota. Este moho está formado por hifas hialinas y tienen reproducción sexual (con formación de ascosporas en el interior de las ascas) y reproducción asexual (con formación de conidios). El hongo es un contaminante habitual de alimentos almacenados (granos y cereales), cuyas condiciones óptimas para la producción de micotoxinas son 25°C y una humedad relativa del 95 %.
Las principales toxinas producidas por este género de mohos son las aflatoxinas y las ocratoxinas (10,12), descritas a continuación:
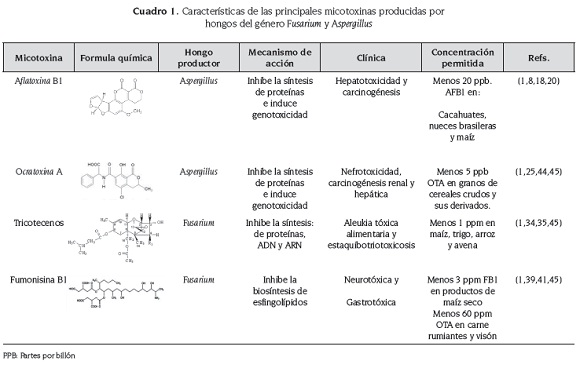
Aflatoxinas: son micotoxinas cancerígenas, teratogénicas, mutagénicas, que tienen tropismo por órganos como hígado, cerebro y riñón. Estas toxinas son producidas bajo condiciones óptimas de temperatura y humedad por A. flavus y A. parasiticus y su síntesis está regulada por los genes (AFLR y AFLS). Se han descrito 18 tipos de esta micotoxina donde se destacan B1, B2, G1, G2, M1, M2. El metabolito tóxico más importante de este grupo es la aflatoxina B1(13,14).
Aflatoxina B1 (AFB1): es un contaminante habitual en climas tropicales y subtropicales de alimentos almacenados (cacahuetes, pistachos, maíz y arroz); esta micotoxina se ha descrito como un potente carcinógeno dietario y está implicado en la etiología del carcinoma hepatocelular. Además, se ha asociado a inmunosupresión y a graves déficits nutricionales (15,16).
El mecanismo toxicológico de AFB1 (cuadro 1) está dado por su radical epóxido, el cual interactúa con proteínas de conjugación, generando toxicidad, inhibición en la síntesis de proteínas e inmunosupresión y además, es capaz de producir genotoxicidad e inducir procesos cancerígenos, debido a la mutación del gen P53, donde se produce la transversión de una guanina a tiamina en el codón 249 (7,17,18).
La intoxicación con esta toxina se denomina aflatoxicosis, en la cual se evidencian dos formas clínicas: aguda y crónica (cuadro 1). La forma aguda está asociada a nefrotoxicidad, cardiotoxicidad y principalmente a hepatotoxicidad, generando un cuadro caracterizado por ictericia, vómitos, dolor abdominal e insuficiencia hepática, provocando de esta manera la muerte (19).
La forma crónica está relacionada con desnutrición protéica, carcinogénesis e inmunosupresión. Debido que estas sustancias inducen aplasia tímica, afectan el número y la función de los linfocitos, inhiben la fagocitosis, reducen la actividad del complemento y disminuyen la expresión de IL-2, como consecuencia de la exposición permanente a dosis sub-letales de esta micotoxina (19).
En humanos portadores del virus de la hepatitis B, la exposición a esta micotoxina se ha relacionado a un incremento de 60 veces el riesgo de carcinoma hepatocelular con respecto a la población general, dado que AFB1 es 30 veces más potente en pacientes portadores de estos virus (20).
Hoy en día, algunos países desarrollados tienen una legislación clara en cuanto a las concentraciones de AFB1 permitidas en sus alimentos, la cual no puede superar las 20 partes por billón (ppb). Adicionalmente, algunos expertos coinciden en que es fundamental trabajar en estrategias preventivas para evitar la exposición a estas toxinas, siendo la más importante la tecnificación del sector agrícola y evitar así la contaminación de los cereales con hongos productores de micotoxinas (21).
Ocratoxinas: son un grupo de metabolitos secundarios tóxicos producidos principalmente por hongos de los géneros Aspergillus y Penicillium, los cuales son contaminantes habituales de cereales, café, pan y alimentos de origen animal. Se han descrito cinco tipos de ocratoxinas: A, B, C, α y β, siendo la más tóxica la ocratoxina A (3).
Ocratoxina A (OTA): es una micotoxina nefrotóxica, cancerígena y mutagénica, la cual es producida esencialmente por las especies Aspergillus ochraceus y A. nigri
OTA es soluble en disolventes orgánicos y ligeramente soluble en agua. Es absorbida en el tracto digestivo, especialmente en el intestino delgado y de ahí es transportada a través de la sangre, principalmente a los riñones y en una menor concentración se deposita en el hígado, en músculos y en grasa (22,23).
Se ha demostrado que ocratoxina A es nefrotóxica, hepatotóxica, teratogénica e inmunotóxica. Además, tiene sinergismo contra otras micotoxinas nefrotóxicas como la citrinina (24).
El mecanismo toxicológico de ocratoxina A está mediado por la inhibición del factor nuclear eritroide- 2 (Nrf2) y la transcripción del gen Nrf2, lo que genera estrés oxidativo, producción de especies reactivas de oxígeno, que inducen a la inhibición en la síntesis de proteínas, interfieren con los sistemas metabólicos, promueven la peroxidación de lípidos de membrana, perturban la homeostasis del calcio, inhiben la respiración mitocondrial y provocan daño del DNA (25-27).
Además, puede inducir a fallos en la apoptosis y a alteraciones en el gen P 53. Por lo tanto esta micotoxina es causante de nefrotoxicidad, teratogénesis y se comporta como un agente promotor del cáncer renal y hepático (25-27).
Se ha relacionado con la nefropatía endémica de Los Balcanes, aunque esta hipótesis no se ha demostrado completamente, a causa de que otros agentes nefrotóxicos podrían estar involucrados en la génesis de la enfermedad (cuadro 1) Se trata de una nefritis progresiva crónica y de lenta evolución, caracterizada por esclerosis glomerular e intersticial difusa, que se asocia a fallo renal terminal y coma azoémico (22,23).
En torno a esta enfermedad existen dos hipótesis: 1) la de las micotoxinas, en la que se considera que es producida por ingestión de ocratoxina A en forma intermitente por los individuos de esta región; y. 2) la de una intoxicación alimentaria crónica producida por el ácido aristolóquico, que podría ser el responsable de la enfermedad, debido a que este ácido es capaz de inducir fibrosis túbulo intersticial, insuficiencia renal crónica y se asocia a un mayor riesgo de desarrollar cáncer urotelial superior. Sin embargo, las investigaciones han demostrado que ninguna de estas exposiciones están firmemente vinculados a la nefropatía endémica de Los Balcanes (3,28-30).
MICOTOXICOSIS INDUCIDA POR HONGOS DEL GÉNERO FUSARIUM
El género Fusarium es un grupo de hongos filamentosos con más de 100 especies descritas, las cuales están ampliamente distribuidas en el suelo y plantas de zonas tropicales y subtropicales (31). Este es uno de los grupos de mohos que tiene mayor capacidad genética para sintetizar micotoxinas bajo condiciones óptimas de temperatura que oscilan entre los 18 a 30 °C y una humedad relativa del 88 % (10).
Las micotoxinas producidos del género Fusarium son capaces de inducir efectos tóxicos agudos y crónicos que suelen relacionarse con el tipo de micotoxina, el nivel de exposición, las especies animales que se exponen y la edad de estos (32). Las principales micotoxinas producidas por este género son: tricotecenas, fumonisinas y zearalelona (10).
Tricotecenos: son producidas por hongos fitotóxicos del género Fusarium, esencialmente por las especies: F. tricinctum, F. nivale, F. roseum, F. graminearum, F. solani, F. culmorum y F. poae. De estas micotoxinas se han identificado más de 200 derivados que se dividen en dos grupos (A-B), siendo las toxinas más importantes del grupo A la toxina T2, la toxina HT-2, diacetoxiscirpenol, monoacetoxiscirpenol, triacetoxiscirpenol y escirpentriol, y las del grupo B son la vomitoxina o deoxinivalenol, fugarenona X, nivalenol. Estas toxinas son contaminantes habituales de cereales y pueden generar toxicidad tanto en animales como en seres humanos (10,33,34).
El mecanismo de toxicidad de estas micotoxinas (cuadro 1) está mediado por su interacción con la unidad ribosomal 60s, lo cual genera la separación de la subunidad rRNA 28s, el bloqueo de los procesos de elongación y la activación de proteínas inactivadoras de ribosomas (RIPs), provocando de esta manera estrés ribotóxico y daños en el rRNA, lo que provoca la inhibición del proceso de traducción y de la síntesis de proteínas, generando de esta manera toxicidad, inhibición de la síntesis de ADN y ARN, alteración en la división celular, en la estructura de la membrana. Además, compromete la integridad y la función de la mitocondria (34).
La exposición a ciertas micotoxinas tricotecenas como deoxinivalenol y la toxina T2 se ha asociado principalmente a aleukia tóxica alimentaria (ATA). Se trata de una intoxicación caracterizada por inflamación de la piel, vómitos y daño a los tejidos hematopoyéticos. La fase aguda se acompaña de necrosis en la cavidad oral, sangrado de la nariz, de la boca y la vagina, además de trastornos del sistema nervioso central y digestivo comprometiendo la integridad del epitelio y de las células inmunes a nivel intestinal, generando así altas tasas de mortalidad dada su predisposición a infecciones oportunistas (35,36).
Fumonisinas: son un grupo de micotoxinas que contaminan el maíz y son producidas principalmente por hongos del género Fusarium. Fueron aisladas y descritas por primera vez en Sudáfrica en 1988, y de acuerdo con la Agencia Internacional de Investigación en Cáncer (IARC, por sus siglas en inglés), desde 1993 se encuentran catalogadas en el grupo 2B como posibles carcinógenos humanos por detrás de AFB1 que se encuentra en el grupo 1 de esta clasificación. Existen 15 tipos de fumonisinas agrupadas en cuatro categorías (A, B, C, P); siendo las más conocidas FB1, FB2 y FB3, de las cuales FB1 es la más tóxica y representa aproximadamente 70 % de la fumonisina total (37).
Fumonisina B1: Es una micotoxina sintetizada durante el metabolismo de cepas toxigénicas de Fusarium verticilloides y F. proliferatum. Las intoxicaciones con esta toxina se han asociado al consumo crónico de maíz y de alimentos derivados de este cereal, que están contaminados con pequeñas concentraciones de FB1. En humanos esta toxina se ha asociado a cáncer esofágico y defectos en el cierre del tubo neural y en animales se ha relacionado a edema pulmonar, hepatoxicidad, neurotoxicidad y nefrotoxicidad (7,38).
El mecanismo de toxicidad de FB1 consiste en bloquear la síntesis de esfingolípidos, los cuales son elementos esenciales en la estructura de la membrana celular, particularmente en las células nerviosas y tienen como función controlar los mecanismos de regulación de la célula actuando como segundos mensajeros en los procesos de crecimiento, diferenciación y muerte celular (cuadro 1) (39,40).
Esta alteración en la biosíntesis de esfingolípidos ocurre como consecuencia de la inhibición de la enzima ceramida sintasa, lo que genera la acumulación de compuestos como son esfingonina y esfingosina, los cuales generan neurotoxicidad, nefrotoxicidad y hepatoxicidad (39,40).
El consumo de alimentos preparados con cereales contaminados con esta micotoxina se ha asociado a intoxicaciones agudas (cuadro 1), en las cuales se presentan manifestaciones gastrointestinales como vómitos, diarrea, dolor abdominal y deshidratación (41).
La toxina se ha asociado a cáncer de esófago en el sur de áfrica, donde se ha relacionado a un bajo status económico, además de dietas ricas en maíz y cereales; alimentos en donde se han aislado altas concentraciones de esta micotoxina (42). FB1 también se ha relacionado con malformaciones congénitas, dado que al bloquear la biosíntesis de esfingolípidos se disminuye la absorción de folato en las gestantes y ésto se ha relacionado con defectos en el cierre del tubo neural (43).
CONCLUSIONES
Las micotoxinas siguen siendo un problema real que afecta silenciosamente la salud pública en países en vía de desarrollo. La investigación en este tema es fundamental para mitigar su impacto, dado los efectos mutagénicos y carcinogénicos causados por estas sustancias tóxicas. Es necesario que las comunidades en riesgo sean educadas a través de seminarios, talleres y anuncios sobre estas toxinas para que de esta manera tengan una percepción de los graves daños que ellas causan en la salud de los seres humanos, de sus animales y en los cultivos agrícolas.
CONFLICTO DE INTERESES
Los autores declaran que no hay conflicto de intereses en relación con la publicación de este documento.
REFERENCIAS
1. Bonifaz A. Micología clinica básica. 4 edición. Mcgraw Hill; 2012. [ Links ]
2. Marr JS, Malloy CD. An epidemiologic analysis of the ten plagues of Egypt. Caduceus Springf Ill. 1996;12(1):7-24. [ Links ]
3. González Salgado A. Diagnóstico y control de especies de Aspergillus productoras de Ocratoxina A. Universidad Complutense de Madrid; 2010. [ Links ]
4. Beardall, J.M., Miller, J.D. Diseases in humans with mycotoxins as possible causes. En: Mycotoxins in Grain: Compounds other than Aflatoxin. 1994; [ Links ]
5. Parada R. Micotoxinas y micotoxicosis del ganado [Internet]. 1988. Recuperado a partir de: http://www.monografiasveterinaria.uchile.cl/index.php/MMV/article/view/6147/6004 [ Links ]
6. Asao T, Buechi G, Abdel-Kader MM, Chang SB, Wick EL, Wogan GN. The structures of aflatoxins B and G. J Am Chem Soc. 1965;87:882-6. [ Links ]
7. Murray PR, Rosenthal KS, Pfaller MA. Medical microbiology. 6th ed. St. Louis: Mosby ; 2009. [ Links ]
8. Darwish WS, Ikenaka Y, Nakayama SMM, Ishizuka M. An overview on mycotoxin contamination of foods in Africa. J Vet Med Sci. 2014;76(6):789-97. [ Links ]
9. Marroquín AG, Johnson NM, Phillips TD, Hayes AW. Mycotoxins in a changing global environment-- a review. Food Chem Toxicol Int J Publ Br Ind Biol Res Assoc. 2014;69:220-30. [ Links ]
10. Gimeno A, Martins ML. Micotoxinas y micotoxicosis en animales y humanos. 3 edición. 2011. [ Links ]
11. Hope J. A review of the mechanism of injury and treatment approaches for illness resulting from exposure to water-damaged buildings, mold, and mycotoxins. ScientificWorldJournal. 2013;2013:767482. [ Links ]
12. Segal BH. Aspergillosis. N Engl J Med. 30 de abril de 2009;360(18):1870-84. [ Links ]
13. Shan X, Williams WP. Toward elucidation of genetic and functional genetic mechanisms in corn host resistance to Aspergillus flavus infection and aflatoxin contamination. Front Microbiol. 2014;5:364. [ Links ]
14. Medina A, Rodriguez A, Magan N. Effect of climate change on Aspergillus flavus and aflatoxin B1 production. Front Microbiol. 2014;5:348. [ Links ]
15. Yunus AW, Razzazi-Fazeli E, Bohm J. Aflatoxin B(1) in affecting broiler's performance, immunity, and gastrointestinal tract: a review of history and contemporary issues. Toxins. 2011;3(6):566-90. [ Links ]
16. Gross K, Eaton DL. Dietary modulation of the biotransformation and genotoxicity of aflatoxin B(1). Toxicology. 2012;299(2-3):69-79. [ Links ]
17. Williams JH, Phillips TD, Jolly PE, Stiles JK, Jolly CM, Aggarwal D. Human aflatoxicosis in developing countries: a review of toxicology, exposure, potential health consequences, and interventions. Am J Clin Nutr. 2004;80(5):1106-22. [ Links ]
18. Kew MC. Aflatoxins as a cause of hepatocellular carcinoma. J Gastrointest Liver Dis JGLD. septiembre de 2013;22(3):305-10. [ Links ]
19. Yard EE, Daniel JH, Lewis LS, Rybak ME, Paliakov EM, Kim AA, et al. Human aflatoxin exposure in Kenya, 2007: a crosssectional study. Food Addit Contam Part Chem Anal Control Expo Risk Assess. 2013;30(7):1322-31. [ Links ]
20. El Serag HB. Epidemiology of viral hepatitis and hepatocellular carcinoma. Gastroenterology. 2012;142(6):1264-73.e1. [ Links ]
21. Mohd S, Jamaluddin R, Abd-Mutalib MS, Ahmad Z. A mini review on aflatoxin exposure in Malaysia: past, present and future. Front Microbiol. 2013;4:334. [ Links ]
22. Sorrenti V, Di Giacomo C, Acquaviva R, Barbagallo I, Bognanno M, Galvano F. Toxicity of ochratoxin a and its modulation by antioxidants: a review. Toxins. 2013;5(10):1742-66. [ Links ]
23. De Fátima E, Borges JG, Cirillo MÂ, Prado G, Paiva LC, Batista LR. Ochratoxigenic fungi associated with green coffee beans (Coffea arabica L.) in conventional and organic cultivation in Brazil. Braz J Microbiol Publ Braz Soc Microbiol. 2013;44(2):377-84. [ Links ]
24. Ostry V, Malir F, Ruprich J. Producers and important dietary sources of ochratoxin A and citrinin. Toxins. 2013;5(9):1574-86. [ Links ]
25. Kamp HG, Eisenbrand G, Janzowski C, Kiossev J, Latendresse JR, Schlatter J, et al. Ochratoxin A induces oxidative DNA damage in liver and kidney after oral dosing to rats. Mol Nutr Food Res. 2005;49(12):1160- 7. [ Links ]
26. Klaric MS, Rašic D, Peraica M. Deleterious effects of mycotoxin combinations involving ochratoxin A. Toxins. 2013;5(11):1965-87. [ Links ]
27. Limonciel A, Jennings P. A review of the evidence that ochratoxin A is an Nrf2 inhibitor: implications for nephrotoxicity and renal carcinogenicity. Toxins. 2014;6(1):371-9. [ Links ]
28. Tatu CA, Orem WH, Finkelman RB, Feder GL. The etiology of Balkan endemic nephropathy: still more questions than answers. Environ Health Perspect. 1998;106(11):689- 700. [ Links ]
29. Hranjec T, Kovac A, Kos J, Mao W, Chen JJ, Grollman AP, et al. Endemic nephropathy: the case for chronic poisoning by aristolochia. Croat Med J. 2005;46(1):116-25. [ Links ]
30. Long DT, Voice TC. Role of exposure analysis in solving the mystery of Balkan endemic nephropathy. Croat Med J. 2007;48(3):300- 11. [ Links ]
31. Tapia C, Amaro J. Género Fusarium. Rev Chilena Infecto [Internet]. 2014; Recuperado a partir de: www.sochinf.cl [ Links ]
32. Antonissen G, Martel A, Pasmans F, Ducatelle R, Verbrugghe E, Vandenbroucke V, et al. The impact of Fusarium mycotoxins on human and animal host susceptibility to infectious diseases. Toxins. 2014;6(2):430-52. [ Links ]
33. Suzuki T, Iwahashi Y. Phytotoxicity evaluation of type B trichothecenes using a Chlamydomonas reinhardtii model system. Toxins. 2014;6(2):453-63. [ Links ]
34. Bin MA, McLaughlin JE, Basu D, McCormick S, Tumer NE. Trichothecene mycotoxins inhibit mitochondrial translation--implication for the mechanism of toxicity. Toxins. 2011;3(12):1484-501. [ Links ]
35. Bennett JW, Klich M. Mycotoxins. Clin Microbiol Rev. 2003;16(3):497-516. [ Links ]
36. Pinton P, Oswald IP. Effect of deoxynivalenol and other Type B trichothecenes on the intestine: a review. Toxins. 2014;6(5):1615-43. [ Links ]
37. Torres L, López L. Fumonisin intake and human health. Salud Pública México. 2010;52(5):461-7. [ Links ]
38. Theumer M, Mary V, Arias S, Rubinstein H. Toxicity mechanism of fumonisin B1 in animals and plant cells. revista bioscience. 2012; 2(1):32-44. [ Links ]
39. Merrill AH, Sullards MC, Wang E, Voss KA, Riley RT. Sphingolipid metabolism: roles in signal transduction and disruption by fumonisins. Environ Health Perspect. 2001;109 Suppl 2:283-9. [ Links ]
40. Soriano JM, González L, Catalá AI. Mechanism of action of sphingolipids and their metabolites in the toxicity of fumonisin B1. Prog Lipid Res. 2005;44(6):345-56. [ Links ]
41. Peraica M, Radic B, Lucic A, Pavlovic M. Toxic effects of mycotoxins in humans. Bull World Health Organ. 1999;77(9):754-66. [ Links ]
42. Scott PM. Fumonisins. Int J Food Microbiol. 1993;18(4):257-70. [ Links ]
43. Suarez L, Felkner M, Brender JD, Canfield M, Zhu H, Hendricks KA. Neural tube defects on the Texas-Mexico border: what we've learned in the 20 years since the Brownsville cluster. Birt Defects Res A Clin Mol Teratol. 2012;94(11):882-92. [ Links ]
44. Uribarren T. Micotoxicosis [Internet]. 2012 jun 11. Recuperado a partir de: http://www.facmed.unam.mx/deptos/microbiologia/micologia/micotoxicosis.html [ Links ]
45. Murphy P, Hendrich S, Landgren C. Food Mycotoxins: An Update. JFS. 2006;volumen 71. [ Links ]
Recibido en: octubre 20 de 2014. Revisado en: mayo 14 de 2015. Aceptado en: mayo 21 de 2015.
Forma de citar:Serrano-Coll HA, Cardona-Castro N. Micotoxicosis y micotoxinas: generalidades y aspectos básicos. Rev CES Med 2015;29(1):143-152.