Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
CES Medicina
versión impresa ISSN 0120-8705
CES Med. vol.29 no.2 Medellín jul./dic. 2015
Estudio de biodisponibilidad de metformina 850 mg tabletas de liberación inmediata
Bioavalability study of Metformin 850 mg immediate-release tablets
ENRIQUE MUÑOZ-CARNAGO1, DANIEL HORACIO OCAMPO-OSORIO2, EDGAR EMILIO ESPINAL-LÓPEZ3, JULIO SANÍN4, NATALIA YEPES-JIMÉNEZ3, ESTEBAN ALEXANDER LOPERA-MAYA5
1 Bioquímico, Coordinador de estudios clínicos CECIF. (Centro de la ciencia y la investigación farmacéutica) Colombia. estudiosbiofarmaceuticos@cecif.org
2 Químico Farmacéutico, CECIF, Colombia.
3 Químico, CECIF, Colombia.
4 Médico, CECIF, Colombia.
5 Ing. Biológico, CECIF, Colombia.
Grupo de investigación CECIF
Forma de citar: Muñoz-Carnago E, Ocampo-Osorio DH, Espinal-López EE, Sanín J, Yepes-Jiménez N, Lopera-Maya EA. Estudio de biodisponibilidad de metformina 850 mg tabletas de liberación inmediata. Rev CES Med 2015;29(2): 199-210
Recibido en: julio 3 de 2014. Revisado en: julio 5 de 2015. Aceptado en: julio 31 de 2015
RESUMEN
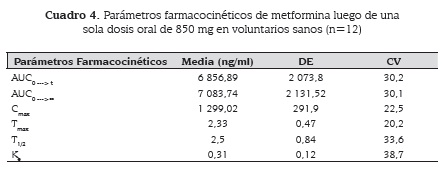
Se desarrolló un estudio de biodisponibilidad de metformina 850 mg tabletas recubiertas de liberación inmediata elaboradas por Laboratorios Coaspharma S.A., en 12 voluntarios sanos de ambos sexos, con edades entre 18 y 26 años. Para llevarlo a cabo se validó previamente un método bioanalítico para la determinación de metformina en plasma humano por cromatografía líquida de alta resolución con detector ultravioleta (HPLC-UV), el cual resultó ser selectivo, específico, lineal, exacto y preciso, por lo tanto adecuado para el análisis de las muestras. Estas fueron recolectadas periódicamente en un lapso desde 0 a 24 horas, luego de la administración por vía oral de una única dosis de metformina 850 mg. Posteriormente se determinaron los parámetros farmacocinéticos promedio de los 12 participantes, obteniendo: área bajo la curva, desde tiempo cero hasta el último tiempo de muestreo t (AUC0--->t) 6856,89 ± 2073,8 ng.h/ml, área bajo la curva desde tiempo cero hasta tiempo infinito (AUC0--->∞) 7083,74 ± 2131,52 ng.h/ml, concentración máxima (Cmaxmax) 1299,02 ± 291,90 ng/ml, tiempo máximo (t) 2,33 ± 0,47 h, tiempo de vida media (t1/2) 2,50 ± 0,84 h y constante aparente de eliminación (Ke) de 0,31 ± 0,12 h-1. Los resultados fueron similares en todos los participantes y no se produjeron reacciones adversas.
PALABRAS CLAVES: Metformina, Disponibilidad biológica, Farmacocinética, Cromatografía líquida de alta presión, Espectrofotometría ultravioleta.
ABSTRACT
A bioavailability study was conducted in 12 healthy volunteers of both genders, aged between 18 and 26. Previous to the study, a bioanalytical method for determination of metformin in human plasma by high performance liquid chromatography with ultraviolet detector (HPLCUV) was validated, and proved to be selective, specific, linear, accurate precise, and therefore, suitable for analysis in plasma. Samples were collected from 0 to 24 hours after the oral administration of a single dose of metformin 850 mg immediate-release coated tablets, produced by Coaspharma S.A. Laboratories. Then, average pharmacokinetic parameters of the twelve volunteers were determined: area under the curve from time zero to last sampling time t (AUC0--->t) 6856.89 ± 2073.8 ng.h/mL, area under the curve from time zero to infinite time (AUC0--->∞) 7083.74 ± 2131.52 ng.h/ml, maximum concentration (Cmax) 1299.02 ± 291.90 ng/mL, maximum time (tmax) 2.33 ± 0.47 h, half-life (t1/2) 2.50 ± 0.84 h and apparent elimination constant (Ke) of 0.31 ± 0.12 h-1. These results are similar between the volunteers and no adverse effect was observed. Also, the results are in agree with those reported in literature.
KEY WORDS: Metformin, Biological bioavailability, High performance liquid chromatography, Pharmacokinetics, Ultraviolet spectrophotometry.
INTRODUCCIÓN
La metformina es un agente antihiperglucemiante oral perteneciente al grupo de las biguanidas, que mejora la tolerancia a la glucosa en pacientes con diabetes tipo 2 disminuyendo la glucosa plasmática basal y post-prandial (1). La metformina no está relacionada químicamente o farmacológicamente con otras clases de agentes antihiperglucemiantes orales. En oposición a las sulfonilúreas, la metformina no produce hipoglicemia en pacientes con diabetes tipo 2 o en sujetos normales y evita la hiperinsulinemia, responsable del aumento de tejido adiposo y de peso a largo plazo (1).
La farmacocinética de la metformina está caracterizada por una absorción lenta e incompleta (biodisponibilidad 50-60 %) (2).
Su distribución es muy rápida por tejidos, acumulándose en el tubo digestivo y en menor medida en riñón e hígado. Accede lentamente a eritrocitos (5 % de la dosis de sangre), alcanzando una concentración en sangre menor que en plasma. Apenas se une a proteínas plasmáticas. El volumen de distribución (Vd) reportado es 654 ± 358 l y la concentración en el estado estacionario (Css) < a 1 µg/ml, entre las 24 y 48 h. No se han descrito metabolitos en humanos (2). Durante los ensayos clínicos controlados de metformina 850 mg, los niveles plasmáticos máximos no exceden 5 µg/mL, a una dosis máxima uniforme.
El tiempo de vida media plasmática fluctúa entre 1,5 y 4,5 h (2). Además, cerca de 30 a 50 % de una dosis oral es excretada en orina de forma no modificada en 24 h por un mecanismo de secreción tubular y, en menor medida, de filtración glomerular; cerca del 30 % de la dosis es eliminada de forma inalterada en las heces (2).
En trabajos previos (3,4) se ha reportado para metformina 850 mg tabletas que las concentraciones plasmáticas máximas en la mayoría de los casos alcanzan entre 590 a 1300 ng/ ml (2) y el tiempo en alcanzarla es aproximadamente entre 2,5 a 3,0 horas. Este último es un parámetro que depende mucho de las características de los pacientes; por lo tanto su valor es característico de la población en que se midió. En 2002, Najib y Marathe reportaron un área bajo la curva desde tiempo cero hasta tiempo infinito (AUC0--->∞) entre 5300 a 7300 ng.h/ml (3, 4).
El objetivo de este estudio fue evaluar la biodisponibilidad de una formulación de metformina 850 mg elaborada en Laboratorios Coaspharma S.A., para determinar el comportamiento cinético del producto en la población colombiana y tener una base para determinar en futuros estudios su intercambiabilidad total con otras formulaciones de metformina, incluyendo el innovador.
MATERIALES Y MÉTODOS
Reactivos
Estándar USP metformina HCL 99 % suministrado por Laboratorio Laproff S.A. (Medellín, Colombia), heptanosulfonato de sodio, acetonitrilo grado HPLC y diclorometano marca JT. Baker (Medellín, Colombia), fosfato de sodio dibásico anhidro (NaH2PO4) marca Carlo Erba Reagents de Filtración y Análisis Ltda. (Medellín-Colombia), agua desionizada obtenida utilizando un equipo de osmosis inversa e intercambio iónico Puro Line PL-5000 Moises®.
Sujetos
Los voluntarios fueron colombianos sanos de ambos sexos, con edades entre 18 y 26 años, con un límite de diferencia de peso de un 15 % de acuerdo con la talla (5). El criterio de inclusión abarcaba no tener ningún antecedente de enfermedad hepática, cardíaca, renal, sanguínea o del sistema nervioso central; presión sanguínea normal (en adultos la presión sistólica debería ser menor de 120 - 130 mm Hg y la presión diastólica de 80 - 90 mm Hg) y ritmo cardiaco adecuado (el ritmo normal en reposo es de 60 a 100 pulsaciones por minuto); resultados normales de los exámenes clínicos practicados: hemograma completo, glicemia en ayunas, análisis de amino tranferasas, colesterol total, creatinina sérica, triglicéridos séricos, prueba de VIH, albúmina sérica, citoquímico de orina) y prueba de embarazo negativa.
Los sujetos fueron informados de la naturaleza del estudio y se obtuvo un consentimiento informado escrito de todos los voluntarios. Se les solicitó no ingerir algún medicamento, inductor enzimático e incluso anticonceptivos, por lo menos dos semanas antes del primer período de toma de muestras (6,7), evitar consumir alimentos o bebidas que contuvieran xantinas: chocolates, té, café y bebidas colas; no haber consumido productos alcohólicos y cigarrillos 48 horas antes de la administración de dosis. A los voluntarios no se les permitió tomar agua una hora antes de la administración de la dosis y presentaron ayuno de 12 horas antes de la administración de la tableta de metformina 850 mg.
Condiciones del estudio de biodisponibilidad
El protocolo y el consentimiento informado para este estudio fueron aprobados por Comité de Bioética para la Investigación en Humanos de CECIF (Medellín-Colombia), el cual está regido por la Resolución 8430 del 4 de octubre de 1993 del Ministerio de Salud de Colombia (6), los principios de la Asamblea Médica Mundial expuestos en la Declaración de Helsinki de 1964 y revisada en 2008 (9), el Código de Regulaciones Federales, título 45, parte 46, para la protección de los sujetos humanos del Departamento de Salud y Servicios Humanos de los Institutos Nacionales de Salud de los Estados Unidos (junio 18 de 1991) y por la Resolución 2378 de junio 25 de 2008 del Ministerio de la Protección Social (8).
El estudio se realizó administrando por vía oral una dosis única de la formulación de metformina 850 mg tabletas, correspondiente al lote suministrado por Coaspharma S.A., aprobado por el laboratorio de control de calidad Los voluntarios fueron reunidos por más de 24 horas en el área clínica del CECIF en condiciones de alojamiento idénticas para llevar a cabo la toma de muestras. La dosis se administró a los voluntarios vía oral, con 240 ml de agua. Todos permanecieron en condiciones de alojamiento idénticas, tales como: actividad física, posición al sentarse o acostarse, entre otras (11) y se les permitió desayunar tres horas luego de la administración de la dosis.
Las muestras de sangre fueron tomadas de la vena ante-cubital de cada voluntario a los siguientes tiempos: 0; 0,5; 1; 1,5; 2, 2,5; 3; 3,5; 4; 4,5; 5; 6; 8; 10; 12; 14 y 24 h (12). Se almacenaron en tubos de ensayo con anticoagulante (citrato de sodio), luego se centrifugaron a 3 500 rpm para obtener el plasma sanguíneo; este se almacenó en tubos estériles y se llevó inmediatamente a -20 ºC hasta el momento de su análisis (13).
Durante el ensayo clínico los voluntarios estuvieron bajo cuidado médico con monitoreo de los signos vitales y demás para prevenir o contrarrestar cualquier reacción adversa.
Descripción del método analítico
Las condiciones de extracción de las muestra de metformina en plasma y del método analítico para la determinación de concentraciones en plasma de metformina fueron determinadas revisando previamente la literatura y realizando modificaciones hasta su optimización (11,14-17).
Instrumentación y condiciones analíticas
Para determinar las concentraciones de metformina en plasma se validó un método por HPLCUV. Para lo cual se utilizó un equipo HPLC Agilen Technologies 1100 Series®, con degasificador G1379A, bomba cuaternaria G1311A, inyector automático G1329A y detector UV G1314A. La adquisición de los datos se desarrolló usando el software Agilent ChemStation B.03.01®. La separación del analito se logró con una columna Agilent Zorbax SB-Aq 4,6 x 150 mm ®, 5 µm a una temperatura de 40 oC Se realizó elución isocrática con fase móvil compuesta por buffer heptanosulfonato de sodio - NaH2PO4 (pH: 5,0): acetonitrilo; 90:10, a un flujo constante de 1 ml/ min. El tiempo total de los corridos fue 13 min. La metformina HCL fue monitoreada a 234 nm y el volumen de inyección fue de 30,0 µL.
Preparación de estándares y muestras de control de calidad
La solución stock de metformina se preparó a 1 000 µg/ml en fase móvil y la solución de trabajo de trabajo se preparó por dilución de la solución stock en el mismo solvente a 100 µg/ml y posteriormente a 10 µg/ml. La curva de calibración se construyó simulando plasma y de donantes sanos al cual se le añadió la solución de trabajo de metformina de 10 µg/ml a los niveles de concentración: 100, 250, 500, 1 000, 2 000, 3 000, 4 000 y 5 000ng/ml.
Preparación de muestras
La extracción de metformina desde el plasma simulado o de muestra de los voluntarios se realizó mediante extracción líquido-líquido. Para lograrlo se adicionó 500 µl de plasma en un microtubo de 1,5 ml, luego se le adicionó 500 µl de acetonitrilo y se llevó a agitación en vórtex durante un minuto. Se centrifugó a 5 000 rpm x 10 minutos y se separó el sobrenadante en un nuevo microtubo. A continuación se adicionó 300 µl de diclorometano y se llevó nuevamente a agitación en el vórtex durante un minuto. Se centrifugó a 5 000 rpm x 45 minutos y posteriormente se tomó el sobrenadante, el cual se filtró al vacío en un equipo de extracción en fase sólida utilizando filtros de 0,45 µm en viales de alta recuperación. Por último se inyectaron 30,0 µL de muestra en el HPLC-UV.
Validación
La validación del método bioanalítico para cuantificar metformina desde plasma se llevó a cabo siguiendo los lineamientos establecidos en guías para la validación de métodos analíticos internacionales (18-21). La selectividad y la especificidad del método se determinaron efectuando extracciones líquido-líquido en tres muestras diferentes de plasma enriquecido con metformina a tres concentraciones estándar y comparándolas con extracciones de seis muestras de blanco de plasma.
Para determinar la linealidad se realizaron tres curvas de calibración graficando el área de pico de metformina vs concentración de metformina en plasma y se verificó si los resultados cumplían con las especificaciones estadísticas de biomuestras y con la flexibilidad que corresponde sin comprometer aspectos de calidad según normas internacionales.
Se aceptaron coeficientes de variación (CV) = 15 % como máximo alrededor de la media de las concentraciones superiores de la curva de calibración y alrededor del límite inferior que no excediera de un CV = 20 % para menos de un tercio del total de puntos (20), analizando los datos mediante procedimientos generales para-métricos de modelos lineales (teoría normal) y se realizó un análisis de varianza (anova).
Los límites de detección (LD) y cuantificación (LC) se determinaron realizando previamente una curva a concentraciones bajas y estableciendo el valor del ruido en los cromatogramas de blancos de plasma. Para el cálculo se utilizó la ecuación:
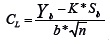
donde:
,CL = Concentración de analito en el límite de cuantificación o detección
Ybl= Señal obtenida del análisis del blanco; ruido de fondo del sistema
K= Constante que usualmente se considera igual a 10 para el LC e igual a tres para el LD
Sbl= Desviación estándar correspondiente a la señal del blanco
b=Pendiente de la curva de calibrado obtenida al representar la respuesta del método frente a la concentración de analito. Evidentemente el rango de esta recta tiene que ser cercano concentraciones a los niveles del límite de cuantificación.
n=Numero de réplicas (en este caso fueron tres).
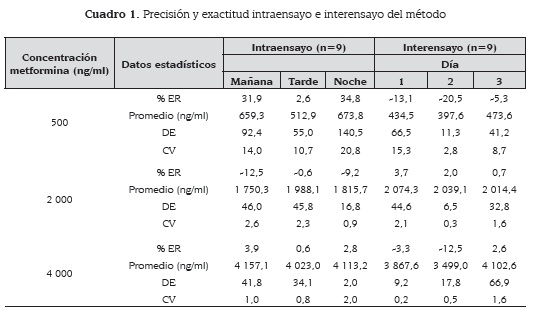
Los límites de detección y de cuantificación determinados para este método (18,19) fueron 129,42 ng/ml y 211,11 ng/ml respectivamente. La precisión y la exactitud se determinaron a dos niveles: intraensayo e interensayo. Para esto se evaluaron muestras de metformina en plasma, teniendo en cuenta el límite de cuantificación y el rango de trabajo, a concentración baja 500 ng/ml, media 2 000 ng/ml y alta 4 000 ng/ml. En el nivel intraensayo se evaluaron muestras por triplicado de cada concentración en la mañana, en la tarde y en la noche y en el nivel interensayo se evaluaron muestras por triplicado de cada concentración en tres días diferentes.
La precisión se calculó como coeficiente de varianza (CV) y la exactitud como porcentaje de error relativo (% ER). El método se acepta como preciso cuando el CV es ≤ 15 % en las concentraciones alta, media y baja y como exacto cuando el % ER es ≤ 15 % en las concentraciones alta, media y baja.
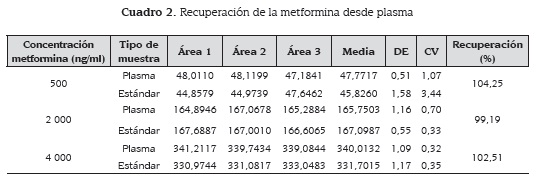
La recuperación del método se evaluó analizando extracciones de muestras de metformina en plasma a concentración baja 500 ng/ml, media 2 000 ng/ml y alta 4 000 ng/ml por triplicado; paralelamente se analizaron muestras de estándar de metformina a estos mismos niveles de concentración. Estas últimas se tomaron como el 100 % de la concentración a la que se debían aproximar las extracciones de plasma.
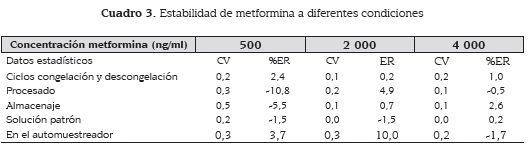
Se evaluó la estabilidad de las muestras de plasma con metformina por triplicado mediante un proceso de congelación y descongelación a concentración baja 500 ng/ml, media 2 000 ng/ml y alta 4 000 ng/ml. Esto se realizó simulando las condiciones de procesamiento, de modo que se mantuvo la muestra a temperatura ambiente durante 24 horas y luego se almacenó durante -20 oC por otras 24 horas.
Además se evaluó la estabilidad de la solución patrón almacenándola en la nevera entre 2 y 8 oC por 48 horas y la estabilidad de las muestras en el inyector automático manteniéndolas allí por 24 horas a temperatura ambiente. Una muestra se considera estable si en estas condiciones presenta CV y ER % máximo de 20 % a la menor concentración cercana al LC.
Análisis de parámetros farmacocinéticos
Fueron tabulados los niveles de metformina en plasma para cada uno de los voluntarios y con base a estos datos se realizaron las curvas de concentración de metformina en plasma vs tiempo. Se calcularon los siguientes parámetros farmacocinéticos: Cmax y tmax que corresponde al pico de la curva, AUC0--->t calculada por el método de los trapecios, área bajo la curva desde el último tiempo de muestreo t hasta infinito (AUCt-->∞) calculada mediante la ecuación AUCt--->∞ = Ct/Ke AUC0--->∞, calculada mediante la ecuación: AUC0--->∞ = AUC0--->t + AUC0--->∞, Ke calculada la pendiente de la fase final de eliminación de la curva y el t1/2. Estos cálculos se realizaron usando el software complementario PK Functions para Microsoft Excel (24-27).
Este ensayo clínico de biodisponibilidad se realizó siguiendo los lineamientos establecidos en guías internacionales para la industria de ensayos de biodisponibilidad y bioequivalencia para productos farmacéuticos administrados oralmente (22).
RESULTADOS
El ensayo clínico se realizó en doce voluntarios sanos colombianos: seis hombres y seis mujeres, con edades entre los 18 y 26 años. Los pesos estuvieron entre 50,6 y 83,4 Kg con un promedio de 68,0 ± 16,9 Kg y sus estaturas entre 1,50 y 1,82 m con promedio de 1,69 ± 0,59 m. No se presentó ningún tipo de reacción adversa que impidiera la participación de algún sujeto; por lo tanto no hubo que rechazar ninguna muestra de los voluntarios seleccionados.
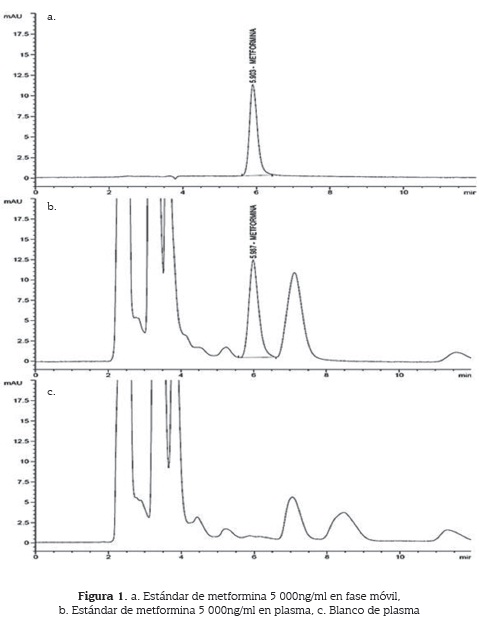
En cuanto a la selectividad del método bioanalítico no se encontraron interferencias entre el analito y los componentes de la matriz; ya que al tiempo de retención de la metformina, que es 5,9 min, no se observó ningún tipo de pico o señal en los cromatogramas de los blancos de plasma, por lo tanto el método es selectivo y específico para este analito (figura 1).
El método es lineal en el rango de 100-5 000 ng/ml con coeficiente de correlación 0,99978; la anova mostró que existe una relación estadísticamente significativa entre el área de pico de metformina y la concentración de ésta en plasma, con un nivel de confianza del 95 %. El método es preciso tanto intraensayo como interensayo con CV ≤ 15 %. Exceptuando la evaluación a concentración baja pero que no llegó al 20 %, mostró también ser exacto en ambos casos con % ER = 15 % (cuadro 1).
En el cuadro 2 se muestran los resultados de uno de los ensayos de recuperación. Se puede observar que la extracción obtiene recuperaciones muy próximas al 100 %, mientras el % CV no supera el 15 %. Los otros ensayos obtuvieron resultados similares.
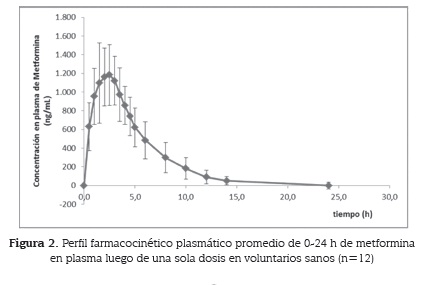
Las muestras de plasma con metformina resultaron ser estables durante el proceso de congelación-descongelación a las concentraciones baja, media y alta con % ER menores que 20 %; al igual que durante el tiempo de procesado de la muestra a temperatura ambiente. Las soluciones patrón se conservaron por 48 horas en la nevera entre 2 y 8 oC. Además, las muestras mostraron ser estables en el inyector automático por 24 horas a temperatura ambiente (cuadro 3). El promedio de los perfiles farmacocinéticos de concentración de metformina en plasma vs tiempo de los 12 voluntarios se muestra en la figura 2 y los parámetros farmacocinéticos promedio se describen en el cuadro 4.
Todos los voluntarios completaron el estudio ya que ninguno presentó ningún tipo de reacción adversa que le impidiera la participación.
DISCUSIÓN
El número de sujetos requeridos para este estudio de biodisponibilidad (tamaño de muestra) se seleccionó de acuerdo a lo establecido en la bibliografía, con el fin de conocer la variabilidad (CV) de los valores de AUC y Cmax, a partir de estudios previos publicados con el mismo producto. También se escogió siguiendo las guías del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) (23), que sugiere un número no menor a 12 individuos, al igual que otras referencias bibliográficas (10) y tal como lo expresa Carrizo en su enfoque metodológico y aplicaciones prácticas en la evaluación de medicamentos genéricos y la USP (22).
Se evidenció que la metformina es estable en plasma a las diferentes condiciones evaluadas, al igual que en la solución stock y al permanecer en el automuestreador por un tiempo luego de ser procesadas. Se validó un método bioanalítico para la cuantificación de metformina en plasma por HPLC-UV, que demostró ser selectivo, específico, preciso y exacto para casi todo el rango de trabajo. Se encontró, sin embargo que la exactitud a concentraciones bajas puede disminuir, presentando valores ER entre 20% y 31%, probablemente porque a estas concentraciones el método es más sensible a errores experimentales.
En este estudio no se presentaron reacciones adversas serias. Los eventos registrados se relacionaron principalmente con molestias gastrointestinales que se resolvieron espontáneamente. Estos efectos colaterales son bastante comunes con este fármaco y han sido descritos por otros investigadores.
La absorción del principio activo fue rápida: a las dos horas se detectaron niveles plasmáticos importantes que permanecieron hasta las 15 horas después de la administración. La Cmax media fue de 1 299,02 ng/ml± 291,90 ng/ml, en tanto que los tiempos para alcanzarlas fueron de 2,33 horas y el AUC0--->t fue de 6 856,89 ± 2 073,8 ng.h/ml.
Esto corresponde, tanto para Cmax como para AUC, a un % CV de aproximadamente 30 %. Estos resultados son similares a los encontrados en otros estudios (13-15). Por ejemplo, en 1994 Liu et al. evalúan la biodisponibilidad de una formulación de metformina entérica de 1 000 mg y obtienen valores Cmax de 2 520 ± 900 ng/ml y AUC 12 740± 4 280 ng.h-1/mL (28).
Igualmente estos resultados se asemeja n a los encontrados por Tucker et al. en 1981 con una formulación de metformina de 1 500 mg, donde obtuvieron valores de Cmax de 3 100 ± 9 300 ng/ml y AUC de 18 400 ± 6 520 ng.h-1/ml (29). Al comparar estos dos estudios con el nuestro se puede apreciar que aun cuando los valores puntuales son distintos, debido a las diferentes dosis, las desviaciones estándar se solapan y el % CV corresponde aproximadamente al 30% para todos. Lo que indica que los resultados, son similares.
CONCLUSIÓN
Al comparar los valores de todos los parámetros farmacocinéticos obtenidos (área bajo la curva, concentración máxima, tiempo en alcanzar la concentración máxima, tiempo de vida medio, etc.) con los publicados (14,16,28,29), se encontraron valores muy similares. Lo que sugiere que la metformina de 850 mg de Coaspharma S.A. podría ser intercambiable con el innovador u otro genérico de metformina de 850 mg, sin riesgo para el paciente colombiano, aunque son muy confiables los resultados estrictamente hablando se aconseja un ensayo de bioequivalencia en un futuro.
AGRADECIMIENTOS
Grupo de investigadores CECIF
CONFLICTO DE INTERESES
Los autores no declaran que no tienen ningún conflicto de interés.
FINANCIACIÓN
Este estudio fue financiado por medio del contrato de prestación de servicios 027/2011 celebrado entre Corporación Centro de la Ciencia y la Investigación Farmacéutica (CECIF) y Coaspharma S.A.S.
BIBLIOGRAFÍA
1. Wishart D. Metformin. [Sitio de internet] Wishart research group. University of Alberta. Hallado en URL: http://redpoll.pharmacy.ualberta.ca/. Acceso en: Agosto 2012. [ Links ]
2. Moffat AC, Osselton MD, Widdop B. Clarke's Analysis of drug and poison. Tercera edición. London. Pharmaceutical Press. 2006. [ Links ]
3. Najib N, Idkaidek N, Beshtawi M, Bader M, Admour I, Alam SM, et al. Bioequivalence evaluation of two brands of metformin 500 mg tablets (Dialon® & Glucophage®) in healthy human volunteers. Biopharm Drug Dispos 2002;23:301, 306. [ Links ]
4. Marathe PH, Arnold ME, Meeker J, Greene DS, Barbhaiya RH. Pharmacokinetics and bioavailability of a metformin/glyburide tablet administered alone and with food. J Clin Pharmacol. 2000;40:1494, 1502. [ Links ]
5. Metropolitan Life Insurance Company Statistical bulletin documenta Geigy. Tablas científicas, 1983. [ Links ]
6. Colombia, Ministerio de Salud. República de Colombia. Normas científicas, técnicas y administrativas para la investigación en salud. Resolución Nº008430 de 1993. Bogotá - Colombia; 1993. [ Links ]
7. Colombia, Instituto Nacional de Vigilancia de Medicamentos y Alimentos -INVIMA-. Guía de Biodisponibilidad y Bioequivalencia de Medicamentos. Bogotá - Colombia; 1997. [ Links ]
8. Colombia, Ministerio de Protección Social. Resolución No 2378 de 2008. Bogotá - Colombia. [ Links ]
9. Korea, 59th World Medical Association 2008. Declaración de Helsinki: Ethical principles for medical research involving human subjects. Seoul - Korea. [ Links ]
10. Carrizo FE. Estudios de bioequivalencia: enfoque metodológico y aplicaciones prácticas en la evaluación de medicamentos genéricos. Rev Med Uruguay 2000; 16:133, 143. [ Links ]
11. Zarghi A, Foroutan SM., Shafaati A, Khoddam A. Rapid determination of metformin in human plasma using ion-pair HPLC. J Pharm Biomed Anal 2003;31:197 200. [ Links ]
12. González Cuesta F, Holguín Martínez G, Archbold Joseph R, Ruiz Correa A, Restrepo Garay MM, Peña Acevedo L, et al. Bioequivalencia de dos formulaciones de metformina, tabletas de 850 mg, en voluntarios sanos colombianos. Iatreia 2005; 18(3):289 301. [ Links ]
13. Cheng CL, Chou CH. Determination of metformin in human plasma by high-performance liquid chromatography with spectrophotometric detection. J Chromatogr B Biomed Sci Appl 2001;762(1):51 58. [ Links ]
14. Porta V, Grigoleto Schramm S, Kazue Kano E, Emiko Koono E, Popst Armando Y, Fukuda K, et al. HPLC-UV determination of metformin in human plasma for application in pharmacokinetics and bioequivalence studies. J Pharm Biomed Anal 2008;46:143 147. [ Links ]
15. Tache F, David V, Farca A, Medvedovicia A. HPLC-DAD determination of Metformin in human plasma using derivatization with pnitrobenzoyl chloride in a biphasic system. J Microchemical 2001;68:13 19. [ Links ]
16. Mistri HN, Jangid AG, Shrivastav PS. Liquid chromatography tandem mass spectrometry method for simultaneous determination of antidiabetic drugs metformin and glyburide in human plasma. J Pharm Biomed Anal 2007;45:97, 106. [ Links ]
17. Donahue SR, Turner KC, Patel S. Pharmacokinetics and pharmacodynamics of glyburide/metformin tablets (glucovance(tm)) versus equivalent doses of glyburide and metformin in patients with type 2 Diabetes. Clin Pharmacokinet 2002:41(15):1301, 1309. [ Links ]
18. ICH Q2A. Text on validation of analytical procedures: definitions and terminology, 1 June 1995. [ Links ]
19. Food and Drug Administration. Guidance for industry. Bioanalytical Method Validation; 2013. [ Links ]
20. España, Asociación Española de Farmacéuticos de la Industria. Validación de Métodos Analíticos. Barcelona; 2001. [ Links ]
21. Cartula Perales MC, Celma Lezcano C, Encíma Garcia G, Jansat Rufach JM, Nieto Abad C, et al. Métodos en Bioanálisis. En: España, Asociación Española de Farmacéuticos de la Industria. Validación de Métodos Analíticos. Barcelona; 2001. Pp. 209 248. [ Links ]
22. Food and Drug Administration. Guidance fot industry. Bioavailability and bioequivalence studies for orally administered drug products; 2003. [ Links ]
23. INVIMA. Guía de Biodisponibilidad y Bioequivalencia de medicamentos. Acta 51 de 1997, Resolución 1400 de 2001, Colombia. [ Links ]
24. Usansky JI, Desai A, Tang-Liu D. PK Functions for Microsoft Excel. Department of Pharmacokinetics and Drug Metabolism Allergan, Irvine, CA 92606, U.S.A. 2011. [ Links ]
25. Gibaldi M, Perrier M. Pharmacokinetics. 2nd Edition. Marcel Dekker. New York. 1982. [ Links ]
26. Rowland M, Tozer T. Clinical Pharmacokinetics. Concepts and Applications. 3rd Edition. Lea and Febiger. 1997. [ Links ]
27. Wagner JG. Pharmacokinetics for the Pharmaceutical Scientist. Technomic Publishing Co. 1993. [ Links ]
28. Liu J, Shen ZF, Xie MZ. Bioavailability of metformin hydrochloride in enteric-solublecapsule form using a new reverse - phase high -performance liquid chromatography assay method. The Chinnese Journal of Clinical Pharmacology. 1994-03. [ Links ]
29. Tucker GT, Casey C, Phillips PJ, Connor H, Ward JD & Woods HF. Metformin kinetics in healthy subjects and in patients with diabetes mellitus. Br. J. clin. Pharmac. (1981), 12, 235-246. [ Links ]