Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina
Print version ISSN 0120-8705
CES Med. vol.30 no.2 Medellín July/Dec. 2016
REPORTE DE CASOS
Histiocitosis de células de Langerhans e imágenes diagnósticas
Langerhans cell Histiocytosis and diagnostic images
Samuel Rosas-Saldarriaga1, Carolina Mesa-Mesa1, Gilberto Rosas-Michaelis2
1 Estudiantes de Medicina. Universidad CES. Medellín, Colombia. Sam.rosas@icloud.com
2Departamento de Radiología, Radiología San Diego, Medellín, Colombia.
Forma de citar: Rosas-Saldarriaga S, Mesa-Mesa C, Rosas-Michaelis G. Histiocitosis de células de Langerhans e imágenes diagnósticas. Rev CES Med 2016; 30(2): 231-237.
Recibido: febrero 15 de 2015. Revisado: julio 2 de 2015. Aceptado: agosto 10 de 2015.
Resumen
El objetivo del artículo es presentar el caso de un paciente que consultó al servicio de imaginología por dolor en la región costal, y quien posteriormente fue diagnosticado como histiocitosis de células de Langerhans. Se pretende proveer al lector una breve revisión de tema de imágenes diagnósticas de esta enfermedad para que el reconocimiento de la misma permanezca dentro de la lista de diagnósticos diferenciales.
Palabras clave: Histiocitosis, Células de Langerhans, Imagenología.
Abstract
The goal of this article is to provide readers with a case presentation of a patient who presented to the radiology department for pain located at the costal region, which later was diagnosed as Langerhans cell histiocytosis (LCH). We pretend with this article to provide a brief, complete and efficient literature review regarding the topic of imaging on this pathology. This was done with the objective of providing the reader with a brief and concise literature review so that this disease entity can remain within the list of differencials.
Keywords: Histiocytosis, Langerhans cells, Imaginology
Caso clínico
Al departamento de imagenología se presentó un paciente masculino de cincuenta años de edad, conductor de un camión transportador, habitante en zona urbana, sin antecedentes personales o familiares de neoplasias, enfermedades congénitas ni de otro tipo de enfermedades de importancia. El paciente venía remitido por el especialista en oncología por un cuadro clínico de varios meses de evolución consistente en dolor inespecífico en la región del hemitórax derecho, que no presentaba ningún tipo de patrón de origen cardíaco, respiratorio, neuropático, irradiado o de serosas.
Se decidió realizar una resonancia magnética nuclear para evaluar posibles etiologías de la sintomatología. La lectura de este estudio identificó fracturas en proceso de consolidación en los arcos laterales derechos, de la cuarta y quinta costilla, asociadas a edema de tejidos blandos alrededor de la lesión. Adicionalmente, el paciente presentaba un hemangioma atípico en la región central derecha del cuerpo vertebral T8.
Se realizó una gammagrafía ósea, en la cual se evidenciaron depósitos patológicos del radiofármaco en los arcos costales laterales derechos previamente descritos, que podrían relacionarse con fracturas según la historia clínica y el informe radiológico.
En el estudio híbrido también se observó hipercaptación del radiofármaco y la morfología de esta captación era lineal, lo que apoya el diagnóstico de posibles fracturas en los arcos costales laterales.
A continuación se le realizó una resonancia magnética corporal total, en la cual se encontró una imagen heterogénea, hiper-intensa, irregular que comprometía el área lateral del séptimo arco costal derecho; además, se evidenció en los tejidos blandos de la zona aledaña, hiper-intensidad que se extendía hasta el margen inferior del quinto arco costal ipsilateral.
Luego se realiza biopsia ósea costal, cuya descripción fue la de una lesión constituida por gran número de histiocitos y eosinófilos, que además presentaba pocas células gigantes alrededor de la lesión. Estos hallazgos favorecían un posible diagnóstico de histiocitosis de células de Langerhans multifocal.
Más tarde se realizaron pruebas de inmunohistoquímica CD1a y proteína S-100 con análisis de inmunohistoquímica que fueron reactivas y que apoyaban el diagnóstico de histiocitosis de células de Langerhans.
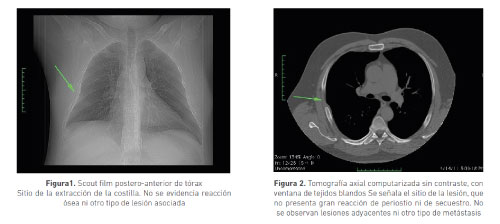
En otra consulta se le realizó tomografía axial computarizada de alta resolución (TACAR) en la cual se observó una lesión lítica del séptimo arco costal derecho, sin masa en tejidos blandos; además presentaba engrosamiento pleural sin lesión intraparenquimatosa pulmonar (figuras 1 y 2).
Posteriormente el paciente fue valorado por ortopedia y hemato-oncología para definir tratamiento. Se decidió una resección quirúrgica curativa sin ningún tratamiento adicional. El paciente no presentó nueva sintomatología aguda y regresó a su lugar de vivienda fuera del país, por lo cual no se tiene conocimiento adicional de recurrencia de lesiones.
Discusión
La histiocitosis de células de Langerhans, también conocida como síndrome X, granuloma eosinofílico, enfermedad de Letterer-Siwe y enfermedad de Hand-Schüller- Christian es una enfermedad proliferativa que se caracteriza por la acumulación irregular y localizada de células en cualquier lugar del organismo (1).
Las células que se acumulan pueden proceder de diferentes orígenes mieloides y pueden o no derivarse de células de Langerhans. Actualmente no existe suficiente literatura científica para asegurar si la histiocitosis X es una enfermedad proliferativa que se desarrolla debido a un cambio en las células de Langerhans normales o, si en cambio, es debida a una proliferación de monocitos y macrófagos que proceden a tener un fenotipo cercano a los histiocitos (2).
Al microscopio, generalmente se observan células inflamatorias y células mononucleadas, lo cual evidencia la característica inflamatoria de esta enfermedad; además puede causar destrucción del tejido donde se produce la proliferación. La etiología puede estar relacionada con una etiología viral (1) y esta propuesta también es compartida por otros autores quienes describen un caso de histiocitosis de células de Langerhans en el atlas de un adulto (3).
Otros autores se inclinan más por una enfermedad neoplásica. Wilejto et al. describen una asociación de la histiocitosis X con una mutación en el protoncogén BRAF (4). Este mismo protoncogén se ve relacionado con melanoma (4), cáncer de tiroides, cáncer seroso de ovario, entre otros (5-8).
La Organización Mundial de la Salud clasifica los tumores hematopoyéticos y linfoides en tres categorías: enfermedades relacionadas con macrófagos, enfermedades malignas histiocíticas y enfermedades de células dentríticas. La histiocitosis X hace parte de este último grupo (9).
La enfermedad es poco común, se presenta con mayor prevalencia en pacientes pediátricos de dos a cuatro años (10) y tiene una incidencia de uno a dos casos por millón de niños (11) y hasta ocho casos por millón según otros autores (4).
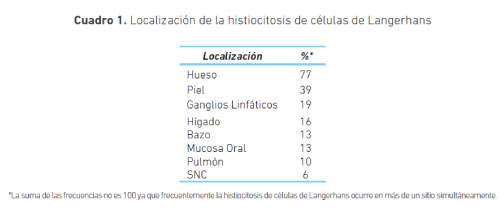
Los órganos más comprometidos en la histiocitosis de células de Langerhans en orden de mayor a menor compromiso son: pulmón, hipotálamo-pituitaria, piel, hueso, nódulos linfáticos, hígado, oído externo, tracto urinario, parótidas, timo y glándulas paratiroideas (12). En el sistema óseo el compromiso es mayor en los huesos planos y el esqueleto axial, sin embargo, también puede haber compromiso de huesos largos (cuadro 1).
El diagnóstico de esta enfermedad es lento y se pueden realizar varias modalidades de imagen que se describirán a continuación y finalmente desarrollar una biopsia de la lesión.
Rayos X
Las lesiones típicas de esta enfermedad son lesiones líticas que aparecen al inicio (16). Varios autores afirman que son lesiones líticas, de bordes irregulares, asociadas a edema de tejidos blandos y reacción del periostio cuando están presentes en el hueso (13,16,17). Además, presentan apariencia maligna y son difíciles de diferenciar de crecimientos tumorales u otras malignidades.
Las lesiones líticas en huesos pueden contener un centro de material óseo intacto conocido como âbotón de secuestroâ(button sequestrum). Esta característica también se presenta en tuberculosis, infecciones, postquirúrgicos y quistes dérmicos y epidérmicos, por lo cual no se puede hacer un diagnóstico únicamente basado en imágenes (13).
Según la clasificación de Lodwick existen tres patrones básicos: 1) patrón geográfico o tipo 1, que muestra destrucción ósea completa dentro de la lesión con bordes bien definidos. Dentro de ésta, se describen también tres clases que son: 1A con márgenes definidos, 1B con anillo esclerótico alrededor y, 1C con margen mal definido. 2) patrón de lesiones carcomidas, con forma de focos pequeños, múltiples y líticos; 3) patrón permeable que consiste en focos múltiples, líticos, mal definidos (18).
El fármaco de elección para el estudio de imágenes de lesiones esqueléticas es el 99m tecnecio de metileno difosfonato, que ingresa a las lesiones esqueléticas por medio de la absorción química que ocurre en el lugar del recambio óseo (18). La histiocitosis de células de Langerhans es un diagnóstico probable, cuando se evidencia edema de gran extensión de la médula alrededor de una lesión ósea. Entre mayor tamaño tenga el edema, mayor probabilidad hay en que sea una lesión benigna (18).
Gammagrafía
Luego de que se aprecie la lesión lítica en los rayos X debe realizarse gammagrafía ósea para observar si hay captación del radiofármaco en otras zonas del cuerpo, lo cual es útil al momento de tomar decisiones terapéuticas. Durante su realización pueden tenerse algunos falsos negativos, como en pacientes que se encuentran en tratamiento con quimioterapia (13).
Debe enfatizarse las diferencias en cuanto a los rayos X y la gammagrafía, pues aunque ésta es más sensible, los rayos X permiten identificar mejor el tipo de destrucción ósea. Para que una lesión ósea sea evidenciada por medio de rayos X, su destrucción debe ser de 30 - 50%. Otra de las ventajas es que son más económicos.
Tomografía axial computarizada
Sus ventajas son la detección de masas de tejidos blandos, su extensión, su relación con órganos y tejidos vecinos y la observación del desgaste peritumoral. Adicionalmente, es útil para la realización de una biopsia guiada. Ante la presencia de alguna imagen posterior o sospechosa de lesión lítica se deben considerar otros diagnósticos diferenciales, como osteomielitis, linfoma de hueso o proceso regenerativo de una fractura antigua.
Resonancia magnética
Puede identificar el sitio donde se presenta la lesión, las áreas contiguas para descartar que se encuentren afectadas y para determinar el grado de inflamación (18). Los resultados se deben comparar con estudios histopatológicos, aunque no se correlacionan exactamente, ya que en la histopatología se realizan cálculos de solo una porción del área necrótica del tumor, mientras que la resonancia magnética realiza cálculos a partir de toda el área del tumor; por esta razón es que los resultados pueden tener un margen de variación.
El sitio de lesión que se identifica en los rayos X o en la TAC se observa como una señal hipo-intensa en T1 e hiper-intensa en T2, y a medida que se va presentando la resolución del crecimiento la señal en T2 va disminuyendo en intensidad (13).
Biopsia
Es vital para el diagnóstico de la histiocitosis realizar una biopsia para el análisis histopatológico, el cual sigue siendo la prueba de oro para el diagnóstico. Debe realizarse un análisis histopatológico usando marcadores de inmunohistoquímica como son el CD-1a y el S-100 (9,10,12).
Tratamiento
Debido a que es una enfermedad poco frecuente, no se encuentran guías basadas en estudios prospectivos y randomizados. La presentación es más común en el paciente pediátrico y por lo tanto las guías de tratamiento de adultos se han limitado a extrapolar la evidencia del menor, lo cual limita fuertemente su validez.
Las guías utilizadas en la práctica colombiana son las del Instituto Nacional de Cáncer de los Estados Unidos, que presentan opciones de tratamiento según la localización primaria de la entidad patológica y su extensión (19).
En cuanto a quimioterapia, las guías proponen utilizar vinblastina con prednisona o arabinosido de citosina o cladrirabina o bifosfonatos, pero carecen de niveles de evidencia elevados como para que sean tomados como tratamiento estándar. Las mismas guías son enfáticas en la resección tumoral únicamente cuando esto no altera la función ni la estética del paciente, ya que ocasionalmente la enfermedad puede desaparecer sin ningún cambio aparente en la vida del paciente. Existe la posibilidad de aplicar corticoesteroides alrededor de la lesión ósea pero también carece de gran evidencia científica.
La radioterapia está descrita en estas guías como método de tratamiento en la histiocitosis pulmonar u ósea (19)
Como factores pronósticos solo se han identificado como significativos: el compromiso únicamente en piel, pacientes mayores de 26 años, relación del volumen espiratorio forzado en un segundo con la capacidad vital forzada disminuida, aumento de la relación de volumen residual sobre capacidad pulmonar total, siendo estos de pronóstico desfavorable (19)
Conclusión
La histiocitosis de células de Langerhans es una enfermedad compleja cuya fisiopatología y pronóstico aún no se han descrito ampliamente. Hay gran variedad de métodos imagenológicos disponibles para el diagnóstico, cada uno con indicaciones, ventajas y desventajas diferentes, por lo cual la elección de una modalidad sobre la otra queda a juicio del médico tratante, teniendo en cuenta que siempre el diagnóstico debe ser apoyado en una biopsia de la lesión. El tratamiento debe ser individualizado.
Conflicto de interés
Ninguno
Bibliografía
1. Mohammed A, Abdullahi K, Mohammed U, Aliyu HO, Liman AA, Abdullahi S, et al. Disseminated Langerhan's cell histiocytosis: a case report and review of the literature. Annals of African medicine. 2011 ;10(4):310-3.. https://www.ncbi.nlm. nih.gov/pubmed/22064259 [ Links ]
2. Klemke CD, Dippel E, Geilen CC, Koenigsmann MP, Thiel E, Orfanos CE, et al. Atypical generalized eruptive histiocytosis associated with acute monocytic leukemia. Journal of the American Academy of Dermatology. 2003 Nov;49(5 Suppl):S233-6. http://www.jaad.org/article/S0190-9622(03)00037-9/abstract [ Links ]
3. Zhong WQ, Jiang L, Ma QJ, Liu ZJ, Liu XG, Wei F, et al. Langerhans cell histiocytosis of the atlas in an adult. European spine journal : official publication of the European Spine Society, the European Spinal Deformity Society, and the European Section of the Cervical Spine Research Society. 2010 Jan;19(1):19-22. https:// www.ncbi.nlm.nih.gov/pubmed/19844749 [ Links ]
4. Wilejto M, Abla O. Langerhans cell histiocytosis and Erdheim-Chester disease. Current opinion in rheumatology. 2012 Jan;24(1):90-6. https://www.ncbi.nlm. nih.gov/pubmed/22157416 [ Links ]
5. Sieben NL, Macropoulos P, Roemen GM, Kolkman-Uljee SM, Jan Fleuren G, Houmadi R, et al. In ovarian neoplasms, BRAF, but not KRAS, mutations are restricted to low-grade serous tumours. The Journal of pathology. 2004 Mar;202(3):336-40. https://www.ncbi.nlm.nih.gov/pubmed/14991899 [ Links ]
6. Singer G, Oldt R, 3rd, Cohen Y, Wang BG, Sidransky D, Kurman RJ, et al. Mutations in BRAF and KRAS characterize the development of low-grade ovarian serous carcinoma. Journal of the National Cancer Institute. 2003 Mar 19;95(6):484-6. https://www.ncbi.nlm.nih.gov/pubmed/12644542 [ Links ]
7. Lupi C, Giannini R, Ugolini C, Proietti A, Berti P, Minuto M, et al. Association of BRAF V600E mutation with poor clinicopathological outcomes in 500 consecutive cases of papillary thyroid carcinoma. The Journal of clinical endocrinology and metabolism. 2007 Nov;92(11):4085-90. https://www.ncbi.nlm.nih.gov/pubmed/ 17785355 [ Links ]
8. Mayr D, Hirschmann A, Lohrs U, Diebold J. KRAS and BRAF mutations in ovarian tumors: a comprehensive study of invasive carcinomas, borderline tumors and extraovarian implants. Gynecologic oncology. 2006 Dec;103(3):883-7. https:// www.ncbi.nlm.nih.gov/pubmed/16806438 [ Links ]
9. Campo E, Swerdlow SH, Harris NL, Pileri S, Stein H, Jaffe ES. The 2008 WHO classification of lymphoid neoplasms and beyond: evolving concepts and practical applications. Blood. 2011; 117(19):5019-32. ttp://www.bloodjournal.org/ content/117/19/5019?sso-checked=true [ Links ]
10. Yildirim-Baylan M, Cureoglu S, Paparella MM. Temporal Bone Histopathology Case of the Month: Langerhans’ Cell Histiocytosis of the Temporal Bone. Otology & neurotology : official publication of the American Otological Society, American Neurotology Society [and] European Academy of Otology and Neurotology. 2012;33(2): 10.1097/MAO.0b013e31821a80f8 [ Links ]
11. Juvet SC, Hwang D, Downey GP. Rare lung diseases III: Pulmonary Langerhans’ cell histiocytosis. Canadian Respiratory Journal : Journal of the Canadian Thoracic Society. 2010 May-Jun;17(3):e55-e62. https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC2900147/ [ Links ]
12. Xia CX, Li R, Wang ZH, Lv FJ, Tang XQ, Li QF, et al. A rare cause of goiter: Langerhans cell histiocytosis of the thyroid. Endocrine journal. 2012;59(1):47-54. https:// www.ncbi.nlm.nih.gov/pubmed/22019948 [ Links ]
13. Azouz EM, Saigal G, Rodriguez M, Podda A. Langerhans’ cell histiocytosis: pathology, imaging and treatment of skeletal involvement. Pediatr Radiol. 2005 2005/02/01;35(2):103-15. https:// www.hindawi.com/journals/crihem/2014/648136/ [ Links ]
14. Stull MA, Kransdorf MJ, Devaney KO. Langerhans cell histiocytosis of bone. RadioGraphics. 1992 1992/07/01;12(4):801-23. https://www.ncbi.nlm.nih.gov/pubmed/ 1636041 [ Links ]
15. Grois N, Potschger U, Prosch H, Minkov M, Arico M, Braier J, et al. Risk factors for diabetes insipidus in langerhans cell histiocytosis. Pediatric blood & cancer. 2006 Feb;46(2):228-33. https://www.ncbi.nlm.nih.gov/pubmed/16047354 [ Links ]
16. Hung PC, Wang HS, Jaing TH, Huang TJ, Pang LC. From normal to abnormal MR findings within three weeks in a solitary pelvic Langerhans histiocytosis. Skeletal radiology. 2003 Aug;32(8):481-4. http://link.springer.com/article/10.1007/ s00256-003-0637-x [ Links ]
17. Huang WD, Yang XH, Wu ZP, Huang Q, Xiao JR, Yang MS, et al. Langerhans cell histiocytosis of spine: a comparative study of clinical, imaging features, and diagnosis in children, adolescents, and adults. The spine journal : official journal of the North American Spine Society. 2013 Sep;13(9):1108-17. https://www.ncbi.nlm. nih.gov/pubmed/23602327 [ Links ]
18. Hwang S, Panicek DM. The evolution of musculoskeletal tumor imaging. Radiologic clinics of North America. 2009 May;47(3):435-53. https://www.ncbi.nlm.nih. gov/pubmed/19361669 [ Links ]
19. National Cancer Institute: PDQ® Langerhans Cell Histiocytosis Treatment. Bethesda, MD: National Cancer Institute. Date last modified <01/30/2015>. Available at: http://cancer.gov/cancertopics/pdq/treatment/lchistio/HealthProfessional [ Links ]