Introducción
Las infecciones micóticas incluyen un amplio grupo que van desde entidades superficiales hasta infecciones profundas asociadas a planos más profundos, que incluso llegan a comprometer estructuras óseas o diseminarse y producir enfermedad sistémica. Dentro de las micosis subcutáneas más importantes en nuestro medio están la esporotricosis y la cromoblastomicosis; las menos frecuentes son micetoma, quistes faeomicóticos, lacaziosis y zigomicosis subcutánea. Los microrganismos causantes se inoculan en la piel luego de un trauma con material vegetal contaminado con el hongo y por esto también han sido llamadas micosis de implantación 1,2.
Esporotricosis
En 1898, en el Hospital de Johns Hopkins en Baltimore - Maryland, Benjamin Schenk, un estudiante de Medicina, fue quien identificó por primera vez la esporotricosis en un hombre de 36 años quien presentaba lesiones en la mano y el brazo derecho. Pero fue solo en 1900 que Hektoen y Perkins denominaron al hongo causal Sporothrix schenckii3-5. En 1940 en Sudáfrica, se detectó la primera epidemia en 2 000 nativos orfebres; a partir de este momento, se han reportado en la literatura varios casos relacionados con esta enfermedad fúngica 6.
El primer método diagnóstico de esta entidad, la reacción intradérmica, fue utilizada por primera vez en 1947 por González-Ochoa y Soto-Figueroa 3. Y en 2007, Marimon et al. encentran que los agentes causantes pueden nombrarse como complejo Sporothrix schenkii: Sporothrix brasiliensis, Sporothrix globosa y Sporothrix mexicana, S. schenkii (sensu stricto) y Sporothrix lurei7.
La esporotricosis es la micosis subcutánea más frecuente, tiene una distribución mundial, siendo más común en áreas tropicales y subtropicales con un clima que varía entre 15-25 °C y una humedad entre 92 y 100 % 3,4. Se considera una enfermedad ocupacional: se presenta con más frecuencia en campesinos, agricultores y jardineros, ya que el hongo se encuentra en la tierra y en material vegetal fresco o seco. Afecta de manera importante al continente americano, principalmente Centro y Sur América, considerándose en Latinoamérica la micosis subcutánea más común 8-10.
En un estudio publicado en 2010 se describen las características de 60 pacientes con esporotricosis: 33 % eran mujeres, la edad de presentación varió entre los tres y los 81 años, con promedio de 25,5 años para las mujeres y 41 para los hombres. En cuanto a la ocupación se reporta que la agricultura es la actividad más frecuente. Los departamentos colombianos más afectados fueron Cundinamarca con 31 % de los casos y Boyacá con 17 % 8.
Puede presentarse a cualquier edad, siendo más común en niños y adultos jóvenes, especialmente entre los 16 a 35 años (cuadro 1) 3,9,11. Sin embargo, hay una publicación del 2011 que reporta 15 casos de esporotricosis en niños menores de 10 meses de edad 12. Algunos estudios reportan una predominio en los hombres, lo cual podría corresponder a las actividades de campo que estos realizan; caso contrario se ha visto en la India y Japón, donde las mujeres son las más afectadas, probablemente por su participación activa en actividades al aire libre en estos países (3,9,11.
También se han descrito otros factores de riesgo independiente de la actividad laboral tales como alcoholismo, diabetes mellitus, neoplasias hematológicas, enfermedad pulmonar obstructiva crónica, trasplante de órganos, uso de medicamentos inmunosupresores, entre otros. En relación a este último aspecto, es importante resaltar que el estado de inmunosupresión es un factor que predispone a la forma diseminada de la enfermedad llegando a ser mortal en algunos casos 3,9,13.
El agente causal es Sporothrix schenckii, hongo dimórfico, heterótrofo que contiene quitina en su pared celular 5,9. En su etapa saprofita o cuando se cultiva a 25°C toma la forma de un filamento compuesto por hifas hialinas septadas (forma de micelio) de 1 a 2 micras de ancho; pero una vez inoculado en el tejido humano o animal se aprecia como una levadura, observándose células levaduriformes en diferentes tamaños y formas de 2 a 6 micras de diámetro. Este dimorfismo podría estar relacionado con el gen de la calmodulina 5,10.
Este hongo se encuentra en el suelo, vegetación en descomposición y excrementos de animales. Pero para el desarrollo de la forma micelar se requiere de un suelo rico en celulosa con un pH entre 3,5 a 9,4, una temperatura de 31 °C y humedad relativa mínima de 92 % 5).
La esporotricosis, conocida tradicionalmente como la enfermedad por el pinchazo de rosa 14, es transmitida en la mayoría de los casos a través de inoculación traumática del hongo en la piel y el tejido celular subcutáneo. En el 10 - 62 % de los pacientes es referido el antecedente de trauma penetrante por espinas de plantas, astillas de madera o materiales contaminados con material orgánico 15.
Aunque el trauma es la principal forma de transmisión, también puede ocurrir por arañazos o mordeduras de animales (gatos, armadillos), apoyando el concepto de zoonosis 13,15,16. Aunque menos común, la transmisión por la inhalación del hongo a través del tracto respiratorio superior también puede presentarse, llevando a un riesgo considerable de desarrollar neumonitis granulomatosa (simulando una infección por tuberculosis) y diseminación hematógena 13.
Una vez el hongo está en el órgano diana, éste induce una reacción granulomatosa supurativa en los tejidos del huésped, siendo la inmunidad de células T dependientes de óxido nítrico muy importante para lograr el control de la enfermedad 17.
Dentro de los factores de virulencia se encuentran los compuestos de ergosterol de su membrana celular y los exoantígenos de la forma de levadura; los cuales activan, a su vez, el sistema inmune innato y adquirido del huésped y citoquinas productoras de especies reactivas de oxígeno, proceso que resultará en la producción de citoquinas tipo Th1 y Th2, impulsado por la acción de la interleucina (IL) 12 y 4 respectivamente 18.
Las células tipo Th1 producen interferón-gamma que activa los macrófagos y promueven la inmunidad celular, estando presentes durante todo el proceso infeccioso; mientras que las células tipo Th2 se hacen presentes luego de la quinta a sexta semana, demostrando un predominio de la inmunidad celular durante todo el proceso de enfermedad y solo en fase avanzadas de la enfermedad toma un papel activo la inmunidad humoral. El papel principal de la inmunidad mediada por células, es la razón por la cual en pacientes inmunosuprimidos esta enfermedad puede ser mortal 19.
Otra forma de medir la mortalidad que puede llegar a producir es su capacidad de unirse a la fibronectina vía las adhesinas de su superficie, un factor de virulencia que permite la invasión y diseminación a tejidos más profundos 20.
La enfermedad puede tener diferentes formas de presentación clínica, siendo las dos principales la forma linfocutánea y la forma fija, siendo esta última es muy polimórfica en su presentación y los estudios han demostrado que tiene un amplio espectro clínico con lesiones verrugosas, ulcerativas granulomatosas, superficiales, acneiformes o psoriasiformes (cuadro 1).
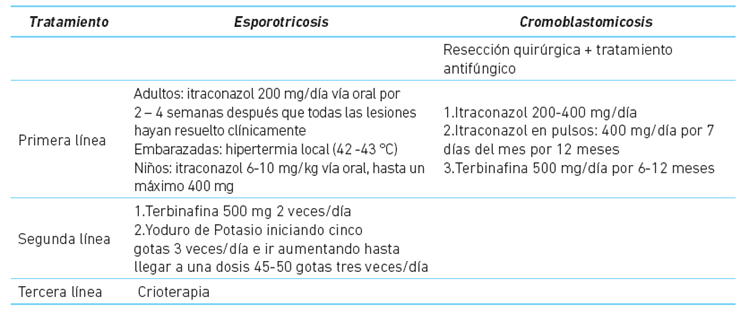
La forma linfocutánea es más común con el 70 % de los casos. Se caracteriza por lesiones nodulares eritemato violáceas, que en ocasiones se pueden ulcerar drenando un material purulento (chancro de inoculación) y posteriormente se desarrollan lesiones nodulares o gomas en un patrón de distribución lineal a lo largo de los vasos linfáticos, pudiendo llegar a comprometer los ganglios linfáticos regionales (figura 1) 2,3,9.
Esta presentación afecta principalmente las extremidades y la cara; generalmente es unilateral, aunque se han reportado casos de afección bilateral 2,3,16. Los pacientes pueden referir prurito y dolor, y en casos excepcionales, puede ocurrir linfedema en caso de que el drenaje linfático esté comprometido 2,3,9.
Esporotricosis fija: corresponde al 25 % de los casos y es la que predomina en niños y en ciertas áreas geográficas (Centro América). Además, es la forma de presentación clínica más limitada que ocurre en pacientes inmunocompetentes.
Se caracteriza por una placa única, eritemato violácea, bien definida, de aspecto verrucoso o vegetante, cubierta en su superficie por escamas o costras, lo que le da una apariencia granulomatosa, pudiendo ser semejante a la leishmaniasis cutánea. Generalmente se localiza en la cara y en ocasiones se pueden observar lesiones satélites pequeñas en la periferia de la lesión. Habitualmente es asintomática y es muy raro que ocurra diseminación linfática, aunque en algunos casos los ganglios linfáticos locales pueden estar aumentados de tamaño 9,12,21.
El que se presente una u otra forma clínica depende de ciertos factores relacionados con el microrganismo y el huésped, tales como profundidad y el tamaño del inóculo, termo-resistencia de la cepa infectante, respuesta inmune del individuo y las condiciones climáticas en el momento de la infección, puesto que en modelos in vitro se ha visto que las altas temperaturas pueden disminuir la posibilidad de infección de algunas cepas 8.
Se han descrito síndromes dermatológicos como eritema nodoso y eritema multiforme en asociación con esporotricosis 16,22. En pacientes inmunocomprometidos se puede diseminar a órganos linfáticos y la esporotricosis pulmonar se presenta al inhalar esporas 22.
El aspecto más importante para llegar al diagnóstico es la sospecha clínica, siendo fundamental una buena historia clínica y examen físico completo. En casos de duda, hay diferentes métodos que pueden confirmar el diagnóstico.
No es método útil el examen directo con KOH de las secreciones del paciente, ya que generalmente las estructuras micóticas no se observan con este medio 3,5. El aislamiento del hongo en medio de cultivo de agar Sabouraud se considera la prueba diagnóstica de oro 8,9,12. Macroscópicamente, las colonias de la levadura son de aspecto suave, membranosas, de crecimiento radial y color crema; y microscópicamente las conidias simpodiales son similares a la margarita 3,5.
La histopatología puede ser un método útil para sugerir el diagnóstico, mostrando una epidermis hiperplásica, con o sin ulceración y se puede ver el “granuloma esporotricoide” supurativo, que consiste en un micro absceso central con neutrófilos, necrosis y un área en la que predominan los linfocitos y macrófagos rodeados de células plasmáticas, fibroblastos y vasos sanguíneos. La forma de levadura del hongo rara vez es vista, pero las tinciones con ácido peryódico de Schiff o tinción de plata metenamina ayudan a la visualización de las células y de las blastoconidias alargadas del hongo en un 50 % de los casos 3,5,6.
En cerca del 20 % de los casos se pueden ver los cuerpos asteroides, estructura característica que permite el diagnóstico de formas clínicas linfangíticas y se cree que corresponde a una forma de resistencia del hongo que usa moléculas del huésped para su propia supervivencia 23. También puede visualizarse el fenómeno de Splendore-Hoeppli que corresponde a complejos antígeno-anticuerpo, inmunoglobulina (Ig) M y G asociadas a detritos celulares de células inflamatorias o de células plasmáticas 3,5,9.
Otro método, aunque no está ampliamente disponible, es la prueba de dermo-reacción a la esporotricina, que detecta una reacción de hipersensibilidad retardada, considerándose positiva cuando en el sitio de la inyección aparece eritema e induración 48 horas después. Sin embargo, no se considera una prueba diagnóstica por dos razones: aquellos pacientes residentes en área endémica pueden estar sensibilizados o puede indicar un contacto previo con el hongo. Su principal utilidad es en investigaciones epidemiológicas 3,5,6.
Las pruebas moleculares para detección de ADN específico del hongo son una alternativa diagnóstica, aunque todavía están en experimentación y no se encuentran disponibles en el mercado 24.
También se han realizado estudios serológicos para detectar anticuerpos, que aunque tienen baja sensibilidad, múltiples reacciones cruzadas y los títulos séricos no se correlacionan con la severidad de la enfermedad, se pueden considerar una prueba de seguimiento para los pacientes que reciben tratamiento, ya que los titulación sí se correlacionan con el proceso de curación 3,5.
El diagnóstico diferencial se basa en la forma de presentación clínica y en la morfología de las lesiones: en la forma linfangítica se debe indagar por otras entidades que se presenten como una linfangitis nodular, principalmente infecciones por micobacterias, principalmente Mycobacterium marinum. También se debe pensar en nocardiosis (producida por Nocardia brasiliensis), cromoblastomicosis, criptococosis, blastomicosis y enfermedad por arañazo de gato 25,26. En la forma fija el principal diagnóstico diferencial es la leishmaniasis cutánea, aunque también se deben considerar úlceras de causa no infecciosa 3,5. Igualmente, debe diferenciarse de infecciones bacterianas cutáneas, lupus vulgar y sarcoidosis 27,28.
La guía realizada por la Sociedad de Enfermedades Infecciosas de América publicada en el 2007, sugiere que es necesario realizar un tratamiento a la mayoría de los pacientes, ya que es rara la resolución espontánea. En cuanto a la esporotricosis linfocutánea y fija, se recomienda (cuadro 2) 29:
1. Itraconazol 200 mg/día vía oral, hasta por 2 a 4 semanas luego que todas las lesiones hayan resuelto clínicamente, generalmente un total de 3 a 6 meses (nivel de evidencia II - A).
2. Quienes no responden al tratamiento anterior, deben recibir cualquiera de las siguientes opciones:
- Itraconazol 200 mg/ dos veces al día, vía oral (nivel de evidencia II-A).
- Terbinafina 500 mg/ dos veces al día, vía oral (nivel de evidencia II-A).
- Solución saturada de yoduro de potasio, iniciando con cinco gotas (usando un gotero estándar) tres veces al día, vía oral e ir aumentando la dosis como sea tolerada hasta llegar a una dosis de 40 - 50 gotas tres veces al día (nivel de evidencia II-A).
3. Fluconazol 400 a 800 mg/día, únicamente si el paciente no tolera los medicamentos descritos anteriormente (nivel de evidencia II-B).
4. Mujeres en embarazo o en período de lactancia, con esporotricosis cutánea fija, se recomienda el uso de hipertermia local (42 - 43°C), puesto que en esta población no es seguro el uso de antimicóticos sistémicos (nivel de evidencia III-B). Para casos graves de esporotricosis en embarazadas, se recomienda anfotericina B (formulación lipídica), en dosis de 3 a 5 mg/kg/día o anfotericina B desoxicolatoa a dosis de 0,7 a 1 mg/kg/día (nivel de evidencia III-B).
5. Niños con esporotricosis limitada a piel, itraconazol 6 a 10 mg/kg vía oral, hasta un máximo de 400 mg (nivel de evidencia III-B). Una alternativa terapéutica es la solución saturada de yoduro de potasio, que se inicia con una gota (usando un gotero estándar) tres veces al día y según tolerancia ir aumentando hasta un máximo de 1 gota/kg o 40 a 50 gotas tres veces/día (nivel de evidencia III-B).
Para la esporotricosis circunscrita a piel, la tasa de respuesta con itraconazol es del 90 - 100 %, manifestándose en las primeras cuatro semanas, en comparación con la tasa de respuesta al fluconazol que es de 63 a 71 % 29,30.
En relación a los pulsos de itraconazol, en el 2008 se publica un estudio con cinco pacientes (cuatro con presentación linfocutánea y uno con forma fija), a quienes se les administra itraconazol 400 mg/día en dos tomas durante una semana, seguido de un descanso de tres semanas y a partir de este momento se inicia la administración en forma de pulsos con intervalos de tres semanas hasta que se lograra la curación clínica y micológica, que se obtuvo en cuatro casos (80 %) con una media de pulsos de 3,5. Ningún paciente presentó efectos adversos. Este estudio plantea que los pulsos de itraconazol pueden ser una nueva opción terapéutica que disminuye los costos del tratamiento y mejora la adherencia por parte del paciente 31.
Se tiene muy poca experiencia clínica con terbinafina, mientras que la anfotericina B sigue siendo el tratamiento de elección en casos de esporotricosis grave o potencialmente mortal 29.
Desde 1903, fecha que se utilizó por primera vez el yoduro de potasio para esta enfermedad se ha seguido utilizando por su efectividad y bajo costo, sobre todo en países subdesarrollados 3,5,30. Sus desventajas, tales como duración prolongada del tratamiento -y por ende una mala adherencia por parte del paciente-, recaídas frecuentes en caso que no se tome mínimo dos semanas después de la cura clínica e intolerancia gástrica, han limitado su uso colocando al itraconazol como primera línea de tratamiento 29,32.
En una revisión de Cochrane publicada en 2009 se concluye que aunque el yoduro de potasio ha sido ampliamente usado por más de 100 años, no se han realizados ensayos controlados con placebo que demuestren su efectividad. Por esta razón, no hay buena evidencia científica a favor o en contra del uso de este medicamento en el manejo de la esporotricosis 33.
En una serie realizada con nueve pacientes con esporotricosis limitada a piel, se encuentra que sesiones mensuales de criocirugía con nitrógeno líquido como tratamiento coadyuvante en pacientes con respuesta lenta a los antimicóticos, reducen el tiempo de tratamiento, los costos y los efectos secundarios asociados a la terapia 34.
Cromoblastomicosis
Es también llamada: cromomicosis, micosis de Carrion, micosis de Lane - Pedroso, dermatitis verrucosa, blastomicosis negra 35.
Esta entidad fue vista por primera vez en 1911 en Brasil por Alexandrino Pedroso, pero sólo se informó hasta 1920 por Pedroso y Gomes, quienes la describieron como una “dermatitis verrucosa de origen infeccioso” 36-38. En 1914, Max Rudolph hizo énfasis en las características clínico patológicas y en 1915, Medlar y Lane reportan el primer caso en Norte América; y el hongo que se aisló se le llamó Phialophora verrucosa36. En 1935, la enfermedad fue nombrada cromoblastomicosis por Moore y Almeida 35.
Tiene una distribución mundial, sin embargo se encuentra con mayor frecuencia en áreas tropicales y subtropicales. Se ha visto en México, Costa Rica, Puerto Rico, Cuba, República Dominicana, Venezuela, Brasil, India, Australia, aunque también se han descrito casos en Europa y Estados Unidos 2,35,36.
Afecta principalmente a hombres entre 30 y 60 años, quienes posiblemente adquieren la infección por inoculación traumática del hongo durante trabajos rurales, por lo tanto las áreas del cuerpo más afectadas son manos y pies. Es rara en mujeres y niños menores de 15 años de edad (cuadro 1) 38-40.
Es causada por un gran número de hongos dematiáceos saprofitos que habitan en el suelo, plantas, flores y madera. Cinco hongos se han asociado con cromoblastomicosis: Fonseca pedrosoi, Fonseca compacta, Phialophora verrucosa, Cladophialophora carrionii y Rhinocladiella aquaspersa; sin embargo, de estos agentes, el más comúnmente aislado es Fonseca Pedrosoi, seguido por Phialophora verrucosa (cuadro 1) 36,39,40. Cladophialophora carrionii es el hongo más importante como causal de enfermedad en desiertos secos de Australia, Sudáfrica y Cuba 39. Estos son hongos de crecimiento lento, baja virulencia y una alta tolerancia al calor (40-42 °C) 36.
La mayoría de las veces el hongo penetra en la piel luego de un trauma con material contaminado y luego se disemina por contigüidad. El período de incubación y su patogénesis no están completamente entendidos, pero se ha sugerido una susceptibilidad genética por el reporte de varios casos familiares; sin embargo, este dato no es del todo claro 36.
Una de las alteraciones que se ha visto en esta enfermedad es un defecto en la inmunidad celular adquirida: hay un desequilibrio entre las células protectoras tipo Th 1 y una menor eficacia en la respuesta de las células tipo Th2 36. La respuesta humoral frente a esta infección involucra las Ig M y A. Los altos niveles de Ig M, son el resultado de una estimulación antigénica constante debido a la lenta degradación del hongo. En cuanto a la Ig A, debido a que la cromoblastomicosis no afecta al epitelio mucoso, los niveles aumentados de esta inmunoglobulina representan solo un marcador del estado inmunológico del huésped 36.
Durante el proceso de infección se están produciendo constantemente anticuerpos antimelanina, ya que la melanina es un factor de virulencia del hongo. Este pigmento interfiere con la activación del complemento, la disminución de la susceptibilidad del hongo a los agentes antimicóticos; por otro lado, protege indirectamente al hongo de los radicales libres y el subsecuente daño oxidativo. Este mecanismo no permite que los macrófagos u otras células fagocíticas eliminen los elementos del hongo explicando así el curso crónico y recurrente de esta entidad 36,41.
La patogénesis de las complicaciones a largo plazo podría ser explicada por la acción del factor de crecimiento transformante β, el cual tiene un efecto doble: induce fibrosis e inmunosupresión de la piel 42.
La enfermedad tiene un curso crónico. Típicamente es limitada a piel y tejido celular subcutáneo, rara vez llega a diseminarse por vía linfática y comprometer estructuras óseas, siendo estas presentaciones más comunes en pacientes inmunosuprimidos 9,35.
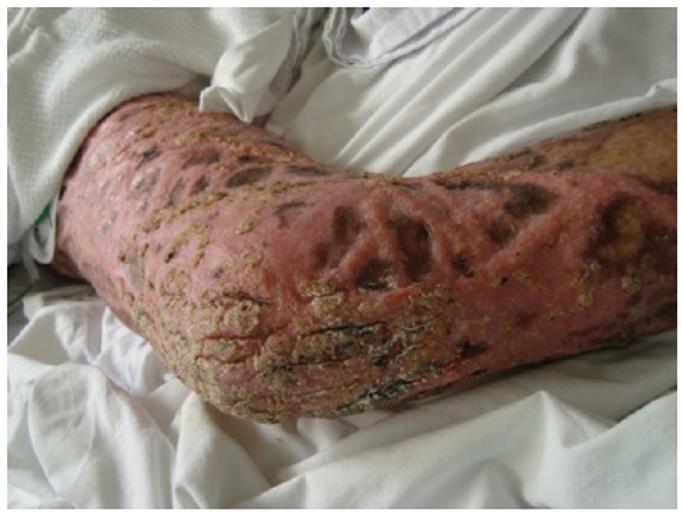
Clínicamente, inicia como una pápula o nódulo eritematoso, pequeño, unilateral, pruriginoso, doloroso o asintomático, que se extiende lentamente a la piel adyacente pudiendo ir desde pocos milímetros hasta muchos centímetros. Las lesiones van avanzando hacia una placa eritematosa con o sin descamación o ulceración, y con bordes tan bien definidos que puede semejar una tiña o una psoriasis. Posteriormente, la placa se extiende de manera centrífuga y toma un aspecto verrucoso o papilomatoso, pueden observarse lesiones satélites y puntos negros sobre su superficie (figura 2). En los meses y años siguientes pueden desarrollarse lesiones similares en la misma zona o en áreas adyacentes. Las lesiones curan con cicatrices atróficas y áreas acrómicas, aunque la formación de queloides no es rara 9,38,39.
El compromiso más común es en las piernas (85 %), seguido por las extremidades superiores (predominantemente en el dorso de la mano); aunque también puede afectar otras áreas expuestas al trauma como: brazos, tronco, cuello, antebrazos, cara y glúteos 37,39. La afección diseminada, tanto en brazos como en piernas, no es común, viéndose en menos del 20 % de los casos 36,43.
En caso que ocurra una sobreinfección bacteriana se pueden observar linfadenopatías, linfedema e incluso elefantiasis, lo cual puede ocurrir también en casos avanzados 36.
La clasificación clínica actual se basa en la morfología de las lesiones así: la forma nodular es la presentación clínica más común (40 %), seguida de la forma verrucosa o vegetante (26 %), y otras formas de presentación: forma linfangítica (esporotricoide), tumoral, cicatricial y mixta (cuadro 1) 36,39.
La principal complicación de esta entidad es su potencial de transformación maligna, llegándose a transformar a un carcinoma escamocelular 44,45.
El diagnóstico se basa en el examen directo y cultivo. El área que clínicamente se ve con puntos negros es la que debe ser seleccionada para la toma de las muestras 37. En el examen directo con KOH se pueden observar células fúngicas muriformes, que son células cafés de paredes gruesas, con una doble membrana y un tabique central (similar a los granos de café). Estas células son fácilmente identificadas con hematoxilina eosina siendo innecesarias las tinciones especiales 2,9,37.
El diagnóstico se debe confirmar con el cultivo del hongo en medio de agar Sabouraud con dextrosa, observándose hongos dematiáceos de crecimiento lento (25-30 días). Las colonias de Fonseca pedrosoi producen un color oliva oscuro, marrón oscuro o negro y las que produce Phialophora verrucosa son oscuras con un tinte marrón grisáceo (cuadro 1) 9,36.
La histología muestra una epidermis hiperplásica pseudo-epiteliomatosa y acantósica; en la dermis papilar y reticular se observa infiltrado linfohistiocítico y granulomas tuberculoides con células epitelioides, células gigantes de Langerhans y de tipo cuerpo extraño. En casos severos se puede ver fibrosis 9,36,37.
Debe diferenciarse de otras enfermedades infecciosas como leishmaniasis verrucosa, tuberculosis verrucosa, esporotricosis fija, lacaziosis, paracoccidioidomicosis, elefantiasis 2,36,38. También de entidades no infecciosas como carcinoma escamocelular, psoriasis o sarcoidosis 36,37.
Es una entidad crónica, refractaria al tratamiento y por lo tanto difícil de erradicar. En las primeras etapas de la enfermedad las lesiones pueden responder a la resección quirúrgica, pero a medida que la enfermedad se extiende y se torna más grave son de elección los antimicóticos sistémicos. La tasa de éxito de la terapia depende del agente etiológico (C. carrionii es más sensible que F. pedrosoi), de la severidad de la enfermedad y del medicamento antifúngico 46.
La falta de estudios aleatorizados comparativos hace que la evidencia sea pobre y que no exista una prueba de oro terapéutica; sin embargo, hay estudios que demuestran superioridad de itraconazol y terbinafina frente a otros antifúngicos, estén o no asociados a terapias físicas coadyuvantes, como calor local a 43 ° C, crioterapia o cirugía 9,46.
Para estadios tempranos de la enfermedad se han utilizado terapias físicas con algún grado de respuesta. Como terapia de primera línea se ha propuesto la cirugía; sin embargo, estudios recientes evidencian la eficacia de un antifúngico sistémico asociado a una terapia física, para disminuir la duración del tratamiento oral (cuadro 2) 46.
Pimentel et al., evaluan la eficacia de la criocirugía con nitrógeno líquido en 11 pacientes (cinco con lesiones localizadas y seis con lesiones generalizadas). Aquellos con lesiones localizadas responden muy bien al tratamiento y no presentan recidivas hasta por 53 meses; en tres pacientes con lesiones generalizadas se obtiene remisión clínica y micológica hasta por 26 meses, y los tres restantes del grupo de lesiones generalizadas presentan mejoría clínica sin curación 47.
En cuanto a la terapia antimicótica sistémica se han utilizado múltiples agentes con tasas variables de éxito como calciferol, yoduro de potasio, 5-fluorocitosina, ketoconazol, fluconazol, anfotericina B. Pero los mejores resultados se han visto con itraconazol y terbinafina con una duración del tratamiento entre 6 y 12 meses 9.
En un estudio de treinta pacientes con cromoblastomicosis tratados con itraconazol a dosis entre 200 a 400 mg/día, los pacientes que alcanzaron curación clínica y micológica fueron: ocho pacientes (89 %) con formas leves de la enfermedad, y 11 de 12 pacientes (91 %) con formas moderadas 48.
Hay estudios que demuestran superioridad de itraconazol y terbinafina frente a otros antifúngicos, estén o no asociados a terapias físicas coadyuvantes, como calor local a 43 ° C, crioterapia o cirugía.
Los pulsos de itraconazol logran muy buena respuesta terapéutica con dosis de 400 mg/día durante una semana del mes por 12 meses 48. También se ha reportado el uso combinado de itraconazol con 5-flucitosina con muy buenos resultados 48,50.
La asociación simultánea de itraconazol en pulsos junto a medidas físicas como la crioterapia mostró éxito en dos de tres pacientes con cromoblastomicosis, acortando la duración del tratamiento comparado con el itraconazol o la crioterapia solos 51.
También se ha descrito el uso de la terbinafina a dosis de 250 a 500 mg/día. Hay varios reportes exitosos con 250 mg/día; sin embargo, se prefiere la dosis de 500 mg/día 9,46,52.
Bonifaz et al., evaluan la respuesta de cuatro casos de cromoblastomicosis con el uso de terbinafina oral a dosis de 500 mg/día. Encuentran curación clínica y micológica en tres casos sin efectos adversos, y concluyen que la terbinafina a esta dosis representa uno de los mejores tratamientos debido a su eficacia y excelente tolerabilidad 53.
Un reporte de caso publicado en el 2012, describe resultados exitosos con el uso combinado de terbinafina oral antes de realizar el tratamiento quirúrgico, para disminuir el tamaño de la misma y lograr mejores resultados con la cirugía 54.
Por esta razón y teniendo en cuenta la refractariedad al tratamiento de esta entidad, siempre se debe considerar la terapia combinada, independiente del medicamento utilizado 9.
Conclusiones
Las micosis subcutáneas siguen afectando a los pacientes susceptibles en las regiones tropicales y subtropicales del mundo, especialmente a las personas que trabajan en áreas rurales y que manejan material vegetal. La mayoría de estas infecciones responden a itraconazol y terbinafina, pero se necesitan ensayos clínicos adicionales para definir el tratamiento óptimo. Es importante la educación acerca de las medidas de protección que deben usar los trabajadores agricolas.