Introducción
El dengue es una infección viral transmitida por picadura de mosquitos del género Aedes. El virus del dengue pertenece a la familia Flaviviridae, género Flavivirus1,2. Se estiman 390 millones de infecciones por año en el mundo 3. En Colombia en 2016 se notificaron 103 822 casos de dengue, de los cuales 1 % fueron dengue grave. La letalidad ese mismo año fue 5,7 % 4. La severidad de esta infección está determinada por el grado de extravasación plasmática que puede conducir a choque y al compromiso de órganos 1,5. Algunos mecanismos para explicar la presencia de formas severas son la virulencia de las cepas, infección secundaria con un nuevo serotipo y factores del huésped como la presencia de co-morbilidad, la edad o factores genéticos 6-8.
Con el objetivo de obtener una aproximación al entendimiento de la fisiopatología de la infección por el virus del dengue se hizo la revisión de 21 artículos que evaluaron 215 casos de pacientes fallecidos durante la infección por dengue y que tuvieron estudio morfológico e histológico postmorten. La revisión consideró artículos disponibles en Pubmed y Scielo. Las palabras clave utilizadas para la búsqueda fueron dengue, authopsy and death. Se excluyeron los artículos que describían pacientes con co-infecciones.
Características generales
La edad de los casos fatales osciló entre 45 días y 86 años. El grupo menor de seis años incluyó 64 casos. El 50,6 % fueron mujeres (cuadro 1) 9-29. Las comorbilidades fueron: diabetes, hipertensión arterial, obesidad, dislipidemia, alcoholismo, hipertensión pulmonar y enfermedad renal.
Cuadro 1 Hallazgos anatomopatológicos postmorten en pacientes con dengue
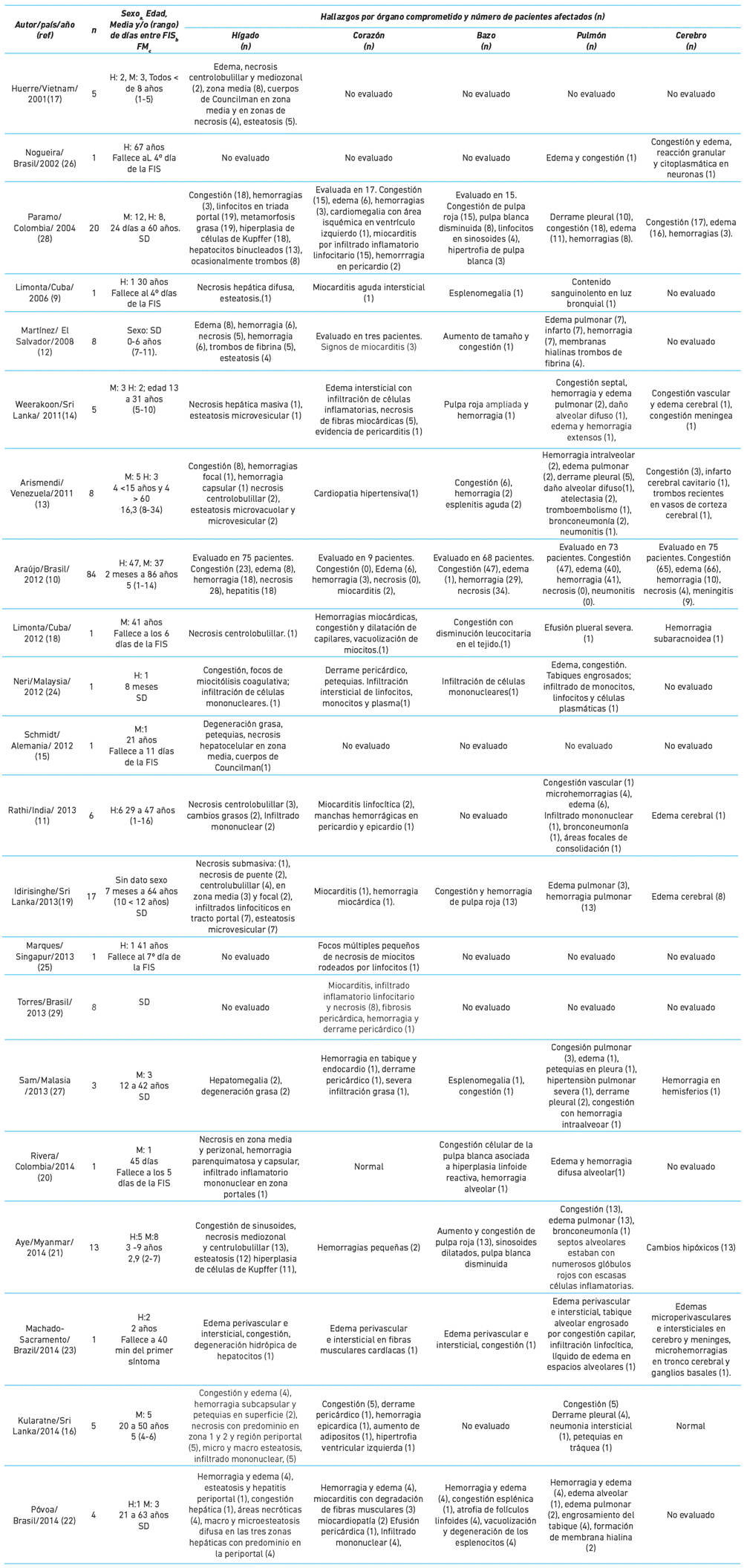
a: sexo: H: hombre, F: mujer. b: FIS: fecha de inicio de síntomas. c: FM: fecha de muerte. SD: sin dato
Fueron identificados antígenos virales en hígado, tejido linfoide, cerebro, bazo, riñón, pulmón, miocardio, sistema nervioso central, médula osea, páncreas y corazón y proteínas no estructurales (NS) del virus NS3 y NS1 y de la envoltura (E) fueron observadas en hígado, pulmón, corazón, bazo y nódulos linfáticos 9,10,12,14,15,17,18,20-24,26.
La sola presencia de antígenos virales por inmunohistoquímica, no confirma la replicación viral porque puede ser consecuencia de fagocitosis celular del virus o por la presencia de complejos antígeno-anticuero 9. Se confirmó la replicación del virus del dengue en el hígado, el pulmón, corazón, cerebro, bazo y tejido linfoide por presencia de NS3, RT-PCR o por aislamiento viral. Los serotipos identificados fueron: DENV-1 en 13 pacientes, DENV-2 en 9, DENV-3 en 16 y DENV-4 en 14 casos 9,10,14,18,20,21,25,26.
Hallazgos postmortem
En 18 artículos se realizó descripción de alteraciones hepáticas y están presentes en todos los menores de seis años. Los hallazgos macro y microscópicos más comunes son congestión, hemorragia capsular y necrosis centrolobulillar focal. La necrosis predomina en la zona 1,2 y en región periportal 9-22. Se observa micro y macroesteatosis 9,11-17,19,21,22. Aye et al.21 encuentran en las áreas esteatósicas hepatocitos agrandados con citoplasmas vacuolares, células anucleadas, que comúnmente se acompañan de cuerpos de Councilman. Povoa et al. 22 identifican la proteína viral NS3 en células de Kupffer, células endoteliales sinusoidales del hígado, hepatocitos necróticos y en los cuerpos de Councilman, indicando replicación viral. Aye et al. 21 identifican infección en hepatocitos y células de Kuffer y el complemento neoC9, como parte del complejo de ataque en áreas de necrosis. Otros autores han observado antígeno viral en celulas de Kuffer, hepatocitos y células endoteliales de hígado 30.
No se encuentra correlación entre la cantidad de RNA viral y la extensión de la necrosis hepática, pero sí se una correlación positiva con el grado de hiperplasia de células de Kupffer y la cantidad de carga víral. Este hallazgo sería el esperado ya que estas células tienen la función macrofagocitica del hígado y serían las encargadas de la producción de citoquinas proinflamatorias en respuesta a esta infección 31. Tres pacientes presentaron falla hepática 11,13,16.
En 17 de los estudios se reporta algún tipo de compromiso pulmonar: edema, efusión pleural, atelectasias y hemorragias intra-alveolares o pleurales 9-14,16,19-24,26-29. Se describe alvéolos con histiocitos, engrosamiento del tabique, infiltrado inflamatorio mononuclear e hiperplasia de macrófagos alveolares 11,14,22-24. En macrófagos alveolares, neumocitos tipo II y endotelio se observa presencia de la proteína NS3 22.
La manifestación cardíaca más común es la miocarditis linfocítica, presencia de infiltrado inflamatorio con necrosis de miocitos 9,11,14,19,22,25,28,29, posiblemente por daño directo del virus. Póvoa et al. 22 demuestran la presencia de NS3 en las fibras miocárdiacas, en monocitos y endotelio.
En el sistema nervioso central se encuentra congestión, edema, hemorragias, necrosis, presencia del antígeno viral en materia gris, reacción granular y citoplasmática en las neuronas 10,23,26.
En riñón se observa dilatación y congestión de los capilares glomerulares, necrosis tubular aguda, microhemorragias 11,12,21,22,23,28. Se identifican antígenos virales, sin presencia de NS3 en el parénquima renal, en macrófagos y células endoteliales en túbulo renal 22,24.
En el bazo los hallazgos mas comunes son congestión, hemorragias y atrofia de folículos linfoides, nfiltrados de mononucleares, necrosis y esplenitis aguda 10,13,14,19,20,22,24,28. Hay presencia de antígeno viral en macrófagos circulantes de la pulpa roja, células multinucleadas y linfoides 22. Se observa acumulación de células dendríticas foliculares con depósitos eosinofílicos intercalados con macrófagos en los centros germinales, que se ha descrito como un hallazgo diagnóstico de la infección por flavivirus 21.
La duración de la enfermedad hasta la fecha de muerte ocurrió en forma temprana en la mayoría de los casos. De los 17 autores con dato del tiempo desde la fecha de inicio de síntomas hasta la muerte, nueve reportan 133 pacientes que fallecieron antes de los ocho días 9,16-18,20,21,23,25,26. Para otros autores el rango fue de 1 a 16 días 10,11,13,14,15 y de 8 a 34 días 13 (cuadro 1).
Las causas de muerte en niños son: falla multiorgánica, hemorragias, falla respiratoria aguda, neumonìa intersticial, compromiso cardíaco y choque 12,21,23,24. En adultos, además de las causas anteriores, se agrega encefalopatía, pancreatitis y edema pulmonar agudo 11,16,22.
Discusión
Los hallazgos postmorten más comunes son la congestión y el edema de órganos, como un resultado de la extravasación del plasma, que conduce al choque hipovolémico, la causa más frecuente de fallecimiento 12.
La extravasación plasmática es causada por el incremento de la permeabilidad capilar, en el que el endotelio vascular juega un papel importante; sin embargo, el mecanismo exacto aún no es claro. Se considera que el aumento de la permeabilidad vascular es por acción de mediadores químicos e inmunológicos como parte de la respuesta inmune del huésped 21,11,12, que a su vez puede conducir a hipoperfusión, isquemia, falla orgánica y muerte 21.
La distribución por sexo essemejante. Esta variable ha sido motivo de controversia, para algunos autores el sexo femenino se asocia a mayor letalidad, posiblemente por una respuesta inmune más robusta 27, para otros, no hay diferencia 32.
Las manifestaciones hepáticas son las más comunes, lo que muestra que el hígado es un órgano blanco para la replicación del virus, 13 sin embargo la falta de correlación entre el daño hepático y la presencia de antígeno o de ARN viral sugiere que la replicación viral no explica por si sola el daño hepático y que factores, como la respuesta inmunológica del paciente, la hipoxia, la absorción del NS1 y la presencia de endotoxinas pueden estar contribuir a las lesiones de este órgano 21. Otros factores como la presencia de co-morbilidades como dislipidemia, obesidad, alcoholismo, enfermedades hepáticas y diabetes también contribuyen a un rápido deterioro 16,30,27.
Es constante la presencia de esteatosis en el hígado, compatible con el requerimiento de un ambiente lipídico para la replicación viral. Durante la infección por dengue se aumenta la B-oxidación de ácidos grasos y la síntesis de colesterol para llevar a cabo la replicación 33.
La fuga plasmática puede causar edema pulmonar no cardiogénico que se manifiesta como un síndrome de dificultad respiratoria 12, en pacientes de cualquier edad, sin embargo las causas de muerte por insuficiencia respiratoria y neumonitis intersticial parecen ser más frecuentes en niños 12,23,24.
El 13,9 % de los pacientes presentan hallazgos sugestivos de compromiso cardíaco. Salgado et al. 34 demuestran el virus en los miotúbulos y aumento de expresión de genes inflamatorios y de las concentraciones de Ca2+ intracelular. Estas observaciones apoyan la hipótesis de que la disfunción cardíaca asociada al dengue, es el resultado directo del virus en miocitos y músculo, que pueden alterar el almacenamiento de Ca2+ intracelular causando el daño de las fibras cardíacas.
La patogénesis del compromiso neurológico durante la infección por dengue puede darse por daño directo del virus, en forma indirecta por la extravasación plasmática y las hemorragias y por la respuesta inmunológica 35,36. Cualquier serotipo del virus del dengue es potencialmente fatal, aunque hay autores que relacionan a los serotipos DENV-2 y DENV-3 con mayor neurovirulencia 26. La presencia de CD68+ infectados en el cerebro, sugiere que la migración de macrófagos infectados al cerebro puede ser una vía para el ingreso del virus al sistema nervioso central. Adicionalmente, el daño sobre la barrera hematoencefálica por los procesos pro-inflamatorios puede facilitar el ingreso del virus al cerebro 37
En el bazo el hallazgo más relevante es la atrofia de los folículos linfoides con la consecuente disminución de linfocitos T y B. En modelos murinos infectados por DENV-2, se ha descrito la reducción de TCD4 + y TCD8 + en el bazo 22, situación que podría repercutir en la respuesta inmunológica.
En el estudio de Martìnez E. et al, 12 se observa que los pacientes fallecen por choque durante las primeras 72 horas de hospitalización, por hemorragia masiva entre el segundo y tercer día, por el compromiso pulmonar después de 24 o 48 horas cuando tiene un choque recurrente y 72 horas cuando hay una confección, como también es tardío el fallecimiento si se realiza cirugía 15. En esta revisión la mayoría de los pacientes fallecieron antes de los ochos días de hospitalización; sin embargo, para determinar diferencias relacionadas con el tiempo de evolución se requiere otro tipo de estudios.
Conclusiones
El virus del dengue puede causar la muerte por extravasación plasmática y por daño multiorgánico y aunque el hígado, el pulmón, el bazo parecen ser los más afectados otros órganos como el cerebro y el bazo deben ser incluidos en el protocolo de las autopsias.
Es importante que los médicos evalúen la función cardíaca y pulmonar en los pacientes con dengue y se deben definir signos de alarma para estos dos órganos.














