Introducción
El cáncer de piel no melanoma es la forma más frecuente de cáncer en Estados Unidos; su incidencia anual se estima entre 1,3 a 3,5 millones de casos 1,2. En Colombia se evidenció un aumento en su incidencia al pasar de 23 a 41 por 100 000 habitantes entre los años 2003 y 2007, esperando al 2020 una incidencia de alrededor de 102 por 100 000 habitantes si persiste esta tasa de crecimiento 3. De acuerdo con lo anterior, se puede esperar un aumento en la demanda de tratamientos para este tipo de condición.
Para su manejo existen diferentes alternativas, siendo una de las opciones terapéuticas la cirugía micrográfica de Mohs, ofreciendo ventajas en lo referente a la preservación de tejido sano, márgenes histológicos mas precisos y, de acuerdo a la técnica, un posible impacto en la recurrencia 3-6.
Generalmente, este procedimiento se realiza bajo anestesia local o con la ayuda de algún medicamento sedante o ansiolítico. Dado que la población afectada es en su mayoría de edad avanzada, deben tenerse en cuenta los riesgos perioperatorios para este grupo etareo, tales como el delirium que puede variar de un 30 a 70 %, y su relación de acuerdo al ansiolítico usado 7,8.
Recientemente, se ha incrementado el uso de agonistas alfa-2 para la anestesia intraoperatoria, siendo reconocidos como medicamentos de primera elección para la sedación en diferentes tipos de procedimientos ortopédicos, oftalmológicos, odontológicos y diagnósticos 9. Medicamentos como la dexmedetomidina han demostrado una adecuada respuesta clínica y baja tasa de complicaciones respiratorias, así como menor incidencia de delirium 10-14
A pesar de los beneficios de dexmedetomidina para sedación, también se ha asociado a eventos adversos graves como bradicardia severa, hipotensión e incluso, paro cardiaco 15-17. Su uso en diferentes procedimientos, asociados a diferentes modalidades de anestesia también se ha visto relacionado con episodios de bradicardia, que requieren de manejo con atropina para la prevención de complicaciones hemodinámicas mas severas 18,19. Sin embargo, no se conocen estudios respecto a las complicaciones cardiovasculares en procedimientos como la cirugía microgáfica de Mohs con requerimiento de sedación.
En consideración de lo anterior y asociado a que en nuestro hospital se realiza la cirugía dermatológica de Mohs, en su mayoría con reconstrucción en el mismo acto quirúrgico, presentando tiempos quirúrgicos prolongados y requiriendo así el uso de anestesia local más sedación con dexmedetomidina, se realizó esta investigción con el objetivo de describir la frecuencia de bradicardia en los casos donde se usó sedación con dexmedetomidina.
Materiales y métodos
Bajo un diseño tipo serie de casos, realizamos una búsqueda de todos los pacientes operados de cirugía de Mohs cuya anestesia fuera local y regional más sedación con dexmedetomidina entre noviembre de 2012 y noviembre de 2013. Se excluyeron aquellos pacientes con información incompleta o mal diligenciada. Para la valoración de las historias clínicas se revisaron los archivos procedentes de salas de cirugía del hospital y se identificaron los pacientes sometidos a cirugía de Mohs; posteriormente, se solicitaron las historias clínicas para revisar cuáles pacientes cumplían los criterios de inclusión y de exclusión. Hallamos 33 pacientes de los cuales se excluyeron tres por datos mal diligenciados.
De las 30 historias clínicas seleccionadas se extrajeron variables demográficas, clasificación ASA, tiempo de cirugía, tiempos de infusión del anestésico y su dosis, medicamentos coadyuvantes a la dexmedetomidina, necesidad de conversión a anestesia general y requerimiento de atropina o de soporte ventilatorio por depresión respiratoria.
El instrumento de recolección de datos fue un formulario electrónico desarrollado con la aplicación LimeSurvey y alojado en los servidores de la Fundación Universitaria de Ciencias de la Salud. Los datos se exportaron desde la aplicación al programa Microsoft Excel y se realizó su análisis en el programa estadístico STATA® 12. La descripción de las variables demográficas, tiempos de cirugía, tiempos de infusión y las dosis de anestésico usado se realizó con medidas de tendencia central y de dispersión. El sexo, la clasificación ASA, la necesidad de conversión, la bradicardia, requerimiento de atropina y demás eventos adversos se expresaron con frecuencias absolutas y relativas. La incidencia acumulada de bradicardia se calculó dividiendo el número de historias que reportaban “sí” para la variable atropina entre el número total de historias clínicas.
La presente investigación se desarrolló previa aprobación del comité de investigación de la Fundación Universitaria de Ciencias de la Salud y el comité de ética del Hospital de San José (acta número 02 de febrero del 2014) y fue clasificado como un estudio sin riesgo, por lo que no se hizo necesario la firma de consentimiento informado.
Resultados
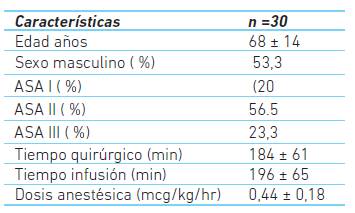
El 53,3 % de los pacientes eran de sexo masculino, la edad promedio fue 68,4 ± 14,1 años; el 20 % fueron clasificados como ASA I, 56,5 % en ASA II y 23,3 % como ASA III.
El tiempo quirúrgico promedio fue de 184 ± 61 minutos y de anestesia con dexmedetomidina fue de 196 ± 65,2 minutos. El 23,3 % recibió bolo inicial de dexmedetomidina con una dosis promedio de 0,68 ± 0,24 mcg/kg y ningún paciente requirió bolo adicional intraoperatorio. La dosis promedio de infusión de dexmedetomidina fue de 0,44 ± 0,18 mcg/kg/h (cuadro 1).
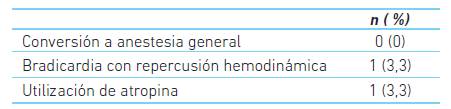
Solo un paciente presentó bradicardia severa requiriendo dosis de atropina y efedrina. En tres pacientes (10 %) se usó como coadyuvante remifentanil en infusión continua durante el procedimiento, en dosis promedio de 0,05 mcg/kg/min; dos pacientes recibieron midazolam (6,6 %) en dosis promedio de 1,5 mg y uno (3,3 %) recibió dosis única de 50 mcg de fentanyl. Ningún paciente requirió apoyo ventilatorio durante la cirugía (cuadro 2).
Discusión
Está ampliamente demostrado que el dolor y ansiedad perioperatorios se asocian a una exacerbación de la respuesta al estrés, con las subsecuentes elevaciones en glicemia, activación del sistema simpático y complicaciones tromboembólicas, isquémicas e inmunológicas 20,21. Por otro lado, una sedación excesiva también puede repercutir negativamente, dada la probabilidad de depresion respiratoria y requerimiento de ventilación mecánica, con la posible necesidad de hospitalización en unidad de cuidado intensivo 16,20,22.
La dexmedetomidina es un agonista alfa-2 altamente selectivo que proporciona ansiolisis y sedación con mínimas tasas de depresión respiratoria y delirium. En 1999 fue aprobada por la F.D.A. como agente sedante e hipnótico. El efecto agonista específico sobre los diferentes tipos de receptor alfa-2 es el que determina su efecto final 16.
Diferentes subtipos de receptores alfa-2 condicionan la variabilidad en la farmacodinamia de la dexmedetomidina. Los receptores alfa-2A se encuentran principalmente en vasos sanguíneos y producen vasoconstricción, mientras que los receptores alfa-2B y 2C se encuentran a nivel de sistema nervioso central, tanto en cerebro como medula espinal; así como en hígado, páncreas, plaquetas, riñones, tejido adiposo y ojos 14,23,24.
La dexmedetomidina tiene características de proveer ‘’sedación cooperativa’’ en el que los pacientes puedan colaborar durante diferentes procedimientos 22,23,25. A pesar de que se ha sugerido un efecto analgésico (inferior al de los opioides), mediado por receptores alfa-2 a nivel central, la analgesia inducida por la dexmedetomidina no es clara y puede estar explicada en relación con la disminución o alteración en la percepción de la ansiedad 15,16,26.
El uso de la dexmedetomidina se ha asociado en ocasiones a eventos adversos como bradicardia, hipertensión, hipotensión e inclusive paro cardíaco, por lo que se debe tener precaución en pacientes que dependen de una adecuada frecuencia cardiaca para mantener gasto cardiaco, como aquellos con trastornos de la conducción auriculo-ventricular, pacientes hipovolémicos u otros problemas cardiacos 15,23,27.
Se dispone de escasa literatura médica sobre el uso de este agente en intervenciones dermatológicas como la cirugía de Mohs. En nuestra institución la mayoría de cirugías micrográficas se continúan con la reconstrucción en el mismo acto quirúrgico, con un tiempo quirúrgico variable de acuerdo con la complejidad de cada lesión. Se estimó un tiempo quirúrgico promedio de 184 ± 61 minutos, siendo una cirugía de larga duración y uno de los principales determinantes de la molestia del paciente, así como de requerimiento de dosis adicionales de anestésico local con el posible riesgo de toxicidad.
Por lo anterior, se decide asociar sedación, además de la anestesia local, buscando ansiolisis, con la intención de garantizar una mejoría en la calidad de vida y atención del paciente. Es así como puede considerarse, durante este tipo de procedimientos, el apoyo farmacológico por medio de sedantes para permitir la ansiolisis y tolerancia por parte del paciente y probablemente disminuir la dosis total de anestésico local.
Estos resultados evidencian una baja tasa (cero casos) de requerimiento de soporte ventilatorio, reiterando la seguridad del medicamento para procedimientos bajo sedación 13,28. Igualmente, la baja incidencia de bradicardia con repercusión hemodinámica se corresponde con la reportada en su ficha técnica, sugiriendo una posibilidad segura para este tipo de cirugías, aunque se necesitan mas estudios de naturaleza comparativa para asegurar esta conclusión 29.
Una de las limitantes del estudio es su naturaleza observacional, basado en el reporte y análisis de historias clínicas, en el que se excluyeron aquellas incompletas o mal diligenciadas, por lo que existe la posibilidad de excluir pacientes que presentaron o que eran susceptibles de presentar descenlaces adversos y así mismo se contribuye a un tamaño de muestra reducido y sesgo de selección.
Otra limitante fue el no considerar en el análisis de factores asociados al desenlace de bradicardia, las posibles interacciones farmacológicas de la dexmedetomidina o condiciones del paciente, tales como los trastornos en la contractilidad o conducción cardiaca, que los hacen más susceptibles a presentar bradicardia severa. A pesar de las limitaciones antes mencionadas y en consideración de la escasez de literatura referente al uso de agonistas alfa-2 para este tipo de procedimientos, los resultados del presente estudio sugieren que es una opción segura para el manejo de pacientes, de acuerdo con cada escenario clínico.
Debe considerarse, además, el posible beneficio en su relación con el costo, por lo que los resultados pueden ser considerados en el planteamiento de nuevas hipótesis para estudios prospectivos que profundicen en la relación de sedación, costos y efectos adversos.
Conclusión
Debido a su baja incidencia de bradicardia con repercusión hemodinámica y la no necesidad de soporte ventilatorio, la dexmetomidina es una buena alternativa para proporcionar sedación en los pacientes llevados a cirugía de Mohs bajo anestesia loco-regional. Sin embargo, por las características de diseño de este estudio hay limitaciones para brindar evidencia sólida, pero sugiere una fuente de hipótesis de trabajo para técnicas anestésicas referentes a la cirugía de Mohs.