Introducción
Los stents de las vías respiratorias están indicados para tratar el estrechamiento sintomático o para cerrar las fístulas de las vías respiratorias centrales 1,2. Generalmente, se dividen en cuatro tipos: silicona, metal expandible con balón, metal auto expandible descubierto y metal auto-expansible cubierto 3,4. Dichos stents actualmente son una solución incompleta para las obstrucciones malignas o benignas de las vías aéreas y todos comparten una característica común: son de carácter permanente, a excepción de los stent de silicona, que sí son retirables 5,6.
En muchas ocasiones la remoción del stent es un objetivo principal desde su colocación temporal, especialmente en condiciones benignas, lo que plantea el desafío de un nuevo procedimiento para la extracción del stent con broncoscopio rígido y bajo anestesia general, con todos los riesgos y costos asociados al procedimiento 4,7.
Por esta razón, el concepto de un stent bronquial bioabsorbible que pueda mantener la permeabilidad de la vía aérea durante un período de tiempo predeterminado es muy atractivo. Este se degradaría de forma gradual y, eventualmente, desaparecería de la vía aérea una vez que ya no se necesite. Dichos stents son actualmente un área de intensa investigación 8. Otro concepto muy prometedor es el suministro de fármacos con stents bioabsorbibles que, gracias a su degradación en el tiempo, podrían entregar gradualmente un medicamento localizado para el tratamiento de diferentes enfermedades 7. El objetivo de este artículo es analizar la literatura disponible sobre los stents bronquiales bioabsorbibles y evidenciar los avances y retos a los que se enfrentan actualmente.
Indicaciones principales para la implantación de stents
El objetivo principal de los stents empleados en la vía aérea es restaurar y mantener la permeabilidad. Cualquier alteración, bien sea endoluminal o extrínseca, que cause reducción mayor del 50 % de la luz de la vía aérea, conduce a síntomas debilitantes como la disnea 7,9.
Las principales indicaciones para la implantación de stents en las vías respiratorias son compresión extrínseca de las vías respiratorias por tumores o ganglios linfáticos, mantenimiento de la permeabilidad de las vías respiratorias después de reducción de una obstrucción benigna o maligna intraluminal, tratamiento de estenosis benignas, estabilización de las vías aéreas colapsadas en condiciones tales como malacia y tratamiento de fístulas 4,7.
Características de un stent ideal
El stent bronquial ideal debe cumplir con muchas características, las cuales se muestran a continuación 4,5,10,11:
- Que sea fácil de implantar y económicamente asequible.
- Que sea biocompatible, bioabsorbible y radio-opaco, que sea bien tolerado y que los productos de descomposición del material no causen irritación tisular; adicionalmente, que no sea necesaria la eliminación o remoción después de cumplir su propósito.
- Que proporcione de una manera eficaz y sostenida los medicamentos necesarios para el tratamiento de una enfermedad determinada.
- Que se encuentre disponible en diferentes tamaños y longitudes, también es deseable que tenga un bajo espesor.
- Que restablezca la vía aérea con una morbilidad y mortalidad mínimas.
- Que cuente con suficiente resistencia expansiva a las fuerzas de compresión resistivas y la elasticidad necesaria para adaptarse a los contornos y movimientos de las vías respiratorias.
- Que tenga la capacidad de mantener la permeabilidad luminal sin causar isquemia o erosión en las estructuras adyacentes.
- Que cuente con características similares a las de la vía aérea para disminuir la acumulación de secreciones.
Para evitar las complicaciones asociadas al retiro de los stents permanentes o no ab-sorbibles, así como otros problemas como migración del stent, fracturas, formación de tejido de granulación, entre otras, muchos grupos de investigación se han enfocado en el desarrollo de stents bioabsorbibles.
- Que permita prevenir el crecimiento tumoral o de tejido de granulación dentro de la luz del stent.
- Que evite la migración de la posición inicial.
Actualidad de los stents bronquiales bioabsorbibles
Para evitar las complicaciones asociadas al retiro de los stents permanentes o no absorbibles, así como otros problemas como migración del stent, fracturas, formación de tejido de granulación, entre otras, muchos grupos de investigación se han enfocado en el desarrollo de stents bioabsorbibles 10,12-15. En la actualidad, existen algunos materiales bioabsorbibles disponibles para la fabricación de los stents, tales como el ácido poliláctico (PLA), ácido poliglicólico (PGA), policaprolactona (PCL), poli-ácido láctico-co-glicólico (PLGA), polidioxanona (PDO), entre otros 15-17.
Actualmente, hay varias investigaciones sobre el tema, algunas de los cuales se ocupan de stents liberadores de fármacos y otras reportan la evaluación de estos stents bajo la metodología de modelo animal. A continuación, se resaltan los trabajos más significativos en esta área.
Chao et al. fabrican stents biodegradables de policaprolactona elaborados por una máquina de moldeo por microinyección y los recubren con cisplatin (medicamento basado en el platino y usado en quimioterapia) y un copolímero de PLGA y polietilenglicol (PEG) por el método de aerosol. Realizan un modelo animal con 15 conejos blancos de Nueva Zelanda implantándoles los stents en la tráquea cervical y realizando semanalmente análisis por broncoscopia durante cinco semanas. El análisis histológico realizado muestra un epitelio ciliado intacto y una marcada infiltración de leucocitos en el área del stent. Igualmente, los stents desarrollados presentan propiedades físicas comparables a los stents metálicos con recubrimiento y una liberación sostenida de cisplatino durante cinco semanas, lo cual representa un gran potencial en el tratamiento de la obstrucción maligna de las vías respiratorias 13 (figura 1).

Figura 1 A. Diseño del elemento stent. B. Cada elemento del stent interconectado con otro elemento de stent. C. Stents biodegradables finales 13.
Novotny et al. evaluan stents bioabsorbibles de polidioxanona empleando un modelo animal de tráquea de conejo, buscando evaluar su biocompatibilidad y seguridad. Los autores no reportan muertes y los animales permanecieron en buenas condiciones durante todo el seguimiento. El análisis macroscópico muestra que la luz del stent permanece siempre abierta y el análisis histológico revela un mayor daño después de las cinco semanas del implante. Según el sistema de clasificación para las lesiones de tejido traqueal (cuadro 1), los autores encuentran un daño leve equivalente a 1 en la escala de 0 a 5 16.
Cuadro 1 Sistema de clasificación para las lesiones de tejido traqueal: Puntuación de daño traqueal 16.

Estos autores reportaron signos clínicos leves de dificultad respiratoria durante las dos primeras semanas, los cuales desaparecieron en las semanas posteriores. Los análisis histológicos realizados ratifican la seguridad y biocompatibilidad del stent. Sin embargo, sugieren continuar con las evaluaciones clínicas de estos dispositivos en los que la degradación completa del stent en las vías respiratorias es deseable. El mismo estudio presenta algunas limitaciones como la falta de ciego para las pruebas histológicas, así como la falta de más de un analista para revisar las placas histológicas 16. Adicionalmente, no se realizaron pruebas in-vitro ya que adoptaron los resultados obtenidos previamente de stents esofágicos de polidioxona desarrollados por el fabricante del material 16. Cabe aclarar que este material ha sido ampliamente usado como material de sutura y la mayoría de polímeros descritos en este artículo ya son usados ampliamente en diferentes aplicaciones en humanos razón por la cual algunas investigaciones omiten realizar pruebas de seguridad biológica sobre los materiales.
La degradación de los polímeros es una de las propiedades más importantes para diseñar un sistema bioabsor-bible que estará en contacto con el cuerpo humano.
Zhu et al. diseñan tres stent bioabsorbibles: uno helicoidal, otro tubular y otro tubular con elución de mitomicina C (MMC), los cuales son comparados con un stent tubular comercial de silicona empleando un modelo animal de 25 conejos. Los stent son fabricados en un copolímero de ácido poli-L-láctico (PLLA) y policaprolactona (PCL). El estudio sugiere que los mejores resultados son los del stent con liberación de MMC, puesto que presenta el menor atrapamiento de moco y menor porcentaje de obstrucción de las vías respiratorias. Luego de 12 semanas de seguimiento la estenosis traqueal de los stents biobsorbibles con liberación MMC fue la mitad respecto a los de silicona 14 (figura 2).
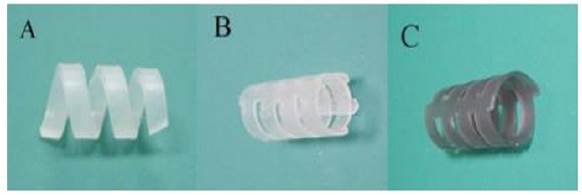
Figura 2 A. Stent bioabsorbible de forma helicoidal. B. Stent bioabsorbible tubular. C. Stent bioabsorbible tubular con liberación de MMC 14.
El trabajo desarrollado por Schopf et al. evalua los stents en forma de espiral y por fragmentos a base PLGA y poli-isopreno en un modelo animal de conejos adultos blancos 11. Este estudio corrobora histológicamente los resultados obtenidos por Marques et al. sobre el uso experimental de fibras de la misma mezcla de polímeros en ingeniería de tejidos 11,18. En el trabajo de Schopf et al. se identifica la importancia de reducir el espesor de los stents bioabsorbibles a fin de disminuir las manifestaciones clínicas y la respuesta inflamatoria asociada a la implantación del stent 11.
Factores que afectan la degradación de los polímeros
Los polímeros bioabsorbibles se degradan o bioabsorben por hidrólisis aleatoria de sus enlaces éster 19,20. Este proceso puede ser acelerado a pH ácido o básico y todos sus productos de degradación, así como los productos intermedios, son inofensivos para el cuerpo humano 16,21.
El proceso de degradación se produce en dos etapas: la primera incluye regiones amorfas de la matriz, y la segunda, las áreas cristalinas del polímero. Debido a que las propiedades mecánicas y físicas dependen mucho de la presencia de las áreas cristalinas, el efecto mecánico de la degradación no es lineal 19-22. La degradación de los polímeros es una de las propiedades más importantes para diseñar un sistema bioabsorbible que estará en contacto con el cuerpo humano, la cual depende de muchos factores 21,23 (figura 3).
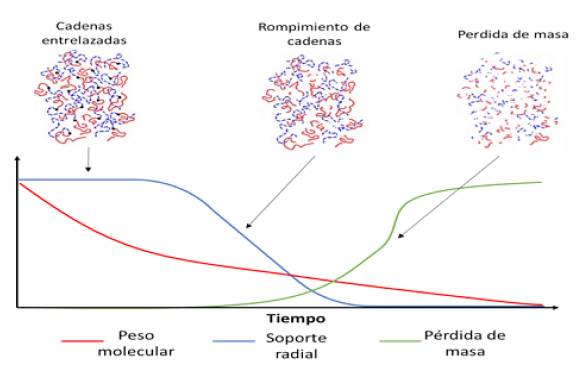
Figura 3 Efecto sobre el peso molecular, la pérdida de masa y el soporte radial de la degradación de polímeros bioabsorbibles en el tiempo.
A continuación se presentan los factores más relevantes que pueden afectar la velocidad de degradación de los polímeros.
Composición: es el factor más importante que determina la velocidad de degradación del polímero o la liberación del medicamento 23,24. Estudios de la degradación de polímeros del PLGA con diferentes composiciones realizados por Lu et al., muestran que al incrementar el porcentaje de ácido glicólico (PGA) en el copolímero se acelera su pérdida de peso o velocidad de degradación, debido al carácter hidrofílico del PGA 25. Resultados similares fueron obtenidos por Makadia y Siege 24.
La cristalinidad de los polímeros y temperatura de transición vítrea (Tg): la composición del copolímero también tiene efectos importantes sobre la temperatura de transición vítrea (Tg, temperatura a la cual el polímero disminuye su densidad, dureza y rigidez, además su porcentaje de elongación disminuye de forma drástica) y la cristalinidad, que tienen un efecto indirecto sobre la velocidad de degradación: a mayor grado de cristalinidad los polímeros suelen aumentar la resistencia química, dureza, tenacidad y temperatura de transición vítrea con lo que disminuye la velocidad de absorción o degradación 24.
Efecto del peso molecular: polímeros con alto peso molecular generalmente suelen exhibir velocidades de degradación más bajas. El peso molecular tiene una relación directa con el tamaño de las cadenas poliméricas; es así que los polímeros de alto peso molecular que contiene largas cadenas requieren de mayor tiempo para su degradación 23,26.
Tipo de solvente: el solvente empleado en la formación de una película, nanopartículas u obtención de una geometría específica de un polímero también pueden afectar las propiedades de degradación del polímero. Choi et al. elaboran películas poliméricas empleando diferentes solventes y encontraron que la Tg varía abruptamente dependiendo del tipo de solvente empleado 27. Esto se explica gracias a que los solventes orgánicos pueden inducir movimientos moleculares en las cadenas amorfas, lo que sugiere que algunos solventes pueden funcionar como plastificantes del polímero, disminuyendo la Tg y con esto aumentando la velocidad de degradación o absorción del polímero 27.
Efecto del pH: ensayos de biodegradación in vitro de polímeros bioabsorbibles fueron realizados por Zolnik y Burgess, quienes encuentran que un medio fuertemente alcalino o fuertemente ácido acelera la degradación del polímero, ya que acelera su hidrólisis o rompimiento de las cadenas éster que conforman el polímero 26,28.
Efecto del tamaño y la forma de la matriz: la relación del área superficial respecto al volumen ha mostrado ser un factor significante para la degradación de muchos dispositivos. Alta área superficial por volumen favorece una rápida degradación del polímero; así que la geometría que se defina puede aumentar o disminuir la velocidad de degradación del polímero 23,24.
Retos futuros
Uno de los retos más significativos es garantizar los tiempos de degradación desde pocas semanas hasta varios meses, así como garantizar las propiedades mecánicas y de soporte durante el tiempo requerido de acuerdo a cada enfermedad o necesidad de tratamiento 1,8,11. En cuanto a la liberación de medicamentos se debe garantizar la entrega efectiva en el tejido deseado, así como la disminución de los efectos tóxicos de algunos medicamentos 15,29.
Conclusiones
Los stents bioabsorbibles empiezan a ganar cada vez más interés debido a sus propiedades y beneficios. Sin embargo, se requiere una mayor comprensión de su desempeño y el uso para el tratamiento específico de diferentes enfermedades obstructivas de la vía aérea. Los estudios actuales muestran el potencial que tienen los stents bioabsorbibles, tanto para mantener la luz de la vía aérea como para liberar sostenidamente medicamentos para el tratamiento de diferentes enfermedades.














