Introducción
El cáncer de mama es el segundo tipo de cáncer más común y el más recurrente en las mujeres 1. Se estima que 1 671 149 casos nuevos fueron diagnosticados en 2012 y se presentaron 521 907 muertes, representando el 25,1 % de los casos 2. En Colombia se estima una tasa de incidencia de 36 por cada 100 000 mujeres y una mortalidad de 9,69 por cada 100 000 mujeres 3,4.
El cáncer de mama es el resultado de interacciones complejas entre factores genéticos y no genéticos. En cuanto a los primeros, se han descrito mutaciones en genes de alta penetrancia como BRCA1, BRCA2, TP53; y genes de baja penetrancia como RAD51, XRCC3 y ATM. Las funciones de estos genes están relacionadas con la reparación del ácido desoxirribonucleico (ADN) y control del ciclo celular 5-11.
Como factores no genéticos se han asociado el uso de anticonceptivos y de hormonas postmenopáusicas, la edad de inicio del proceso reproductivo, el número de embarazos, el consumo de bebidas alcohólicas, el cigarrillo, el sobrepeso, la obesidad, la dieta y el sedentarismo, entre otros 12,13.
De todos los eventos de cáncer aproximadamente 10 % son debido a mutaciones hereditarias 14, los cuales se caracterizan por tener presentación temprana (antes de los 50 años) 15, y estar relacionada con factores observados en los genes antes mencionados. Adicionalmente, la conjugación de las mutaciones puede inducir a fluctuaciones en los niveles de riesgo 16,17, razón por la cual los casos de cáncer de mama hereditarios son considerados heterogéneos. Además, se han identificado en ciertas poblaciones mutaciones con una distribución específica de un lugar geográfico y que han sido relacionadas con el desarrollo de la enfermedad (mutaciones fundadoras) 14.
Estas mutaciones están localizadas en alguna región del genoma que está en desequilibrio de ligamiento, transmitiéndose como una unidad 15. Así, estos cambios genéticos son heredados y están restringidos a una o pocas poblaciones de una región geográfica, situación que ha sido reportada para la población “paisa” (Antioquia, Caldas, Risaralda y Quindío) para otras enfermedades 18,19 y que explica la gran variabilidad encontrada en diferentes regiones 15,20.
Esta población es particular dado que representa un caso de múltiples fundadores, con un patrón de mezcla genética y un aislamiento geográfico del resto de la población colombiana 21,22. Varias líneas de investigación sugieren que esta comunidad exhibe las características de un aislado genético y aunque actualmente la población no se mantiene aislada, el efecto de esas condiciones aún no se ha dilucidado 23.
En base a lo expuesto, el objetivo de este estudio es evaluar los aspectos genéticos previamente mencionados y reportados en otras poblaciones, para determinar su asociación con el desarrollo de los casos tempranos de cáncer de mama dentro de la población paisa.
Metodología
Se realizó un estudio retrospectivo de casos en población “paisa”. Previo al inicio de la investigación, el proyecto fue avalado por el comité de ética de la Universidad CES que determinó que la investigación era de riesgo mínimo para los pacientes y que sigue los principios éticos para investigaciones médicas en seres humanos descritos en la declaración de Helsinki.
Todos los individuos participantes tuvieron como criterio de inclusión que ellos, sus padres y sus abuelos pertenecieran a esta población y debían tener un diagnóstico de cáncer de mama verificado por un mastólogo, tomando como base el estudio de la anatomía patológica del tejido. Este grupo de individuos se estratificó en mayores y menores de 50 años, dado que la enfermedad presenta una penetrancia relacionada con la edad.
El cálculo del tamaño de la muestra se realizó por separado para aquellos con edades de diagnóstico menores de 50 años o mayores o iguales a 50 años. Para su cálculo se utilizó la frecuencia del fenotipo la cual es del 10 % (23, un poder del 80 % y un nivel de significancia del 5 %. Basado en esto, se colectaron muestras de 165 mujeres diagnosticadas con cáncer de mama (81 menores de 50 años y 84 mayores de 50 años).
Las muestras fueron captadas directamente por los investigadores en diferentes centros hospitalarios de la ciudad de Medellín durante los años 2013 y 2014. A cada individuo quien voluntariamente aceptó participar en el estudio se le realizó una encuesta personal acerca de su origen para verificar la pertenencia a la población de estudio, el criterio de los antecedentes familiares y para consultar sobre las diferentes variables de riesgo no genético, tales como el índice de masa corporal, edad de menarquia, edad de menopausia, edad del primer hijo, terapia de reemplazo hormonal, uso de anticonceptivos, consumo de cigarrillo y actividad física.
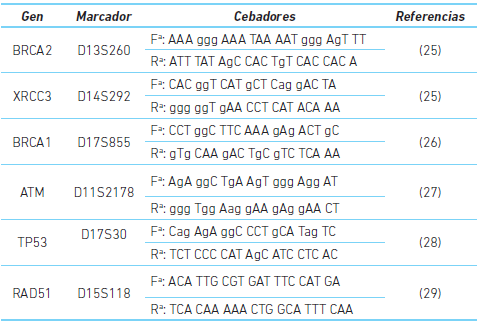
Además, se les solicitó un consentimiento informado y se les tomó una muestra de sangre periférica que fue usada para obtener ADN, empleando el método descrito por Miller et al. 24; posteriormente, el material genético fue cuantificado y por medio de reacción en cadena de la polimerasa (PCR), se amplificaron los marcadores tipo STR (siglas en inglés de repeticiones cortas en tandem), los cuales se encontraban cerca al gen de interés (cuadro 1) y tenían una heterocigosidad igual o superior al 60 %. Después de concluida la PCR se confirmó la amplificación en geles de agarosa al 1,5 % teñidos con bromuro de etidio y finalmente los genotipos fueron resueltos en geles de poliacrilamida al 6 % y tinción con nitrato de plata.
Para el análisis estadístico se evaluaron diferentes parámetros genéticos poblacionales (equilibrio de Hardy Weinberg, coeficiente de endogamia -FIS- y prueba de desequilibrio gamético) como un referente de la distribución de genotipos en los grupos de estudio, usando el software Genepop versión 4,2 30. Se estableció la medida de desequilibrio gamético, la cual estima la combinación no aleatoria de alelos en cada grupo de estudio y lo compara contra el supuesto de que los genes, segregan de forma independiente 15,20.
Ambos grupos de edad fueron comparados mediante una prueba chi cuadrado de independencia para identificar diferencias con respecto a los genotipos evaluados y, cuando se requirió, se utilizó el test exacto de Fisher. Las variables no genéticas fueron comparadas entre los dos grupos usando una prueba de Mann-Whitney para el caso de las variables numéricas y mediante una prueba chi-cuadrado para el caso de las variables dicotómicas. El análisis fue realizado en el software R 31.
Resultados
Entre las 165 muestras captadas hubo algunos datos faltantes dado que las pacientes no aportaron la información solicitada, no se encontraba en la historia clínica o la muestra biológica dio un resultado genético negativo. Se encontró que en las menores de 50 años la edad media de diagnóstico fue de 42±5,6 años y en las mayores o iguales a 50 años la edad media de diagnóstico fue 56±8,3 años. Con excepción de la edad de la menopausia, no se encontraron diferencias entre los dos grupos en las variables no genéticas (cuadro 2).
Cuadro 2 Caracterización de las variables no genéticas en función de los grupos y edad de diagnóstico
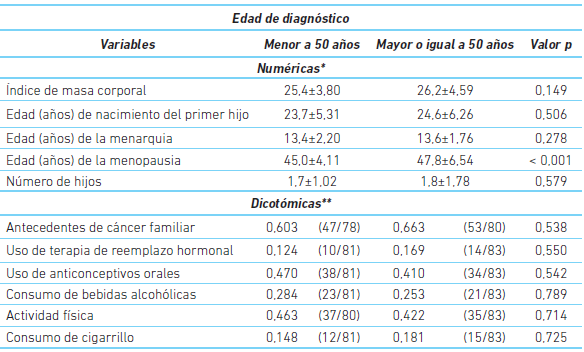
* Se muestra la media (desviación estándar). El valor P compara la tendencia central de los dos grupos mediante una prueba de Mann-Whitney. El tamaño muestral por variable y por grupo varía entre 42 y 83.
** Se muestra la proporción de la presencia de la característica. Entre paréntesis el conteo de éxitos y el tamaño de la muestra. El valor P compara las dos proporciones usando una prueba chi-cuadrado.
Después de genotipificar los marcadores tipo STR asociados a los genes de interés se evaluó el equilibrio de Hardy Weinberg (datos no mostrados) donde se encontró que, excepto el locus BRCA1, todos los loci evaluados a través de los grupos no se ajustaron al modelo, con valores de FIS entre 0,22 y 0,56. Además, se encontró que los marcadores estudiados tenían entre cuatro y seis alelos, con excepción del STR D17S30 asociado al gen TP53, que solo presentó un alelo, por lo que se retiró de los análisis.
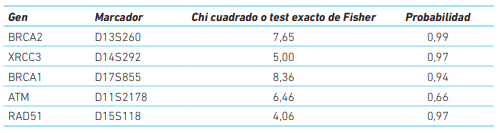
Posteriormente, se estimó la frecuencia de genotipos en los grupos de estudio y se evaluó la diferencia entre ellos por medio de un chi cuadrado o test exacto de Fisher (cuadro 3) y no se encontraron diferencias en cuanto a la distribución de alelos entre casos mayores de 50 años y casos menores de 50 años que indicara una asociación entre alguno de los genes y la aparición del cáncer de mama en estos grupos.
Cuadro 3 Prueba de Chi cuadrado o test exacto de Fisher para los alelos hallados en cada marcador con respecto a la presentación del cáncer de mama
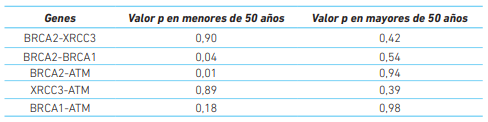
Como se conoce que el cáncer puede ser multicausal se procedió a evaluar las interacciones entre los genes usando una prueba de desequilibrio gamético (cuadro 4). Con este análisis se establece si hay una combinación de alelos que se presente con una mayor frecuencia dentro de cada grupo. Particularmente, se detectaron dos combinaciones genéticas (BRCA1-BRCA2 y BRCA2-ATM) en las pacientes menores de 50 años que pueden estar asociadas a esta condición.
Discusión
El cáncer de mama es una neoplasia de origen multifactorial y los agentes causales pueden fluctuar dependiendo de la población de estudio 15,20, dada la variabilidad de causas genéticas, no genéticas y de las interacciones entre ellas.
En primera instancia, la edad de diagnóstico fue similar a lo reportado en Molecular Taxonomy of Breast Cancer International Consortium32. Aunque se han descrito múltiples variables no genéticas relacionadas con la ocurrencia del cáncer de mama, en la población de estudio se comportaron de forma homogenea en ambos grupos, exceptuando la edad de menopausia, aunque debe aclararse que solo se analizaron casos y no se incluyó un grupo control. Sin embargo, era necesario establecer si alguna de ellas mostraba diferencias entre los grupos de estudio (mayores de 50 años y menores de 50 años), para su control posterior.
Los datos genéticos no se ajustan a lo propuesto por el modelo del equilibrio de Hardy Weinberg 15,20. Varios autores sugieren que esto puede ser consecuencia de errores en la genotipificación o que no se cumplen los supuestos del modelo 33-35. En este estudio no se pueden descartar errores de genotipificación; sin embargo, la distribución de genotipos es consistente con lo esperado para un modelo de endogamia ampliamente documentado en esta población (FIS entre 0,22 y 0,56), 21,22 y es una explicación plausible para los hallazgos; además, la muestra estudiada no es representativa de la población general, dado que se tuvieron encuentra criterios de selección (diagnóstico de cáncer de mama, ancestría paisa, entre otros), y en este contexto no se cumple con los supuestos del modelo. Finalmente, las desviaciones observadas de Hardy Weinberg son similar en ambos grupos de casos, por lo cual las diferencias observadas entre ellos no serán consecuencia de este hallazgo.
Se encontró diversidad alélica, con excepción del locus D17S30, el cual resultó monomórfico a pesar de ser reportado como polimórfico en otras poblaciones 28. La diversidad alélica es de gran relevancia dado que la posibilidad de que los individuos estudiados compartan genotipos similares por el azar será menor. Además, en la población de estudio se propone un fuerte desequilibrio de ligamiento por su proceso de fundación 18,21,22; así, un genotipo o una combinación de ellos que muestre una distorsión entre las categorías estudiadas será un indicativo de la participación genética por un fenómeno de hitchhiking36.
A pesar de que el análisis que se realizó es indirecto (no se estaban genotipificando las mutaciones funcionales en los genes de interés, sino que estos se estudiaron por medio de marcadores cercanos), esta metodología permite identificar la participación como tal del gen sin tener en cuenta cuál o cuáles cambios son los causales, llegando así, a identificar genes candidatos previo a la identificación de mutaciones 37.
Los genes estudiados han sido relacionados con cáncer de mama, pero se ha propuesto que este contexto varía entre las poblaciones 12,23,38 situación que se evidenció en este trabajo, donde no se encontró relación genética entre cada uno de los genes estudiados y la ocurrencia del cáncer de mama hereditario 39.
Al evaluar la existencia de desequilibrio gamético como una medida de interacción génica y encontrar dos combinaciones genética relevantes en las menores de 50 años (BRCA2-BRCA1 p= 0,04 y BRCA2-ATM p= 0,01), se sugiere la participación de estas interacciones genéticas en la ocurrencia temprana de cáncer de mama. Estos resultados son consistentes con la hipótesis de Knudson quien propone que un evento de cáncer es el resultado de unas mutaciones acumuladas en las células, además que si estas son heredadas de los padres, los efectos acumulativos se evidencias a edades más tempranas 40.
Asimismo, los productos de estos genes participan conjuntamente en los procesos de reparación del ADN. Se ha reportado la importancia de la interacción directa entre RAD51, XRCC3, BRCA1 y BRAC2 para formar un complejo esencial para la reparación de quiebres de doble cadena en el ADN que se dan durante la recombinación homóloga entre los cromosomas 38. Se conoce que la aparición de estos quiebres contribuyen al desarrollo de los procesos de carcinogénesis a través de la acumulación de errores genéticos e inestabilidad genética 41,42 y mutaciones en estos genes han sido descritas en la población de estudio 39,43,44.
Conclusión
Ninguno de los genes estudiados tuvo una participación individual y diferencial entre los grupos de pacientes mayores o menores de 50 años. Cuando se evaluaron interacciones génicas entre ellos se identificó una fuerte asociación entre combinaciones de genes BRCA1, BRCA2, ATM y la ocurrencia del cáncer de mama a edades tempranas. Sin embargo, es necesario realizar estudios posteriores que permitan identificar mutaciones o cambios a nivel de ADN que representen una explicación biológica plausible ante estos resultados. En otra instancia se podría considerar evaluar otros genes candidatos como los relacionados con el ambiente hormonal, el control de ciclo celular y la reparación de ADN que puedan estar interactuando con los genes evaluados y modulando los resultados presentados.