Introducción
El cáncer cervical es uno de los más comunes a nivel mundial, con una incidencia para el 2012 de 528 000 casos, de los cuales 85 % se presentan en países de medianos y bajos ingresos 1. Se ha demostrado que la infección por el virus del papiloma humano es necesaria pero no suficiente para el desarrollo del cáncer de útero y se han reconocido otros cofactores que favorecen su progresión a carcinoma cervical y cervical invasivo como la Chlamydia trachomatis. El interés por esta bacteria como cofactor para el cáncer cervical se relaciona con su naturaleza asintomática, la persistencia de la infección, la modulación de la respuesta inmune del hospedero y la inducción de inflamación crónica y metaplasia. 2.
Generalmente, la infección por C. trachomatis cursa asintomática y persiste en el hospedero después de inducir respuesta inmune y producir infección crónica, lo que conlleva a daño epitelial como la amplificación del centrosoma y formación del huso multipolar, conduciendo a la inestabilidad cromosómica que puede dar origen a la transformación celular. La presencia de estos defectos dentro de las células en división infectadas identifica un posible mecanismo para C. trachomatis como cofactor en la formación del cáncer cervical 2.
Esta infección se constituye la segunda infección de transmisión sexual mas frecuente a nivel mundial, especialmente en mujeres jóvenes. Para el año 2012 se reportaron a nivel mundial 130,9 millones de casos nuevos, de los cuales 47 % fueron mujeres 3,4; en Colombia, para el año 2011, se reportaron 1 313 casos principalmente, en personas de 15 a 49 años 5 y se relaciona con infecciones y enfermedades del aparato reproductor femenino como salpingitis, linfogranuloma venéreo, enfermedad pélvica inflamatoria, infertilidad y cáncer de cuello uterino 6,7.
El inicio precoz de la vida sexual representa un factor que predispone al desarrollo de lesiones premalignas y malignas del cuello uterino 8; además, las adolescentes y mujeres jóvenes se infectan con mayor frecuencia con C. trachomatis por la susceptibilidad del epitelio endocervical 4,9.
El objetivo de la presente revisión es describir los mecanismos de patogenicidad y respuesta inmune por C. trachomatis como cofactor de cáncer de cuello uterino. Para ello se revisó la literatura a partir de las bases PubMed/ Medline, Lilacs y Redalyc; se emplearon los tesauros MeSH y DeCS. Se seleccionaron los artículos que hacían referencia al tema específico.
Actualmente, los avances se dirigen a esclarecer el papel de C. trachomatis como cofactor para el cáncer cervical 10, favoreciendo el efecto oncogénico del virus del papiloma humano 11.
Aún no se ha establecido el mecanismo que lleva a la enfermedad, pero sí se ha definido que causa inflamación significativa y cambios citológicos permanentes 12, de manera que la respuesta inflamatoria ocasionada por la bacteria podría estar contribuyendo al inicio de la transformación maligna del epitelio endocervical 13.
Ciclo reproductivo
La bacteria posee ciclo reproductivo bifásico que comienza cuando una partícula no activa metabólicamente, infecciosa, denominada cuerpo elemental ingresa a la superficie apical de las células epiteliales 14. Tras la entrada por endocitosis, los cuerpos elementales se reorganizan diferenciándose en órganos más grandes, metabólicamente activos, no infecciosos denominados cuerpos reticulares (por sus siglas en inglés de reticular bodies -RB-), que se someten a la replicación del ADN y la fisión binaria en repetidas ocasiones. Finalmente, los cuerpos reticulares se diferencian a cuerpos elementales (elemental bodies, -EB-) que escapan de la célula por lisis o apoptosis pudiendo infectar células vecinas. Si durante la replicación se expone a factores de estrés como interferón gamma (IFN-γ) o antibióticos betalactámicos, la bacteria entra a un estado viable/no cultivable o forma no cultivable, conocida como “cuerpo aberrante”, de mayor tamaño que los cuerpos reticulares y permaneciendo en este estado de latencia hasta nueve meses y retomando su ciclo normal cuando los factores de estrés han sido removidos (figura 1) 15,16.
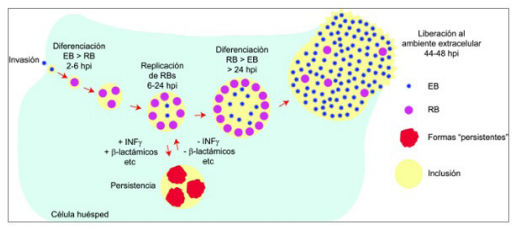
Fuente y agradecimientos: Saka, HA. Centro de Investigaciones en Bioquímica Clínica e Inmunología. Universidad Nacional de Córdoba - Argentina
Figura 1 C. Trachomatis se propaga mediante un ciclo bifásico que involucra el cuerpo elemental (EB) y el cuerpo reticulado (RB). Si durante la replicación se ve expuesta a estrés la bacteria pasa a una “forma persistente” (cuerpo aberrante) y permanece en este estado como forma latente.
Mecanismos de patogenicidad y respuesta inmune
Cuando C. trachomatis entra en el epitelio, el sistema inmune innato se activa reconociendo patrones moleculares asociados a patógenos (PAMP), tales como receptores toll-like (por su sigla en inglés TLR´s) o receptores tipo Toll 17. Aunque los lipopolisacáridos de C. trachomatis pueden ser reconocidos por los 11 receptores toll-like (excepto por el 10), los del tipo 2 son cruciales para la señalización de la producción de citoquinas pro-inflamatorias tales como la interleuquina-1 (IL-1), IL-6, factor de necrosis tumoral-a (TNF-a). También se estimulan granulocitos, macrófagos, factor estimulante de colonias y quimioquinas como la IL-8, que aumentan el reclutamiento de macrófagos; además, se activan las células natural killers, células dendríticas y neutrófilos que, a su vez, estimulan más citoquinas proinflamatorias para restringir el crecimiento de la bacteria 18.
Se ha encontrado que las células infectadas producen interferón-γ (IFN-γ) y a la vez IL-1, IL-8 y IL-12 que conllevan a la lesión tisular durante la infección primaria, buscando la depuración del agente infeccioso. El IFN-γ inhibe la reproducción de la bacteria; sin embargo, la concentración de esa citocina es crítica para el resultado de la infección: altos niveles de IFN-γ muestran una eliminación de la bacteria y bajos niveles le permiten sobrevivir sin replicarse. La infección puede persistir por años y la reactivación puede generar una respuesta secundaria más potente con incremento de la inflamación 19.
Tanto el epitelio del tracto genital como las células inmunes T y B constituyen la primera línea de defensa contra C. trachomatis; sin embargo, hay respuesta inmune que puede conducir a inflamación crónica causando daño a los tejidos 20. Al respecto, las células epiteliales infectadas liberan metaloproteasas de la matriz (por su sigla en inglés, MMP´s) que contribuyen a la proteólisis de tejido y remodelación. Los neutrófilos, por su parte, también liberan metaloproteasas de la matriz y elastasas que favorecen al daño tisular. De otro lado, las células natural killer producen IFN-γ que impulsa las células T CD4 hacia la respuesta inmune mediada por Th1 21.
Finalmente, las células dendríticas presentan los antígenos de C. trachomatis y por tanto contribuyen al balance de la inmunidad innata y adaptativa 14,18. Esta respuesta puede ser protectora o patológica dependiendo del balance entre la inmunidad mediada por células T auxiliadoras tipo 1 (Th1) y las células T auxiliadoras tipo 2 (Th2) 22. Si se potencia una respuesta inmune Th1 se genera protección contra la infección crónica; sin embargo, la respuesta patológica Th2 contraC. trachomatis puede conducir a inflamación crónica 14,20.
Los mecanismos de patogénesis también están determinados por propiedades del genoma del hospedero, ya que variantes alélicas han sido correlacionadas con diferencias en la inmunobiología de la infección. La mayoría de los polimorfismos identificados se ubican en ellocide la defensa inmunológica, determinando la resistencia o la susceptibilidad a la infección en cada individuo (14.
Modulación de la respuesta inmune del hospedero
C. trachomatis utiliza mecanismos para evadir la respuesta inmune y producir cambios celulares que le permitan su supervivencia para perpetuar la inflamación. Uno de los mecanismos que usa para evadir la respuesta inmune de reconocimiento y su destrucción por los linfocitos T citotóxicos es la regulación negativa de la expresión del complejo mayor de histocompatibilidad clase I 17.
Otro mecanismo es contrarrestar la apoptosis bloqueando la liberación del citocromo C desde la mitocondria hacia el citosol e inhibiendo la activación de la caspasa 3 y su señal proapoptótica para completar su ciclo reproductivo intracelular 23. Además, C. trachomatis posee proteínas que metilizan ADN de la célula hospedadora, contribuyendo a la activación o supresión de genes, permitiendo la resistencia a mecanismos inmunológicos.
Por otra parte, modula negativamente la respuesta de factor de necrosis-kappa B (NF-κB) mediante su interacción con la proteína inhibidora B, favoreciendo su sobrevida en el hospedero y evitando la expresión de genes que codifican para citocinas proinflamatorias, quimiocinas, moléculas de adhesión y reguladores de apoptosis, que funcionan como reclutadores de macrófagos y polimorfonucleares para erradicar la infección 17.
El difosforil-lípido A, un componente de la pared de bacteriana, antagoniza el TLR-4 disminuyendo parcialmente la expresión del receptor de IFN-γ, citocina proinflamatoria que participa en el control de la infección 20.
C. trachomatis presenta mecanismos relacionados con mayor daño tisular tales como modulación positiva de la actividad de las células natural killer; incrementa la longevidad de los polimorfonucleares y la producción de citocinas proinflamatorias y de la enzima metaloproteinasa (MMP9) vía dependiente de TLR-2. Además, aumenta la actividad de la oxidasa fagocitaria, con gran producción de especies reactivas de oxígeno, asociado con lesión tisular 20.
C. trachomatis induce anticuerpos contra la proteína 60 del choque térmico (cHSP60), considerada marcador de persistencia de infección, relacionándose con antiapoptosis y conduciendo a la proliferación incontrolada y a transformación neoplásica 14,18. Ésta, además, genera una reacción de hipersensibilidad retardada que por similitud con una proteína de choque térmico producida por las células epiteliales y los macrófagos, induce a un mimetismo molecular que reafirma la teoría de autoinmunidad durante la infección persistente 20.
Para inhibir la apoptosis, C. trachomatis evade la respuesta inmune del organismo y secreta proteasas en el citoplasma de la célula hospedera (secreción tipo III). Una de las proteasas secretadas es el factor de actividad proteasomal, que degrada las proteínas proapoptóticas del dominio único BH3, de la familia de proteínas Bcl-2 para protegerse de la apoptosis y sobrevivir en la célula hospedera. Otra es la “proteína de Chlamydia asociada a receptores de muerte» (por sus siglas en inglés, CADD), expresada al final del ciclo de infección, la cual posee una región de dominio de muerte inhibiendo la apoptosis 17.
Así pues, las células infectadas están protegidas contra muchos estímulos apoptóticos: la infección activa la vía Raf / MEK / ERK (proteínas de señalización interna tipo receptor, que van de la membrana celular al núcleo) y la vía PI3K / AKT (fosfatidilinositol- 3-kinasa); igualmente, la inhibición de estas vías sensibiliza las células infectadas e impide la muerte celular mediada por granzima B. La infección puede conducir a la regulación positiva mediada por Raf / MEK / ERK y la estabilización dependiente de PI3K del miembro de la familia anti-apoptótica, Bcl-2 Mcl-1 (B-cell lymphoma 2, Mcl-1, proteína codificada por este gen que pertenece a la familia Bcl-2). La interferencia con la regulación ascendente de Mcl-1 sensibiliza células infectadas para la apoptosis inducida a través del receptor de TNF, aumenta el daño del ADN, la granzima B y el estrés. La regulación positiva Mcl-1 mantiene la resistencia a la apoptosis en células infectadas pero en la degradación de las proteínas, BH3 es la razón de la resistencia a la apoptosis 21,23.
Puesto que C. trachomatis entra en un estado reversible de persistencia es necesario plantear cómo se alberga en las vías de supervivencia celular durante la infección aguda y tras la interrupción de una infección persistente. La infección aguda induce actividad de la telomerasa humana transcriptasa inversa (por sus siglas en inglés: hTERT), reduce la señalización de daño de ADN telomérico, y los niveles de p21 24.
Las vías de señalización de apoptosis y daño del ADN están relacionadas con envejecimiento celular. En células somáticas eucariotas diferenciadas la expresión de la subunidad catalítica de la telomerasa humana transcriptasa inversa es determinante de la actividad de la telomerasa y en ausencia de hTERT los telómeros que se erosionan en cada división celular se acortan y no pueden mantener estructuras de protección de los extremos abiertos teloméricos. Esto inicia daño en el ADN generando respuestas mediadas por p53 y dando lugar a la transición de las células a un estado de senescencia, caracterizada por regulación positiva de p21 y apoptosis. Además, hTERT influye en la respuesta al daño del ADN por tener funciones en extensión de vida útil independiente de su función en el alargamiento de los telómeros 23,24.
Además, p53 es el principal regulador de la apoptosis y progresión del ciclo celular en respuesta al daño del ADN, del envejecimiento y longevidad; por tanto, la actividad interrumpida de p53 lleva a desregulación del ciclo celular, generando en este caso, procesos cancerosos y deficiencias en su expresión. Adicionalmente, la actividad de la telomerasa es frecuentemente desregulada en células cancerosas que han sido inmortalizadas y adquirido la capacidad proliferativa ilimitada 23.
La presencia de C. trachomatis persiste después de la eliminación de la infección, altera el envejecimiento celular y las vías de supervivencia. Es probable que las células que sobreviven a la infección presenten una fisiología alterada inducida por daño al ADN favoreciendo la transformación celular 14.
La infección persistente disminuye en 4,7 veces la expresión del gen supresor de tumor caveolin-1 y aumenta en 2,1 veces la expresión del oncogen c-myc. La modulación de la expresión de estos genes constituye uno de los cofactores que contribuyen a cambios neoplásicos intraepiteliales en las células cervicales metaplásicas 14.
C. trachomatisalerta al sistema inmunológico provocando una vigorosa respuesta de citoquinas pro-inflamatorias y disminuyendo la secreción de quimioquinas T. Lo anterior se da porque en la infección con C. trachomatis se aumenta la IL-1a en secreciones apical y baso-lateral y más del 95 % de infección, no regula la secreción de citoquinas pro-inflamatorias IL8, IL6 o TNF ya sea en las secreciones apical o basolateral, lo que sugiere que C. trachomatis evade la respuesta de citoquinas epiteliales endocervicales provocando el establecimiento de la bacteria y el sostenimiento en el endocérvix 23.
Aunque el número de células de replicación en la zona de transformación cervical es bajo, éstas estaban infectadas, indicando ausencia de protección para infección en la región del tracto reproductivo; también se demuestra que la infección induce la hiperproliferación y causa moderada neoplasia intraepitelial cervical 5.
La multinucleación, los defectos de posicionamiento de los centrosomas y la formación de micronúcleos son fenotipos que se acumulan localizándose en los tejidos infectados. El descubrimiento de células multinucleadas y micronúcleos sugiere que la infección induce inestabilidad cromosómica y defectos del centrosoma 25.
La combinación de la proliferación celular inducida por la infección, el centrosoma inducido por C. trachomatis y los defectos del huso mitótico que promueven la inestabilidad genómica, son factores que contribuyen a la displasia cervical 24. Además, la evidencia de defectos de localización del centrosoma inducidos por C. trachomatis y la inestabilidad genómica, presentes en lesiones precancerosas y cancerosas, sugiere la hipótesis de que la infección puede cebar el cuello uterino progresando a neoplasia o exacerbar lesiones neoplásicas ya presentes 25. Además, el mecanismo de eliminación de la infección, sea de forma natural o con tratamiento antibiótico, podría ser un factor contribuyente en la acumulación de células con defectos citológicos inducidos por C. trachomatis26,27.
Conclusiones
La infección genital por C. trachomatis se ha relacionado con el desarrollo de cáncer de cuello uterino por factores como su ciclo reproductivo, la naturaleza asintomática, la persistencia dentro de la célula y su capacidad de reactivación y de reinfección, la propiedad de producir lesión tisular, la intensidad de la respuesta inmunológica, la capacidad de la bacteria para modular la respuesta inmune y la complejidad de dichos mecanismos inmunes que finalmente inducen a inflamación crónica y alteraciones citológicas. La presencia de esta infección tiene importancia en el inicio de la transformación maligna del epitelio endocervical y en la progresión de adenocarcinoma induciendo una inflamación que daña la barrera de la mucosa incluyendo la membrana basal.
Una respuesta inmunitaria adecuada es esencial para eliminar C. trachomatis; sin embargo, esta respuesta no siempre es suficiente ocasionando persistencia de la infección y aumento al riesgo de cáncer de cuello uterino. Considerando la alta prevalencia de la infección por esta bacteria es preciso avanzar en estudios que aporten más evidencias que relacionen C. trachomatis con cáncer de cuello uterino; adicionalmente se hace necesario mejorar las estrategias de salud pública para la detección y tratamiento oportuno, al tiempo que promover el uso de métodos de barrera para disminuir el riesgo de nuevas infecciones.














