Introducción
La leucemia promielocítica aguda es un subtipo de leucemia mieloide aguda caracterizada por una proliferación y acumulación de promielocitos anormales en la medula ósea, causando una deficiencia en la producción normal de eritrocitos, leucocitos y trombocitos 1.
Es una rara enfermedad que se presenta entre el 10-15 % de los adultos con leucemia mieloide aguda, con una frecuencia de 600-800 casos/año en los Estados Unidos 2. En Madrid (España) la incidencia de leucemia promielocítica aguda es del 23 % sobre el total de pacientes con leucemia mieloide aguda, una incidencia mayor en comparación con otras regiones de Europa del norte 3. Estudios realizados en países latinoamericanos han demostrado que esta enfermedad tiene una alta frecuencia entre los pacientes con leucemia mieloide aguda: en Lima (Perú) se presenta en el 22 % de los casos; en México el 20 %, y en Venezuela el 27,8 % 4. En Colombia hay reportes que señalan que la leucemia promielocítica aguda corresponde alrededor del 12 % de todas las leucemias mieloides agudas 5.
La leucemia promielocítica aguda se caracteriza por presentar un reordenamiento en el cual el gen RARα (17q21.2) se fractura en el extremo 5’ y se fusiona con el extremo 3’ del gen PML (15q24.1), formándose así el gen fusión PML/RARα. El punto de ruptura del cromosoma 17 ocurre en el intrón 2 del gen RARα, uniéndose al cromosoma 15 en uno de tres posibles puntos de ruptura ubicados en el gen PML, en el intrón 6 (bcr1), en el exón 6 (bcr2) y uno en el intrón 3 (bcr3) (figuras 1, 2) (6.
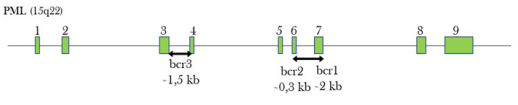
Figura 1 Esquema de la estructura exón/intrón del gen PML con los posibles sitios de ruptura: intrón 6 (bcr1), exón 6 (bcr2) e intrón 3 (bcr3). (Figura adaptada de referencia 7)

Figura 2 Esquema de la estructura exón/intrón del gen RARα, con el sitio de ruptura en el intron 2. (Figura adaptada de referencia 7)
A pesar de que existe tratamiento efectivo, la enfermedad sigue estando asociada a una alta incidencia de muerte prematura debido a la frecuente aparición de hemorragias fatales 8. El síndrome hemorrágico se desarrolla más frecuentemente en pacientes con un recuento de leucocitos mayores de 10*109 células/L 9.
Los análisis morfológicos e inmunofenotípicos por citometría de flujo son estudios importantes que definen inicialmente el subtipo de leucemia mieloide aguda. Sin embargo, el diagnóstico definitivo de la leucemia promielocítica aguda se basa en la detección del gen fusión PML/RARα mediante técnicas moleculares o la presencia de la traslocación (15;17) mediante la citogenética convencional 10-12.
Existen distintas técnicas citogenéticas con las que se puede detectar PML/RARα; entre éstas se encuentra el análisis de hibridación in situ con fluorescencia (FISH, por sus siglas en inglés), en el cual se usan sondas que marcan los cromosomas y emiten fluorescencia. Esta técnica es una de las más utilizadas para la detección del gen fusión PML/RARα y las distintas variantes del gen RARα; además puede mostrar la proporción de células que tienen el gen fusión 13,14.
Igualmente, la técnica de reacción en cadena de la polimerasa (PCR, por sus siglas en inglés) utiliza la amplificación enzimática de ácidos nucléicos por medio de cebadores específicamente diseñados para el fragmento génico que se quiere amplificar, en este caso PML/RARα. Este método es muy rápido, ya que arroja resultados de tres a seis horas aproximadamente. También ha mostrado tener una sensibilidad y una especificidad entre el 96-100 %, amplificando directamente la región objetivo de una muestra de cDNA, por lo que resulta útil para el monitoreo confiable de la enfermedad mínima residual (EMR) 14-16.
Otra de las ventajas de esta técnica es que puede localizar el punto de ruptura del gen PML 17. Sin embargo, esta técnica no permite determinar el radio de células que tienen el gen fusión y tampoco se pueden identificar muestras de mala calidad que puedan dar lugar a resultados falsos negativos 18.
Todas las opciones antes mencionadas son altamente específicas. Sin embargo, la citogenética es menos sensible que las demás. En términos de rapidez, especificidad y sensibilidad, las pruebas FISH y la inmunotinción con anticuerpos monoclonales anti-PML son altamente eficientes para confirmar el diagnóstico de leucemia promielocítica aguda. No obstante, la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR, por sus siglas en inglés) complementa estas técnicas, permitiendo la definición del tipo de isoforma PML/RARα y la evaluación de EMR (16.
El interés en el desarrollo de pruebas moleculares para la detección de PML/RARα, se ha enfocado sobre todo en la evaluación de EMR en leucemia mieloide aguda. El consorcio de investigación BIOMED-1 ha logrado desarrollar pruebas de RT-PCR para la detección de varios transcritos fusión relacionados con diferentes tipos de leucemia mieloide aguda, incluyendo PML/RARα. En este ensayo se utiliza una PCR anidada, mediante la implementación de una PCR externa que flanquea todos los sitios posibles de ruptura descritos, seguidas por una PCR interna que permite aumentar la sensibilidad de los ensayos y determinar el sitio de ruptura 19. Esta PCR tiene una sensibilidad de 10-5 (detección de una célula leucémica entre 105 células normales), obteniéndose productos amplificados que oscilan entre 178-1300 pb, fácilmente identificables por electroforesis en gel de agarosa.
Este mismo consorcio ha desarrollado también pruebas estandarizadas por PCR en tiempo real, que además de permitir la determinación de la presencia del transcrito fusión y el tipo de ruptura génica, cuantifica la presencia del transcrito para determinar la enfermedad mínima residual que está directamente relacionada con el pronóstico y seguimiento del paciente 20.
Debido a las distintas repercusiones que ocasiona esta enfermedad y a su frecuencia entre los subtipos de leucemia mieloide aguda, se ve la necesidad de una prueba que complemente las técnicas desarrolladas para su diagnóstico.
Materiales y métodos
Pacientes
En este estudio de corte transversal se recolectaron muestras de sangre periférica de pacientes diagnosticados con leucemia mieloide aguda, para ajustar e implementar mediante RT-PCR anidada, la detección de PML/RARα basados en un protocolo previamente establecido 19. Los pacientes formaron parte del proyecto “Evaluación de marcadores moleculares, proteómicos y epigenéticos en pacientes con leucemia mieloide aguda antes y después de tratamiento”. Dentro de los criterios de selección de éstos se tuvo en cuenta que fueran pacientes con diagnóstico de leucemia mieloide aguda de novo, reciente, sin haber recibido tratamiento de inducción, no tener antecedentes de enfermedades neoplásicas, ser mayores de 18 años y que no tuvieran un diagnóstico de leucemia mieloide aguda secundiaria a síndrome mielodisplasico. Todos los pacientes firmaron consentimiento informado. Este trabajo fue financiado por Colciencias (contrato 669-2014) y contó con el aval ético de las instituciones participantes. El trabajo fue realizado por el ITM en colaboración con el Hospital Manuel Uribe Ángel (Envigado, Antioquia) y la Clínica Sómer (Rionegro, Antioquia) entre los años 2015-2017. Las historias clínicas de los pacientes incluidos fueron revisadas para verificar algunas variables clínicas y paraclínicas.
Extracción de RNA y retrotranscripción
A partir de una muestra de 6 mL de sangre venosa periferica se realizó la extracción de RNA con el kit Trizol LS (Thermo Fisher Scientific - US) de acuerdo con las recomendaciones del fabricante. El RNA obtenido se cuantificó mediante Nanodrop 2000 (Thermo Fisher Scientific - US) a 260 nm y su calidad fue evaluada mediante análisis de la relación 260/280 y 260/230. A partir de 500 ng de RNA se realizó retrotranscripción mediante la enzima RevertAid reverse transcriptase (Thermo Fisher Scientific - US), random primers (Qiagen - US) y dNTPs (Thermo Fisher Scientific - US). En resumen, el programa de PCR se configuró así: 10 minutos a 25°C, seguido de 60 minutos a 42°C y finalmente 10 minutos a 70°C. Se almacenaron los cDNA resultantes a -20°C para su posterior uso.
PCR para detección del gen fusión PML/RARα
Para el ensayo de RT-PCR anidada se utilizaron seis primers, de los cuales cuatro se unen a la porción del gen PML (PML-A1, PML-A2, PML-C1 y PML-C2) y los otros dos al gen RARα (RARα-B y RARα -D) (figura 3). Con estos, se logra formar cuatro conjuntos de primers A1-B, A2-B, C1-D y C2-D. La PCR A1-B/C1-D genera productos de 214 pb y 178 pb para bcr1 y bcr2, respectivamente; mientras que A2-B/C2-D produce amplificados de 688 pb, 652 pb y 289 pb para bcr1, bcr2 y bcr3, respectivamente 19.
A partir de 2µL de cDNA en solución con buffer 1X, 25 mM de MgCl2, 0,2 mM de dNTPs y 5 U/µL de Taq polimerasa para un volumen final de 25 µl, se realizó inicialmente una PCR externa utilizando los primers A1 o A2 y el primer B, a una concentración 0,4 uM. Luego se realizó la PCR interna a partir de 1µl del producto resultante en la PCR externa con los mismos reactivos y las mismas concentraciones mencionadas anteriormente y los primers C1 o C2 y el primer D. En todos los casos se incluyó un control negativo. El protocolo de amplificación para ambas PCR se realizó con el BIO-RAD C1000 Touch Thermal Cycler y se configuró así: 95°C por 30 s, seguido por 30 ciclos de 94°C por 30 s, 65°C por 60 s, 72°C durante 60s por 30 ciclos; teniendo en cuenta el protocolo de referencia 19.
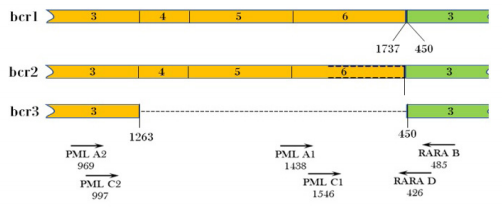
Figura 3 Diagrama de los tres tipos de transcrito PML-RARΑ Los números bajo el transcrito del gen fusión corresponden a la posición del nucleótido donde se da el empalme exón-exón. Las celdas amarillas corresponden a los exones del gen PML y la verde al exón del gen RARA. Las seis flechas indican la posición relativa de los cebadores y los números en ellas, se refieren a la posición de nucleótidos (5’) de cada cebador. (Figura adaptada de referencia 19)
Análisis estadístico
Se tomaron todas las variables cuantitativas de los datos clínicos de todos los pacientes y se comparó el promedio de cada variable para los pacientes diagnosticados con leucemia promielocítica aguda versus pacientes con otro subtipo de leucemia mieloide aguda por medio del software RStudio 1.1.453. La prueba de normalidad se realizó con el test Shapiro Wilk y las comparaciones se realizaron usando la prueba t de Student para las variables con distribución normal y la prueba u Mann Whitney para los datos con distribución no normal. Los valores de p inferiores a 0,05 indicaron significancia estadística.
Resultados
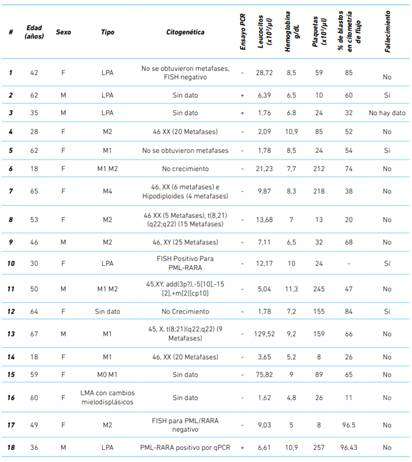
El cuadro 1 resume las características clínicas de los pacientes con leucemia mieloide aguda al momento del diagnóstico por medio de inmunofenotificación, antes del inicio del tratamiento de inducción. Dentro del estudio hubo 12 mujeres y seis hombres, con edades entre los 18 y 67 años (promedio de 46 años). El 27,7 % fueron diagnosticados con leucemia promielocítica aguda, con una edad promedio de 41 años y por debajo de la edad promedio de los pacientes con otros subtipos de leucemia mieloide aguda (49,1 años).
En promedio, la realización de la prueba de PCR tomó tres horas, sin incluir el proceso de extracción de RNA. De los cinco pacientes con leucemia promielocítica aguda, tres (60 %) fueron confirmados para el transcrito PML/RARα con el ensayo RT-PCR y sólo uno (# 18) había sido positivo para en el ensayo FISH. El paciente # 10 también presentó, en el análisis citogenético, la t(15;17), sin embargo, no se logró la detección con el ensayo de RT-PCR. El paciente # 1 fue diagnosticado con leucemia promielocítica aguda, aunque no presentó el transcrito PML/RARα en el análisis citogenético, ni en el ensayo de PCR. Sin embargo, el ensayo FISH detectó una señal verde (RARα) extra en 75/200 núcleos que fueron analizados, indicando que existe un re-arreglo (tipo translocación o trisomía) que involucra únicamente al cromosoma 17, razón por la cual no fue detectada por ninguna de las técnicas anteriores.
Cuatro pacientes fueron positivos para la presencia de PML/RARα. De estos, tres habían sido diagnosticados con leucemia promielocítica aguda ya fuera por hallazgos morfológicos o por la presencia del gen fusión por medio de otra técnica (FISH o PCR).
En la figura 4 se observa que los pacientes # 2 y 3 presentaron el transcrito fusión PML/RARα, con punto de ruptura bcr1, ya que en la PCR externa el tamaño fue de 688 pb utilizando la pareja de primers (A2-B)(C2-D), y en la PCR interna se obtuvo un producto de 214 pb mediante la pareja de primers (A2-B)(C1-D) 19.
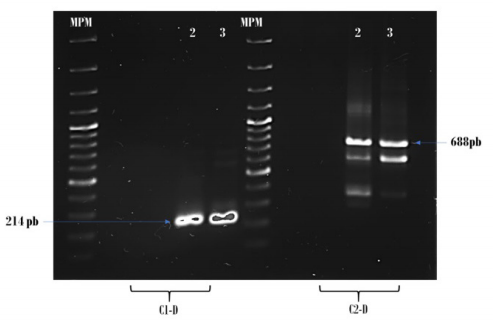
Figura 4. Amplificación de PML/RARα con los conjuntos de primers C1-D (izquierda) y C2-D (derecho) en los pacientes # 2 y 3 con el tipo de ruptura bcr1
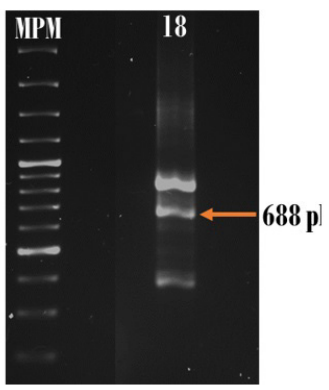
El paciente # 6 resultó positivo para PML/RARα con el tipo de ruptura bcr3. La amplificación mediante el conjunto de primers (A2-B) (C2-D), los cuales amplifican el punto de ruptura de PML en bcr3, resultó en un tamaño de 289 pb, aproximadamente (figura 5). El paciente 18 también fue positivo para PML/RARα al amplificar la muestra con el conjunto de primers (A2-B) (C2-D) con un tamaño de 688 pb, por lo que se estima que el punto de ruptura de PML también es bcr1 (figura 6).
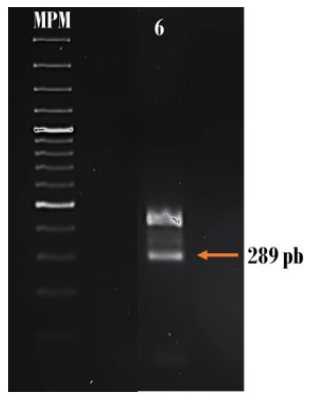
Figura 5 Amplificación de PML/RARα en el paciente 6 con el tipo de ruptura bcr3. MPM: marcador de peso molecular 100 pb.
Discusión
En este trabajo se detectó el transcrito fusión PML/RARα por medio de RT-PCR anidada en tres de cinco casos diagnosticados anteriormente con leucemia promielocítica aguda. En uno de los casos no detectados (#1) que ya había sido diagnosticado por inmunofenotificación con leucemia promielocítica aguda no hubo evidencia de la t(15;17) con FISH ni con el ensayo de PCR anidada. Hipotéticamente, se asume que este hace parte del porcentaje de pacientes con leucemia promielocítica aguda que no presentan la t(15;17), si no un rearreglo que solo involucra el gen RARα y otros genes asociados; es por eso que probablemente no se detecta el transcrito fusión con ninguna de las técnicas que se utilizaron. Y es que hasta ahora estas translocaciones variables son muy poco frecuentes y los algoritmos estándar de laboratorio de diagnóstico no incluyen sondas o cebadores específicos para diagnosticar estas variantes raras 13.
El segundo falso negativo (#10) puede estar explicada por dos motivos: primero, cabe la posibilidad de que haya sido por degradación del RNA y segundo, por el tipo de sonda que se utilizó en el ensayo FISH, la cual pudo haber sido mucho más específica para la secuencia específica de este paciente que la secuencia de primers utilizada para el ensayo de RT-PCR. Se requiere realizar un estudio de cohorte de mayor tamaño para determinar la proporción precisa de falsos positivos y falsos negativos por esta técnica basada en PCR 21.
Existen estudios en donde al realizar el ensayo FISH se obtiene un resultado positivo, pero al hacer el estudio con RT-PCR, este se vuelve negativo, lo cual se ve explicado por la misma existencia de reordenamientos del gen RARα a nivel del DNA 22.
Se logró identificar el punto de ruptura del gen en todos los ensayos positivos, dado que ésta es una técnica que permite la definición del punto de ruptura del gen PML, lo cual es útil para la realización de un monitoreo molecular confiable. En este estudio no se valoró la enfermedad mínima residual, aunque esta técnica puede ser utilizada para este tipo de evaluación. Al utilizar esta técnica para hacer un seguimiento mejoran significativamente la capacidad de identificar pacientes con mayor riesgo de recaída 23.
Cuatro pacientes de la cohorte murieron, ninguno de los cuales tuvo diagnóstico citogenética de la enfermedad al momento del fallecimiento (el paciente # 10 tuvo diagnóstico post-mortem). Estudios previos han reportado que el no tener un resultado citogenética definido es un factor que se asocia a mal pronóstico en los pacientes con leucemia mieloide aguda y también una mayor tasa de muerte temprana 24.
La ausencia de resultados citogenéticos definidos depende de múltiples factores como el hallazgo de pocas metafases disponibles para el análisis, demasiado tiempo en tránsito de la muestra, temperatura extrema de exposición durante el transporte, error de etiquetado, muestra hemolizada o recuento bajo de células, entre otros. Se ha reportado que estas variables que llevan a una falla en el análisis citogenético predicen una respuesta deficiente a la quimioterapia y deben considerarse una característica de alto riesgo 25. Por eso se considera que el ensayo propuesto en este estudio es una alternativa válida frente a las pruebas citogenéticas, dado que la RT-PCR brinda un resultado confiable con el que se puede dar un diagnóstico rápido y preciso para estos pacientes.
En conclusión, los resultados de este estudio sugieren que el uso de este protocolo de RT-PCR anidada es una alternativa diagnóstica que permite la detección del gen fusión PML/RARα, en pacientes con leucemia promielocítica diagnosticada por citometría de flujo. La implementación de pruebas moleculares para esta alteración citogenética redundaría en toma de decisión terapéuticas mejor informadas, que por ende mejorarían el pronóstico de los pacientes.