Introducción
El carcinoma hepatocelular representa el 80 % de casos de cáncer primario de hígado, y es la segunda causa de muerte más frecuente asociada al cáncer 1. Sus principales factores de riesgo son la infección crónica por el virus de la hepatitis B (VHB), la infección crónica por el virus de la hepatitis C, el consumo crónico de alcohol, el síndrome metabólico y la exposición dietaria a aflatoxina B1 (AFB1) 2.
La aflatoxina B1 es un metabolito secundario producido por hongos, principalmente por especies del género Aspergillus. En los trópicos, debido a las condiciones de humedad y temperatura, se facilita su proliferación en la cadena de producción y almacenamiento de alimentos, contaminando granos, nueces y semillas 3.
La aflatoxina B1 es un potente agente genotóxico, clasificado en el grupo 1 de cancerígenos por la Agencia Internacional para la Investigación del Cáncer 1. Al consumir alimentos contaminados con aflatoxina B1, esta micotoxina es metabolizada en el hígado por el complejo citocromo CYP450, dando lugar a 8,9-exo-epóxido, altamente reactivo, que se une covalentemente con proteínas (aflatoxicosis) o al ADN, formando aductos (4.
El epóxido tiene una marcada preferencia por el gen TP53, específicamente por el exón 7 codón 249, causando la transversión G→T, que conlleva al cambio de arginina por serina en la proteína 5. TP53 es un gen supresor de tumores que codifica la proteína p53, un factor de transcripción que regula el ciclo celular, la muerte celular programada, la respuesta al estrés celular y la reparación del ADN 6.
En poblaciones con alta exposición a aflatoxinas, como países tropicales y subtropicales, se ha encontrado la mutación R249S del gen TP53 en 30 % a 60 % de los pacientes con carcinoma hepatocelular 7. En individuos sin evidencia de enfermedad crónica hepática o asintomáticos, la frecuencia de la mutación varía según la presencia del antígeno de superficie del virus de la hepatitis B (HBsAg), con su máximo nivel en pacientes positivos para este antígeno viral (8. Se ha demostrado en modelos in vivo e in vitro la relación causal de aflatoxina B1 y R249S 2,7, razón por la cual se ha descrito que en pacientes con carcinoma hepatocelular esta mutación sirve como una “huella” de exposición a aflatoxina B1, lo cual está sustentado bajo el criterio de Bradford-Hill 9.
El estudio de este factor de riesgo es de importancia en salud pública, con el fin de regular el nivel máximo permisible de aflatoxinas presente en alimentos de consumo humano por la legislación del país y la inclusión en el diagnóstico diferencial en pacientes a riesgo de cáncer primario de hígado.
Adicionalmente, se ha descrito una sinergia entre la exposición dietaria a aflatoxinas y la infección crónica por el virus de la hepatitis B en el riesgo de carcinoma hepatocelular 10,11. Se ha postulado que la sinergia de la infección por VHB y la exposición a aflatoxina B1 en el desarrollo de carcinoma hepatocelular se debe principalmente a la función pleiotrópica de la proteína viral X, que puede interferir con la reparación del ADN celular 10.
La relación entre la infección crónica por virus de la hepatitis B y la exposición a aflatoxina B1 se ha documentado en otras investigaciones que reportan un Odds Ratio de 399 (IC 95 %: 48,6 - 3 270) entre los casos de carcinoma hepatocelular positivos para la mutación e infección por VHB y el grupo control 12. Asimismo, se ha encontrado esta sinergia en modelos animales como la marmota y ratones transgénicos infectados con VHB 13,14.
Este trabajo de investigación se enmarca en un estudio de casos y controles en el que se evaluaron los factores de riesgo de las hepatopatías terminales en población colombiana.
Se planteó este estudio para determinar la frecuencia de la mutación R249S del gen TP53 como evidencia de la exposición a aflatoxina B1.
Metodología
Tejido hepático
Se recolectaron 30 muestras de explante de pacientes con diagnóstico de cirrosis y/o carcinoma hepatocelular, sometidos a trasplante hepático en el Hospital Pablo Tobón Uribe de Medellín, desde junio de 2014 hasta agosto de 2016; las muestras se almacenaron a -70 °C.
La extracción de ADN total con TRIzol® (Ambion®, USA) se realizó a partir de tejido hepático siguiendo las instrucciones de la casa comercial. El ADN se re-suspendió en Hepes comercial (Amresco®, USA) y se almacenó a -20 °C. Para determinar la pureza del ADN extraído se cuantificaron los radios 260/280 y 260/230 (NanoDrop 2000 Thermo Fisher Scientific®, USA). Luego se prepararon diluciones de ADN para tener una concentración de trabajo estándar de 40 ηg/µL. Posteriormente, se verificó la integridad del ADN extraído mediante una PCR del gen constitutivo gliceraldehído-3-fosfato deshidrogenasa con los primers 5’-CCTTCATTGACCTCAACTACATGG-3’ y 5’-AGTCTTCTGGGTGGCAGTGATGG-3’ 15.
Los ensayos de amplificación del fragmento de interés de TP53 se realizaron utilizando los primers 5´-CTTGCCACAGGTCTCCCCAA-3´ (nt 13 941-13 960) y 5´-AGGGGTCAGCGGCAAGCAGA-3´ (nt 14 167-14 158) 12. El volumen final de la reacción fue de 25 µL utilizando 200 ηg de ADN, 1 U de Taq ADN polimerasa (Thermo Fisher Scientific®, USA), 0,6 µM de cada primer, 200 µM de cada dNTP (Fermentas® , Canadá), 2,5 µL de 10 X Buffer Taq polimerasa (Thermo Fisher Scientific® , USA), 1,5 mM de MgSO4 (Thermo Fisher Scientific® , USA) y agua libre de nucleasas (Amresco® , USA). El ciclaje se estandarizó con el siguiente protocolo: 4 min a 94 ºC para la activación de la polimerasa, posteriormente 35 ciclos a 94 ºC por 30 s, 65 ºC por 30 s, 72 ºC por 30 s, y finalmente 7 min a 72 ºC para la extensión final (iCycler, Biorad).
En todos los ensayos de reacción en cadena de polimerasa se incluyó un control negativo (agua) y como control positivo ADN de la línea celular derivada de hepatoma humano PLC/PRF/5 (ATTC # CRL-8024), homocigota para la mutación R249S. Los resultados se revelaron mediante electroforesis en un gel de agarosa al 1,5 % corrido a 100 V por una hora, con un fragmento esperado de 237 pb.
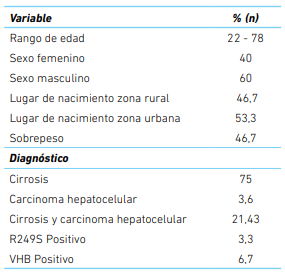
Los productos de la reacción en cadena de polimerasa se sometieron a un ensayo de polimorfismos de longitud de fragmentos de restricción (por sus siglas en inglés, RFLP) con la enzima HaeIII (Invitrogen®, USA) que reconoce GG↓CC del codón 249 (AGG). El control positivo para este ensayo fue el producto de reacción en cadena de polimerasa de la línea celular PLC/PRF/5. Para la reacción fueron necesarios 5 µL de producto de PCR, 2 µL de 10 X Buffer M (Invitrogen®, USA) y 5 U de HaeIII (Invitrogen®, USA). Los resultados se revelaron mediante electroforesis en un gel de agarosa al 3 % con cinco fragmentos esperados de 92, 66, 37, 30 y 12 pb para las muestras wildtype y cuatro fragmentos para las mutantes R249S, de 158, 37, 30 y 12 pb (Figura 1A). Tanto para la reacción en cadena de polimerasa del gen TP53 como la RFLP se realizaron duplicados para verificar los resultados.
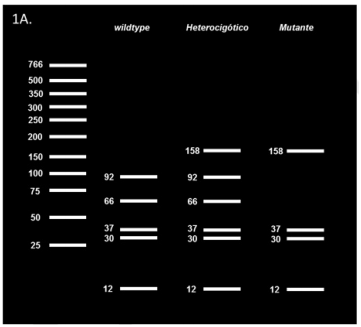
Figura 1A Patrón de bandas esperadas para la RFLP de la mutación R249S del gen TP53. En la figura 1A se muestra un esquema con los cuatro puntos de cortes esperado (5 bandas) para el genotipo wildtype, tres puntos de corte esperado (4 bandas) para el mutante y la combinación de ambos alelos en el genotipo heterocigótico para un total de 6 bandas
Para describir y analizar las variables se usaron estadísticos descriptivos; se verificó el equilibrio de Hardy Weinberg y la posible asociación entre la mutación puntual en el codón 249 del gen TP53 y la infección por VHB se verificó usando una prueba exacta de Fisher. Los análisis se llevaron a cabo en el programa R usando un valor de significancia p<0,05.
El trabajo fue aprobado por el comité de bioética del Instituto de Investigaciones Médicas de la Universidad de Antioquia y el comité de ética del Hospital Pablo Tobón Uribe. Todos los participantes firmaron un consentimiento informado en el que autorizaron que las muestras de sangre o tejido hepático fueran utilizadas para el análisis de factores de riesgo de cirrosis y cáncer de hígado con métodos bioquímicos y de biología molecular; además del polimorfismo en algunos genes que codifican enzimas que participan en el metabolismo del alcohol como alcohol deshidrogenasa y el citocromo P450 CYP2E1. Adicionalmente, los pacientes respondieron una encuesta de datos sociodemográficos.
Resultados
La mayoría de los pacientes fueron del sexo masculino (60 %), con una edad promedio de 56 años (IC 95 %: 51,5 - 60,7). Otros datos demográficos y clínicos de los pacientes se presentan en el cuadro 1. No se encontraron diferencia entre las variables sobrepeso/no-sobrepeso (p=0,85), así como tampoco entre la zona de nacimiento urbana/ rural (p=0,85). Adicionalmente se crearon dos grupos, del estrato 1-3 y del 4-6. Tampoco se encontró relación entre la mutación y el estrato socioeconómico (p=0,33).
La mutación puntual R249S del gen TP53 fue detectada en un solo caso (3,33 %) proveniente de un paciente con cirrosis y carcinoma hepatocelular (figura 1B). La población se ajustó al equilibrio de Hardy Weinberg (p= 0,926). Adicionalmente, se encontró infección crónica por virus de hepatitis B en 6,67 % (dos casos), ambos positivos para HBsAg y anti-HBc total y negativos para la mutación R249S. La distribución de la mutación en los casos evaluados no mostró una relación de dependencia con el factor etiológico de infección crónica por VHB (p=1).
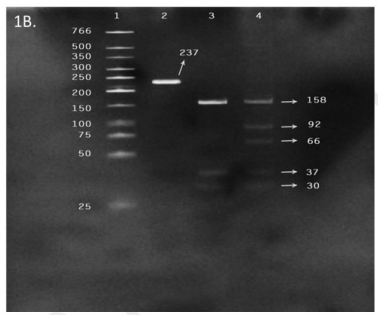
Figura 1B Detección de la mutación R249S del gen TP53 por RFLP en muestras de tejido hepático obtenidas de pacientes con diagnóstico de cirrosis y/o carcinoma hepatocelular
Línea 1, marcador de peso molecular de 25pb. Línea 2, control negativo con ADN de HepG2 sin enzima. Línea 3, control positivo con la línea celular PLC/ PRF/5 homocigótica para la mutación, con tres puntos de corte en cada alelo (se observan 3 bandas). Línea 4, muestra HPTU-01-062 heterocigótica para la mutación, con cuatro puntos de cortes (se observan 4 bandas) para el alelo mutante y tres puntos de corte en el alelo wildtype (se observan 3 bandas). En las líneas 3 y 4 no se logra observar la banda de 12 pb debido a las características del gel.
Discusión
La aflatoxina B1 es reconocida como un potente hepatocarcinógeno. Evidencias in vivo e in vitro demuestran que la mutación R249S del gen TP53 es uno de los principales cambios genéticos en el carcinoma hepatocelular inducido por esta micotoxina 16,17. En zonas de alta exposición como Guangxi, China, Stern et al. encuentran la mutación R249S en el 36 % de las muestras (18/50) obtenidas de pacientes con diagnóstico de carcinoma hepatocelular 18. Adicionalmente, Stern et al. realizan un metaanálisis con otros 48 reportes de esta zona geográfica y demuestran que la proporción de casos con la mutación R249S se correlaciona con el nivel de exposición dietaria a aflatoxinas 18.
Para Tailandia se ha descrito una frecuencia de la mutación de 26,9 % en casos de carcinoma hepatocelular 19. Este resultado puede relacionarse con la dieta, puesto que, en dos de los principales alimentos de la población tailandesa, maíz y nueces, se han encontrado concentraciones de aflatoxina B1 superiores a los 20 µg/kg permitidas por el gobierno de este país 19,20.
En el presente estudio la población se encontró en equilibrio de Hardy Weinberg, lo cual sugiere que no hay estructuración poblacional 21. La infección por VHB se demostró en dos de los casos, que no fueron positivos para la mutación R249S 22,23. La frecuencia de la mutación detectada por PCR-RFLP es similar a la reportada en el metaanálisis de Liu et al. (3 %) en el que se estiman los casos de carcinoma hepatocelular atribuibles a exposición a aflatoxinas en países de África, Norte América, Latino América, Mediterráneo, Asia y Europa, según los datos de contaminación en alimentos, consumo de alimentos contaminados y prevalencia de la infección por virus de la hepatitis B 24.
En un estudio realizado con muestras de carcinoma hepatocelular remitidas a laboratorios de patología de Bogotá, Medellín y Cali durante el periodo 2000 a 2007, se encuentra la mutación R249S por PCR-RFLP y secuenciación en 10,5 % (4/38) de las muestras de tejido hepático embebido en parafina 25. Dos de los casos analizados en este estudio fueron positivos para R249S e infección por VHB simultáneamente.
Estos hallazgos sugieren que la exposición a aflatoxina B1 en Colombia es entre baja e intermedia. La frecuencia encontrada en dicho estudio es mayor que en el presente estudio, debido, posiblemente, a que se incluyeron pacientes de varias regiones del país con diferencias en la prevalencia de infección por VHB y el nivel de contaminación dietaria por aflatoxinas.
Otros estudios demuestran la exposición a aflatoxina B1 en pacientes con hepatopatías terminales en México y Brasil. Soini et al. encuentran la mutación R249S por secuenciación en 18,7 % (3/16) de muestras de tejido hepático obtenido de pacientes mexicanos con diagnóstico de carcinoma hepatocelular 26. En Brasil, Carvalho et al. analizan 33 muestras de pacientes con carcinoma hepatocelular y 43 de pacientes con cirrosis. La mutación R249S se demostró en 39 % de las muestras por la técnica de PCR-RFLP y en 14,6 % de las muestras por la técnica de secuenciación 27. Nogueira et al. analizan muestras de carcinoma hepatocelular obtenidas de 74 pacientes de la ciudad de São Paulo. La mutación se encontró por PCR-RFLP en el 28 % de las muestras y por secuenciación en 16,2 %, lo cual sugiere que existe una contaminación moderada en Brasil y que la aflatoxina B1 cumple un rol en los casos de carcinoma hepatocelular en este país 22.
En Colombia, se ha reportado contaminación por aflatoxina B1 en alimentos provenientes de diferentes zonas del país como: Pamplona, Norte de Santander, con niveles entre 18,42 y 71,25 µg/kg en alimentos de consumo infantil comercializados en la zona 28; además, cinco departamentos de la costa Caribe con reportes de niveles entre 2,4 y 12,5 ppb en arroz y maíz colectadas en diferentes fábricas y comercializadoras 29. En el departamento de Amazonas se encontró aflatoxina B1 en niveles entre 6,4 y 458,2 µg/kg en muestras de maíz, arroz y mandioca, recolectadas en tres comunidades indígenas 30.
Según la legislación colombiana el nivel de aflatoxinas B1, B2, G1 y G2 para todos los cereales y productos a base de cereales, incluidos los productos transformados, no debe ser mayor de 4 µg/kg y el nivel máximo permitido de aflatoxinas B1, B2, G1 y G2 en maíz para el consumo humano es de 10 µg/kg 31. Sin embargo, para este último se dispuso que “dicho nivel máximo no es posible en maíz de producción nacional dadas algunas condiciones de manejo postcosecha”, por lo cual mediante la resolución 02671 de 2014 se aumentaron los límites para el maíz a 20 µg/kg y el arroz a 10 µg/kg 32.
Una alternativa para controlar la contaminación dietaria con aflatoxinas es la sugerida por Wu et al. quienes demuestran que la prevención por biocontrol en los cultivos e intervenciones postcosecha tienen un radio costo-efectivo de 5,10-24,8 y 0,21-2,08 , respectivamente 33.
La contaminación dietaria por aflatoxinas es un fenómeno que depende de las condiciones ambientales, manejo adecuado, cadena de distribución y fuente de abastecimiento de alimentos 3. Algunas de estas características podrían variar entre los diferentes estratos socioeconómicos en el país. Pese a esto, no se pudo observar una relación significativa entre la mutación y el estrato. La falta de significancia en las diferentes pruebas realizadas puede deberse al limitado tamaño de muestra y a que en poblaciones con baja exposición a aflatoxinas y baja prevalencia de infección por VHB esta mutación es reparada por escisión de nucleótidos (NER) 3,34.
La exposición dietaria a aflatoxinas y la infección crónica por el virus de la hepatitis B son dos importantes factores de riesgo para el carcinoma hepatocelular que deben preocupar a las autoridades de salud pública. Sin embargo, la frecuencia de la mutación en el codón 249ser del gen TP53 como marcador de la posible exposición previa a aflatoxinas y la posible relación epidemiológica con VHB y el CHC ha sido poco explorada en Colombia.
Teniendo en cuenta los resultados de este estudio y la evidencia de contaminación con aflatoxina B1 de alimentos para el consumo humano en Colombia se hace necesario sugerir inspecciones sanitarias, regulación de los límites permisibles por la legislación del país y la inclusión en el diagnóstico diferencial de carcinoma hepatocelular, dada la heterogeneidad de las condiciones de la población en diferentes regiones del país.