Introducción
Las bacterias del género Campylobacter sp. son bacilos gramnegativos, no esporulados, helicoidales y delgadas, que pueden presentar diversas morfologías. Dentro del género, Campylobacter jejuni y Campylobacter coli son especies que se encuentran comúnmente como patógenos humanos. Campylobacter sp. puede colonizar el tracto digestivo y causar bacteriemia, endocarditis, peritonitis y sepsis oportunistas, especialmente en pacientes inmunosuprimidos 1.
Se considera que un alto porcentaje de las infecciones por Campylobacter sp son causadas por el consumo de carne de ave mal cocinada. En los países en desarrollo la enfermedad parece ocurrir con mayor frecuencia en menores de dos años 2. El período de incubación es de dos a cinco días, pero puede extenderse hasta 10 días 3. El microorganismo se adquiere por vía oral a través de la ingestión de alimentos o bebidas contaminadas o por contacto con animales infectados. Campylobacter jejuni es sensible al pH gástrico por lo que debe ingerirse en dosis altas como un inóculo de 104 para producir infección; sin embargo, en algunos casos se ha observado como altamente infeccioso, causando una infección con un orden de dosis de 500 microorganismos 4.
El principal mecanismo patogénico de Campylobacter sp. es a través de la invasión de la mucosa intestinal, similar a Shigella sp., donde la invasión de la lámina propia ocurre dentro del intestino delgado y del colon, dando como resultado una enterocolitis inespecífica que puede incluir degeneración y atrofia glandular, pérdida de producción de la mucosa, absceso en las criptas intestinales y ulceración de la mucosa epitelial 5.
El objetivo del presente estudio es informar sobre las características inusuales morfológicas y de crecimiento In Vitro de Campylobacter sp. en un paciente adulto inmunosuprimido.
Reporte de caso
Un paciente masculino de 65 años y con cáncer colo-rectal en manejo antineoplásico y evolución favorable fue remitido para una consulta por síndrome febril. Se realizaron exámenes clínicos y los resultados demostraron hepatitis con un componente colestásico y tejido dañado, anemia, eosinofilia y neutropenia leve. Se le tomaron muestras para hemocultivos aeróbicos (Bactec) y a las 24 horas se extrajo una porción de ambos frascos y bajo microscopio a 1000X se observó una bacteria de gran movilidad que se extendía en forma de espirales, se tiñó con un gram invertido (colorante safranine - colorante violeta cristalino), observándose una forma helicoidal extendida (figura 1).
Se enviaron muestras del hemocultivo al Instituto Nacional de Salud para identificar a Leptospira sp. mediante reacción en cadena de polimerasa, cuyos resultados fueron negativos. Paralelamente, las muestras se cultivaron en agar sangre a 42 o C en microaerófilia y agar aerobio a 37 o C. Después de cinco días de incubación en ambos cultivos se observaron unas pocas colonias, cremosas y de gran tamaño. Una tinción de gram invertida mostró un bacilo curvado con la morfología de Campylobacter sp. a 1000X en ambos casos (figura 2).
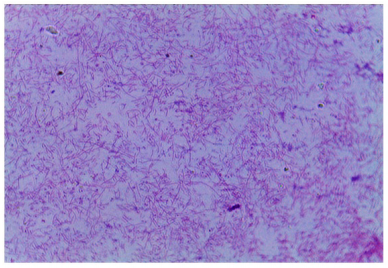
Figura 1 Muestra microscópica tomada de un hemocultivo y teñida con gram invertido. Se observan bacterias en una forma extendida y en espiral (1000x).
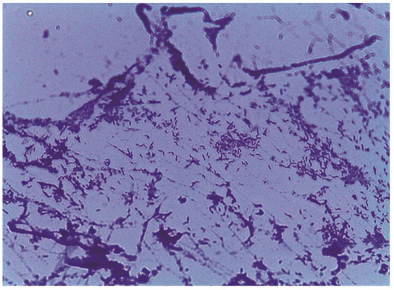
Figura 2 Muestra microscópica (1000X) tomada de una colonia en crecimiento cultivada en medio microaerófilo, teñida con gram invertido. Se puede observar la presencia de la bacteria en su típica forma de coma pequeña.
El antibiograma reportó sensibilidad a eritromicina y ciprofloxacina que se usó como guía para la antibioterapia y el paciente respondió favorablemente. Para confirmar el agente etiológico se realizó una reacción en cadena de la polimerasa para Campylobacter sp. utilizando gen 16S rRNA de 812 pb que confirmó la identificación molecular de Campylobacter sp.
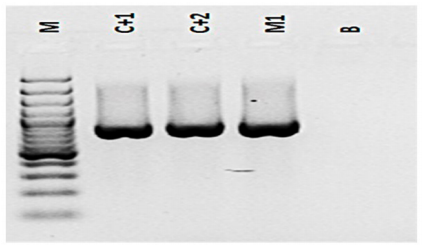
Se llevó a cabo una electroforesis en gel de agarosa. La visualización del amplicón (gen 16S rRNA de 812 bp) se realizó en gel de agarosa (Invitrogen) al 1,5 % (coloreado con bromuro de etidio). Se añadieron 10 μL al marcador (M) de 100 pb a 1000 pb y los respectivos amplicones. Una vez que se había llevado a cabo las siembras de todas las muestras se prendió la cámara electroforética y se llevó a 80 voltios durante 60 minutos; posteriormente, las muestras se observaron en el transiluminador mediante luz UV (Biorad). La muestra analizada presentó un amplicón de 812 pb, similar a los controles positivos (figura 3).
Discusión
En el presente estudio la bacteria fue sensible según el esquema terapéutico clásico 6, sin presentar mayores complicaciones al paciente. Aunque los factores de virulencia son varios, los estudios previos indican mayor importancia a la motilidad de Campylobacter. Este factor está determinado por grupos de varios genes regulados (inducidos) por el medio en el cual se encuentran 7,8. Además, el aparato de locomoción o flagelos dependen de la viscosidad del medio, las condiciones del oxígeno y los nutrientes 9,10. En el presente caso pudo observarse la alta movilidad de las bacterias recuperadas en el medio líquido aeróbico, con una notable forma de espiral extendida.
Aunque no se conocía la fuente de infección es posible que el paciente debía presentar inmunosupresión por la quimioterapia sufría además daño tisular medicamentoso. El paciente pudiera haber adquirido la bacteria mediante el consumo de alimentos, y luego se diseminaron a través de la sangre más allá de las barreras gastrointestinales dañadas. Esto resalta la importancia de los genes de motilidad, adhesión e invasión desde un tejido a otro 1,11.
La morfología del medio líquido fue similar a Leptospira sp., por lo tanto, fue útil el resultado negativo de la reacción en cadena de polimerasa para Leptospira sp y positiva para Campylobacter sp., aunque la tinción de gram debería habernos hecho sospechar que la bacteria era diferente de Leptospira sp., ya que el tinte era más claro, en contraste con lo que generalmente sucede con Leptospira sp. donde la espiroqueta no se tiñe bien porque es muy delgada Además, un hecho interesante es que la bacteria pudo recuperarse en un medio anaeróbico sólido, lo que permitió deducir su tolerancia en diferentes condiciones 12,13.
La capacidad de Campylobacter sp. para colonizar grandes cantidades de nichos está estrechamente relacionada con la extensión metabólica, que se refiere a la activación y supresión génica en diferentes medios y que está relacionada con los procesos evolutivos y de adaptación de la bacteria 14,15. Otro factor importante de Campylobacter sp. y que apoya la colonización es que la termo-tolerancia está entre 37° C0 a 42° C, lo que permitió la recuperación de bacterias a 37 °C en un medio aerobio y 42 °C en medio microaerófilo, tal como ha sido corroborado 16.
La enfermedad por Campylobacter se incrementado notablemente a nivel mundial y se relaciona principalmente con el consumo de animales contaminados, como las aves de corral que sirven como reservorios 17. Adicionalmente, se ha estudiado la importancia en el proceso de infección de otras especies diferentes de Campylobacter diferentes a C. coli y C. jejuni, por lo que se hace importante el control multifactorial (aves, agua y manipulación) 18. Los estudios moleculares, como el realizado en el presente estudio, son gran valor en especial para la detección del agente y determinar las fuentes de contaminación y las personas afectadas, pudiendo determinar patrones moleculares en ambos grupos 19.
En conclusión, Campylobacter sp. es un agente de riesgo especial en personas inmunodeprimidas y puede cambiar drásticamente de forma dependiendo de las condiciones encontradas, siendo la motilidad un factor importante en la diseminación y extravasación de tejidos, por tanto, es necesario hacer hincapié en un correcto diagnóstico microbiológico.