Introducción
La leptospirosis es una enfermedad zoonótica re-emergente, causada por espiro quetas gram-negativas pertenecientes al orden Spirochaetales, familia Leptospi raceae y género Leptospira. Es considerada una zoonosis de distribución mundial aunque se encuentra principalmente en regiones tropicales, relacionada con factores ambientales, climáticos y sociales que favorecen su transmisión. Anualmente, a nivel global, se reportan aproximadamente 1,03 millones de casos y 58 900 muertes por la enfermedad 1.
Los humanos infectados con Leptospira patogénicas pueden presentar manifestacio nes clínicas altamente variables, desde formas asintomáticas hasta presentaciones clínicas severas y potencialmente fatales. Los signos clínicos van desde un cuadro febril simple hasta formas fatales incluyendo el síndrome de Weil, caracterizado por insuficiencia renal, ictericia y hemorragias 2.
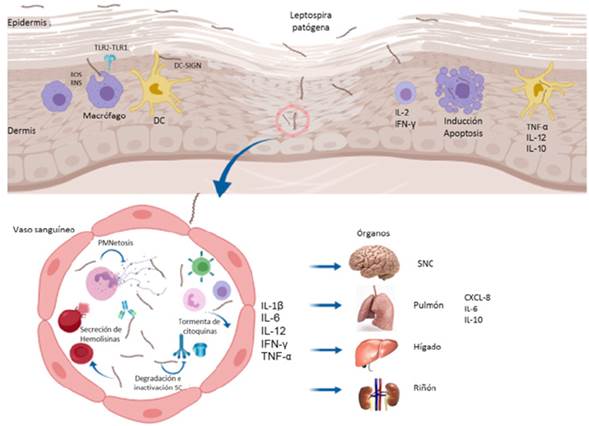
La principal vía de infección es el contacto directo de Leptospira patogénicas con membranas mucosas o heridas en piel con sangre, tejidos, orina o aguas contami nadas, las cuales se diseminan por sangre y alcanzan órganos como hígado, pulmón y tubos proximales del riñón donde se multiplican y sobreviven por meses 3. En la fase inicial de la infección la respuesta inmune innata juega un papel fundamental como primera línea de defensa en leptospirosis, destacándose la respuesta me diada por receptores de reconocimiento de patrones, fagocitosis por macrófagos, inducción de trampas extracelulares de neutrófilos e intervención del sistema del complemento 4.
La respuesta inmune en el humano tiene un papel esencial en el desarrollo de los signos clínicos, al igual que los factores de virulencia de algunas cepas patógenas. La mayoría de infecciones en humanos son asintomáticas o leves y solo un 10 % de los casos desarrollan formas severas con falla multiorgánica e incremento de las tasas de mortalidad relacionada con una tormenta de citoquinas y un estado de inmuno- parálisis 5.
Las especies patógenas presentan mecanismo de evasión de la respuesta humoral en la fase de bacteremia, aunque no es claro el comportamiento posterior de la respuesta inmune. En estudios realizados en pacientes con múltiples manifesta ciones clínicas con leptospirosis se ha asociado la gravedad del cuadro clínico con diversos niveles de citoquinas en suero como TNF-α, IL-10 e IL-6 6. Sin embargo, otros estudios, de manera controversial, han demostrado asociaciones opuestas a las mencionadas 7. Estas condiciones han abierto el interés en la comprensión de la respuesta inmune en general y profundizar en los eventos biológicos que ocurren en la infección.
Esta revisión pretende compartir los últimos avances y estudios de la respuesta in mune en leptospirosis con el fin de aportar al entendimiento de la interacción de la bacteria con su hospedador; además, reconocer otros mecanismos diferentes de la respuesta de evasión en la fase humoral e integrar información asociada a la iden tificación de posibles biomarcadores de gravedad, los cuales pueden ser de utilidad en el manejo clínico de la enfermedad.
Respuesta del sistema inmune innato y el ingreso de Leptospira patogénica en el hospedador susceptible
Leptospira y sistema de complemento
La actividad proteolítica de las proteasas leptospirales contra la matriz extracelular permite que la infección ingrese al torrente circulatorio. El sistema del complemento en el sistema circulatorio es uno de los principales mecanismos de la respuesta in mune innata ante la infección por Leptospiras patogénicas y su función es el recono cimiento y eliminación de microorganismos. Leptospira ha desarrollado estrategias para escapar al ataque del sistema de complemento mediante la unión de proteínas a moléculas del complemento y producción de proteasas como la termolisina que afecta la cadena α de la proteína C3. Las cepas patogénicas unen el factor H, la pro teína relacionada con el factor H-1 (FHR-1), la proteína tipo factor H-1 (FHL-1) y la proteína de unión al C4b, todas encargadas de inhibir el sistema de complemento 8.
La proteína relacionada con el factor H-1-1 inhibe la actividad de la convertasa C5, evitando la generación de moléculas C5b y la eliminación de Leptospira9. La proteína de unión al C4b inhibe la vía alternativa y la vía de las lectinas al actuar como co factor del factor I para clivar la molécula C4b e inhibir la formación de la convertasa C3. Un mecanismo regulador del sistema del complemento requiere de la proteasa serina, factor I, el cual en presencia del cofactor factor H-1 o la proteína cofactor de membrana clivan C3b en fragmentos, lo que resulta en la inhibición de la cascada del complemento y la producción de iC3b opsonina que es reconocida por los recep tores CR1 y CR3. Las proteasas producidas por Leptospiras patogénicas clivan C3b en productos distintos a los producidos por el factor I; estas proteasas bacterianas también pueden clivar iC3b, inactivando esta molécula como opsonina 10.
Leptospiras patogénicas también interactúan con el factor regulador C1INH man teniendo su capacidad reguladora con C1, impidiendo así la activación del sistema de complemento. La adhesina Lsa23 leptospiral inhibe el ensamble del complejo de ataque a membrana 8. Leptospiras patogénicas logran evadir la respuesta humoral y continúa su progresión en la infección.
Leptospira y receptores de inmunidad innata
Leptospiras patogénicas son reconocidas por receptores de inmunidad innata pre sentes en células fagocíticas que identifican patrones moleculares asociados a mi croorganismos como lipopolisacáridos, lipoproteínas de membrana externa y ácido desoxirribonucleico hipometilado. Receptores tipo Toll (TLR) y receptores tipo Nod (NLR’s) presentes en células fagocíticas participan en la respuesta y han sido rela cionados con el control temprano de la leptospirosis. El heterodímero TLR2/TLR1 identifica lipopolisacáridos y LipL32 induciendo la producción de TNFα y es recono cido como el principal receptor involucrado en el reconocimiento de la bacteria. Indi viduos con polimorfismo Arg753Gln (2258 G>A) en el gen tlr2 y Ile602Ser (1805 T>G) en el gen tlr1 se han asociado con susceptibilidad a la leptospirosis. El polimorfismo de Arg753Gln del tlr2 en pacientes con leptospirosis los hace más susceptibles a desarrollar cuadros clínicos con insuficiencia renal e ictericia, lo que se explica por la deficiencia en la señalización del tlr2 afectando la heterodimerización tlr2/tlr6, la fosforilación de residuos de tirosina y el reclutamiento de las proteínas adaptadoras MyD88. El SNP Ile602Ser en el tlr1 afecta la expresión de molécula en la superficie de la célula fagocítica 11.
Leptospira y neutrófilos
Durante la infección las especies patógenas de Leptospira desencadenan una fuerte activación de neutrófilos y de la respuesta pro-inflamatoria. Los neutrófilos son im portantes en el control de microorganismo, pero también contribuyen con el daño de tejidos en el hospedero. Leptospira estimula la formación de netosis, un tipo de muerte celular ocasionada por trampas extracelulares de neutrófilos. Se ha demos trado que los bajos niveles de trampas extracelulares de neutrófilos por baja activi dad de neutrófilos en sangre incrementan la leptospiremia, lo que determina que la formación intravascular de trampas de neutrófilos puede ser crítica en la prevención de la diseminación temprana de Leptospiras patogénicas 4.
Leptospira y macrófagos
En la fase inicial de infección por Leptospira los macrófagos juegan un papel impor tante en la eliminación de la bacteria. Su mecanismo efector junto con una eficiente respuesta de citoquinas está relacionado con el control fagocítico y la diseminación de la infección, aunque se ha demostrado que Leptospira spp induce apoptosis en macrófagos a través de la vía Fas/FasL-caspasa-8-3 y facilitan su supervivencia y proliferación en el hospedero, debido a la liberación de factor mitocondrial inductor de apoptosis y endonucleasas (EndoG) en macrófagos infectados 12.
La producción de especies reactivas de oxígeno lleva a la defosforilación de Akt y el clivaje de Bid (agonista de muerte con dominio BH3). Este procesamiento en Bid genera una permeabilización de la membrana mitocondrial y la liberación del factor inductor de apoptosis mitocondrial y Endo G, moléculas que van al núcleo de la cé lula y causa fragmentación del ADN y apoptosis 13.
Otro mecanismo de apoptosis independiente de caspasa se relaciona con la trans locación intranuclear de p53 que induce un incremento en la expresión de p21 y de las proteínas de la familia pro apoptótica BCL-2 (Bax, Noxa y Puma) y, junto a la liberación de factor inductor de apoptosis mitocondrial y EndoG, lleva a apoptosis de macrófagos infectados con Leptospira14.
Recientemente, se han realizado investigaciones con la caracterización del micro trascriptoma de macrófagos infectados con Leptospira en los mecanismos epige néticos como la regulación post trascripcional por RNA. Los macrófagos infectados con Leptospira han demostrado que los micro RNA (miRNAs) son regulados por la infección con la espiroqueta, lo que demuestra que esta regulación es de vital im portancia en la respuesta de estas células del sistema inmune en la infección por Leptospira15.
En macrófagos humanos, la activación del inflamasoma mediada por especies re activas de oxígeno y catepsina B lisosomal generada por la infección con Leptospira presenta niveles altos de NLRP3 y de IL-18, favoreciendo la producción de IL-1β lo que demuestra la alta habilidad para la fagocitosis y la rápida modelación de algunas citoquina correlacionadas con la resistencia a la leptospirosis 16.
Leptospira y célula dendrítica
Las células dendríticas a través de sus receptores DC-SIGN ingresan a su citoplasma Leptospiras con contenido de manosa en sus membranas, que es el principal com ponente glúcido estructural de Leptospira. Este glúcido contribuye a que la bacte ria sea fagocitada y posteriormente sea presentada para estímulo de la respuesta adaptativa a través de las moléculas del complejo mayor de histocompatibilidad II (CMH-II). La unión de DC-SIGN y manosa inducen la maduración de células dendríti cas y la producción de citoquinas como TNF-α, IL-12 e IL-10 17. La manosa presen te en L. interrogans puede estar relacionada con la unidad de mannobiosa presente en el lipopolisacárido de Leptospiras y puede ser un importante antígeno especifico. No se conocen muchos aspectos de la infección de Leptospira en la célula dendrítica, pero esta población celular ha sido relacionada en presencia con otras células infla matorias en tejido linfoide terciario en infecciones por Leptospira en nefritis folicular linfoide 18.
Respuesta del sistema inmune adaptativo y progresión de la infección con Leptospira patogénica
Respuesta de linfocitos T y citoquinas
Especies patógenas de Leptospira inducen una respuesta inmune mediada por lin focitos T y B, acompañada con la expresión de citoquinas que pueden asociarse con cuadros de gravedad. La activación de linfocitos T durante la infección con Leptospiras inicia la respuesta inflamatoria, principalmente con la producción de citoquinas; esto es fundamental en la eliminación temprana de la infección, pero también la producción no controlada de citoquinas pro-inflamatorias puede resultar en un proceso de tor menta de citoquinas seguida de un estado de inmuno-parálisis que puede conducir a sepsis y falla multiorgánica 5.
Las células leucocitarias y linfocitos T producen IL-1β, IL-6, IL-12, IFN- γ y TNF-α que actúan como quimio-atrayentes para recrudecer la acción de leucocitos en el sitio de la infección. En pacientes con leptospirosis severas y con compromiso pulmonar se obtuvieron niveles altos de IL-6, CXCL8 e IL-10 cuando fueron comparados con pacientes con leptospirosis leves 6. Estas concentraciones altas de citoquinas en pacientes con leptospirosis evidencian el importante papel en el desarrollo de lep tospirosis severa.
En pacientes con infección grave se encuentran linfocitos T CD4+ con perfil pro-infla matorio y productores de IL-2 e IFNγ y están casi ausentes linfocitos T CD4+ CD25high productores de IL-10. La regulación de la respuesta inmune mediada por linfocitos T parece no prevenir el daño tisular generado por la respuesta inflamatoria por Leptos pira. En linfocitos T CD4+ de humanos con leptospirosis severa se ha encontrado que la producción de TNF-α y otras citoquinas proinflamatorias es más alta que aquellos con cuadros leves, lo cual determina que estas citoquinas hayan sido relacionadas como marcadores de severidad en la fase inmunológica de la infección 19.
La producción de IL-10 se ha asociado con riesgo de muerte en humanos con leptos pirosis; sin embargo, un estudio realizado con humanos expuestos y asintomáticos asocia la producción de esta citoquina con el control de la respuesta inflamatoria y sobrevida 19. Durante la infección por Leptospira los mediadores inflamatorios y la acción de algunas células leucocitarias como los linfocitos T son rápidamente regulados en individuos resistentes contrastando esta regulación en individuos con formas severas de leptospirosis 5 (Figura 1).
Respuesta humoral en leptospirosis
La respuesta humoral específica contra Leptospira se caracteriza por la producción ha cia el tercer día de iniciado el cuadro clínico de anticuerpos IgM y de IgG; además, se ha reportado producción de IgA desde el quinto día hasta el noveno mes post-infección; el incremento de IgM ha sido usado como alternativa en el diagnóstico temprano de lep tospirosis 20.
El efecto de la respuesta humoral en humanos con leptospirosis ha permitido que, hasta la actualidad, se haya realizado diagnóstico serológico después de la infección natural 21, incluso con el descubrimiento de nuevos péptidos de Leptospira pro puestos para nuevos esquemas de detección serológica 22.
Sin duda, el aspecto más importante de la respuesta humoral en la infección con Leptospira es la formación de anticuerpos protectores. Las vacunas actualmente disponibles para leptospirosis están compuestas de preparaciones completas de la célula y tiene limitaciones como una baja eficacia, múltiples efectos secundarios, generación de baja memoria inmunológica y falta de protección cruzada para dife rentes serovares; así, el desarrollo de nuevas vacunas es necesario para el control de la enfermedad por lo que en la actualidad se desarrollan investigaciones para producir vacunas a partir de la inmunización genética 23.
Las proteínas de membrana externa de Leptospira han sido consideradas como an tígenos con mejor inmunogenicidad para linfocitos B, entre estos se encuentran los epítopes estructurales OmpL187-98, OmpL1173-191, OmpL1297-320, LipL4130-48, LipL41233-256, y LipL41263-282 24. Estos epítopes son candidatos promisorios para el desarrollo de una vacuna universal.
Además, se han explorado estrategias de inmunización basadas en el sistema DNA prime-protein boost, DNA vaccine, puesto que estudios en modelos animales han de mostrado que se requiere tanto de la inducción de una respuesta humoral como celular en la infección 25.
Recientes investigaciones con proteínas recombinantes relacionadas con factores de virulencia como LcpA (rLcpA), LenA (rLenA) y LTB (rLTB) han demostrado la in munogenicidad de estos antígenos en modelos animales y su capacidad protectora ante L. interrogans, aunque se continúa con la expectativa de la permanencia en el tiempo de títulos de anticuerpos protectores 26. Aunque se han probado muchos antígenos candidatos a vacunas a partir de la membrana celular de la bacteria y con la formación de anticuerpos post vacunales especialmente contra lipopolisacáridos, los resultados de estas vacunas en humanos siguen siendo limitados.
Conclusión
La comprensión de la respuesta inmune frente a la infección con Leptospira no está completamente dilucidada, debido entre otros factores, a que está profundamente relacionada con el comportamiento clínico de los pacientes con leptospirosis que interactúan con los diferentes factores de virulencia del genoma bacteriano y que le confieren a Leptospira una sólida capacidad patógena. Ha habido avances en el conocimiento de la interacción entre “respuesta inmune del hospedero y factores de virulencia de Leptospira spp” que han permitido desarrollar tratamientos, estra tegias inmunoprotectoras y principalmente diagnósticas, pero el camino de genera ción de conocimiento de esta interacción que lleve a disminuir la carga de la morbi mortalidad causada por leptospirosis a nivel global, apenas comienza.